有机电气元件用化合物、利用其的有机电气元件及其电子装置
文献发布时间:2023-06-19 11:55:48
技术领域
本发明涉及有机电气元件用化合物、利用其的有机电气元件及其电子装置。
通常,有机发光现象是指,利用有机物质将电能转换为光能的现象。利用有机发光现象的有机电气元件通常具有阳极、阴极及它们之间包括有机物层的结构。在此,有机物层为了提高有机电气元件的效率和稳定性而普遍形成为由各种不同物质构成的多层结构,例如,可以由空穴注入层、空穴输送层、发光层、电子输送层及电子注入层等形成。
在有机电气元件中,用作有机物层的材料能够根据功能来分为发光材料和电荷输送材料,例如,空穴注入材料、空穴输送材料、电子输送材料及电子注入材料等。并且,上述发光材料可根据分子量来分为高分子型和低分子型,可根据发光机理来分为源于电子的单线激发态的荧光材料和源于电子的三线激发态的磷光材料。并且,发光材料可根据发光色来分为蓝色、绿色、红色发光材料和用于体现更好的天然颜色的黄色及朱黄色发光材料。
另一方面,在使用一种物质作为发光材料的情况下,具有因分子间的相互作用而使最大发光波长向长波长移动,且因纯色度降低或发光衰减效果而减少元件的效率的问题,因此,为了通过增加纯色度和转移能量来增加发光效率,可使用主体/掺杂类作为发光材料。其原理在于,若与形成发光层的主体相比,将能量带间隔小的掺杂物少量混合于发光层,则使在发光层中发生的激子被输送至掺杂物,使得发出效率高的光。此时,由于主体的波长向掺杂物的波长带移动,因此无法根据所利用的掺杂物的种类来获得所需的波长的光。
目前,便携式显示屏市场为了满足大面积显示屏的需求而呈现出其大小不断增加的趋势,因此,所消耗的电力也高于现有便携式显示屏的消耗电力。在这种情况下,对于仅配备了电池这一有限电力供应源的便携式显示屏,电力消耗是一种非常重要的性能因素,也必须解决其效率和寿命问题。
效率、寿命及驱动电压等相互具有关联,若效率增加,则驱动电压相对降低,而在降低驱动电压并驱动时所发生的基于焦耳加热(Joule heating)的有机物质的结晶化减少,最终呈现出寿命提高的倾向。但即使单纯地改善上述有机物层,也无法将效率极大化。这是因为,只有在各有机物层之间的能量等级(energy level)及T
因此,正急需开发能够具有高的热稳定性,并在发光层内有效地实现电荷均衡(charge balance)的发光材料。即,为了充分发挥有机电气元件所具有的优秀的特征,应先选择在元件内形成有机物层的物质,例如,空穴注入物质、空穴输送物质、发光物质、电子输送物质、电子注入物质等被稳定且有效的材料支撑的物质,但到目前为止,仍旧处于未能充分研发出稳定且有效的有机电气元件用有机物层材料的状态,而在其中,尤其对发光层的主体物质的开发有着迫切需求。
发明内容
技术课题
本发明的目的在于,提供可以降低元件的驱动电压,提高元件的发光效率及寿命的化合物、利用其的有机电气元件及其电子装置。
技术方案
在一方面,本发明提供由以下化学式表示的化合物,利用其的有机电气元件及其电子装置。
<化学式1>
在一方面,本发明提供在发光层中包含化学式1表示的化合物和化学式2表示的化合物的有机电气元件及其电子装置。
<化学式2>
技术效果
通过利用本发明实施例的化合物,不仅可以降低元件的驱动电压,而且可以大大提高元件的发光效率及寿命。
附图说明
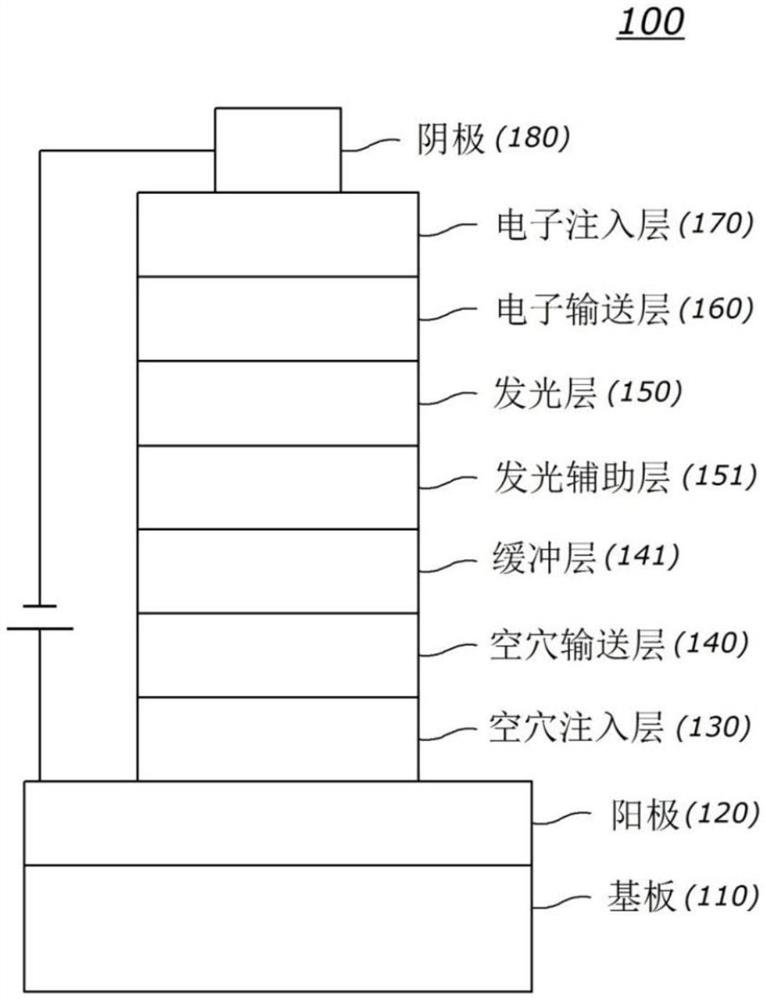
图1为本发明的有机电致发光元件的例示图。
图2为根据本发明一方面的化学式。
[附图标记的说明]
100:有机电气元件 110:基板
120:第一电极 130:空穴注入层
140:空穴输送层 141:缓冲层
150:发光层 151:发光辅助层
160:电子输送层 170:电子注入层
180:第二电极
具体实施方式
在本发明中所使用的术语“芳基”及“亚芳基”只要没有别的说明,就分别具有6至60的碳数,但并不局限于此。在本发明中,芳基或亚芳基包含单环型、环聚集体、融合后的多环类及螺环化合物等。并且,在本说明书中只要没有明确的说明,芳基中可以包含芴基,亚芳基中可以包含亚芴基。
只要没有其他说明,在本发明中所使用的术语“芴基”或“亚芴基”分别意味着在以下结构中R、R’及R”均为氢的1价或2价官能团,“被取代的芴基”或“被取代的亚芴基”意味着取代基R、R’、R”中的至少一种为除了氢之外的取代基,并包括R和R’相键合来与其所键合的碳一同形成螺环化合物的情况。
在本发明中所使用的术语“螺环化合物”意味着“螺接(spiro union)”,而螺接意味着由两个环仅仅共享一个原子,从而实现连接。此时,将在两个环中共享的原子称为“螺环原子”,并且,根据一种化合物所包含的螺环原子的數,将这些分别称为“单螺环-”、“二螺环-”、“三螺环-”化合物。
在本发明中所使用的术语“杂环基”不仅包含“杂芳基”或“杂亚芳基”之类的芳香族环,而且还包含非芳香族环,只要没有其他说明,就意味着分别包含一种以上的杂原子的碳原子数2至60的环,但本发明并不局限于此。在本发明中所使用的术语“杂原子”只要没有其他说明,表示N、O、S、P或Si,也可以包括代替形成环的碳而包含如同下述化合物的SO2、P=O等的杂原子团的化合物。杂环基意味着包含杂原子的单环型、环聚集体、融合后的多环类及螺环化合物等。
在发明中使用的术语“脂肪族环基”意味着除芳香族碳氢之外的环型碳氢,包含单环型、环聚集体、融合后的多环类及螺环化合物等,若非另有说明,意味着碳数为3至60的环,但并不局限于此。例如,作为芳香族环的苯和作为非芳香族环的环己烷(cyclohexane)融合的情况下,也相应于脂肪族环。
在本说明书中,以各符号及其取代基的示例被示出的对应于芳基、亚芳基、杂环基等的“基名称”,可记载“反映价数的基的名称”,但是,也可记载为“母体化合物名称”。例如,在作为芳基的一种的“菲”的情况下,一价的“基”为“菲(基)”,二价的基为“伸菲(基)”等,也可通过区分价数来记载基的名称,但是,与价数无关地,也可记载为作为母体化合物名称的“菲”。类似地,在嘧啶的情况下,也与价数无关地,可记载为“嘧啶”,或者可记载为该价数的“基的名称”,例如,在一价的情况下,可记载为嘧啶(基)、在二价的情况下,可记载为亚嘧啶(基)等。
另外,在本发明中记载化合物名称或取代基的名称时,也可以省略表示位置的数字或字母等。例如可以将吡啶并[4,3-d]嘧啶记载为吡啶并嘧啶、将苯并呋喃并[2,3-d]嘧啶记载为苯并呋喃并嘧啶,将9,9-二甲基芴记载为二甲基芴等。因此,可将苯并[g]喹喔啉或苯并[f]喹喔啉均记载为苯并喹喔啉。
并且,只要没有明确的说明,在本说明书中所使用的化学式能够以与以下化学式的指数定义的取代基的定义相同地适用。
其中,在a为0的整数的情况下,取代基R
并且,只要没有明确的说明,‘相邻的基之间可相互结合形成环’为选自由C
并且,只要没有明确的说明,芳基可以为C
下面,参照图1,对于包含本发明的化合物的有机电气元件的层叠结构进行说明。
在对本发明进行说明的过程中,在判断相关的公知结构或功能的具体说明会模糊本发明的要旨的情况下,将省略详细说明。
并且,在层、膜、区域及板等结构要素位于其他结构要素“上”或“上部”的情况下,这不仅可以理解为位于其他结构要素的“正上方”,而且还可以理解为在中间还有其他结构要素。相反,在一个结构要素位于另一部分的“正上方”的情况下,应理解为中间没有其他部分。
图1为本发明的实施例的有机电气发光元件的例示图。
参照图1,本发明的一实施例的有机电气元件100包括:第一电极120形成于基板(110)上、第二电极180,以及有机物层,在第一电极120和第二电极180之间。上述第一电极120可以为阳极,第二电极180可以为阴极,在倒置型的情况下,第一电极可以为阴极,第二电极可以为阳极。
有机物层可在第一电极120上依次包括空穴注入层130、空穴输送层140、发光层150、电子输送层160及电子注入层170。此时,这些层中的至少一个可以被省略,或还可以包括空穴阻挡层、电子阻挡层、发光辅助层151、缓冲层141等,也可以由电子输送层160等执行空穴阻挡层的作用。
并且,虽未图示,但本发明的一实施例的有机电气元件还可以包括保护层或光效率改善层。这种光效率改善层可形成在第一电极的两面中的不与有机物层相接的面或可形成在第二电极的两面中不与有机物层相接的面。
适用于上述有机物层的根据本发明的一个实施例的化合物,可以用作空穴注入层130、空穴输送层140、发光辅助层151、电子输送辅助层、电子输送层160、电子注入层170,发光层150的主体或掺杂剂,或者可以用作光效率改善层的材料。优选地,根据本发明的化学式1的化合物,或化学式1表示的化合物和化学式2表示的化合物的混合物可以用作发光层的主体。
即使是相同类似的核,根据哪个位置上哪个取代基被键合,带隙(band gap)、电气特性、表面特性等可能会有所不同,因此需要对核的选择以及与其键合的子(sub)取代体的组合进行研究,特别是,当各有机物层之间的能量等级和T
因此,在本发明中,将以化学式1表示的化合物或混合以化学式1表示的化合物和化学式2表示的化合物的混合物用作为发光层的主体,从而可将有机物层之间的能量等级和T
本发明的一实施例的有机电致发光元件可利用多种蒸镀法来制备。可利用PVD或CVD等蒸镀方法来制备,例如,可通过在基板上蒸镀金属或具有导电性的金属氧化物或它们的合金来形成阳极120,并在其上方形成包括空穴注入层130、空穴输送层140、发光层150、电子输送层160及电子注入层170的有机物层之后,在其上方蒸镀能够用作阴极180的物质来制成。并且,可在空穴输送层140与发光层150之间还形成有发光辅助层151,可在上述发光层150与电子输送层160之间还形成有电子输送辅助层。
并且,有机物层使用多种高分子材料,通过并非蒸镀法的溶剂处理或溶剂精制法,例如,旋涂工序、喷嘴印刷工序、喷墨打印工序、狭缝涂布工序、浸涂工序、卷对卷工序、刮涂工序、丝网印刷工序或热转印方法等方法来制成为更少数量的层。由于本发明的有机物层能够由多种方法形成,因此,本发明的保护范围不会因形成方法而受到限制。
本发明的一实施例的有机电气元件可根据所使用的材料分为前面发光型、后面发光型或双面发光型。
并且,本发明的一实施例的有机电气元件可以为选自由有机电致发光元件、有机太阳能电池、有机感光体、有机晶体管、单色照明用元件及量子点显示器用元件组成的组。
本发明的另一实施例可包括电子装置,上述电子装置包括:显示装置,包括上述本发明的有机电气元件;以及控制部,用于控制上述显示装置。此时,电子装置可以为当前或未来的有无线通信终端,并包括手机等移动通信终端、PDA、电子词典、PMP、遥控器、导航仪、游戏机、各种TV、各种计算机等所有电子装置。
以下,对本发明的一实施方式的化合物进行说明。
本发明的一实施方式的化合物由以下化学式1表示。
<化学式1>
在上述化学式1中,各符号能够以如下方式进行定义。
X
Ar
优选地,Ar
在Ar
在Ar
L
L
R
a为0至9的整数,且当a为2及以上的整数时,多个R
相邻的R
R
上述L’相互独立地选自由单键;C
上述R
上述化学式1由以下化学式中的一个表示。
在上述化学式1-A至化学式1-G中,各符号能够以如下方式进行定义。
Ar
X
R
‘相邻的基团之间相互结合而形成的环’为C
d为0至7的整数,e为0至6的整数,在这些分别为2及以上的整数的情况下,多个R
上述L
上述R
上述化学式1-F由以下化学式中的一个表示。
在上述化学式1-F-1及1-F-2中,X
上述化学式1-G由以下化学式中的一个表示。
在上述化学式1-G-1至化学式1-G-5中,X
优选地,上述化学式中的各符号可以被进一步取代。例如,化学式1、化学式1-A至化学式1-G、化学式1-F-1、化学式1-F-2、化学式1-G-1至化学式1-G-5中,Ar
根据本发明的另一侧面,本发明提供包括第一电极、第二电极及形成在上述第一电极和上述第二电极之间的有机物层的有机电气元件,此时,有机物层包括以化学式1表示的化合物,优选地,上述化学式1-A至化学式1-G中的一个表示的化合物,更优选地,化学式1-F和/或化学式1-G表示的化合物包括在有机物层的发光层中。
根据本发明的另一侧面,本发明提供包括第一电极、第二电极及形成在上述第一电极和上述第二电极之间的有机物层的有机电气元件,此时,上述有机物层包括磷光性发光层,上述磷光性发光层的主体包括如下化学式1表示的第一化合物及如下化学式2表示的第二化合物。
<化学式2>
在上述化学式2中,各符号能够以如下方式进行定义。
Ar
n为0至3的整数,且当n为2及以上的整数时,多个R
在Ar
L
L
R
相邻的R
b为0至4的整数,c为0至3的整数,且在这些分别为2及以上的整数时,多个R
上述L’相互独立地选自由单键;C
上述R
上述化学式2由以下化学式2-A或化学式2-B表示。
在上述化学式2-A和2-B中,L
并且,上述化学式2可以下述化学式2-C化学式2-F中的一个表示。
在上述化学式2-C至化学式2-F中,各符号能够以如下方式进行定义。
Ar
R
相邻的基团之间相互结合而形成的环为C
相邻的R
k及l分别为0至4的整数,n及m分别为0至3的整数,且在这些分别为2及以上的整数时,多个R
V为N-(L
上述R'及R”相互独立地选自由氢;重氢;卤素;氰基;硝基;C
上述Ar
上述L
上述R
上述化学式2由以下化学式2-G至化学式2-T中的一个表示。
上述化学式2-G至化学式2-T中,Ar
上述化学式2由以下化学式2-U表示。
<化学式2-U>
在上述化学式2-U中,各符号能够以如下方式进行定义。
Ar
U为N-(L
R
相邻的R
o为0至3的整数,p为0至4的整数,且在这些分别为2及以上的整数时,多个R
上述R'及R”相互独立地选自由氢;重氢;卤素;氰基;硝基;C
上述Ar
上述L
上述R
上述化学式2、化学式2-A至化学式2-U中,各符号可以被进一步取代。例如,Ar
优选地,在上述化学式1及化学式2中,上述L
在上述化学式b-1至化学式b-3中,各符号能够以如下方式进行定义。
R
相邻的R
Y为N-(L
Z
f为0至6的整数,e、g、h及i分别为0至4的整数,j及k分别为0至3的整数,l为0至2的整数,m为0至3的整数,且在这些分别为2及以上的整数时,多个R
上述R'及R”相互独立地选自由氢;重氢;卤素;氰基;硝基;C
在C(R')(R”)中,R'和R”之间任选地相结合来形成环,且在C(R')中,相邻的R'之间任选地相结合来形成环。
上述Ar
上述L
上述R
上述R
具体地,上述化学式1表示的化合物可以为以下化合物中的一个,但并不局限于此。
具体地,上述化学式2表示的化合物可以为以下化合物中的一个,但并不局限于此。
以下,举出实施例来对本发明的由化学式1表示的化合物及化学式2表示的化合物的合成例及有机电气元件的制备例进行具体说明,但本发明并不局限于以下的实施例。
由根据本发明的化学式1表示的化合物(终产物)如以下反应式1,可通过使Sub1与Sub2反应来制备,但不受此限定。
<反应式1>
属于反应式1的Sub1的化合物可为如下所述的化合物,但并不局限于此。
所属于Sub1的上述化合物的FD-MS值如下表1。
[表1]
属于反应式1的Sub2的化合物可为如下所述的化合物,但并不局限于此。
所属于Sub2的上述化合物的FD-MS值如下表2。
[表2]
1.Sub1的合成例
上述反应式1的Sub1可通过以下反应式2的反应途径来合成,但并不局限于此。
<反应式2>
向2-溴萘并[2,3-b]苯并呋喃(35.4g,119.13mmol),添加二(频哪醇基)二硼(CAS登记号:73183-34-3)(33.28g,131.04mmol)、PdCl
向8-溴苯并[b]萘并[2,3-d]噻吩(35.40g,113.02mmol),添加二(频哪醇基)二硼(CAS登记号:73183-34-3)(31.57g,124.33mmol)、PdCl
(1)Sub1-37a的合成
向4,4,5,5-四甲基-2-(萘并[2,3-b]苯并呋喃-2-yl)-1,3,2-二氧杂硼杂环戊烷(60g,174.31mmol),添加1-溴-4-碘萘(69.65g,209.17mmol)、Pd(PPh
(2)Sub1-37的合成
向Sub1-37a(45.01g,106.33mmol),添加二(频哪醇基)二硼(CAS登记号:73183-34-3)(29.70g,116.96mmol)、PdCl
(1)Sub1-68a的合成
向4,4,5,5-四甲基-2-(萘并[2,3-b]苯并呋喃-2-yl)-1,3,2-二氧杂硼杂环戊烷(60g,174.31mmol),添加1-溴-8-碘二苯[b,d]噻吩(81.38g,209.17mmol)、Pd(PPh
(2)Sub1-68的合成
向Sub1-68a(56.82g,118.53mmol),添加二(频哪醇基)二硼(CAS登记号:73183-34-3)(33.11g,130.38mmol)、PdCl
(1)Sub1-98a的合成
向2-(苯并[b]萘并[2,3-d]噻吩-2-基)-4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷(60g,166.54mmol),添加1-溴-5-碘萘(66.54g,199.84mmol)、Pd(PPh
(2)Sub1-98的合成
向1-98a(46.83g,106.58mmol),添加二(频哪醇基)二硼(CAS登记号:73183-34-3)(29.77g,117.24mmol)、PdCl
6.Sub1-111的合成例
(1)Sub1-111a的合成
向2-(苯并[b]萘并[2,3-d]噻吩-11-基)-4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷(60g,166.54mmol),添加1-溴-8-碘二苯[b,d]噻吩(77.75g,199.84mmol)、Pd(PPh
(2)Sub1-111的合成
向Sub1-111a(54.46g,109.92mmol),添加二(频哪醇基)二硼(CAS登记号:73183-34-3)(30.70g,120.91mmol)、PdCl
2.Sub2的合成例
上述反应式1的Sub2可通过以下反应式3的反应途径来合成,但并不局限于此。
<反应式3>
向2,4-二氯-6-苯-1,3,5-三嗪(35.4g,156.60mmol),添加[1,1'-联苯]-3-基硼酸(31.01g,156.60mmol)、Pd(PPh
向2,4-二氯-6-苯-1,3,5-三嗪(35.4g,156.60mmol),添加萘-1-基硼酸(26.93g,156.60mmol)、Pd(PPh
向2-([1,1'-联苯]-4-基)-4,6-二氯-1,3,5-三嗪(35.4g,117.16mmol),添加二苯并[b,d]噻吩-4-基硼酸(26.72g,117.16mmol)、Pd(PPh
向2,4-二氯-6-苯-1,3,5-三嗪(35.4g,156.60mmol),添加二苯并[b,d]呋喃-1-基硼酸(33.20g,156.60mmol)、Pd(PPh
向2,4-二氯-6-苯-1,3,5-三嗪(35.4g,156.60mmol),添加苯并[b]萘并[2,1-d]噻吩-5-基硼酸(43.55g,156.60mmol)、Pd(PPh
3.最终化合物的合成例
将Sub1-6(56.7g,164.72mmol)放入圆底烧瓶中并以THF(604mL)溶化后,添加Sub2-3(67.96g,197.66mmol)、Pd(PPh
向Sub1-9(56.7g,164.72mmol),添加THF(604mL)、Sub2-22(88.94g,197.66mmol)、Pd(PPh
向Sub1-29(56.7g,134.90mmol),添加THF(495mL)、Sub2-65(70.24g,161.88mmol)、Pd(PPh
向Sub1-38(56.7g,120.54mmol),添加THF(442mL)、Sub2-6(45.97g,144.65mmol)、Pd(PPh
向Sub1-67(56.7g,111.09mmol),添加THF(407mL)、Sub2-6(42.36g,133.31mmol)、Pd(PPh3)4(5.13g,4.44mmol)、K
向Sub1-97(56.7g,116.56mmol),添加THF(427mL)、Sub2-6(44.45g,139.87mmol)、Pd(PPh
向Sub1-106(56.7g,107.70mmol),添加THF(395mL)、Sub2-6(41.07g,129.24mmol)、Pd(PPh
根据上述合成例制备的本发明的化合物1-1至1-176的FD-MS值在以下表3中被示出。
[表3]
本发明的以化学式2表示的化合物(终产物2)如以下反应式4,通过使Sub3与Sub4反应来合成,但不受此限定。
<反应式4>
反应式4的Sub3可通过以下反应式4的反应途径来合成,但并不局限于此。
所属于Sub3的化合物的FD-MS值如下表4所示。
[表4]
属于反应式4的Sub3的化合物可为如下所述的化合物,但并不局限于此。
所属于Sub4的化合物的FD-MS值如下表5所示。
[表5]
1.Sub3的合成例
Sub3可通过以下反应式4-1的反应途径来合成,但并不局限于此。
<反应式4-1>
将3-溴-9-苯-9H-咔唑(45.1g,140mmol)以DMF(980mL)溶解后,依次添加二(频哪醇基)二硼(39.1g,154mmol)、PdCl
将2-溴-9-苯-9H-咔唑(76.78g,238.3mmol)以DMF(980mL)溶解后,添加二(频哪醇基)二硼(66.57g,262.1mmol)、Pd(dppf)Cl
将Sub3-c(2)(29.5g,80mmol)以THF(360mL)溶解后,添加1-溴-4-碘苯(23.8g,84mmol)、Pd(PPh3)4(2.8g,2.4mmol)、NaOH(9.6g,240mmol)和水(180mL)后,进行搅拌回流。反应完成后,以醚和水萃取,有机层浓缩后,将有机层以MgSO
将Sub3-c(2)(73.92g,200.2mmol)在圆底烧瓶中以THF(880mL)溶解后,添加1-溴-2-碘苯(85.0g,300.3mmol)、Pd(PPh
将Sub3-c(1)(29.5g,80mmol)以THF(360mL)溶解后,添加3-溴-3'-碘-1,1'-联苯(30.16g,84mmol)、Pd(PPh
将Sub3-c(2)(73.92g,200.2mmol)在圆底烧瓶中以THF(880mL)溶解后,添加2-溴-7-碘二苯[b,d]呋喃(112.0g,300.3mmol)、Pd(PPh
将Sub3-c(2)(73.92g,200.2mmol)在圆底烧瓶中以THF(880mL)溶解后,添加1,3-di溴-5-碘苯(108.65g,300.3mmol)、Pd(PPh
2.Sub4的合成例
反应式4的Sub4可通过以下反应式4-2的反应途径来合成,但并不局限于此。
<反应式4-2>
将溴苯(37.1g,236.2mmol)在圆底烧瓶中以甲苯(2200mL)溶解后,依次添加苯胺(20g,214.8mmol)、Pd
将3-溴二苯并[b,d]噻吩(42.8g,162.5mmol)在圆底烧瓶中以甲苯(1550mL)溶解后,添加[1,1'-联苯]-4-胺(25g,147.7mmol)、Pd
3.最终化合物的合成例
将Sub3-5(20.7g,52.0mmol)在圆底烧瓶中以甲苯(500mL)溶解后,添加Sub4-35(24.5g,59.8mmol)、Pd
向Sub3-6(20.7g,52.0mmol)、甲苯(500mL)、Sub4-1(8.0g,47.3mmol)、Pd
(1)Inter_A-1的合成
对于Sub3-22(24.8g,52.0mmol)、Sub4-2(11.6g,47.3mmol)、甲苯(500mL)、Pd
(2)2-54的合成
对于Inter_A-1(20.5g,32mmol)、Sub4-13(10.1g,36.7mmol)、甲苯(305mL)、Pd
对于Sub3-33(8.73g,22mmol)、Sub4-46(9.1g,25.2mmol)、Pd
对于Sub3-34(12.2g,22mmol)、Sub4-12(12.3g,25.4mmol)、Pd
对于Sub3-35(13.9g,24.1mmol)、Sub4-16(12.1g,55.4mmol)、Pd
根据上述合成例制备的本发明的化合物2-1至2-136的FD-MS值在以下表6中被示出。
[表6]
[实施例1]红色有机电气发光元件
在形成于玻璃基板上的ITO层(阳极)上真空沉积4,4',4”-三[2-萘基(苯基)氨基]三苯基胺(以下,简称为“2-TNATA”)膜来形成60nm厚度的空穴注入层后,在空穴注入层上真空沉积60nm厚度的N,N'-双(1-萘基)-N,N'-二苯基-(1,1'-联苯)-4,4'-二胺(以下简称为“NPB”)膜来形成空穴输送层。
之后,在空穴输送层上使用上述发明的化合物1-19作为主体,使用双(1-苯基异喹啉基)乙酰丙酮铱(III)(以下,简称为“(piq)
然后,上述发光层上以10nm的厚度真空沉积(1,1’-联苯-4-羟基)二(2-甲基-8-羟基喹啉)铝(以下,简称为“BAlq”)来形成空穴阻挡层,在上述空穴阻挡层上以40nm的厚度真空沉积二(10-羟基苯并[h]喹啉)铍(以下,简称为“BeBq
[实施例2]至[实施例13]
除了使用以下表7所记载的本发明的化合物来代替本发明的化合物1-19作为发光层的主体材料之外,以与上述实施例1相同的方法制成了有机电气发光元件。
[比较例1]至[比较例5]
除了使用比较化合物1至比较化合物5中的一种来代替本发明的化合物1-19作为发光层的主体材料之外,以与上述实施例1相同的方法制成了有机电气发光元件。
向通过本发明的实施例1至实施例13及比较例1至比较例5来制备的有机电气发光元件施加正向偏压直流电压,并利用美国photo research公司的PR-650来测定电发光(EL)特性。在2500cd/m
[表7]
从上述表7可确认,相较于将比较化合物1至比较化合物5作为发光层的磷光主体来使用的元件(比较例1至比较例5),将以本发明的化学式1-F或1-G表示的化合物作为发光层的磷光主体材料来使用的元件(实施例1至实施例13)的电气特性得到了显著改善。
比较化合物1至比较化合物5与本发明的化合物,在基本骨架包含三嗪与融合芳香族环的杂环的这一点上类似,但与本发明的化合物的区别在于,在比较化合物1中,三嗪与苯并[b]萘并[2,3-d]呋喃直接结合,而在比较化合物2中,三嗪与苯并[b]萘并[2,3-d]呋喃以苯基连接基连接。另外,虽然比较化合物3与比较化合物2整体上类似,但在苯并[b]萘并[2,1-d]呋喃与三嗪连接上具有区别。而且与本发明的化合物(化学式1-F)类似点在于,在比较化合物4中,三嗪与四环之间具有三环的连接基,但区别在于,与三嗪以连接基连接的四环的杂环的杂元素为N,而比较化合物5的区别在于,苯并[b]萘并[2,3-d]呋喃与三嗪之间导入有苯基-萘基连接基,三嗪在邻位(ortho)位置结合于萘基。
对比较例1至比较例3进行比较,相较于三嗪与苯并[b]萘并[2,3-d]呋喃直接结合的比较化合物1(以下,也称为“Trz-fused DBF”),将在三嗪与苯并萘并呋喃之间导入有连接基的比较化合物2、3(以下,也称为“Trz-L-fused DBF”)作为主体来使用时,元件的电气特性更为优秀。
比较比较例2与比较例3可知,虽然在具有作为追加融合(fused)芳香族环的形态的二苯并呋喃的一点上相同,但相较于使用包含苯并[b]萘并[2,1-d]呋喃的比较化合物3,当使用包含苯并[b]萘并[2,3-d]呋喃的比较化合物2时电气特性更为优秀。
因此,可知,结合于三嗪的融合杂环具有线型(linear)的融合结构,且在三嗪与四环杂环之间导入连接基会影响元件的性能改善。由此可知,化合物的骨架和结构上的差异是能够影响元件的电气特性的。
比较化合物2与比较化合物5虽然在三嗪与苯并[b]萘并[2,3-d]呋喃之间导入连接基的一点上相同,但区别在于,连接基分别为苯基、苯基-萘基,而相较于比较例5,比较例2虽然在元件的效率方面略有改善,但在寿命方面则示出降低的结果。这是因为,比较化合物5虽因作为连接基的苯基-萘基的结构特性而能量等级改变从而导致元件的效率降低,但由于化合物的分子量增加而使得寿命得到了改善。
另外,在三嗪与融合杂环之间作为连接基而具有特定杂环基的比较化合物4,因具有杂环基连接基从而使得化合物的热稳定性增加,因此相较于使用比较化合物1~3、5,元件的电气特性得到改善。
因此,比较比较例1至5与本发明的化合物可确认,三嗪与具有线型结构的融合杂环以微弯曲结构(在间位(meta-)或对位(para-)的位置结合的结构而非在邻位(ortho-)的位置结合的结构)的连接基为媒介相互连接,当像二苯并噻吩或二苯并呋喃一样的特定取代基作为连接基导入时,表现出最好的性能。
以本发明的化学式1-F或化学式1-G表示的本发明化合物,在三嗪与苯并[b]萘并[2,3-d]噻吩或苯并[b]萘并[2,3-d]呋喃(以下,也称为“fused DBT/DBF”)之间必然存在有连接基,作为连接基导入像萘基、二苯并呋喃、二苯并噻吩一样的特定连接基,因此相较于比较例1至比较例5,元件特性显著得到改善。
即,如同以本发明的化学式1-G表示的化合物(化合物1-91、1-92、1-103、1-148、1-149),在三嗪与fused DBT/DBF之间作为连接基具有萘时,和三嗪与fused DBT/DBF以单键连接的比较化合物1、以苯基连接基连接的比较化合物2、以苯基-萘基连接基连接的比较化合物5相比,元件的特性显著得到改善。
这可以用各化合物的LUMO值进行说明。下述表8表示比较化合物1、2、5及本发明的化合物1-103的LUMO值。
[表8]
参照上述表8,在比较化合物中比较化合物2的LUMO能级最低,相较于比较化合物2,本发明的化合物的LUMO能级更低(deep)。
因此可知,当苯基连接基存在时,相较于连接基不存在,LUMO能级更低,相较于苯基连接基,当作为像本发明的化合物一样的萘连接基时,LUMO能级会更降低。另外,相较于将ortho-萘基作为连接基包含的比较化合物5,将meta-萘基作为连接基包含的本发明的实施例的化合物1-103的LUMO能级更低(deep)。
这启示出,根据连接基的种类及分子的弯曲程度,化合物的物性会显著不同,相较于比较化合物1、2、5,以本发明的化学式1-G表示的化合物具有电子容易向发光层转移的适宜的LUMO能级,因此判断元件特性得到了改善。
而且,可知,以本发明的化学式1-F表示的化合物(化合物1-121、1-122、1-158、1-160、1-172、1-173、1-174),在三嗪与fused DBT/DBF之间导入有像DBF、DBT一样的特定连接基。将导入有这样的特定连接基的化合物作为主体来使用时(实施例4、5、9~13),相较于比较化合物4,元件的寿命得到改善,由此,在以本发明的化学式1-F表示的化合物中,当融合杂环的杂元素为0或S而非N的情况下,元件的寿命得到提升。
而且,与将以本发明的化学式1-G表示的化合物作为主体使用时(实施例1~3、实施例6~8)相比,当使用以本发明的化学式1-F表示的化合物时(实施例4、5、9~13),元件的寿命得到提升,而这是由于就分子量而言,因化学式1-F更大而沉积温度低使得化合物的热稳定性增加的缘故。
另外,就本发明的实施例12、13而言,元件的寿命显著得到改善,由此,当结合于三嗪的四环(苯并萘并噻吩、苯并萘并呋喃)的苯环结合除氢(H)之外的取代基时,可确认到有机电气元件的特性得到了改善。这是因为相较于氢进行取代,结合于三嗪的四环的苯环结合除氢(H)之外的取代基时,会形成立体结构而具有低的沉积温度,并因分子量的增加使得玻璃化转变温度(Tg)提升,从而抑制沉积时的分解并使热稳定性得到了增加。
因此,从表7的结果可知,根据构成化合物的取代基的种类、取代位置及杂原子的种类,化合物的能量等级(HOMO、LUMO、T1等等)会显著不同,这样的化合物物性的差异,在元件沉积时,对于元件性能提升起到主要因子的作用,并导出相异的元件结果。进一步可知,像以本发明的化学式1-F及化学式1-G表示的化合物一样,在具有三嗪与fused DBT/DBF类型(type)的基本骨架的化合物中,作为连接基具有萘基和特定杂取代基,且fused DBT/DBF的融合方向具有线型结构的2,3-fused DBF/DBT结构是适合提升元件的性能的结构。
[实施例14]发光层的混合的磷光主体
在形成于玻璃基板上的ITO层(阳极)上真空沉积2-TNATA膜来形成60nm厚度的空穴注入层后,在空穴注入层上真空沉积60nm厚度的NPB膜来形成空穴输送层。
然后,在空穴输送层上形成厚度为30nm的发光层。此时,将以3:7的重量比的本发明的化合物1-61(第一主体)和由化合物2-9(第二主体)的混合物用作为主体,将(piq)
然后,上述发光层上以10nm的厚度真空沉积BAlq来形成空穴阻挡层,在上述空穴阻挡层上以50nm的厚度真空沉积BeBq
[实施例15]至[实施例73]
作为发光层的主体物质,如同在下述表9中的记载,除了使用了第一主体的化合物和第二主体的化合物的混合物的一点之外,以与上述实施例14相同的方法制成了有机电气发光元件。
[比较例6]至[比较例9]
作为发光层的主体物质,如同在下述表9中的记载,除了使用由单独的化合物1-61,化合物1-92,化合物1-145或者化合物1-160的一点之外,以与上述实施例14相同的方法制成了有机电气发光元件。
[比较例10]及[比较例11]
作为发光层的主体物质,如同在下述表9中的记载,除了使用了比较化合物6和比较化合物7的混合物、比较化合物6和比较化合物8的混合物的一点之外,以与上述实施例14相同的方法制备了有机电气发光元件。
向通过本发明的实施例14至实施例73及比较例6至比较例11来制备的有机电气发光元件施加正向偏压直流电压,并利用美国photo research公司的PR-650来测定电发光(EL)特性。在2500cd/m
[表9]
从上述表9可确认,在对以化学式1及化学式2表示的本发明的有机电致发光元件用化合物进行混合,从而作为磷光主体使用时(实施例14-73),相较于使用单一物质(比较例6-9)或混合比较化合物6-8而使用的元件(比较例10及11),驱动电压、效率及寿命显著得到改善。
即,可知,相较于将以化学式1表示的本发明的化合物分别作为单一主体来使用的比较例6至比较例9,在将混合2种化合物作为主体来使用的比较例10及比较例11的情况下,驱动电压降低并效率得到提升,在混合本发明的化合物来使用的实施例14-73的情况下,元件特性显著得到改善。
本发明的发明人从这样的结果判断出,混合化学式1的物质和化学式2的物质的混合物具有除各个物质具有的特性之外的其他新特性,从而使用这些各个物质及混合物来测量PL寿命(lifetime)。其结果,确认到,与单独化合物时不同地,在混合本发明的化学式1及化学式2的混合物的情况下,形成了新的PL波长。
这是由于,在混合本发明的化合物来使用时,不仅各个物质通过具备的能量等级来使电子和空穴移动,而且因借助于新领域(exciplex)的电子及空穴的移动或者能量传递而使得效率及寿命得到了增加。其中,上述新领域为具有因混合而形成的新的能量等级的新领域。这可以说是,在使用本发明的混合物时,混合薄膜显示出激基复合物的能量传递及发光过程的重要的例子。
而且,当将组合本发明的化合物来使用的情况下元件特性优秀的原因是,在以具有不仅对电子(electron)而且对空穴(hole)的稳定性、高T1等的特征的化学式1来表示的多环化合物中,混合以空穴特性强的化学式2表示的化合物时,因高T1和高LUMO能量值使得电子阻挡能力提升,更多的空穴快速且容易地移动至发光层,随之,空穴与电子的发光层内的电荷均衡(charge balance)增加,使得在发光层内部而非在空穴输送层界面顺利实现发光。其结果,减少了空穴输送层界面的劣化,从而极大化元件整体的驱动电压、效率及寿命。即,认为以化学式1及化学式2表示的化合物的组合实现电化学协同作用,从而提升了元件整体的性能。
[实施例74]及[实施例76]
如同下述表10中的记载,除了以7:3的重量比使用本发明的化合物1-92和化合物2-54以外,以与上述实施例14相同的方法制备了有机电气发光元件。
[实施例75]及[实施例77]
如同下述表10中的记载,除了以5:5的重量比使用本发明的化合物1-121和化合物2-117以外,以与上述实施例14相同的方法制备了有机电气发光元件。
向通过本发明的实施例74至实施例77来制备的有机电气发光元件施加正向偏压直流电压,并利用美国photo research公司的PR-650来测定的电发光(EL)特性,在2500cd/m
[表10]
从上述表10可知,当混合化合物1-92与化合物2-54,或混合化合物1-121与化合物2-117来使用时,混合比率为3:7的情况下,驱动电压、效率及寿命最为优秀,越增加第1主体的混合量,元件特性会越低下。这是因为相较于以化学式1表示的化合物(第1主体),当以空穴特性相对较强的化学式2表示的化合物(第2主体)的量多的情况下,会极大化发光层内的电荷均衡(charge balance)。
以上的说明仅为例示,只要是本发明所属技术领域的普通技术人员,就能在不脱离本发明的本质特性的范围内进行多种变形。因此,本说明书所公开的实施例并不用于限定本发明,而是用于说明本发明,本发明的思想和范围不会因这种实施例而受到限制。本发明的保护范围应根据发明要求保护范围来解释,与其等同范围内的所有技术应解释为包括在本发明的保护范围。
本专利申请根据美国专利法119条至121条,365条(35U.S.C§119至§121,§365),针对2018年12月06日在韩国申请的专利申请编号第10-2018-0156305号主张优先权,其全部内容作为参照文献合并于本专利申请。并且,除了在美国之外,若本专利申请在其他国家也以相同的理由而主张优先权,则其全部内容作为参照文献合并于本专利申请。
- 有机电气元件用化合物、利用其的有机电气元件及其电子装置
- 有机电气元件用化合物、利用其的有机电气元件及其电子装置
