胰腺细胞的扩增和分化方法以及应用
文献发布时间:2023-06-19 11:59:12
技术领域
本发明涉及生物技术领域,尤其涉及胰腺细胞的扩增和分化方法以及应用。
背景技术
糖尿病是一种以胰岛素分泌不足或周围组织胰岛素抵抗导致的高血糖为特征的慢性代谢紊乱疾病,晚期可导致全身组织器官,特别是眼、肾、心血管及神经系统的损害及其功能障碍和器官衰竭。药物治疗和胰岛素补充是糖尿病目前最常见的治疗方法,但并不能完全治愈糖尿病,同时难以阻止远期并发症的发生发展。
人类β细胞能够分泌胰岛素,降低血糖,以调节脂肪和蛋白质代谢,而人胚胎干细胞由于具有无限的增殖能力,理论上可以从其产生无限量的人类β细胞,因而近年来备受关注。现有技术中对胚胎干细胞进行逐步诱导能够得到具有胰岛素分泌功能的细胞,但诱导的过程程序复杂,周期长且成本高;另外,由胚胎干细胞诱导得到的细胞团中,具有胰岛素分泌功能的细胞占比一般不会超过30%,后期的纯化过程容易污染细胞团,从而使得到的具有胰岛素分泌功能的细胞具有潜在的致癌风险。因此,找到切实有效的胰岛细胞的替代细胞并获得足够数量的可用于细胞替代治疗的种子细胞刻不容缓。
因此,有必要开发一种新型的胰腺细胞的扩增和分化方法,以解决现有技术中存在的上述问题。
发明内容
本发明的目的在于提供一种胰腺细胞的扩增方法、分化方法以及应用,以提供良好的胰岛细胞的替代选择,避免现有技术中的胚胎干细胞衍生疗法的伦理方面的限制和可能带来的致癌风险,以及由于使用基因编辑方法改变基因序列而容易造成的非特异性及脱靶缺失等风险。
为实现上述目的,本发明的所述胰腺细胞的扩增方法,包括以下步骤:
S1:获取胰腺组织,所述胰腺组织来源于哺乳动物的胰腺导管;
S2:对所述胰腺组织依次进行消化处理、重悬处理和不连续密度梯度离心处理后,收集各密度梯度交界处的细胞团,然后去除所述细胞团中的胰岛细胞和腺泡细胞,得到原代细胞;
S3:采用扩增培养基对所述原代细胞进行扩增处理,以诱导所述原代细胞重编程,得到胰腺前体样细胞;
所述扩增培养基包括由若干小分子化合物组成的重编程物质,所述重编程物质包括生长因子、Rock信号通路抑制剂、WNT信号通路激动剂和TGF-β信号通路抑制剂。
本发明的所述扩增方法的有益效果在于:使用哺乳动物的胰腺导管作为所述胰腺前体样细胞的来源,并采用所述不连续密度梯度离心处理后,去除得到的所述细胞团中的胰岛细胞和腺泡细胞,保证了所述原代细胞中绝大部分细胞为胰腺导管上皮细胞,提高了所述胰腺前体样细胞的得率,同时避免了由于使用胚胎干细胞而带来的伦理方面的限制和可能带来的致癌风险;另外,所述步骤S3的所述扩增培养基包括由若干小分子化合物组成的重编程物质,且所述重编程物质包括生长因子、Rock信号通路抑制剂、WNT信号通路激动剂和TGF-β信号通路抑制剂,能够通过诱导所述原代细胞重编程的方式得到胰腺前体样细胞,避免了由于使用基因编辑方法改变基因序列而容易造成的非特异性及脱靶缺失等风险。
优选的,所述胰腺组织来源于人胰腺导管。
优选的,所述生长因子包括表皮细胞生长因子、肝细胞生长因子和成纤维细胞生长因子中的至少一种,所述扩增培养基中,所述表皮细胞生长因子、所述肝细胞生长因子和所述成纤维细胞生长因子中的任意一种的含量为5-100纳克/毫升。其有益效果在于:有利于促进所述原代细胞向胰腺前体样细胞转化。
优选的,所述扩增培养基中,所述Rock信号通路抑制剂的含量为2-15微摩尔/升,所述WNT信号通路抑制剂的含量为2-10微摩尔/升,所述TGF-β信号通路抑制剂的含量为0.5-20微摩尔/升。其有益效果在于:有利于促进所述原代细胞的增殖。
进一步优选的,所述Rock信号通路抑制剂为Y27632、Fasudil、Thiazovivin和SB-772077-B中的至少一种,所述WNT信号通路激动剂为重组WNT蛋白、重组R-spondin蛋白和糖原合成酶激酶3β抑制剂中的至少一种,所述糖原合成酶激酶3β抑制剂为BIO、CHIR99021和TWS119中的至少一种,所述TGF-β信号通路抑制剂为A83-01、RepSox和SB431542中的至少一种。
优选的,所述扩增培养基还包括基础培养基、血清和无血清神经元添加物,所述扩增培养基中,所述血清和所述无血清神经元添加物的总体积百分比不高于15%,所述血清的体积百分比为2-10%。
进一步优选的,所述重编程物质还包括脂类信号物质,所述扩增培养基中,所述脂类信号物质的含量为0.5-10微摩尔/升。
进一步优选的,所述脂类信号物质为1-磷酸鞘氨醇和溶血磷脂酸中的至少一种。
进一步优选的,所述基础培养基为MEM、DMEM、BME、DMEM/F12、RPMI1640、CMRL1066、WilliamE、Neurobasal和Fischers培养基中的至少一种,所述血清为胎牛血清,所述无血清神经元添加物为N2添加剂和B27添加剂中的至少一种。
优选的,所述步骤S2中,使用至少三种具有不同密度的分层剂进行所述不连续密度梯度离心处理,相邻所述分层剂分别为低密度分层剂和高密度分层剂,所述低密度分层剂的密度相对所述高密度分层剂的密度下降0.1-3%。其有益效果在于:有利于使绝大部分胰腺导管上皮细胞存在于相邻的密度梯度之间的交界处。
进一步优选的,所述步骤S2中,所述至少三种具有不同密度的分层剂中,密度最高的分层剂的密度不高于1.1克/毫升,密度最低的分层剂的密度不低于1.03克/毫升。
本发明的所述胰腺前体样细胞的分化方法包括:将所述胰腺前体样细胞接种于培养容器中,然后通过分化培养基诱导所述胰腺前体样细胞分化为胰岛样细胞。
本发明的所述分化方法的有益效果在于:由于所述胰腺前体样细胞由本发明的所述扩增方法得到,有利于得到胰岛细胞的良好替代细胞。
优选的,所述分化培养基包括若干小分子诱导剂,所述若干小分子诱导剂包括肝素、去乙酰化酶抑制剂、ALK5抑制剂、T3和GLP-1受体激动剂。其有益效果在于:有利于定向诱导所述胰腺前体样细胞分化为具有良好胰岛功能的所述胰岛样细胞。
进一步优选的,所述去乙酰化酶抑制剂为尼克酰胺和尼曲古抑菌素A中的至少一种,所述GLP-1受体激动剂为胰高血糖素样肽-1和Exendin-4中的至少一种。
进一步优选的,所述分化培养基还包括基础培养基和无血清神经元添加物,所述基础培养基为MEM、DMEM、BME、DMEM/F12、RPMI1640、CMRL1066、WilliamE、Neurobasal和Fischers培养基中的至少一种,所述无血清神经元添加物为N2添加剂和B27添加剂中的至少一种。
进一步优选的,所述分化培养基中,所述肝素的含量为5-15微克/毫升,所述去乙酰化酶抑制剂的含量为5-15毫摩尔/升,所述ALK5抑制剂的含量为5-15微摩尔/升,所述T3的含量为0.5-2微摩尔/升,所述GLP-1受体激动剂的含量为10-50纳摩尔/升。
本发明还提供给了由所述分化方法得到的胰岛样细胞的应用,包括:应用于体外高糖试剂的所述胰岛样细胞分泌胰岛素,以及将所述胰岛样细胞应用于动物模型的8周后,所述动物模型的体重变化率为-5%-+5%,血糖值为10-20毫摩尔/升。
附图说明
图1为本发明实施例的原代细胞加入扩增培养基后第1天的增殖情况照片;
图2为图1所示的原代细胞加入扩增培养基后第7天的增殖情况照片;
图3为本发明对比例的原代细胞加入扩增培养基后第1天的增殖情况照片;
图4为图3所示的原代细胞加入扩增培养基后第7天的增殖情况照片;
图5为本发明实施例的三种胰腺前体样细胞的增殖性能对比示意图;
图6为本发明实施例的一种胰腺前体样细胞增殖至第10代的增殖状态照片;
图7为本发明实施例的胰岛样细胞在100倍的放大倍数下的微观形貌图;
图8为本发明实施例和对比例的不同NSG重度免疫缺陷小鼠在移植实验完毕后的血糖值随时间的变化曲线;
图9为本发明实施例和对比例的不同NSG重度免疫缺陷小鼠在移植实验完毕后的体重随时间的变化曲线。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面结合附图对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。除非另外定义,此处使用的技术术语或者科学术语应当为本发明所属领域内具有一般技能的人士所理解的通常意义。本文中使用的“包括”等类似的词语意指出现该词前面的元件或者物件涵盖出现在该词后面列举的元件或者物件及其等同,而不排除其他元件或者物件。
现有技术中,尽管使用胚胎干细胞能够得到与人胰岛β细胞形态功能相似的单激素分泌细胞,其表达成熟β细胞标志物,例如PDX1,MAFA,Insulin等在移植入免疫缺陷的糖尿病小鼠体内后部分逆转了高血糖,但其功能及转录水平仍与真正的β细胞存在差距,潜在的致瘤性及伦理问题也限制了其在人体的应用。其他的非胰岛细胞如胃肠道上皮细胞,肝细胞等转化而来的β样细胞其分子和功能特性均与人β细胞差异较大,并存在表观遗传的不稳定状态。
针对现有技术存在的问题,本发明实施例提供了一种胰腺细胞的扩增方法,以及对经所述扩增方法得到的胰腺前体样细胞进行的分化方法。
本发明实施例主要试剂来源如下:
V型胶原酶、Ficoll细胞分离液、Percoll细胞分离液、链脲佐菌素、双硫腙、肝素、尼克酰胺、胎牛血清和T3来源于Sigma公司;HBSS缓冲液和Hanks液来源于碧云天生物科技有限公司;DMEM/F12来源于上海源培生物科技有限公司;N2添加剂、B27添加剂和Y27632来源于Thermo Fisher Scientific公司;表皮细胞生长因子、肝细胞生长因子和人成纤维细胞生长因子来源于PeproTech公司;Thiazovivin、SB431542、BIO、CHIR99021、1-磷酸鞘氨醇、溶血磷脂酸、A83-01、ALK5inhibitorⅡ和GLP-1来源于陶塑生化有限公司;转铁蛋白、胰岛素、Accutase细胞消化液来源于上海翊圣生物科技有限公司。
本发明实施例的所有统计分析均使用GraphPad Prism 7进行。为了比较两个平均值,使用two-tailed unpaired t-test来计算统计显着性。为了比较多个值,将one-wayANOVA与Dunnett校正一起使用进行多个值与单个值比较,将多个值相互比较时,进行Tukey校正。P值小于0.05被认为具有统计学意义。
所述扩增方法包括以下步骤:
S1:获取胰腺组织,所述胰腺组织来源于哺乳动物的胰腺导管;
S2:对所述胰腺组织依次进行消化处理、重悬处理和不连续密度梯度离心处理后,收集各密度梯度交界处的细胞团,然后去除所述细胞团中的胰岛细胞和腺泡细胞,得到原代细胞;
S3:采用扩增培养基对所述原代细胞进行扩增处理,以诱导所述原代细胞重编程,得到胰腺前体样细胞。
胰腺负责人体的内分泌和外分泌功能,胰腺的外分泌腺由腺泡和腺管组成,负责分泌并排出胰液,以辅助消化;内分泌腺由胰岛组成,负责调节机体的葡萄糖稳定水平,而胰岛中的内分泌细胞通常都是从胰腺导管干细胞连续分化而来,且有研究证明在某些病理条件下,胰腺导管是新生胰岛的来源。本发明实施例的所述步骤S1中,所述胰腺组织来源于哺乳动物的胰腺导管,有利于通过所述扩增方法和所述分化方法得到具有良好胰岛功能的细胞。
本发明实施例中,所述哺乳动物的胰腺导管不存在病变。
本发明实施例1-3中,所述哺乳动物为人,所述胰腺组织来源于人胰腺导管。
具体的,所述人胰腺导管不存在病变。
本发明一些实施例的所述步骤S2中,进行所述消化处理使用的消化试剂包含V型胶原酶。
本发明实施例1-3中,所述消化试剂为含有V型胶原酶的HBSS缓冲液,每100毫升消化试剂中含有1克V型胶原酶。
具体的,将所述胰腺组织用含有10%双抗的生理盐水反复冲洗以去除血污后,剪碎为1立方毫米左右的胰腺组织碎块并加入5倍体积的所述消化试剂,然后置于37℃的恒温振荡水浴中以120转/分钟的速率进行30分钟的消化;然后使用含胎牛血清的HBSS缓冲液终止所述消化,以完成所述消化处理。胎牛血清的质量浓度为10%,HBSS缓冲液的温度为4℃。
本发明一些实施例中,使用含胎牛血清的Hanks液终止所述消化,胎牛血清的质量浓度为10%,Hanks液的温度为4℃。
本发明一些具体的实施例中,所述消化试剂含有DNA酶、V型胶原酶和IV型胶原酶。
具体的,所述DNA酶的酶活力单位为15,所述IV型胶原酶的体积与所述V型胶原酶的体积相等,浓度均为1毫克/毫升。
本发明实施例1-3中,所述消化处理结束后,使用孔径为150微米的筛网对经所述消化处理后得到的消化产物过滤后,在1000g的离心力下离心3分钟后取沉淀,使用分层剂对所述沉淀进行重悬,得到细胞悬液。
本发明实施例的所述步骤S2中,为确定得到的所述原代细胞中的绝大部分细胞为胰腺导管上皮细胞,以提高所述胰腺前体样细胞的得率,需要收集各密度梯度交界处的细胞团,然后去除所述细胞团中的胰岛细胞和腺泡细胞。
本发明一些实施例的所述步骤S2中,使用至少三种具有不同密度的分层剂进行所述不连续密度梯度离心处理,相邻所述分层剂分别为低密度分层剂和高密度分层剂,所述低密度分层剂的密度相对所述高密度分层剂的密度下降0.1-3%,有利于使绝大部分胰腺导管上皮细胞存在于相邻的密度梯度之间的交界处。
进一步的,所述具有不同密度的分层剂中,密度最高的分层剂的密度不高于1.1克/毫升,密度最低的分层剂的密度不低于1.03克/毫升。
本发明一些实施例中,所述分层剂为Percoll细胞分离液。
本发明实施例1中,配置密度分别为1.075g/ml、1.045g/ml以及1.035g/ml的三种Percoll细胞分离液,并顺次加入到离心管中,然后放入经所述重悬处理后得到的细胞悬液,得到待离心悬液;对所述待离心悬液在4℃,2500g的离心力下离心15min,并控制注意加速度为3m/s
本发明一些具体的实施例中,每种密度的Percoll细胞分离液的体积相同,且为所述待离心悬液体积的2倍。
本发明实施例1中,每种密度的Percoll细胞分离液的体积为10毫升,所述待离心悬液的体积为5毫升。
本发明一些实施例中,所述分层剂为Ficoll细胞分离液。
本发明实施例2中,配置密度分别为1.088g/ml、1.076g/ml、1.066g/ml和1.040g/ml的四种Ficoll细胞分离液,并顺次加入到离心管中,然后放入所述待离心悬液;对所述待离心悬液在4℃,3000g的离心力下离心20min,并控制注意加速度为3m/s
本发明实施例3中,配置密度分别为1.1g/ml、1.080g/ml、1.060g/ml和1.040g/ml的四种Ficoll细胞分离液。
本发明实施例2和实施例3中,每种密度的Ficoll细胞分离液的体积为10毫升,所述待离心悬液的体积为5毫升。
本发明实施例的所述步骤S2中,存在于相邻的密度梯度之间的交界处细胞团包括导管上皮细胞、胰岛细胞、腺泡细胞以及其他类型的导管细胞,需要进一步去除所述细胞团中的胰岛细胞和腺泡细胞,以保证得到的所述原代细胞中的绝大部分细胞为胰腺导管上皮细胞。
本发明一些实施例中,对所述细胞团进行双硫腙(Dithizone,DTZ)染色后,在显微镜下手动去除呈现红色或猩红色的胰岛细胞,以及呈葡萄串珠样的腺泡细胞。具体的染色和去除方法为本领域技术人员的常规技术手段,在此不做赘述。
本发明实施例的所述步骤S3中,所述扩增培养基包括由若干小分子化合物组成的重编程物质,所述重编程物质包括生长因子、Rock信号通路抑制剂、WNT信号通路激动剂和TGF-β信号通路抑制剂,能够通过诱导所述原代细胞重编程的方式得到胰腺前体样细胞,避免了由于使用基因编辑方法改变基因序列而容易造成的非特异性及脱靶缺失等风险。
本发明一些实施例的所述步骤S3中,将所述原代细胞接种于预先包被有基质胶的培养皿中静置培养48小时后,然后使用所述扩增培养基继续所述扩增处理。
本发明一些实施例中,所述扩增培养基由基础培养基、血清、无血清神经元添加物以及所述重编程物质组成。所述扩增培养基中,所述血清和所述无血清神经元添加物的总体积百分比不高于15%。
本发明一些实施例中,所述扩增培养基中,所述血清的体积百分比为2-10%。
本发明一些具体的实施例中,所述基础培养基为MEM、DMEM、BME、DMEM/F12、RPMI1640、CMRL1066、WilliamE、Neurobasal或Fischers培养基中的至少一种。
本发明一些具体的实施例中,所述血清为胎牛血清,所述无血清神经元添加物为N2添加剂和B27添加剂中的至少一种。
本发明一些实施例中,所述生长因子包括表皮细胞生长因子、肝细胞生长因子和成纤维细胞生长因子,以有利于促进所述原代细胞的发育。所述扩增培养基中,所述表皮细胞生长因子、所述人肝细胞生长因子和所述人成纤维细胞生长因子的含量均为5-100纳克/毫升。
本发明一些实施例中,所述表皮细胞生长因子为人表皮细胞生长因子,所述肝细胞生长因子为人肝细胞生长因子,所述成纤维细胞生长因子为人成纤维细胞生长因子。
本发明一些实施例的所述扩增培养基中,所述Rock信号通路抑制剂的含量为2-15微摩尔/升。
具体的,所述Rock信号通路抑制剂为Y27632,Fasudil,Thiazovivin和SB-772077-B中的至少一种。
本发明一些实施例的所述扩增培养基中,所述WNT信号通路激动剂的含量为2-10微摩尔/升。
具体的,所述WNT信号通路抑制剂为重组Wnt蛋白,重组R-spondin蛋白和糖原合成酶激酶3β抑制剂中的至少一种。所述糖原合成酶激酶3β抑制剂为BIO,CHIR99021和TWS119中的至少一种。
本发明一些实施例的所述扩增培养基中,所述TGF-β信号通路抑制剂的含量为0.5-20微摩尔/升。
具体的,所述TGFβ信号通路抑制剂为A83-01,RepSox和SB431542中至少一种。
本发明一些实施例中,所述扩增培养基还包括脂类信号物质,所述脂类信号物质的含量为0.5-10微摩尔/升。
具体的,所述脂类信号物质为1-磷酸鞘氨醇和溶血磷脂酸中的至少一种。
本发明实施例1中,所述扩增培养基由DMEM/F12、胎牛血清、N2添加剂、B27添加剂、人表皮细胞生长因子、人肝细胞生长因子、人成纤维细胞生长因子、Y27632、CHIR99021、A83-01、1-磷酸鞘氨醇和溶血磷脂酸组成。
具体的,所述扩增培养基中,人表皮细胞生长因子的含量为20纳克/毫升,人肝细胞生长因子的含量为20纳克/毫升,人成纤维细胞生长因子的含量为20纳克/毫升、Y27632的含量为10微摩尔/升,CHIR99021的含量为3微摩尔/升,1-磷酸鞘氨醇的含量为1微摩尔/升,溶血磷脂酸的含量为5微摩尔/升,A83-01的含量为1微摩尔/升,所述胎牛血清的体积百分比为2%,N2添加剂的体积百分比为0.5%,B27添加剂的体积百分比为1%。
本发明实施例2的扩增培养基由DMEM/F12、胎牛血清、N2添加剂、B27添加剂、人表皮细胞生长因子、人成纤维细胞生长因子、人肝细胞生长因子、Thiazovivin、BIO和A83-01组成。
具体的,本发明实施例2的扩增培养基中,人表皮细胞生长因子的含量为20纳克/毫升,人成纤维细胞生长因子的含量为20纳克/毫升、Thiazovivin的含量为2微摩尔/升,BIO的含量为10微摩尔/升,A83-01的含量为1微摩尔/升,胎牛血清的体积百分比为5%、N2添加剂的体积百分比为0.5%,B27添加剂的体积百分比为1%。
本发明实施例3的扩增培养基由DMEM/F12、胎牛血清、N2添加剂、B27添加剂、人表皮细胞生长因子、人成纤维细胞生长因子、人肝细胞生长因子、Y27632、CHIR99021和SB431542组成。
具体的,本发明实施例3的扩增培养基中,人表皮细胞生长因子的含量为20纳克/毫升,人肝细胞生长因子的含量为20纳克/毫升,Y27632的含量为10微摩尔/升,CHIR99021的含量是3微摩尔/升,SB431542的含量为10微摩尔/升,胎牛血清的体积百分比为5%、N2添加剂的体积百分比为0.5%、B27添加剂的体积百分比为1%。
本发明实施例的对比例1中,对比扩增培养基由DMEM/F12、表皮细胞生长因子、胎牛血清、转铁蛋白和胰岛素组成,胎牛血清的体积百分比为10%,表皮细胞生长因子的含量为20纳克/毫升,转铁蛋白的含量为5微克/毫升,胰岛素的含量为10微克/毫升。
本发明实施例1和对比例1中,所述扩增处理的时间至少为72小时,待细胞贴壁后每48小时更换所述扩增培养基,除所述扩增培养基的组成不同外,所述步骤S1至S3的其他操作控制均相同。
本发明实施例1考察了所述原代细胞中的胰岛细胞和腺泡细胞的去除程度。使用所述扩增培养基对所述原代细胞进行3天的静置培养,发现大部分细胞贴壁并平铺为单细胞层,利用RT-PCR技术对这些细胞进行相关基因表达的检测。具体的检测方法请参见CN108330099A,在此不做赘述。
具体的,所述原代细胞显著表达HNF1B、CK19以及FOXA2,表达量分别可达3000、300000和10000,而在与腺泡细胞和胰岛细胞相关的基因中,仅HNF1A和INS有表达的现象,但表达量均低于100,几乎可以忽略不计,说明所述原代细胞中的胰岛细胞和腺泡细胞几乎可以忽略不计。
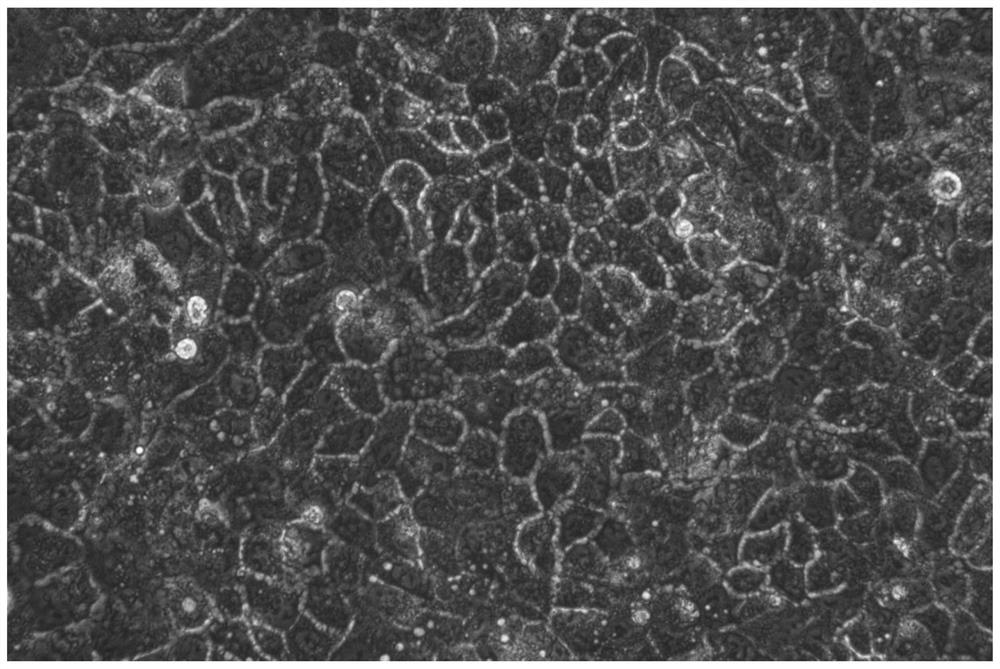
图1和图2分别为本发明实施例1的原代细胞加入扩增培养基后第1天和第7天的增殖情况照片,图3和图4分别为本发明对比例1的原代细胞加入扩增培养基后第1天和第7天的增殖情况照片。
参照图1和图2,本发明实施例1的原代细胞在加入扩增培养基后第1天就表现出了显著的增殖,第7天表现出了明显的扩增。
参照图3和图4,对比例1的原代细胞在加入扩增培养基后第1天的增殖情况不显著,直至第7天也没有出现明显的扩增,可见本发明实施例的所述扩增培养基能够赋予所述原代细胞强大的扩增能力,有利于解决胰岛细胞的替代细胞得率低的问题。
本发明实施例1-3分别考察了所述胰腺前体样细胞的增殖性能,并通过Edu渗入实验进一步考察了增殖至第10代的胰腺前体样细胞的增殖状态。
具体的,将5000个待考察前体细胞接种于预包被有基质胶的六孔板中静置24小时,然后消化细胞并使用countstar计数,计算倍增时间。具体的技术方法以及倍增时间的计算方法请参见http://www.doubling-time.com/compute.php。
所述Edu渗入实验使用碧云天生物科技有限公司的BeyoClickTMEdU-488细胞增值检测试剂盒将第10代细胞染色,由Hoechst33342标定细胞核,然后用NikonTs2-FL荧光倒置显微镜拍照。
图5为本发明实施例1-3的胰腺前体样细胞的增殖性能对比示意图。
参照图5,由图5所示的实施例1-3的胰腺前体样细胞的增殖性能可以得到实施例1、2和3的胰腺前体样细胞的倍增时间分别为14小时、15小时和12小时。可见,三种胰腺前体样细胞具有良好的增殖能力。
图6为本发明实施例1的胰腺前体样细胞增殖至第10代的增殖状态照片,可见本发明实施例1的所述胰腺前体样细胞至少增殖至第10代,仍能保持活跃的增殖状态。
本发明实施例1-3中的每种胰腺前体样细胞的传代次数分别为15、16和22。
本发明实施例1-3中,将每种胰腺前体样细胞增殖形成的第10代细胞与100纳克/毫升的秋水仙碱在37℃下孵育40分钟,然后洗涤得到的培养物,并使用Accutase细胞消化液将其解离为单细胞,以进行核型分析并计数至少40个中期停滞细胞的染色体。所述核型分析在杭州极地基因有限公司核型分析部门进行。其中,每种胰腺前体样细胞增殖至第10代仍处于指数增长期。所述核型分析的结果发现细胞仍能保持稳定的二倍体核型而不会发生变异。
本发明实施例1-3中,通过流式细胞术考察加入所述扩增培养基后的第5天和第9天得到的每种胰腺前体样细胞的干细胞相关标志物的表达水平。
一方面,EpCAM、Pdx1以及Krt19在加入所述扩增培养基后的第5天和第9天后均显著表达,表明本发明实施例得到的所述胰腺前体样细胞获得了部分的前体细胞特性。所述流式细胞术的具体操作方法请参见CN108330099A,在此不做赘述。
具体的,以加入所述扩增培养基后的第5天通过流式细胞术统计表达干细胞相关标志物EpCAM、Pdx1以及Krt19的阳性细胞数占比为例,分别为99.2±0.7%,74.8±2.3%和92.0±4.7%。
另一方面,表1统计了和胰腺组织相比,本发明实施例1-3的胰腺前体样细胞表达腺泡相关标志物、内分泌相关标志物以及导管或前体相关标志物的平均表达水平,具体的统计方法为本领域技术人员的常规技术手段。
表1
从表2中可以看到:
相较于胰腺组织的腺泡相关标志物,具体为Ptf1a、Gata4和Cpa1的表达水平,本发明实施例的胰腺前体样细胞中上述腺泡相关标志物的表达水平极低,证明通过本发明实施例的所述步骤S2有效去除了腺泡细胞。
相较于胰腺组织的内分泌相关标志物,具体为Nkx2.2、Mafb、Gcg、Sst和Ins的表达水平,本发明实施例的胰腺前体样细胞中上述内分泌相关标志物的表达水平极低,证明本发明实施例的胰岛样细胞的内分泌功能确实来源于分化后的胰腺前体样细胞。
相较于胰腺组织的导管或前体相关标志物,具体为Pdx1、Nkx6.1、Foxa2、Hnf1b、EpCAM和Krt19的表达水平,本发明实施例获得的胰腺前体样细胞中上述导管或前体相关标志物的表达水平相差并不大,证明本发明实施例获得的胰腺前体样细胞具有分化为具有内分泌功能的胰岛样细胞的潜力。
本发明实施例的所述胰腺前体样细胞的分化方法包括:将所述胰腺前体样细胞接种于培养容器中,然后通过分化培养基诱导所述胰腺前体样细胞分化为胰岛样细胞。
本发明一些实施例中,所述分化培养基包括若干小分子诱导剂,所述若干小分子诱导剂包括肝素、去乙酰化酶抑制剂、ALK5抑制剂、T3和GLP-1受体激动剂,以有利于定向诱导所述胰腺前体样细胞分化为具有良好胰岛功能的所述胰岛样细胞。
本发明一些实施例的所述分化培养基中,所述肝素的含量为5-15微克/毫升,所述去乙酰化酶抑制剂的含量为5-15毫摩尔/升,所述ALK5抑制剂的含量为5-15微摩尔/升,所述T3的含量为0.5-2微摩尔/升,所述GLP-1受体激动剂的含量为10-50纳摩尔/升。
本发明一些实施例中,所述分化培养基由基础培养基、无血清神经元添加物和所述若干小分子诱导剂组成。
本发明一些实施例中,所述去乙酰化酶抑制剂为尼克酰胺和尼曲古抑菌素A中的至少一种。
本发明一些实施例中,所述GLP-1受体激动剂为GLP-1和Exendin-4中的至少一种。
本发明一些实施例中,所述分化培养基中的基础培养基为MEM、DMEM、BME、DMEM/F12、RPMI1640、CMRL1066、WilliamE、Neurobasal和Fischers培养基中的至少一种。
本发明一些具体的实施例中,所述分化培养基中的无血清神经元添加物为N2添加剂和B27添加剂中的至少一种。
本发明实施例1中,所述分化培养基由DMEM/F12培养基、N2添加剂、B27添加剂、尼克酰胺、肝素、ALK5inhibitorⅡ、T3和GLP-1组成。
具体的,所述分化培养基中,N2添加剂和B27添加剂的体积百分比均为5%,尼克酰胺的含量为10毫摩尔/升,肝素的含量为10微克/毫升,ALK5inhibitorⅡ的含量为10毫摩尔/升,T3的含量为1微摩尔/升,GLP-1的含量为30纳摩尔/升。
本发明实施例2和3中的分化培养基具有与实施例1的分化培养基相同的物质组成。
本发明实施例2的分化培养基中,N2添加剂和B27添加剂的体积百分比均为3%,尼克酰胺的含量为5毫摩尔/升,肝素的含量为5微克/毫升,ALK5inhibitorⅡ的含量为5毫摩尔/升,T3的含量为0.5微摩尔/升,GLP-1的含量为10纳摩尔/升。
本发明实施例3的分化培养基中,N2添加剂和B27添加剂的体积百分比均为10%,尼克酰胺的含量为15毫摩尔/升,肝素的含量为15微克/毫升,ALK5inhibitorⅡ的含量为15毫摩尔/升,T3的含量为2微摩尔/升,GLP-1的含量为50纳摩尔/升。
本发明实施例1-3中,所述分化培养的时间为7-10天,每48小时更换所述分化培养基。
图7为本发明实施例1得到的胰岛样细胞在100倍的放大倍数下的微观形貌图。参照图7,所述胰岛样细胞呈现出明显的轮廓,轮廓形状类似多边形。
本发明实施例1-3中,以GAPDH为内参照基因,使用Q-PCR方法检测每种胰腺前体样细胞和对应的胰岛样细胞的CK19、SOX9、NKX2-2、PDX1、INS、GCG、SST以及MAFA的基因水平。
一方面,在mRNA水平上,与未分化的胰腺前体样细胞相比,胰岛样细胞的前体相关基因CK19和SOX9的表达水平有所下降。
以实施例1为例,CK19的表达水平下降80%,SOX9的表达水平下降30%。
另一方面,在mRNA水平上,与未分化的胰腺前体样细胞相比,成熟胰岛相关基因,诸如PDX1、NKX2-2、MAFA、INS、GCG以及SST的表达水平有显著上调。
以实施例1为例,PDX1的表达水平上调110%,NKX2-2的表达水平上调300%,MAFA的表达水平上调200%,INS的表达水平上调350%,GCG的表达水平上调220%,SST的表达水平上调900%。
进一步的,对实施例1-3的胰岛样细胞进行体外胰岛素激发分泌实验,以考察胰岛样细胞的胰岛功能。
首先通过Krb缓冲液配置低糖Krb缓冲液、高糖Krb缓冲液和Krb激发溶液;取1×10
具体的,所述Krb缓冲液具有128mM NaCl、5mM KCl、2.7mM CaCl
所述低糖Krb缓冲液中,葡萄糖的浓度为2毫摩尔/升;所述高糖Krb缓冲液缓冲液中,葡萄糖的浓度为20毫摩尔/升。所述Krb激发溶液中,葡萄糖的含量为2毫摩尔/升,KCl的浓度为30毫摩尔/升。
所述体外胰岛素激发分泌实验的表明,对于实施例1的胰岛样细胞来说,每10
对于实施例2的胰岛样细胞来说,每10
对于实施例3的胰岛样细胞来说,每10
另外,以实施例1为例,由高糖分泌的胰岛素与低糖分泌的胰岛素之比计算得出的刺激指数为2.2±0.4。
综合所述体外胰岛素激发分泌实验的实验结果可知,应用于体外高糖试剂的所述胰岛样细胞能够有效分泌胰岛素,所述胰岛样细胞具有分化为胰岛细胞的潜力。
本发明实施例1-3将所述胰岛样细胞应用于动物模型,考察实验动物的体重变化率和血糖值。
具体的,将柠檬酸缓冲液以1%的浓度溶解链脲佐菌素(Streptozocin,STZ),形成注射液。对NSG重度免疫缺陷小鼠称重后以130mg/kg腹腔注射所述注射液。注射完毕的一周后,NSG重度免疫缺陷小鼠血糖值≥20mM即视为建立了NSGⅠ型糖尿病模型。将1×10
本发明实施例还提供了对比例2,对NSG重度免疫缺陷小鼠按130mg/kg腹腔注射所述注射液后,将基质胶移植入造模成功的NSG重度免疫缺陷小鼠的肾被膜下,其余应用于动物模型的过程与实施例1-3相同。
图8和图9分别为实施例1-3以及对比例2的NSG重度免疫缺陷小鼠在所述移植实验完毕后的第2、4、6和8周的血糖值随时间的变化曲线和体重随时间的变化曲线。可见,所述移植实验完毕后的8周内,实施例1-3的所述动物模型的体重变化率为-5%-+5%,血糖值为10-20毫摩尔/升,表明本发明实施例的所述胰岛样细胞能有效协助控制血糖和体重。
虽然在上文中详细说明了本发明的实施方式,但是对于本领域的技术人员来说显而易见的是,能够对这些实施方式进行各种修改和变化。但是,应理解,这种修改和变化都属于权利要求书中所述的本发明的范围和精神之内。而且,在此说明的本发明可有其它的实施方式,并且可通过多种方式实施或实现。
- 胰腺细胞的扩增和分化方法以及应用
- 人类胰腺腺泡细胞体外扩增并转分化为胰岛素产生细胞的方法
