一种钼纳米点在制备用于治疗急性肺损伤/急性呼吸窘迫综合征的药物中的应用
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及一种钼纳米点,具体涉及一种钼纳米点在制备用于治疗急性肺损伤/急性呼吸窘迫综合征的药物中的应用。
背景技术
急性肺损伤(ALI)及其严重形式急性呼吸窘迫综合征(ARDS)是临床上常见的呼吸危重症,可由严重的肺部感染等肺内原因和全身严重感染、休克等肺外原因所致。全球范围内每年ARDS患者300多万,占重症监护病房(ICU)患者的10%。一项横跨全球5大洲、共50个国家的医院参与的研究显示,轻、中、重症ARDS的死亡率分别为34.9%,40.3%和46.1%。目前对ARDS的治疗主要分为机械通气治疗与非机械通气治疗两大类,除处理原发疾病以外,对ARDS的治疗基本处于对症治疗阶段。
尽管ALI/ARDS的发病机制复杂且目前尚未明确,但许多研究报道过度产生的活性氧(ROS)和不可控的炎症反应在ALI/ARDS疾病的发生发展中起着关键作用。疾病发生时,大量炎症细胞迁移到肺泡腔并被激活,一方面被激活后的炎症细胞会释放细胞毒性物质如ROS和炎症因子等,这些物质会进一步损伤毛细血管内皮细胞和肺泡上皮细胞;另一方面,肺泡毛细血管屏障的通透性增加促进炎性细胞在肺泡内聚集和浸润从而释放更多细胞毒性物质,造成组织损伤。如果加速ROS清除并控制过度炎症反应,打破这个恶性循环,有望改善ALI/ARDS。然而如糖皮质激素、N-乙酰半胱氨酸(NAC)等临床前研究中被认为很有前景的抗炎和抗氧化药物,在临床实验中并没有达到预期的结果或研究结果尚存在争议。
随着纳米技术和生物医学技术的深入交叉融合,越来越多功能性纳米材料被引入医学领域,大量研究证明了多种具有抗炎与抗氧化功能的纳米材料可以改善各类疾病模型。如《Supramolecular arrangement of protein in nanoparticle structurespredicts nanoparticle tropism for neutrophils in acute lung inflammation》中提出具有凝集蛋白的纳米颗粒(NAPs)对炎症具有特异性,但仅部分NAPs结合DBCO(20×)-IgG脂质体使用时能够缓解ALI/ARDS的进程,且未能明确作用机理,也未验证具体的治疗性能。因而,该技术仅说明了纳米颗粒的使用可能可以用于炎症的诊断和治疗。如《Nano-enabledreposition of proton pump inhibitors for TLR inhibition:toward a new targetednanotherapy for acute lung injury》中开发出一种多肽-金纳米复合物P12,可通过调控内涵体的pH值来抑制TLR的活化实现抗炎作用,但是该复合物制备存在一定难度和复杂性,对于规模化生产和应用提出了挑战。
由上可见,现有技术中虽有提出纳米颗粒或纳米材料用于实现抗炎作用,但由于缺乏实验验证或制备流程复杂等各种不足,导致少有技术应用于ALI/ARDS的治疗中。因此,需要提出一种制备简单、具有良好抗氧化与抗炎效果,且作用机理明确的材料应用于ALI/ARDS的治疗中。
发明内容
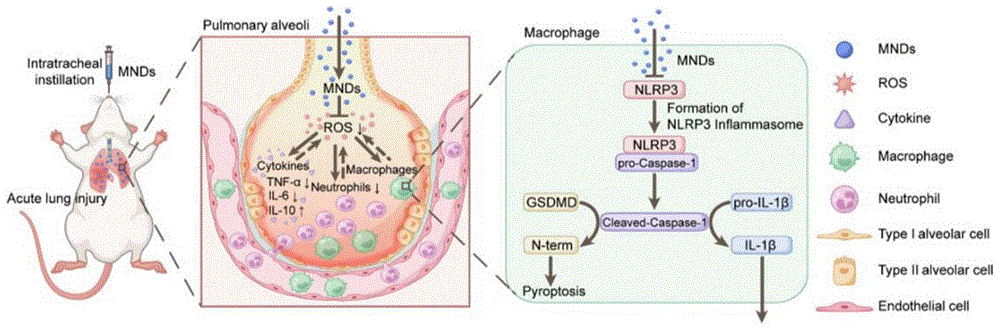
本发明的目的就是为了解决上述问题至少其一而提供一种钼纳米点在制备用于治疗急性肺损伤/急性呼吸窘迫综合征的药物中的应用,以解决现有技术中缺少作用机理明确、制备简单、具有临床转化意义的ALI/ARDS治疗药物。基于钼原子的强还原作用,实现了在肺组织部位清除过量的ROS,通过抑制NLRP3依赖性焦亡通路,发挥抗炎与抗氧化作用,从而改善肺组织损伤情况,有望作为一种安全、有效、具有临床转化意义的ALI/ARDS治疗药物。
本发明的目的通过以下技术方案实现:
一种钼纳米点在制备用于治疗急性肺损伤/急性呼吸窘迫综合征的药物中的应用。
优选地,所述的急性肺损伤/急性呼吸窘迫综合征为细菌感染所致的急性肺损伤/急性呼吸窘迫综合征。
优选地,所述的钼纳米点通过清除肺部的过量ROS实现抗炎作用和抗氧化作用。
优选地,所述的钼纳米点通过抑制NLRP3炎症小体激活实现抗炎作用和抗氧化作用。
优选地,所述的药物的剂型包括注射剂、透皮制剂、经肺吸入的给药制剂和冻干制剂。
优选地,所述的经肺吸入的给药制剂包括气雾剂或鼻喷雾剂。
优选地,所述的药物的给药途径包括气管内给药、注射给药和吸入给药。
优选地,所述的药物的作用对象包括哺乳动物。
优选地,所述的哺乳动物包括人、猴、大鼠、小鼠、兔、猫、狗、羊和猪。
优选地,所述的钼纳米点通过如下方法制备:
S1:将钼粉末与异丙醇按3g:50mL的用量混合,在冰浴下进行机械剥离;
S2:静置步骤S1得到的混合液并取其上清液,通过旋蒸除去异丙醇后,将固体溶解于去离子水中,通过高速离心分离得到钼纳米点。
与现有技术相比,本发明具有以下有益效果:
本发明提出钼纳米点用于治疗ALI/ARDS,该纳米颗粒具有良好的生物相容性和活性氧清除能力,可很好地发挥抗炎和抗氧化作用。体外研究验证了该钼纳米点具有清除ROS和保护细胞的作用。动物实验验证了气管滴注给予钼纳米点治疗可显著缓解脂多糖(LPS)诱导和铜绿假单胞菌(P.aeruginosa)感染的两种ALI小鼠模型;通过气管滴注(i.t.)和静脉注射(i.v.)途径给予钼纳米点,验证钼纳米点不会对小鼠产生毒性作用;通过对小鼠肺组织的RNA-seq测序发现该纳米材料可通过抑制NLRP3炎症小体激活从而抑制焦亡来发挥治疗作用。总之,本发明提供的钼纳米点是一种安全、有效、具有临床转化意义的肺部炎症性疾病治疗药物,在ALI/ARDS治疗上是一个理想的候选者。
附图说明
图1为通过CCK-8试剂盒检测钼纳米点(MNDs)与RAW 264.7共培养后的细胞活性曲线(n=3,平均值±SD),采用One-way ANOVA with Tukey’s multiple comparisons test进行分析,其中,a为共培养24小时,b为共培养48小时;
图2为通过CCK-8试剂盒检测MNDs与MLE-12共培养后的细胞活性曲线(n=3,平均值±SD),采用One-way ANOVA with Tukey’s multiple comparisons test进行分析,其中,a为共培养24小时,b为共培养48小时;
图3为在RAW 264.7和MLE-12两种细胞系上验证MNDs清除ROS的能力,采用One-wayANOVA with Tukey’s multiple comparisons test进行分析,其中,a,流式分析:在H
图4为在LPS诱导的ALI小鼠中验证MNDs抗氧化作用,采用One-way ANOVA withTukey’s multiple comparisons test进行分析,ns不显著,其中,a,LPS诱导的ALI小鼠模型的实验设计流程,b,各组小鼠肺组织ROS染色的相对荧光强度(n=4-5,平均值±SD),c,DHE对各组肺组织的ROS荧光染色代表图(红色荧光)(n=4-5),d,各组BALF中髓过氧化物酶(MPO)水平(n=4-5,平均值±SD),e,各组肺组织中超氧化物歧化酶(SOD)活性(n=4-5,平均值±SD),f,各组脂质过氧化物(MDA)活性(n=4-5,平均值±SD);
图5为在LPS诱导的ALI小鼠中验证MNDs抗炎作用,采用One-way ANOVA withTukey’s multiple comparisons test进行分析,ns不显著,其中,a,各组小鼠BALF中白细胞(WBC)计数(n=4-5,平均值±SD),b,各组小鼠BALF中中性粒细胞计数(n=4-5,平均值±SD),c,免疫荧光标记各组肺组织F4/80(巨噬细胞,绿色荧光)和Ly6G(中性粒细胞,红色荧光)的代表图(n=4-5),d,各组肺组织F4/80的相对荧光强度(n=4-5,平均值±SD),e,各组肺组织Ly6G的相对荧光强度(n=4-5,平均值±SD),f,各组BALF中促炎因子肿瘤坏死因子α(TNF-α)水平(n=4-5,平均值±SD),g,各组BALF中白介素6(IL-6)水平(n=4-5,平均值±SD),h,各组BALF中抑炎因子白介素10(IL-10)水平(n=4-5,平均值±SD),i,各组BALF中蛋白水平(n=4-5,平均值±SD),j,各组肺组织肺湿干比(n=4-5,平均值±SD),k,各组肺组织H&E染色代表图(n=4-5),l,各组肺组织损伤评分(n=4-5,平均值±SD);
图6为在铜绿假单胞菌(PAO1)感染诱导ALI小鼠模型上验证MNDs的抗氧化和抗炎作用,采用One-way ANOVA with Tukey’s multiple comparisons test进行分析,ns不显著,其中,a,DHE对各组肺组织的ROS染色代表图(红色荧光)(n=4-5),b,各组小鼠肺组织ROS染色的相对荧光强度(n=4-5,平均值±SD),c,各组小鼠BALF中白细胞(WBC)计数(n=4-5,平均值±SD),d,各组小鼠BALF中中性粒细胞计数(n=4-5,平均值±SD),e,各组BALF中蛋白水平(n=4-5,平均值±SD),f,各组肺组织肺湿干比(n=4-5,平均值±SD),g,各组BALF中促炎因子肿瘤坏死因子α(TNF-α)水平(n=4-5,平均值±SD),h,各组BALF中白介素6(IL-6)水平(n=4-5,平均值±SD),i,各组BALF中抑炎因子白介素10(IL-10)水平(n=4-5,平均值±SD),j,各组肺组织H&E染色代表图(n=4-5),k,各组肺组织损伤评分(n=4-5,平均值±SD);
图7为RNA-seq中PCA分析显示两组的多样性(n=5);
图8为通过RNA-seq分析进一步探索和验证MNDs发挥治疗作用的机制,采用One-way ANOVA with Tukey’s multiple comparisons test进行分析,ns不显著,其中,a,ALI-MNDs组和ALI组差异表达基因火山图(倍数变化>1.5;p-adjust<0.05),b,ALI-MNDs组和ALI组差异表达基因中与炎症反应相关基因的反应热图,c,ALI-MNDs组和ALI组基因表达对炎症小体复合物相关的基因集富集分析(GSEA),d,各组小鼠肺组织中Nlrp3的mRNA水平(n=4-5,平均值±SD),e,各组小鼠肺组织中Casp1的mRNA水平(n=4-5,平均值±SD),f,各组小鼠肺组织中Gsdmd的mRNA水平(n=4-5,平均值±SD),g,各组小鼠肺组织中Il1b的mRNA水平(n=4-5,平均值±SD),h,各组肺组织中与NLRP3依赖性焦亡通路有关的关键蛋白表达的蛋白质印迹分析(n=3),i,ELISA法测定各组肺组织中白介素1β(IL-1β)的水平(n=4-5,平均值±SD),j,各组肺组织caspase-1免疫组化代表图(n=4-5);
图9为RNA-seq分析中两组差异表达基因的KEGG富集通路前20条;
图10为MNDs治疗ALI/ARDS的机理示意图;
图11为健康小鼠分别通过气管滴注和静脉注射给予MNDs后1天的:a,肝功能指标,b,肾功能指标,c-g,血常规指标,h,主要器官(肝脏、脾脏、肾脏、心脏和肺)的脏器指数,i,肝脏与肾脏的碱性磷酸酶(ALP)水平,j,肝脏中的铜元素含量,采用One-way ANOVA withTukey’s multiple comparisons test进行分析(n=5,平均值±SD);
图12为健康小鼠分别通过气管滴注和静脉注射给予MNDs后28天的:a,肝功能指标,b,肾功能指标,c-g,血常规指标,h,主要器官(肝脏、脾脏、肾脏、心脏和肺)的脏器指数,i,肝脏与肾脏的碱性磷酸酶(ALP)水平,j,肝脏中的铜元素含量,采用One-way ANOVA withTukey’s multiple comparisons test进行分析(n=5,平均值±SD);
图13为健康小鼠分别通过气管滴注和静脉注射给予MNDs后28天内的:a,体重变化情况,b,食物摄取变化情况,采用One-way ANOVA with Tukey’s multiple comparisonstest进行分析(n=5,平均值±SD),与对照组比较,**P<0.01,****P<0.0001;
图14为健康小鼠分别通过气管滴注和静脉注射给予MNDs后1天的:a,肺组织H&E染色图,b,肺组织损伤评分,c,主要器官(肝脏、脾脏、肾脏和心脏)的组织H&E染色图(n=3);
图15为健康小鼠分别通过气管滴注和静脉注射给予MNDs后30天的:a,肺组织H&E染色图,b,肺组织损伤评分,c,主要器官(肝脏、脾脏、肾脏和心脏)的组织H&E染色图(n=3)。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明。
如下所述中,若未做特别说明,则所采用的试剂选用常规市售产品,所使用的方法为本领域公知手段。
如下实施例中所使用的钼纳米点采用《Oral zero-valent-molybdenum nanodotsfor inflammatory bowel disease therapy》中公开的钼纳米点,优选其中公开的方法制备得到,具体为:
(1)混合钼粉末3g与异丙醇50mL,在冰浴下通过机械剥离合成钼纳米点,其中机械剥离的参数为450瓦,每超声3秒间隔1秒,累计20小时。
(2)静置取上清液,用旋转蒸发仪除去异丙醇,溶于去离子水中,并通过高速离心去除残留的粒径较大的颗粒,即可得到钼纳米点(molybdenum nanodots,简称MNDs)。
本发明中,MNDs通过清除过量的ROS发挥抗炎与抗氧化作用,改善肺组织损伤。
如下各实验例将详细阐述该机理。
实验例1
MNDs有良好的清除ROS能力,而大量的证据表明过量的ROS显著促进ALI/ARDS的发生发展。因此,本实验例中对MNDs的清除ROS能力进行了体外验证。
首先分别在RAW 264.7细胞(小鼠巨噬细胞系)和MLE-12细胞(小鼠肺上皮细胞系)上评估MNDs的细胞毒性,与一系列浓度梯度MNDs(0-150μg/mL)共培养24和48小时的RAW264.7和MLE-12细胞均表现出正常的细胞形态,CCK-8测定结果表明MNDs浓度小于100μg/mL时,对RAW 264.7细胞无明显的细胞毒性,甚至在浓度高达150μg/mL时,细胞活性依然大于80%(图1a和图1b)。对于MLE-12细胞,MNDs不仅没有产生细胞毒性,甚至在高浓度时轻微促进其增殖(图2a和图2b)。这些结果与过往文献中的发现一致,这表明MNDs具有良好的生物相容性。
鉴于MNDs具有很强的抗氧化特性,接着我们体外测量了它们清除ROS的潜在能力。使用H
实验例2
本实验例中,通过构建LPS诱导ALI小鼠模型来探索MNDs在体内的抗氧化和抗炎作用从而改善肺组织孙损伤的治疗效果。LPS诱导肺损伤是最常用的一种ALI动物模型。
实验方法如下:
将8周的雄性C57BL/6小鼠随机分为对照组(Control组)、LPS组(Normal saline组)、LPS+0.1mg/kg MNDs组(0.1mg/kg MNDs组)、LPS+1mg/kg MNDs组(1mg/kg MNDs组)。通过气管滴注4mg/kg LPS来建立ALI模型,3小时后再次气管滴注MNDs(仅对于0.1mg/kg MNDs组和1mg/kg MNDs组两组实施),在给予LPS 36小时后处死所有小鼠取BALF或肺组织(图4a)。我们首先通过使用二氢乙锭(DHE)染色检测了ALI模型中小鼠肺组织中的ROS水平。如图4b和4c所示,相较于LPS组,给予MNDs治疗的小鼠肺组织的ROS水平明显降低,表明MNDs可以作为抗氧化剂在体内清除ROS。
由于MPO、SOD和MDA是与氧化应激和抗氧化有关的关键标志物,因此我们通过检测它们在小鼠肺中的水平或活性来反映肺组织的氧化应激程度以及MNDs的抗氧化作用。此外,腹腔注射给予传统抗氧化药物NAC与合成的超氧化物歧化酶和过氧化氢酶模拟物EUK-134,作为两个阳性对照组。结果发现BALF中MPO水平在MNDs、NAC和EUK-134治疗组中明显下降(图4d)。相似的,肺组织匀浆中SOD活性在使用MNDs治疗后明显高于未治疗组(图4e),而MDA活性在两个MNDs治疗组均明显下降(图4f)。这些结果说明MNDs可以在LPS诱导的ALI小鼠肺内通过清除ROS来减轻氧化应激反应,从而可能可以抑制ALI疾病进展。
根据文献报道,过量ROS会引起肺泡毛细血管屏障功能障碍并且表达大量促炎因子,导致肺组织损伤和肺水肿。因此我们进一步探索MNDs是否可以改善LPS诱导ALI小鼠肺中的炎症反应和组织损伤情况。根据图5a和图5b所示,相较于未治疗组,给予0.1和1mg/kgMNDs治疗组的小鼠BALF中WBCs与中性粒细胞计数均明显下降,有文献报道MPO主要表达于多形核中性粒细胞,因此这些结果与上述MPO变化趋势是一致的。为了进一步观察肺组织中炎症细胞聚集情况,我们使用免疫荧光方法通过标记F4/80和Ly6G来识别单核/巨噬细胞与中性粒细胞。通过荧光显微镜观察可见,LPS诱导发生肺损伤后大量炎症细胞涌入肺中,被激活炎症细胞会释放ROS和炎症因子,从而激活更多的炎症细胞,形成一个正反馈的恶性循环。由于MNDs可以清除ROS,因此用MNDs治疗后肺组织中单核/巨噬细胞与中性粒细胞数量都明显减少(图5c-图5e)。我们为了进一步验证MNDs抗炎作用,通过ELISA法检测BALF中的促炎因子和抑炎因子水平。结果发现用MNDs治疗后ALI小鼠BALF中促炎因子TNF-α和IL-6明显下降(图5f和图5g),而抑炎因子IL-10在高剂量即1mg/kg MNDs治疗组中显著升高(图5h)。以上证据表明,MNDs可以抑制炎症细胞涌入肺中,并减少促炎因子的产生,具有良好的抗炎功效。
为了评估MNDs对肺泡毛细血管屏障功能障碍的治疗效果,我们使用BCA法测定BALF中的蛋白水平,如图5i所示,LPS组小鼠BALF中蛋白水平明显升高,这可能是由于肺泡毛细血管屏障通透性增加,富含蛋白质的液体涌入肺泡腔中,用MNDs治疗后小鼠BALF中蛋白水平明显下降。另外,我们通过计算肺湿干比来评估肺水肿的严重程度,在接受MNDs治疗的小鼠中也观察到了类似的治疗效果(图5j)。这些结果表明,MNDs可以改善肺泡毛细血管屏障功能、减轻ALI中的肺水肿情况。进一步的肺组织病理切片结果显示,未予治疗的ALI小鼠肺组织中有明显的炎症细胞浸润、肺泡壁增厚和肺泡腔融合,MNDs治疗后肺组织损伤情况明显好转(图5k和图5l)。因此,肺组织病理学结果提供了直接证据,证明了MNDs对LPS诱导的ALI小鼠具有积极的保护作用。
实验例3
除了使用LPS外,使用活细菌也是建立ALI小鼠模型非常常用的方法。这种模型模拟了细菌性肺炎的过程,与人类的ALI疾病非常相似。PAO1是一种抗生素耐药的细菌病原体,是重症肺炎的常见病原体之一,可导致ALI和ARDS。为了进一步确认MNDs疗效,本实验例中我们在PAO1诱导的ALI小鼠模型中也进行研究。
首先我们在PAO1诱导的ALI小鼠模型中探究MNDs的抗氧化作用,用DHE染色后结果显示MNDs治疗组的荧光强度明显低于未治疗组(图6a和图6b),表明MNDs对LPS和PAO1诱导的ALI小鼠具有相似的抗氧化作用。给PAO1诱导的ALI小鼠气管滴注0.1和1mg/kg MNDs治疗后,发现肺组织中炎症细胞计数(图6c和图6d)、BALF中蛋白总量(图6e)和肺组织的湿干比(图6f)均下降。小鼠经MNDs治疗后,BLAF中促炎因子水平显著下降(图6g和图6h),而抑炎因子IL-10水平明显升高(图6i)。这些结果表明,MNDs可以保护肺组织,减少PAO1诱导的肺部炎症和肺泡毛细血管屏障功能障碍产生的影响。此外,肺组织的H&E染色结果也进一步证明了MNDs可以改善PAO1诱导ALI产生的肺部损伤和炎症反应(图6j和图6k)。总而言之,我们的研究结果证明,在LPS和PAO1诱导的ALI小鼠模型中,MNDs通过清除ROS发挥抗炎和抗氧化作用。
实验例4
为了揭示MNDs的潜在治疗机制,本实验例中我们使用了LPS诱导的ALI模型,对小鼠肺组织进行了RNA测序(RNA-seq)。PCA结果表明ALI组和ALI-MNDs组之间存在显著不同的转录组谱(图7)。火山图显示,与ALI组相比,MNDs处理后的ALI小鼠肺中有486个基因上调,1068个基因下调(图8a)。KEGG通路富集分析结果显示,TNF信号通路、NF-kappa B信号通路、趋化因子信号通路和IL-17信号通路与MNDs的治疗机制高度相关(图9)。这一结果与我们上述发现一致,即MNDs可以减轻肺部炎症。
在与炎症反应相关的上调和下调基因中,我们发现MNDs治疗后,Nlrp3、Casp1、Gsdmd和Il1b的表达明显下调(图8b)。此外,GSEA分析结果显示,与炎症小体复合物相关的上调基因在ALI组中明显富集(图8c)。炎症小体是由胞质蛋白组成,其中包含胞质免疫传感器如NLRP3,它能在感染时促进IL-1β的分泌。炎症小体通过激活caspase-1触发GSDMD的裂解,从而导致膜孔的形成并诱导焦亡发生,最终会导致细胞死亡。有研究报道称,NLRP3炎症小体在激活ALI的炎症反应中发挥着关键作用。因此我们根据这些结果猜测,MNDs可能可以抑制NLRP3依赖性焦亡通路的激活。
为了探索MNDs对ALI小鼠肺组织的NLRP3炎症小体和焦亡通路的影响,我们使用定量实时PCR方法检测转录组学中发现表达显著下调四个基因的mRNA水平。如图8d-图8g所示,MNDs治疗显著抑制肺组织中Nlrp3、Casp1、Gsdmd和Il1b的表达。接下来,为了进一步验证MNDs是否能抑制NLRP3依赖性焦亡通路的激活,我们进行了蛋白质印迹分析。由于MCC950是特异性NLRP3炎症小体的抑制剂,因此我们设置MCC950治疗组作为阳性对照组。我们观察到,与LPS组相比,MNDs治疗组小鼠的NLRP3、Caspase-1剪切片段、GSDMD N-末端和IL-1β剪切片段水平明显降低,这表明MNDs可以抑制NLRP3炎症小体的激活和焦亡的发生(图8h)。ELISA结果显示,给予MNDs治疗的小鼠肺组织匀浆中IL-1β的水平显著降低,这与蛋白质印迹的结果一致(图8i)。此外,免疫组化染色结果进一步证明,LSP+MNDs组肺部的Caspase-1蛋白水平明显低于LPS组(图8j)。这些发现与实时定量PCR的结果一致。综上所述,MNDs通过抑制LPS诱导的ALI小鼠肺内NLRP3炎症小体激活和焦亡发生,从而发挥抗氧化和抗炎的治疗作用。
图10阐述了MNDs治疗ALI的示意图,MNDs可以通过清除ROS发挥抗炎和抗氧化作用来改善肺组织损伤情况,深入机制探索发现MNDs通过抑制NLRP3依赖性焦亡通路来保护肺组织免受损伤。
实验例5
众所周知,纳米材料的安全性在临床转化中至关重要,因此本实验例中,我们对MNDs在健康小鼠中的安全性进行了评估。有研究曾报道,钼中毒会导致大鼠生长不良、厌食、贫血、肝脏ALP升高和肾脏ALP降低。此外,钼中毒还会导致急性肾小管坏死和肝脏坏死,过量的钼元素会使动物体内铜元素的含量下降。有关人类钼中毒的研究报道很少,一项医学调查曾显示,高钼会增加痛风和血尿酸升高的发病率。
为了评估MNDs对健康小鼠的安全性,首先,我们将小鼠随机分为四组,包括阴性对照组、1mg/kg MNDs气管滴注(i.t.)组、1mg/kg MNDs静脉注射(i.v.)组和50mg/kg钼酸铵溶液i.v.组,其中大剂量钼酸铵组为阳性对照组。我们分别在用药后1天和28天采集血液和组织样本。血清中丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)、谷丙转氨酶(ALP)、尿素、肌酐和尿酸的浓度均在正常范围内,各组之间在用药后第1天和第28天各项指标均无显著差异(图11a,11b和图12a,12b)。与对照组相比,MNDs i.t.组和MNDs i.v.组的血常规各项结果(图11c-图11g和图12c-图12g)以及肝脏和肾脏组织中的ALP水平均无差异(图11i和图12i)。内脏指数是一个检测药物毒性的灵敏指标,通常用于毒理学研究。与对照组相比,MNDs i.t.组和MNDs i.v.组小鼠主要器官的内脏指数计算结果无差异(图11h和图12h)。此外,对照组、MNDs i.t.组和MNDs i.v.组小鼠肝脏铜元素水平也相近(图11j和图12j)。
在28天的观察时间里,我们每两天测量并记录一次小鼠的体重和食物摄入量。如图13a和13b所示,注射大剂量钼酸铵溶液的阳性对照组小鼠在处理后2天出现明显的体重下降和厌食,但很快恢复,而其他三组小鼠的体重变化和进食量一直相差不大,给予MNDs后没有观察到明显的体重下降。
此外,与对照组相比,MNDs给药后1天和30天,肺部均未出现明显的组织损伤或炎症反应(图14a,14b和图15a,15b)。并且在其他主要器官中也没有观察到坏死、充血或出血等现象(图14c和图15c)。
综上所述,这些结果均表明MNDs具有良好的安全性,可以作为一种安全、有效、具有临床转化意义的肺部炎症性疾病治疗药物,在ALI/ARDS治疗上是一个理想的候选者。
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
- 一种制备氟化氢移动床过滤器专用滤料造粒装置的使用方法
- 一种基于电磁感应模拟泥沙冲刷及实现自动整平的试验装置及方法
- 一种土料快速挤压成槽装置及方法
- 一种晶圆表面光强分布的快速获取方法及装置
- 一种针刺滤料表面快速整平装置和方法
- 一种回转体表面快速整平的脉动态电解加工装置及方法
