人血清淀粉样蛋白A时间分辨荧光免疫层析试纸及应用
文献发布时间:2023-06-19 19:27:02
技术领域
本发明涉及临床医学检测技术领域,特别涉及人血清淀粉样蛋白A时间分辨荧光免疫层析试纸及应用。
背景技术
荧光免疫层析方法中,双抗体夹心法,以固相免疫层析形式进行检测。待检样本血清/血浆/全血在加样端由毛细作用力向上扩散,经过结合物垫时样本中的PCT抗原与标记物结合为标记抗体-抗原的复合物;复合物随样本扩散到硝酸纤维素膜上,被包被有PCT抗体的区域检测线拦截,形成标记抗体-抗原-包被抗体的免疫复合物,标记物沿着膜继续向前移动至质控线时反应,检测线处荧光显色强度与PCT含量成正比,根据荧光强度定量测定PCT浓度。
由于待测样本的复杂性及免疫反应过程受到层析过程样本流动性、样本基质影响、蛋白包被捕获差异、硝酸纤维素膜的均一性、毛细牵引左右差异等的影响,导致T线的反应强度可能由于层析过程差异发生显著的变化,而C线会跟T有相同的影响,本着控制变量的试验理念,因此C线可对检测结果修正,故用T/C值以减少试纸条间的差距。理论上,结合物信号应与样本浓度呈正相关,但受样本中待检物剂量较高和仪器检测荧光信号强度范围的局限性影响,T线荧光信号强度达到饱和难以继续上升,测试信号T/C线性后端曲线趋于平缓,甚至出现下弯落状态,导致出现假低值,甚至假阴性结果,该现象是固相测定方法特有的异常现象,出现该现象会使检测样本浓度线性范围过窄,高浓度样本检测值不准确。
目前现有的解决该问题的技术,基本是增加荧光标记的单克隆抗体原料浓度、降低荧光标记单克隆抗体浓缩液稀释倍数、增大的包被单克隆抗体原料浓度、降低样本浓度、提高抗体纯度等角度调试,但是整体调试过程比较繁琐。并且,仍然存在高浓度样本检测值不准确的问题。
发明内容
针对以上述背景技术的不足,本发明提供一种线性范围更宽且高端测值精密度更高的人血清淀粉样蛋白A时间分辨荧光免疫层析试纸及应用。
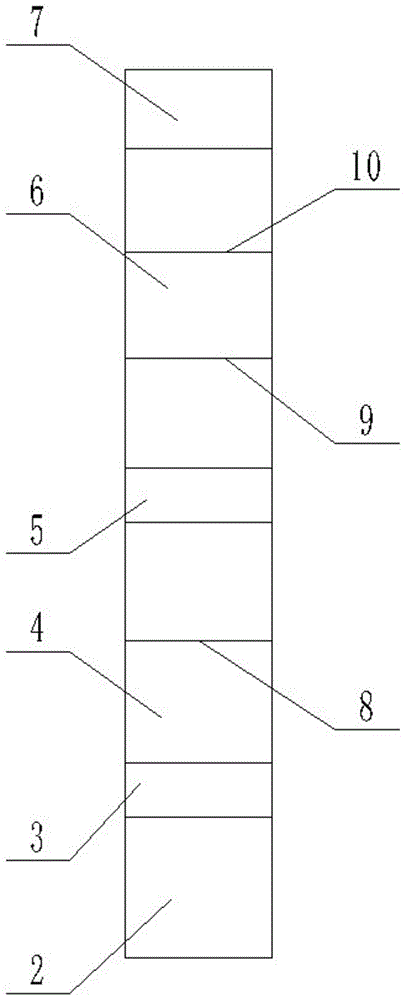
本发明采用的技术方案如下:人血清淀粉样蛋白A时间分辨荧光免疫层析试纸及应用,关键在于:包括依次搭接的样品垫、第一结合垫、第一包被膜、第二结合垫、第二包被膜及吸水垫,所述第一包被膜上包被有T1检测线,所述第二包被膜上包被有T2检测线和C线质控线。
优选的,所述T1检测线和T2检测线包被有第二抗体,并且所述T1检测线和T2检测线包被的第二抗体浓度比为0.6-1:1。
优选的,所述第一结合垫和所述第二结合垫上喷有相同浓度的荧光微球-抗体复合物。
优选的,所述荧光微球-抗体复合物采用如下方法制得:分别将荧光微球和EDC用PB溶液稀释,然后快速涡旋混匀,置于37℃摇床中震荡15min,高速离心,去除上清,沉淀用PB溶液稀释,超声分散,得到荧光微球溶液;再将第一抗体加入荧光微球溶液,涡旋混匀,置于37℃摇床中震荡16h,再将50μl封闭剂加入到荧光微球溶液中,涡旋混匀,置于37℃摇床中震荡2h,高速离心,去除上清,沉淀用处理液稀释,超声分散,制得。
优选的,所述第一结合垫和所述第二结合垫上的第一抗体浓度比为0.6-1:1。
优选的,所述处理液由以下原料组成:97.99%PBS、1%葡萄糖、0.5%PEG2000、0.01%TWEEN20、0.5%BSA溶液。
优选的,所述C线质控线靠近所述吸水垫设置。
优选的,所述样品垫采用以下方法制备:将玻璃纤维膜浸入样品垫处理液中处理后,放入45℃烘箱烘干8h制得,样品垫处理液由以下原料组成:94.3%PBS、5%葡萄糖、0.1%PEG2000、0.1%TWEEN20、0.5%BSA。
优选的,第一包被膜和第二包被膜为硝酸纤维素膜、所述第一结合垫和所述第二结合垫的材质为玻璃纤维。
有益效果:与现有技术相比,本发明提供的人血清淀粉样蛋白A时间分辨荧光免疫层析试纸及应用,通过增设第一结合垫和仅有检测线而没有质控线的第一包被膜,当样本中抗原剂量较高时,可以拦截一部分的SAA,剩余的SAA由一包被膜捕获,有效避免单一T线荧光信号强度达到饱和难以继续上升,测试信号T/C线性后端曲线趋于平缓,甚至出现下弯落状态,导致出现假低值,甚至假阴性结果,导致检测样本浓度线性范围过窄,高浓度样本检测值不准确。
附图说明
图1为本发明的结构示意图;
图2为试剂盒的结构示意图。
具体实施方式
为使本领域技术人员更好的理解本发明的技术方案,下面结合附图和具体实施方式对本发明作详细说明。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。文中所述的较佳实施方法与材料仅作示范之用。
主要外购试剂:
EDC:碳酰二亚胺盐酸盐,购于自西格玛公司;硝酸纤维素膜:购于赛多利斯公司;BSA:牛血清白蛋白,购于上海西宝科技有限公司;TWEEN20:购于西格玛公司;SAA单克隆抗体1,购于杭州伊佰新生物技术有限公司);SAA单克隆抗体2,购于杭州贤至生物技术有限公司;羊抗鼠IgG抗体,购于杭州贤至生物技术有限公司;荧光微球,购于BangsLaboratories,Inc.
自行配置试剂:
10mM pH7.4 PB:浓度为10毫摩每升,PH7.4的磷酸盐缓冲液;
10mM pH7.4 PBS:浓度为10毫摩每升,PH7.4,含终浓度为0.9%氯化钠的磷酸盐缓冲液;
样品垫处理液PBS:浓度为10毫摩每升,PH7.4的磷酸盐缓冲液;
实施例1试纸条的制备
2.1样品垫的制备
将玻璃纤维膜浸入样品垫处理液中处理后,放入45℃烘箱烘干8h制得,样品垫处理液由以下原料组成:94.3%PBS、5%葡萄糖、0.1%PEG2000、0.1%TWEEN20、0.5%BSA。
2.2结合垫的制备
1)制备荧光溶液微球:将荧光微球用10mM pH7.4 PB稀释至0.1%(W/W);
2)微球活化:将EDC用10mM pH7.4 PB溶解至10mg/ml,然后快速加入到荧光微球溶液中,涡旋混匀,EDC溶液的加入量为0.5mg/ml,置于37℃摇床中震荡15min。
3)15000rpm,15min高速离心,去除上清,沉淀用10mM pH7.4 PB的交联反应溶液稀释至475ul,超声分散2min。
4)将SAA单克隆抗体1加入到荧光微球溶液中,涡旋混匀,置于37℃摇床中震荡16h。
5)将50μl封闭剂加入到荧光微球溶液中,涡旋混匀;封闭剂为10%BSA溶液,置于37℃摇床中震荡2h。
6)15000rpm高速离心15min,去除上清,沉淀用处理液稀释至400ul,超声均匀,处理液由以下原料组成:97.99%PBS、1%葡萄糖、0.5%PEG2000、0.01%TWEEN20、0.5%BSA溶液。
7)将荧光微球溶液喷涂在玻璃纤维膜上,45℃烘箱烘干8h。
8)按照以上方法制备双份结合垫,分别标号为第一结合垫3和第二结合垫5。
2.3第一包被膜的制备
1检测线T1:用0.01M pH7.4 PBS将SAA单克隆抗体2稀释后进行包被,划线参数为1μL/cm,速度80mm/s;
2划线后将硝酸纤维素膜放入45℃烘箱烘干8h。
2.4第二包被膜的制备
1质控线C:用pH7.4的0.01M PBS将羊抗鼠IgG抗体稀释至3.0mg/mL进行包被,划线参数为1μL/cm,速度80mm/s;
2检测线T2:用pH7.4的0.01M PBS将SAA单克隆抗体2稀释后进行包被,划线参数为1μL/cm,速度80mm/s;
2.4组装
将样品垫2、第一结合垫3、第一包被膜4、第二结合垫5、第二包被膜6及吸水垫7依次组装切条装卡而成。
实施例2人血清淀粉样蛋白A时间分辨荧光免疫层析试剂盒
如图1-2所示,人血清淀粉样蛋白A时间分辨荧光免疫层析试剂盒,包括中空结构的条形盒体1及设置该条形盒体1中的试纸条;所述试纸条采用实施例1的方法制得。具体的,本方案通过在样本垫与第二结合垫之间依次增设第一结合垫和第一包被膜,增设的第一结合垫可避免因荧光标记抗体浓度过低造成的荧光信号强度难以上升,同时也避免出现因抗原和抗体浓度过高导致的抗原抗体结合效率过低而产生的“后带效应”,增设的仅有一条检测线T没有质控线C的第一包被膜可以将样本中的高浓度待检物一分为二在第一包被膜和第二包被膜上分别呈现,既避免了因包被原料浓度不足造成的检测线荧光信号强度不再上升,又避免了因荧光干式分析仪测定荧光信号强度范围局限而造成的T/C线性上升趋势改变的问题,因此可扫描出两个T峰和一个C峰,而T1峰信号+T2峰信号/C峰信号能拉开较大梯度,即扩大了线性范围;同时定标曲线模型的上端呈上升趋势,因此在测定高浓度样本并带入定标曲线中进行计算时,得出的浓度的变异系数小,因此线性范围更宽且高端测值精密度更高。
本实施例中,所述T1检测线8和T2检测线9包被有第二抗体,并且所述T1检测线8和T2检测线9包被的第二抗体浓度比为0.6-1:1。优选的方案中,所述T1检测线和T2检测线包被的第二抗体浓度比为1:1,更优选的方案中,第二抗体为SAA单克隆抗体2。
本实施例中,所述第一结合垫3和所述第二结合垫5上喷有相同浓度的荧光微球-抗体复合物。
本实施例中,所述第一结合垫3和所述第二结合垫5上的第一抗体浓度比为0.6-1:1。优选的方案中,所述第一结合垫3和所述第二结合垫5上的第一抗体浓度比为1:1,更优选的方案中,第一抗体为SAA单克隆抗体1。
本实施例中,所述条形盒体1的顶部开包被有第一可视窗口11、第二可视窗口12和加样孔13,所述第一可视窗口11位于所述第一包被膜4的上方,所述第二可视窗口12位于所述第二包被膜6的上方,所述加样孔13位于所述样品垫2的上方。
本实施例中,所述第二包被膜6上还包被有C线质控线10,所述C线质控线10靠近所述吸水垫7设置。
本实施例中,第一包被膜4和第二包被膜6为硝酸纤维素膜、所述第一结合垫3和所述第二结合垫5的材质为玻璃纤维。
实施例3性能评价
根据实施例1的方法制备16组试纸条,各试纸条的制备条件相同,不同在于,各试纸条上第一结合垫与第二结合垫上的第一抗体浓度比不同,且各试纸条上T1检测线和T2检测线上的第二抗体浓度比不同,具体见表1。
表1
/>
线性评价:配制不同浓度的SAA阳性样本,对各组试纸条进行测试,通过荧光免疫分析仪分别采集T1、T2和C线的荧光信号强度。由于待测样本的复杂性及免疫反应过程受到层析过程样本流动性、样本基质影响、蛋白包被捕获差异、NC膜的均一性、毛细牵引左右差异影响,导致检测线的反应强度可能由于层析过程差异发生显著的变化,而质控线会跟检测线有相同的影响,因此可用质控线对检测结果进行修正,以可减少试纸条间的差距。分别计算不同SAA阳性样本中(T1+T2)/C值或T2/C值,见表2。
表2 SAA样本T/C信号比值
精密度评价:为检测16组试纸条对高浓度SAA阳性样本的测量精密度,用上述16组试纸条分别测量浓度为120mg/L的SAA样本,重复测10次,计算各组试纸条的变异系数(CV),结果如表3所示。
表3精密度测定数据
最后需要说明,上述描述仅为本发明的优选实施例,本领域的技术人员在本发明的启示下,在不违背本发明宗旨及权利要求的前提下,可以做出多种类似的表示,这样的变换均落入本发明的保护范围之内。
- 定量检测血清淀粉样蛋白A的时间分辨荧光免疫层析试纸条及其制备方法
- 定量联合检测C-反应蛋白与血清淀粉样蛋白A的时间分辨免疫层析试纸条及其制备方法
