一株Kerstersia gyiorum CY-2、菌剂、还原剂、修复剂和应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明属于功能微生物技术领域,具体涉及一株Kerstersia gyiorum CY-2、菌剂、还原剂、修复剂和应用。
背景技术
铬是一种常见的剧毒重金属,广泛应用于金属电镀、合金制造、皮革鞣制、木材保存和陶瓷制造等工业制造业中,其中,Cr(VI)和Cr(III)是最常见的两种形态。与Cr(III)相比,Cr(VI)具有更高的溶解度和流动性,对细胞毒性和诱变的危害性也更高,高出Cr(III)100倍。当Cr(VI)的含量≥0.2mg·mL
传统的铬处理方法如吸附/积累存在成本高的缺陷、离子交换方法存在产生有毒污泥的缺陷,化学沉淀方法存在衍生污染物的缺陷。相比之下,生物修复技术具有成本低、特异性和环境兼容性强,便于大规模执行、效率高等优点。
目前已分离出多种具有铬生物修复能力的细菌,并对它们与铬的相互作用进行了深入研究。据报道,细菌通过多种机制对抗Cr(VI)的毒性,包括络合、离子交换、配位、吸附、螯合和微沉淀、还原和外排等。例如,Liao等研究证明了超氧化物歧化酶和Na
发明内容
本发明的目的提供一株Kerstersia gyiorum菌株、菌剂、还原剂、修复剂和应用,本发明提供的Kerstersia gyiorum CY-2能够高效还原Cr(VI),提高Cr(VI)的还原率。
为了解决上述技术问题,本发明提供了以下技术方案:
本发明提供了一株Kerstersia gyiorum CY-2,其保藏编号为GDMCC 63672。
本发明提供了一种含有上述技术方案所述的Kerstersia gyiorum CY-2的菌剂。
优选的,所述菌剂包括Kerstersia gyiorumCY-2的菌液或菌悬液。
本发明提供了一种含有上述技术方案所述的Kerstersia gyiorum CY-2或含有上述技术方案所述的菌剂在用于还原Cr(VI)和/或提高Cr(VI)的还原率中的应用。
优选的,所述应用时Kerstersia gyiorumCY-2的有效活菌数为≥2×10
本发明提供了一种Cr(VI)还原剂,有效成分包括上述技术方案所述的KerstersiagyiorumCY-2和/或上述技术方案所述的菌剂。
优选的,所述Cr(VI)还原剂的有效活菌数为≥2×10
本发明提供了一种Cr(VI)污染修复剂,有效成分包括上述技术方案所述的Kerstersia gyiorumCY-2和/或上述技术方案所述的菌剂。
本发明提供了一种还原Cr(VI)和/或提高Cr(VI)的还原率的方法,包括以下步骤:将上述技术方案所述的Kerstersia gyiorum CY-2或上述技术方案所述的菌剂和含有Cr(VI)的待还原物混合,进行还原。
优选的,所述含有Cr(VI)的待还原物中Cr(VI)的质量浓度<300mg/L。
本发明的有益效果:本发明提供一株Kerstersia gyiorum CY-2,其保藏号为GDMCC 63672。本发明提供的Kerstersia gyiorum CY-2从李氏禾CW-MFC反应器中筛选得到,是一株铬还原菌,可用于重金属铬污染的治理。该菌可能通过还原、生物累积和外排等机制有效解毒铬,菌株CY-2可能通过生物积累Cr(VI),将它累积到细胞内,并将其还原为Cr(III),从而使其离子主动释放出细胞。菌株CY-2在重金属污染治理领域具有十分重要的应用前景。
生物保藏说明
Kerstersia gyiorum CY-2,于2023年07月20日保藏于广东省微生物菌种保藏中心,保藏编号为GDMCC 63672,保藏单位地址:广州市先烈中路100号大院59号楼5楼。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍。
图1为分离的5株细菌对Cr(VI)的最低抑制浓度数据图;
图2为Kerstersia gyiorum CY-2在50mg/L
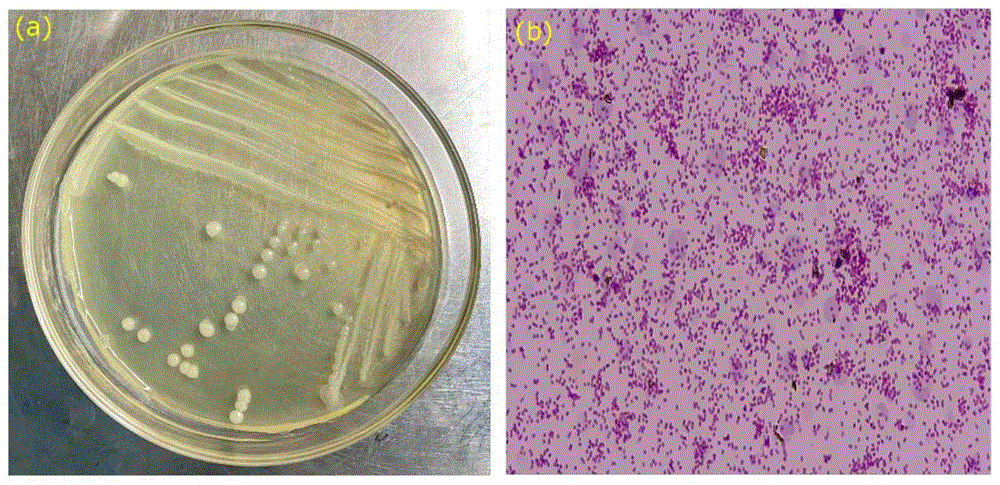
图3为Kerstersia gyiorum CY-2的菌落图及革兰氏染色图;
图4为Kerstersia gyiorum CY-2基于16S rRNA基因序列同源性的系统发育树;
图5为不同pH条件下Kerstersia gyiorum CY-2的铬还原曲线图;
图6为不同温度下Kerstersia gyiorum CY-2的铬还原曲线图;
图7为不同接种量下Kerstersia gyiorum CY-2的铬还原曲线图;
图8为LB培养基中不同Cr(VI)初始浓度下Kerstersia gyiorum CY-2的铬还原曲线图;
图9为金属离子对Kerstersia gyiorum CY-2还原Cr(VI)效果的影响图;
图10为Kerstersia gyiorum CY-2在不同抗生素下的生长状况图;
图11为Kerstersia gyiorum CY-2未与Cr(VI)反应前的SEM图;
图12为Kerstersia gyiorum CY-2未与Cr(VI)反应前的EDS图;
图13为Kerstersia gyiorum CY-2未与Cr(VI)反应前的EDX图;
图14为Kerstersia gyiorum CY-2与Cr(VI)反应后的SEM图;
图15为Kerstersia gyiorum CY-2与Cr(VI)反应后的EDS图;
图16为Kerstersia gyiorum CY-2未与Cr(VI)反应后的EDX图;
图17为Kerstersia gyiorum CY-2与Cr(VI)反应前后的FT-IR图谱。
具体实施方式
本发明提供了一株Kerstersia gyiorum CY-2,保藏编号为GDMCC 63672。本发明所述Kerstersia gyiorum CY-2的16S rRNA基因序列如SEQ ID NO.1所示。菌株CY-2的全基因组序列在Genebank中的序列号为OQ773627。
SEQ ID NO.1序列:ATCGCCCTCCTTGCGGTTAGGCTAACTACTTCTGGTAGAACCCACTCCCATGGTGTGACGGGCGGTGTGTACAAGACCCGGGAACGTATTCACCGCGACATTCTGATCCGCGATTACTAGCGATTCCGACTTCATGTAGTCGAGTTGCAGACTACAATCCGGACTACGATCGGGTTTCTGAGATTAGCTCCACCTCGCGGTTTGGCAACCCTCTGTCCCGACCATTGTATGACGTGTGAAGCCCTACCCATAAGGGCCATGAGGACTTGACGTCATCCCCACCTTCCTCCGGTTTGTCACCGGCAGTCTCATTAGAGTGCCCTTTCGTAGCAACTAATGACAAGGGTTGCGCTCGTTGCGGGACTTAACCCAACATCTCACGACACGAGCTGACGACAGCCATGCAGCACCTGTGTTCCGGTTCTCTTGCGAGCACTCCCAAATCTCTTCGGGATTCCAGACATGTCAAGGGTAGGTAAGGTTTTTCGCGTTGCATCGAATTAATCCACATCATCCACCGCTTGTGCGGGTCCCCGTCAATTCCTTTGAGTTTTAATCTTGCGACCGTACTCCCCAGGCGGTCAACTTCACGCGTTAGCTGCGCTACTAAGGCCCGAAGGCCCCAACAGCTAGTTGACATCGTTTAGGGCGTGGACTACCAGGGTATCTAATCCTGTTTGCTCCCCACGCTTTCGTGCATGAGCGTCAGTGTTATCCCAGGGGGCTGCCTTCGCCATCGGTGTTCCTCCGCATATCTACGCATTTCACTGCTACACGCGGAATTCCACCCCCCTCTGACACACTCTAGCTCGGTAGTTAAAAATGCAGTTCCAAGGTTAAGCCCTGGGATTTCACATCTTTCTTTCCGAACCGCCTGCGCACGCTTTACGCCCAGTAATTCCGATTAACGCTTGCACCCTACGTATTACCGCGGCTGCTGGCACGTAGTTAGCCGGTGCTTATTCTTCAGGTACCGTCATCCACTCGGGGTATTATCCCGGGCGATTTCTTTCCTGACAAAAGTGCTTTACAACCCGAAGGCCTTCATCGCACACGCGGGATGGCTGGATCAGGGTTTCCCCCATTGTCCAAAATTCCCCACTGCTGCCTCCCGTAGGAGTCTGGGCCGTGTCTCAGTCCCAGTGTGGCTGGTCGTCCTCTCAAACCAGCTACGGATCGTTGCCTTGGTAGGCCTTTACCCCACCAACTAGCTAATCCGATATCGGCCACTCCAATAGTGCAAGGCCCGAAGGTCCCCTGCTTTCTCCCGTAGGACGTATGCGGTATTAGCCACTCTTTCGAGTAGTTATCCCCCGCTACTGGGCATGTTCCGATATATTACTCACCCGTTCGCCACTCGCCACCAAGGAGCAAGCTCCTCGTGCTGCCGTTCGACTTGCA。
本发明所述Kerstersia gyiorum CY-2菌落形态外观呈现灰白色,圆形,显微镜下呈杆状,为革兰氏阴性菌。菌株CY-2的接触酶反应、氧化酶反应、H
本发明利用菌株CY-2的16S rRNA序列与NCBI 16S数据库中的数据进行比对,初步确定菌株的分类信息,构建菌株CY-2的系统发育树,鉴定结果表明菌株CY-2为Kerstersiagyiorum菌株。
细菌还原Cr(VI)具有复杂的反应机制,尽管Cr(VI)解毒的一般机制已被广泛研究,但对于特异性功能微生物对铬的解毒机制所具有的复杂网络仍需进一步探究。本发明从李氏禾人工湿地-微生物燃料电池(CW-MFC)反应器的阳极区域取样,通过富集培养法分离得到一株能够高效还原Cr(VI)的菌株CY-2,为促进Cr(VI)的高效还原提供可选择的菌株。菌株CY-2对铬不进行生物吸附,该菌株在Cr(VI)存在的情况下,细胞呈现出明显的形态学变化,表面呈不规则结构,细胞聚集成块并严重变形,细胞膜组成发生了变化,这是由于Cr(VI)与硫竞争ABC转运蛋白进入细胞,在Cr(VI)存在的条件下含硫酸盐的大分子在菌株CY-2细胞膜上的含量减少。菌株CY-2在细胞内将Cr(VI)还原为三价Cr,再外排出细胞。
菌株CY-2对Mg
菌株CY-2对克拉霉素、阿莫西林、四环素、左氧氟沙星和庆大霉素敏感,但对呋喃唑酮、利福平和甲硝唑表现出耐药性,说明菌株能够在存在呋喃唑酮、利福平和甲硝唑的环境中存活和生长,耐药性菌株可能通过多种机制来获得对某种或某些抗生素的耐药性,如基因突变、质粒传递等。
本发明提供了一种含有上述技术方案所述的Kerstersia gyiorum CY-2的菌剂。
本发明所述菌剂优选包括Kerstersia gyiorum CY-2菌悬液、Kerstersiagyiorum CY-2菌液。
本发明所述Kerstersia gyiorum CY-2菌悬液的制备方法优选包括:将菌株CY-2在无菌环境下接种到50mL的LB培养基中第一培养后得到菌液;将所述菌液接种在新的LB培养基中第二培养后,得到培养液;将所述培养液离心后得菌体;将所述菌体利用PBS缓冲液洗涤后得到纯菌体;将所述纯菌体与PBS缓冲液混合后得到菌悬液。本发明所述第一培养的温度优选为27~52℃,更优选为37℃;所述第一培养的时间优选为20~26h,更优选为24h。本发明所述第一培养的转速优选为180~220rpm,更优选为200rpm。本发明所述第二培养的温度优选为27~52℃,更优选为37℃;所述第二培养的时间优选为22~27h,更优选为24h。本发明所述第二培养的转速优选为190~210rpm,更优选为200rpm。本发明所述离心的温度优选为4℃;所述离心的时间优选为9~11min,更优选为10min;所述离心的转速优选为7800~8200rpm,更优选为8000rpm;本发明对PBS缓冲液的洗涤次数没有特殊限定,保证得到不含培养基的纯菌体即可。本发明所述菌悬液的OD
本发明所述Kerstersia gyiorum CY-2菌液的制备方法优选包括:将所述Kerstersia gyiorum CY-2接种于LB液体培养基中进行培养,得到菌液。本发明所述培养的温度优选为27~52℃,更优选为37℃;本发明所述培养的时间优选为8~24h,进一步优选为9~13h,更优选为10~12h。本发明所述接种的参数没有特殊限定,采用常规的方法即可。
本发明所述LB液体培养基优选以水为溶剂,包括以下浓度组分:9.8~10g/L胰蛋白胨、4.8~5g/L酵母粉和9.8~10g/L氯化钠,更优选为10g/L胰蛋白胨、5g/L酵母粉和10g/L氯化钠。
在本发明中,所述菌液的OD
本发明提供了上述技术方案所述的Kerstersia gyiorum CY-2或上述技术方案所述的菌剂在用于还原Cr(VI)和/或提高Cr(VI)的还原率中的应用。
在本发明中,所述Kerstersia gyiorum CY-2的菌剂的OD
本发明提供了一种Cr(VI)还原剂,有效成分包括上述技术方案所述的Kerstersiagyiorum CY-2和/或上述技术方案所述的菌剂。
本发明所述Cr(VI)还原剂优选还包括常规的Cr(VI)还原剂组分,不作具体限定。
本发明所述Cr(VI)还原剂的工作温度优选为35~40℃,进一步优选为36~38℃,更优选为37℃。
本发明所述Cr(VI)还原剂的工作pH值优选为5~9,进一步优选为6~8,更优选为6或7。
本发明所述Cr(VI)还原剂中的菌株CY-2的有效活菌数为≥2×10
本发明提供了一种Cr(VI)污染修复剂,有效成分包括上述技术方案所述的Kerstersia gyiorum CY-2和/或上述技术方案所述的菌剂。
本发明所述Cr(VI)污染修复剂优选还包括常规的Cr(VI)还原剂组分,不作具体限定。
本发明所述Cr(VI)污染修复剂的工作温度优选为35~40℃,进一步优选为36~38℃,更优选为37℃。
本发明所述Cr(VI)污染修复剂的工作pH值优选为5~9,进一步优选为6~8,更优选为6或7。
本发明所述Cr(VI)污染修复剂中的菌株CY-2的有效活菌数为≥2×10
本发明提供了一种还原Cr(VI)和/或提高Cr(VI)的还原率的方法,将上述技术方案所述的Kerstersia gyiorum CY-2或菌剂与含有Cr(VI)的待还原物混合后进行还原。
本发明对所述混合的方法没有特殊限定,采用常规的方法即可。在本发明中,所述的Kerstersia gyiorum CY-2与含有Cr(VI)的待还原物混合后进行还原,更优选为Kerstersia gyiorum CY-2的菌悬液与含有Cr(VI)的待还原物混合后进行还原。本发明所述Kerstersia gyiorum CY-2的菌悬液的OD
在本发明中,所述还原的温度优选为35~40℃,更优选为37℃。本发明所述还原的时间优选为1~2d,进一步优选为1.5~2d,更优选为2d。本发明所述含有Cr(VI)的待还原物的pH值优选为6~9,进一步优选为6~8,更优选为6或7。
在本发明的实施例中,所述含有Cr(VI)的待还原物采用包括含有Cr(VI)的还原培养基。本发明所述含有Cr(VI)的还原培养基优选为含有Cr(VI)的LB培养基。本发明所述含有Cr(VI)的LB培养基优选以蒸馏水为溶剂,每1000mL的蒸馏水中优选包括以下浓度的组分:9.8~10g/L胰蛋白胨、4.8~5g/L酵母粉、9.8~10g/L氯化钠和1~300mg/LCr(VI),更优选为10g/L胰蛋白胨、5g/L酵母粉、10g/L氯化钠和1~300mg/LCr(VI)。在本发明中,所述含有Cr(VI)的还原培养基中Cr(VI)的质量浓度优选为≤300mg/L,进一步优选为1~300mg/L,再进一步优选为50~250mg/L,更优选为50~100mg/L。本发明优选在LB培养基中添加重铬酸钾得到含有Cr(VI)的LB培养基。
本发明所述pH值、培养时间、Cr(VI)在还原培养基中的初始质量浓度的设定在于提高Kerstersia gyiorum CY-2的Cr(VI)还原率。
当待还原物中的Cr(VI)的质量浓度为≤50mg/L时,菌株CY-2培养36h,Cr(VI)还原率为100%。
近年来,申请人已经围绕人工湿地-微生物燃料电池(CW-MFC)中湿地植物李氏禾、不同构型和不同基质碳源下的电化学性能、污染物净化效果和电子传递机制等方面进行了一系列研究。为了探究CW-MFC中特异性耐铬菌或具有铬还原能力菌种,还需进一步探究特异性微生物对Cr(VI)的作用机制。本发明的菌株CY-2对Cr(VI)不进行生物吸附,而是将六价铬积累在细胞内,还原成三价铬,再排出细胞,该菌株在Cr(VI)存在的情况下,细胞呈现出明显的形态学变化,表面呈不规则结构,细胞聚集成块并严重变形,细胞膜组成发生了变化,这是由于Cr(VI)存在时,Cr(VI)与硫竞争ABC转运蛋白进入细胞,导致细胞膜上的含硫酸盐的大分子减少,同时铬的存在导致了细菌细胞表面官能团的变化。
为了进一步说明本发明,下面结合附图和实施例对本发明提供的技术方案进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
以下实施例中应用的LB液体培养基(即富集培养基)组成及制备方法:称取10g胰蛋白胨,5g酵母粉,10g的氯化钠,溶解后定溶于1000mL的容量瓶中,得到LB液体培养基。LB液体培养基高压蒸汽灭菌后应用。
以下实施例中应用的LB固体培养基组成及制备方法:称取10g胰蛋白胨,5g酵母粉,10g的氯化钠和琼脂15~20g,溶解后定溶于1000mL的容量瓶中,得到LB固体培养基。LB固体培养基高压蒸汽灭菌后应用。
测定Cr(VI)的还原率时,LB液体培养基和LB固体培养基中添加的是重铬酸钾K
实施例1菌株CY-2的筛选
(1)在李氏禾人工湿地-微生物燃料电池(CW-MFC)反应器的阳极区域取100g砾石及污泥,通过富集培养法分离出耐铬菌株。富集培养时LB培养基中添加K
(2)将步骤(1)富集培养所得的菌液进行梯度稀释,然后涂布在含有50mg/LCr(VI)的LB固体培养基平板上;平板再倒置于恒温培养箱中,在37℃下培养48h。从培养所得菌落中挑选5个形态各异的菌落,分别标记为CY-1、CY-2、CY-3、CY-4和CY-5。
(3)将上述5个菌株的培养所得的指数期菌液分别接种到Cr(VI)初始浓度为50mg/L、100mg/L、150mg/L、200mg/L、250mg/L、300mg/L、350mg/L和400mg/L的LB培养基中,并在37℃,200r·min
(4)根据最低抑制浓度(即MIC)结果,选择MIC最高的菌株CY-2进行培养。
处理1:将菌株CY-2接种到Cr(VI)初始浓度为50mg/L的LB培养基中,在37℃,200r·min
处理2:以不加菌的培养基作对照,其他条件同处理1。设置3个平行实验。
处理1和处理2培养过程中,每间隔12h取样,监测菌株CY-2生长情况,并检测培养基上清液(即菌液)中Cr(VI)的残余量和总铬变化,以确定细菌的还原潜力。
具体测定方法如下:
取处理1的2mL菌液于紫外分光光度计(上海仪电分析仪器有限公司)600nm处检测其吸光度值(OD),即为菌体的浊度(或浓度)。
将处理1的上清液以8000r·min
用移液枪取处理1的100μL的上清液于50mL比色管中用水稀释至刻度,加入0.5mL的1+1硫酸溶液(即98%浓硫酸与蒸馏水在常温下按等体积比混合)、0.5mL的1+1磷酸溶液(即85%浓磷酸与蒸馏水在常温下按等体积比混合)以及2mL的显色剂(称取二苯碳酰二肼0.2g溶于50mL丙酮中,加水稀释到100mL),10min后在540nm处测定吸光度,测定残余Cr(VI)浓度。
式中,E(%)表示Cr(VI)还原率;C0是初始Cr(VI)浓度(mg·L
处理2的培养基中的总铬、残余Cr(VI)浓度测定方法同处理1。
处理1和处理2的菌体浊度、培养基中的总铬、残余Cr(VI)浓度测定结果如表1和图2所示,在60h内对Cr(VI)还原率高达90%,而对总铬的还原率较低。且在48h后对Cr(VI)的还原保持稳定,这一现象可归因于在较高铬浓度下,生物积累的Cr(VI)流出细胞以减少细胞内损伤。
表1处理1和处理2菌体浊度、培养基中总铬、残余Cr(VI)浓度测定结果(单位:mg·L
注:RSD代表相对标准偏差。
实施例2菌株CY-2的鉴定
1.形态特征鉴定
将实施例1筛选出的菌株CY-2涂布在LB培养基上,菌株的菌落形态和革兰氏染色结果如图3所示。菌株CY-2的菌落为圆形,灰白色;显微镜观察CY-2的革兰氏染色为红色,CY-2为革兰氏阴性杆菌。
2.生物生化特性鉴定
用广东环凯微生物科技有限公司购入的试剂盒对菌株CY-2进行生化特性测试。实验结果显示接触酶反应(靛基质试剂,货号029030)、氧化酶反应(氧化酶试剂,货号029172)、H
3.测定16SrRNA序列
用DNA提取试剂盒(广州艾基生物技术有限公司)提取菌株CY-2的DNA。
然后使用16S引物组27F/1492R(27F:5-AGAGTTTGATCCTGGCTCAG-3,SEQ ID NO:2和1492R:5-GGTTACCTTGTTACGACTT-3,SEQ ID NO:3)进行PCR扩增,得到约1401bp的PCR产物,如SEQ ID NO:1序列。将获得的PCR产物纯化后委托广州艾基生物技术有限公司完成测序。之后然后通过National Center for Biotechnology Information(NCBI)数据库进行比对分析。利用MEGA7.0软构建系统发育树(图4),进行同源性分析。发现CY-2与Kerstersiagyiorum的相似性最高,同源性达到99.64%,命名为Kerstersia gyiorum CY-2。
实施例3:菌株CY-2还原Cr(VI)的影响因素
1pH值的确定
CY-2菌株菌悬液的制备:将菌株在无菌环境下接种到50mL的LB培养基中,在37℃,200rpm的摇床中培养24h后,取1mL的菌液接种到新的50mL的LB培养基中,继续在37℃,200rpm的摇床中培养24h。取摇好的菌液在4℃,8000rpm下离心10min,离心后去上清液,加入PBS清洗3次并重复上述步骤离心,得到不含培养基的纯菌体悬浊液,保证菌悬液的浓度为OD
处理1:实施例1筛选出的MIC最高的CY-2菌株在含有50mg/L的Cr(VI)的LB培养基中进行还原实验。在初始pH值为4.0、培养温度为37℃、CY-2菌株菌悬液接种量为培养基体积10%的条件下对CY-2菌株进行培养,分别在培养的第6h、12h、24h、36h、48h、60h、72h、84h、96h和第120h培养液,测定Cr(VI)的剩余浓度,计算Cr(VI)的还原率。设定3个平行实验。
处理2:同处理1,唯一的区别在于LB培养基初始pH值为5.0。设定3个平行实验。
处理3:同处理1,唯一的区别在于LB培养基初始pH值为6.0。设定3个平行实验。
处理4:同处理1,唯一的区别在于LB培养基初始pH值为7.0。设定3个平行实验。
处理5:同处理1,唯一的区别在于LB培养基初始pH值为8.0。设定3个平行实验。
处理6:同处理1,唯一的区别在于LB培养基初始pH值为9.0。设定3个平行实验。
处理1~处理6均监测CY-2生长情况,检测上清液中的Cr(VI)的剩余浓度,具体的测定方法同实施例1。结果见表2和图5,结果表明在pH值为6时,菌株CY-2对Cr(VI)的还原效果最佳。Cr(VI)还原率根据如下公式计算:
Cr(VI)还原率=(初始浓度-剩余浓度)/初始浓度×100%
表2不同培养pH值下的锥形瓶中Cr(VI)的含量和培养液吸光值
注:还原率代表Cr(VI)还原率;RSD代表三个平行实验的相对标准偏差。
2培养温度的测定
为了验证培养温度对CY-2菌株还原Cr(VI)的影响,进行如下验证实验。重新制备CY-2菌株菌悬液。
CY-2菌株菌悬液的制备同步骤1。
处理1:实施例1筛选出的MIC最高的CY-2菌株在含有50mg/L的Cr(VI)的LB培养基中进行还原实验。在培养温度为27℃、pH值为7.0、接种量为10%的条件下对CY-2菌株进行培养,分别在培养的第6h、12h、24h、36h、48h、60h、72h、84h、96h和第120h培养液,测定Cr(VI)的剩余浓度,计算Cr(VI)的还原率。设定3个平行实验。
处理2:同处理1,唯一的区别在于培养温度为32℃。设定3个平行实验。
处理3:同处理1,唯一的区别在于培养温度为37℃。设定3个平行实验。
处理4:同处理1,唯一的区别在于培养温度为42℃。设定3个平行实验。
处理5:同处理1,唯一的区别在于培养温度为47℃。设定3个平行实验。
处理6:同处理1,唯一的区别在于培养温度为52℃。设定3个平行实验。
处理1~处理6取样后均监测CY-2生长情况,检测上清液中的Cr(VI)的剩余浓度,具体的测定方法如实施例2所述。在温度为37℃时,菌株CY-2对Cr(VI)的还原效果最佳。结果见图6和表3。
表3不同培养温度下的锥形瓶中Cr(VI)的含量
注:还原率代表Cr(VI)还原率;RSD代表三个平行实验的相对标准偏差。
3接种量的测定
为了验证培养温度对CY-2菌株还原Cr(VI)的影响,进行如下验证实验。重新制备CY-2菌株菌悬液。
CY-2菌株菌悬液的制备同步骤1。
处理1:实施例1筛选出的MIC最高的CY-2菌株在含有50mg/L的Cr(VI)的LB培养基中进行还原实验。在接种量为培养基体积的1%,培养温度为37℃、pH值为7.0的条件下对CY-2菌株进行培养,分别在培养的第6h、12h、24h、36h、48h、60h、72h、84h、96h和第120h培养液,测定Cr(VI)的剩余浓度,计算Cr(VI)的还原率。设定3个平行实验。
处理2:同处理1,唯一的区别在于接种量为培养基体积的5%。设定3个平行实验。
处理3:同处理1,唯一的区别在于接种量为培养基体积的10%。设定3个平行实验。
处理4:同处理1,唯一的区别在于接种量为培养基体积的15%。设定3个平行实验。
处理5:同处理1,唯一的区别在于接种量为培养基体积的20%。设定3个平行实验。
处理1~处理5均监测CY-2生长情况,并检测培养所得上清液中的Cr(VI)的剩余浓度,具体的测定方法如实施例2所述,结果见表3和图7。在接种量为培养基体积的10%时,菌株CY-2对Cr(VI)的还原效果最佳。
表3不同培养接种量下的锥形瓶中Cr(VI)的还原率
注:还原率代表Cr(VI)还原率;RSD代表三个平行实验的相对标准偏差。
4Cr(VI)的初始浓度确定
为了验证培养温度对CY-2菌株还原Cr(VI)的影响,进行如下验证实验。重新制备CY-2菌株菌悬液。
CY-2菌株菌悬液的制备同步骤1。
处理1:调节LB培养基中Cr(VI)的初始浓度为50mg/L,在pH值为6、温度为37℃、接种量为培养基体积10%时的条件下对菌株CY-2进行培养,分别在培养的第6h、12h、24h、36h、48h、60h、72h、84h、96h和第120h培养液,测定Cr(VI)的剩余浓度,计算Cr(VI)的还原率。设定3个平行实验。
处理2:同处理1,唯一的区别在于LB培养基中Cr(VI)的初始浓度为100mg/L。设定3个平行实验。
处理3:同处理1,唯一的区别在于LB培养基中Cr(VI)的初始浓度为150mg/L。设定3个平行实验。
处理4:同处理1,唯一的区别在于LB培养基中Cr(VI)的初始浓度为200mg/L。设定3个平行实验。
处理5:同处理1,唯一的区别在于LB培养基中Cr(VI)的初始浓度为250mg/L。设定3个平行实验。
处理1~处理5均监测CY-2生长情况,并检测上清液中的Cr(VI)的剩余浓度,具体的测定方法同实施例2。结果见表4和图8。在最佳条件下,如表4和图8所示,该菌在36h内完全还原50mg/L的Cr(VI)的还原率达到了100%,而对初始浓度为100mg/L、150mg/L、200mg/L和250mg/L的Cr(VI),在120h内的还原率分别为62.49%、42.14%、27.05%和14.30%。此外,随着Cr(VI)浓度增加,100mg/L~250mg/L浓度下的Cr(VI)还原百分比降低,而在50mg/L浓度下未观察到这种现象。这可能是由于生物蓄积的Cr(VI)会从细胞中释放出来,以最大程度地减少Cr(VI)对细胞的损伤;在较低的Cr(VI)浓度下,细菌可能不会排出Cr(VI),因此其生长几乎不受Cr(VI)的影响。
表4不同培养Cr(VI)的初始浓度下的锥形瓶中Cr(VI)的还原率(单位:mg/L)
注:还原率代表Cr(VI)还原率;RSD代表三个平行实验的相对标准偏差。
5金属离子的耐受性
CY-2菌株菌悬液的制备同步骤1。
处理1:在pH值为6、温度为37℃、CY-2菌株菌悬液接种量为培养基体积10%的条件下,调节LB培养基中Cr(VI)初始浓度为100mg/L,将金属离子Mg
处理2:同处理1,唯一的区别在于添加Mn
处理4:同处理1,唯一的区别在于添加Cu
处理5:同处理1,唯一的区别在于添加Co
处理6:同处理1,唯一的区别在于添加Ni
处理7:同处理1,唯一的区别在于添加Zn
空白组(CK):在pH值为6、温度为37℃、CY-2菌株菌悬液接种量为培养基体积10%的条件下,调节LB培养基中Cr(VI)初始浓度为100mg/L,测定培养所得CY-2上清液中的Cr(VI)含量。设定3个平行实验。
处理1~处理7和空白组均每隔12h取样,检测上清液中的Cr(VI)的残余量,具体的测定方法同实施例2。结果见图9和表5。根据表5和图9可知,在72h内,Cu
表5不同金属离子下的锥形瓶中Cr(VI)的还原率
注:还原率代表Cr(VI)还原率;RSD代表三个平行实验的相对标准偏差。
实施例4
处理1:制备实施例1筛选出的MIC最高的菌株CY-2的菌悬液(制备方法同实施例3)。将OD
处理2:唯一的区别在于LB固体培养基中的抗生素替换为:添加终浓度为15μg的抗生素阿莫西林。其余条件同处理1。设置3个平行实验。
处理3:唯一的区别在于LB固体培养基中的抗生素替换为:添加终浓度为5μg的抗生素甲硝锉。其余条件同处理1。设置3个平行实验。
处理4:唯一的区别在于LB固体培养基中的抗生素替换为:添加终浓度为30μg的抗生素四环素。其余条件同处理1。设置3个平行实验。
处理5:唯一的区别在于LB固体培养基中的抗生素替换为:添加终浓度为5μg的抗生素利福平。其余条件同处理1。设置3个平行实验。
处理6:唯一的区别在于LB固体培养基中的抗生素替换为:添加终浓度为5μg的抗生素左氧氟沙星。其余条件同处理1。设置3个平行实验。
处理7:唯一的区别在于LB固体培养基中的抗生素替换为:添加终浓度为10μg的抗生素庆大霉素。其余条件同处理1。设置3个平行实验。
处理8:唯一的区别在于LB固体培养基中的抗生素替换为:添加终浓度为100μg的抗生素呋喃唑酮。其余条件同处理1。设置3个平行实验。
不加抗生素对照组:制备实施例1筛选出的MIC最高的菌株CY-2的菌悬液(制备方法同实施例3)。将OD
处理1~处理8、不加抗生素对照组在37℃下培养72h后,根据抑菌圈直径大小评估对抗生素的敏感性。每个处理平行三次,取平均值分析。
图10中,FR为呋喃唑酮、MTZ为甲硝唑、CN为庆大霉素、RD为利福平、AML为阿莫西林、TE为四环素、CLR为克拉霉素、LEV为左氧氟沙星。由图10可知,菌株CY-2对克拉霉素、阿莫西林、四环素、左氧氟沙星、庆大霉素敏感,但对呋喃唑酮、利福平和甲硝唑表现出耐药性,说明该菌株的抗干扰能力强,具有良好的环境适应性。
实施例5:菌株CY-2对Cr(VI)还原的物理表征
处理1:在Cr(VI)初始浓度为100mg/L的LB培养基中培养菌株CY-2,48h后收集细胞样品。
处理2:在不含铬的LB培养基中培养菌株CY-2,48h后收集细胞样品。处理1和处理2的细胞样品均采用扫描电子镜显微镜(SEM,捷克TESCAN MIRALMS)对细菌表面形貌进行观察,并利用能量色散X射线谱仪(EDX)来确定元素含量。与铬反应前后的SEM-EDX图如图11~图16所示。可以看出,在Cr(VI)存在的情况下,细胞呈现出明显的形态学变化,表面呈不规则结构,细胞聚集成块并严重变形。与铬反应前后的EDX图中均未观察到Cr元素的存在,说明该菌株对Cr(VI)不进行生物吸附。
处理1和处理2的细胞样品均采用傅立叶红外光谱仪(FTIR,美国Frontier)在400~4000cm
结果表明:在3312cm
菌株CY-2与Cr(VI)反应前后的红外光谱图如图17所示,在与Cr(VI)反应后的FTIR图谱中,观察不到对应于硫酸盐吸收的峰,表明细胞膜组成发生了变化,特别是含硫酸盐的大分子在Cr(VI)处理后出现减少,这主要是因为铬与硫竞争ABC转运蛋白进入细胞,并由于铬诱导的氧化应激而降低细胞中硫的可用性。因此,菌株CY-2能生物积累Cr(VI),同时将Cr(VI)还原为Cr(III),进而使铬离子主动从细胞中释放出来。
综上,本发明了提供一株Kerstersia gyiorum CY-2,该菌株在不同的pH值(4~9)、接种量(1%~20%)、温度(27~52℃)、Cr(VI)初始浓度(50~250mg/L)的条件下均可以有效还原Cr(VI)。该菌株CY-2对Cr(VI)的最低抑制浓度为300mg/L;同时,菌株CY-2对Mg
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
- 一株寡养单胞菌及其应用和微生物菌剂
- 一株提高玉米耐盐能力的樊氏盐单胞菌菌株JPT10-1及其菌剂与应用
- 一株蜡状芽孢杆菌DIF1及其生产的微生物菌剂和应用
- 一株苯氧羧酸类除草剂降解菌及其应用
- 一株低温秸秆降解真菌JGDW-1及其菌剂与应用
- 一株草酸青霉、复合菌剂、联合修复剂及其应用
- 一株节杆菌和一种复合修复菌剂及其制备方法与应用
