使氨基酸代谢正常化的方法
文献发布时间:2023-06-19 10:58:46
发明领域
本发明涉及使食用补充有氨基酸的限制性蛋白质饮食的对象中受损的氨基酸代谢正常化的方法,包括治疗由该受损的代谢引起的医学病症的方法,该方法采用氨基酸的调释制剂,所述调释制剂模拟来自完整天然蛋白质的氨基酸的药物动力学吸收。
背景技术
一些疾病的特征是由加工一种或多种氨基酸所必需的酶的活性缺陷引起的先天性氨基酸代谢错误。苯丙酮酸尿(PKU)是这类疾病的原型实例,由苯丙氨酸羟化酶的活性缺陷引起,所述酶是将必需氨基酸苯丙氨酸转化为酪氨酸所需要的。在PKU个体中,苯丙氨酸很少或完全不被代谢为酪氨酸,随之发生苯丙氨酸及其产生毒性作用(尤其是在中枢神经系统中)的代谢产物的循环水平增加,如果没有开始适宜的营养管理的话。
由于苯丙氨酸是必需氨基酸(即,其不能由身体合成,而是需要从饮食中摄取),因此PKU个体的营养管理的目标是维持足够的血浆苯丙氨酸浓度以支持最佳生长、正常脑发育和精神功能,同时提供营养全面的饮食和预防神经学和心理学变化。因此,除了摄入不含苯丙氨酸的氨基酸混合物以满足他们的蛋白质需要外,PKU个体需要终身坚持在天然食物中受限制的低苯丙氨酸饮食,以限制天然蛋白质的摄入和同时提供足够量的苯丙氨酸。
从2010年以来,已经获得了合成氨基酸混合物的替代物:即,糖巨肽(GMP),其为来源于牛乳酪蛋白的天然64个氨基酸的糖磷酸肽(glycophosphopeptide),在干酪生产过程中产生。它是不含苯丙氨酸的合成氨基酸混合物的替代物,具有潜在的更天然的吸收特性。然而,GMP含有残留量的苯丙氨酸,后者可改变苯丙氨酸控制。
当蛋白质替代物的主要供给是合成来源(可容易吸收的不含苯丙氨酸的氨基酸混合物)时,蛋白质摄入相对于游离氨基酸摄入的潜在差异应当特别关注。已经知晓,氨基酸用于合成身体蛋白质的有效利用受到多种因素的影响,包括蛋白质消化和氨基酸吸收进入血流的速率、所有必需氨基酸的同时存在以及能量和总膳食氮的充分摄入,以支持蛋白质合成的高代谢成本(MacLeod和Ney 2010)。与完整天然蛋白质相比,当大多数氨基酸由基于要素游离氨基酸的饮食提供时,需氮量被认为增加,这是由于在基于游离氨基酸的饮食后氨基酸快速吸收(Metges等人,2000;Dangin等人,2001;Gropper和Acosta 1991)。氨基酸的这种快速吸收进入血流可造成较高的饮食酸负荷,特别是当施用较高剂量时。
在健康志愿者中,游离氨基酸的饮食摄入诱导了氨基酸快速吸收进入血流(t
Dangin等人(2001)评价了如下效果:通过肠进入血流的氨基酸的不同吸收量/速率可对全身蛋白质合成、分解和氧化产生影响,因而对蛋白质沉积的控制产生影响。在该研究中,通过在健康志愿者中比较单餐酪蛋白(缓慢释放蛋白质的典型实例)的摄入相对于游离氨基酸混合物(模拟酪蛋白的氨基酸组成,但是充当快速摄入餐食)的摄入以及比较单餐快速消化的乳清蛋白相对于重复餐的乳清蛋白(模拟慢消化速率)的摄入,评价了餐后全身动力学。全身亮氨酸平衡(蛋白质沉积指数和餐后蛋白质利用效率指数)在不同情况中显示不同。与慢餐相比,“快”餐诱导了血流中氨基酸水平的强的、快速的和瞬时的升高。这伴有蛋白质合成和氧化增加以及蛋白质分解的仅瞬时/轻微抑制。与之不同,在慢餐后氨基酸在血浆中的出现更慢、更低,并且被延长,具有不同的全身响应:没有刺激蛋白质合成,适度刺激氧化,但显著抑制蛋白质分解。
长期摄入氨基酸对肾脏的影响是潜在的问题。与喂食GMP饮食的小鼠相比,喂食氨基酸饮食的小鼠证实肾质量和尿体积显著增加15-30%,并且酸性尿pH<5.5(Solverson等人,2012)。此外,GMP与氨基酸混合物相比较慢的摄入和吸收促进饱腹感,并且可调节餐后血糖水平的控制(MacLeod等人,2011;Van Calcar等人,2009)。
随着游离氨基酸配方和饮食疗法的发展,由于PKU引起的严重精神发育迟缓已经被减轻。然而,对于所有年龄组和性别的PKU个体,包括通过低蛋白质饮食结合补充游离氨基酸配方物或使用现有可用药物而良好控制苯丙氨酸水平的PKU患者,仍然存在大量未被满足的医学需求。
目前未被满足的医学需求主要涉及终生摄入合成的、快速吸收的游离氨基酸配方物。这些临床表现主要在经典PKU患者中观察到。由于对苯丙氨酸的耐受低,这些患者在他们的整个生命中食用主要由游离氨基酸配方物组成的饮食,其占总每日蛋白质摄入量的高达80-85%。
需要新的选择来提供现有合成游离氨基酸混合物的替代物,改善食用大量游离氨基酸的个体的饮食管理。
本发明人已经出人意料地发现了在食用补充有氨基酸的限制性蛋白质饮食的患者中模拟蛋白质消化的一些优点,包括改善的氮平衡、减少的肌肉分解代谢、改善的葡萄糖和胰岛素控制和减少的氨基酸浓度波动,以及随之产生的代谢和肌肉骨骼益处。
因此,在第一个主要实施方案中,本发明提供了在食用补充有口服氨基酸的限制性蛋白质饮食的对象中治疗或预防氨基酸浓度升高的方法,该方法包括给所述对象施用治疗有效量的调释氨基酸制剂,由此延长所述口服氨基酸的释放和通过所述氨基酸模拟天然蛋白质的代谢。
在第二个主要实施方案中,本发明提供了在食用补充有口服氨基酸的限制性蛋白质饮食的对象中治疗或预防苯丙氨酸浓度升高或波动的方法,该方法包括给所述对象施用治疗有效量的调释氨基酸制剂,由此延长所述口服氨基酸的释放和通过所述氨基酸模拟天然蛋白质的代谢。该第二个主要实施方案可特别应用于PKU患者,其中补充的口服氨基酸排除苯丙氨酸。
在第三个主要实施方案中,本发明提供了在食用补充有口服氨基酸的限制性蛋白质饮食的对象中治疗或预防肌肉蛋白酶解的方法,所述肌肉蛋白酶解表现为重量或肌肉损失或者BUN或尿素浓度升高,该方法包括给所述对象施用治疗有效量的调释氨基酸制剂,由此延长所述口服氨基酸的释放和通过所述氨基酸模拟天然蛋白质的代谢。
在第四个主要实施方案中,本发明提供了在食用补充有口服氨基酸的限制性蛋白质饮食的对象中治疗或预防BUN或尿素浓度升高的方法,该方法包括给所述对象施用治疗有效量的调释氨基酸制剂,由此延长所述口服氨基酸的释放和通过所述氨基酸模拟天然蛋白质的代谢。
在第五个主要实施方案中,本发明提供了在食用补充有口服氨基酸的限制性蛋白质饮食的对象中稳定葡萄糖水平和降低胰岛素水平的方法,该方法包括给所述对象施用治疗有效量的调释氨基酸制剂,由此延长所述口服氨基酸的释放和通过所述氨基酸模拟天然蛋白质的代谢。
在第六个主要实施方案中,本发明提供了在食用补充有口服氨基酸的限制性蛋白质饮食的对象中稳定酪氨酸吸收的方法,该方法包括给所述对象施用治疗有效量的氨基酸制剂的制剂,所述氨基酸制剂包含酪氨酸和海藻酸或其可药用盐的、未用调释包衣进行包衣的制粒颗粒。该第六个主要实施方案可特别应用于PKU患者,其中补充的口服氨基酸排除苯丙氨酸。
在第七个主要实施方案中,本发明提供了在食用补充有口服氨基酸的限制性蛋白质饮食的对象中使一种或多种代谢标记物正常化的方法,所述代谢标记物选自血浆胰岛素、血浆葡萄糖、血尿素氮、尿液尿素氮和血浆苯丙氨酸,该方法包括给所述对象施用治疗有效量的调释氨基酸制剂,由此延长所述口服氨基酸的释放和通过所述氨基酸模拟天然蛋白质的代谢。本发明的其它优点在随后的说明书中部分地给出,并且部分地从说明书中显而易见,或者可通过本发明的实施来获知。本发明的优点将通过所附权利要求中特别指出的要素和组合来实现和获得。应当理解,前面的概述和后面的详细说明均仅仅是示例性和说明性的,而不限制所要求保护的本发明。
附图并入本说明书并构成本说明书的一部分,其解释了本发明的一些实施方案,并且与说明书一起用于解释本发明的原理。
图1是实施例1中使用的测试产品的生产流程图。
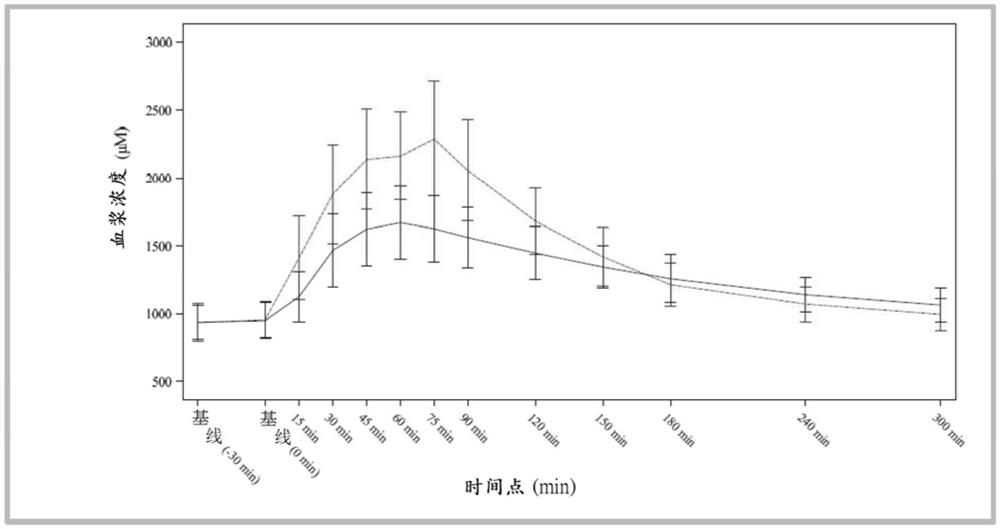
图2绘制了如实施例1中所述的测试产品和参比产品在5小时(300分钟)期间必需氨基酸的平均血浆浓度-时间曲线。虚线指示参比产品的结果;实线指示测试产品的结果。
图3绘制了如实施例1中所述的测试产品和参比产品在7小时(420分钟)期间必需氨基酸的平均血浆浓度-时间曲线。虚线指示参比产品的结果;实线指示测试产品的结果。
图4绘制了如实施例1中所述的测试产品和参比产品在7小时(420分钟)期间的大分子中性氨基酸的平均血浆浓度-时间曲线。虚线指示参比产品的结果;实线指示测试产品的结果。
图5绘制了如实施例1中所述的测试产品和参比产品在7小时(420分钟)期间支链氨基酸的平均血浆浓度-时间曲线。虚线指示参比产品的结果;实线指示测试产品的结果。
图6绘制了如实施例1中所述的测试产品和参比产品在7小时(420分钟)期间总氨基酸的平均血浆浓度-时间曲线。虚线指示参比产品的结果;实线指示测试产品的结果。
图7绘制了如实施例1中所述的测试产品和参比产品在7小时(420分钟)期间酪氨酸的平均血浆浓度-时间曲线。虚线指示参比产品的结果;实线指示测试产品的结果。
图8绘制了如实施例1中所述的测试产品和参比产品在7小时(420分钟)期间苯丙氨酸的平均血浆浓度-时间曲线。虚线指示参比产品的结果;实线指示测试产品的结果。
图9绘制了如实施例1中所述的测试产品和参比产品在5小时(300分钟)期间胰岛素的平均血浆浓度-时间曲线。虚线指示参比产品的结果;实线指示测试产品的结果。
图10绘制了如实施例1中所述的测试产品和参比产品在5小时(300分钟)期间葡萄糖的平均血浆浓度-时间曲线。虚线指示参比产品的结果;实线指示测试产品的结果。
图11绘制了如实施例1中所述的测试产品和参比产品在5小时(300分钟)期间血浆中BUN的平均浓度-时间曲线。虚线指示参比产品的结果;实线指示测试产品的结果。
图12绘制了如实施例1中所述的测试产品和参比产品在5小时(300分钟)期间尿液中尿素的平均浓度-时间曲线。虚线指示参比产品的结果;实线指示测试产品的结果。
图13是实施例1中所述的参比产品随时间推移释放的氨基酸总和的重量溶出试验结果的曲线图,根据实施例3中所述方法测量。
图14是实施例1中所述的测试产品随时间推移释放的氨基酸总和的重量溶出试验结果的曲线图,根据实施例3中所述方法测量。
图15是实施例1中所述的参比产品随时间推移释放的个体氨基酸的溶出试验结果的曲线图,根据实施例3中所述方法测量。
图16是实施例1中所述的测试产品随时间推移释放的个体氨基酸的溶出试验结果的曲线图,根据实施例3中所述方法测量。
图17的柱状图描绘了饲喂本发明的调释制剂的动物和饲喂安慰剂的动物的握力随时间推移的变化,如实施例4中所述。基线结果报告在每个图的左柱中;研究结束的结果报告在右侧。
图18的图描绘了在实施例4中报到的动物研究中通过蛋白质印迹测定的股二头肌中BNIP3L/NIX表达。PL结果对应于安慰剂;CR结果对应于测试制剂。
无论何处需要分析或测试来理解本文所述的给定性质或特征时,应当理解,所述分析或测试根据自2018年8月30日起有效的、在美国适用于药物产品的美国食品和药品管理局(“FDA”)和美国药典(“USP”)的适用指导、草案指导、规章和专著来进行,另有说明除外。
如本说明书和随后的权利要求书中所用的单数形式“一个”、“一种”或实体名词等包括复数指代物,上下文另有清楚指示除外。
如本说明书和随后的权利要求书中所用的词语“包含”及其变体如“含有”指“包括但不限于”,并且不旨在排除例如其它添加物、组分、整数或步骤。当要素被描述为包含多个组分、步骤或条件时,应当理解,该要素也可以被描述为包含所述多个组分、步骤或条件的任何组合,或者“由”或“基本上由”多个组分、步骤或条件或其组合“组成”。
当通过与范围的上限分开地指定范围的下限或通过指定特定数值来给出范围时,应当理解,可以通过选择性地组合下限变量、上限变量和特定数值中的任一个来定义范围,这在数学上是可能的。以类似方式,当范围定义为从一个端点跨越到另一个端点时,该范围还将理解为涵盖两个端点之间的跨度并且排除这两个端点。
当在本文中使用时,术语“约”将补偿制药工业中允许的和该工业中产品固有的可变性,例如由于生产变异和时间引起的产品降解而导致的产品强度的差异。该术语允许任何变异,其在良好生产规范的实践中将允许所评价的产品被认为在人体中与所要求保护的产品的所述强度在治疗上等同或生物等效,如FDA在2003年3月的关于口服施用药物产品的生物利用度和生物等效性研究的工业指导——通用考量(Guidance for Industry onBioavailability and Bioequivalence Studies for Orally Administered DrugProducts–General Considerations)中所述。
当本文给出百分比时,应当理解,百分比是重量百分比,比例是基于重量的,另有相反教导除外。
如本发明的组合物中使用的短语“可接受”指该组合物的分子实体和其它成分是生理学上可耐受的,当施用于对象(例如哺乳动物,如人)时通常不产生不良反应。
术语“氨基酸”指能够参与肽和蛋白质合成的任意天然存在的氨基酸。为了便于撰写,氨基酸通常不以立体构型的方式书写,虽然可以理解,氨基酸应当以其天然存在的立体异构体存在。在本发明的制剂中,氨基酸可以以游离碱、盐酸盐或其它适宜的盐的形式存在。
“生物等效性”指:在适当设计的研究中,当在相似条件下以相同摩尔剂量施用时,药物等同物或药物替代物中的活性成分或活性部分在药物作用处变得可利用的速率和程度没有显著差异。曲线下面积(AUC)生物等效性指:在适宜设计的交叉试验中,历经300分钟、420分钟的时间段或外推至无穷大时,测试产品的平均AUC为参比产品的平均AUC的80%至125%。
术语“制剂”指药物或医学食品或食品成分的成品或半成品组合,包括活性成分和非活性赋形剂或添加剂。该术语指过程中制剂、成品制剂和包装成最终单位剂量的制剂。
术语“调释”指其中释放速率被有意改变以实现期望的治疗或药物动力学响应的任意药物制剂。因此,该术语包括这样的延迟释放制剂:其中药物的释放随时间被延迟,或者释放速率不依赖于周围环境的pH。该术语还包括其中活性成分从制剂(或其部分)的释放被延迟以在初始摄入后发生的延迟释放制剂。延迟释放制剂通常被设计成释放主要在制剂一到达小肠就发生。
根据主要实施方案和亚实施方案描述了本发明,并且可以理解,可以将主要实施方案组合以定义其它主要实施方案,可以将亚实施方案组合以定义另外的亚实施方案,并且可以将亚实施方案和亚实施方案的组合与所有的主要实施方案组合以定义本发明的其它实施方案。组合实施方案和亚实施方案的能力仅受数学上或物理上不可能的限制。
因此,在第一个主要实施方案中,本发明提供了在食用补充有口服氨基酸的限制性蛋白质饮食的对象中治疗或预防氨基酸浓度升高的方法,该方法包括给所述对象施用治疗有效量的调释氨基酸制剂,由此延长所述口服氨基酸的释放和通过所述氨基酸模拟天然蛋白质的代谢。
在第二个主要实施方案中,本发明提供了在食用补充有口服氨基酸的限制性蛋白质饮食的对象中治疗或预防苯丙氨酸浓度升高或波动的方法,该方法包括给所述对象施用治疗有效量的调释氨基酸制剂,由此延长所述口服氨基酸的释放和通过所述氨基酸模拟天然蛋白质的代谢。
在第三个主要实施方案中,本发明提供了在食用补充有口服氨基酸的限制性蛋白质饮食的对象中治疗或预防肌肉蛋白酶解的方法,所述肌肉蛋白酶解表现为重量或肌肉损失或者BUN或尿素浓度升高,该方法包括给所述对象施用治疗有效量的调释氨基酸制剂,由此延长所述口服氨基酸的释放和通过所述氨基酸模拟天然蛋白质的代谢。
在第四个主要实施方案中,本发明提供了在食用补充有口服氨基酸的限制性蛋白质饮食的对象中治疗或预防BUN或尿素浓度升高的方法,该方法包括给所述对象施用治疗有效量的调释氨基酸制剂,由此延长所述口服氨基酸的释放和通过所述氨基酸模拟天然蛋白质的代谢。
在第五个主要实施方案中,本发明提供了在食用补充有口服氨基酸的限制性蛋白质饮食的对象中稳定葡萄糖水平和降低胰岛素水平的方法,该方法包括给所述对象施用治疗有效量的调释氨基酸制剂,由此延长所述口服氨基酸的释放和通过所述氨基酸模拟天然蛋白质的代谢。
在第六个主要实施方案中,本发明提供了在食用补充有口服氨基酸的限制性蛋白质饮食的对象中稳定酪氨酸吸收的方法,该方法包括给所述对象施用治疗有效量的氨基酸制剂的制剂,所述氨基酸制剂包含酪氨酸和海藻酸或其可药用盐的未用调释包衣进行包衣的制粒颗粒。
在第七个主要实施方案中,本发明提供了在食用补充有口服氨基酸的限制性蛋白质饮食的对象中使一种或多种代谢标记物正常化的方法,所述代谢标记物选自血浆胰岛素、血浆葡萄糖、血尿素氮、尿液尿素氮和血浆苯丙氨酸,该方法包括给所述对象施用治疗有效量的调释氨基酸制剂,由此延长所述口服氨基酸的释放和通过所述氨基酸模拟天然蛋白质的代谢。
在各个实施方案中,升高的氨基酸或苯丙氨酸浓度表现在非健康状态中或具有表现在非健康状态中的可能,施用调释氨基酸治疗或预防非健康状态,特别是在受累于非健康苯丙氨酸浓度的患者中。因此,在一个亚实施方案中,升高的苯丙氨酸浓度表现为选自智力障碍、焦虑、抑郁、执行功能缺陷、认知缺陷、智商降低、癫痫发作、发育迟缓、行为问题、精神障碍、情绪不稳、不能集中注意力、震颤、信息处理延迟、记忆缺陷、身体蛋白质缺乏、身高缺陷、骨丢失、肌无力、步态障碍、精力减退或嗜睡的病症,并且调释氨基酸治疗或预防所述病症。在另一个亚实施方案中,升高的氨基酸浓度表现为选自体重或肌肉损失或者BUN或尿素浓度升高的病症,并且调释氨基酸治疗或预防所述病症。在另一个亚实施方案中,升高的氨基酸浓度表现为选自不稳定的葡萄糖或升高的胰岛素水平的病症,并且调释氨基酸治疗或预防所述病症。
所述方法和制剂可特别用于给患有先天性代谢错误的个体补充对氨基酸的特殊膳食需求。因此,在一些实施方案中,所述对象患有选自下述的代谢病症:苯丙酮酸尿、酪氨酸血症、亮氨酸病、甲基丙二酸血症、高胱氨酸尿症、高甘氨酸血症、异戊酸血症、丙酸血症和谷氨酸血症,在需要其的对象中。在其它实施方案中,所述对象患有慢性肾病、肝病、糖尿病、心血管疾病、少肌症(sarcopenia)、恶病质或低血浆白蛋白(>3.5g/L
在更进一步的亚实施方案中,所述对象具有选自以下三个严重程度之一的PKU:
·经典PKU,定义为苯丙氨酸浓度大于1200微摩尔/升(20mg/dL),并且调释氨基酸制剂不含苯丙氨酸。
·轻度PKU,定义为苯丙氨酸浓度为600至1200微摩尔/L(10至20mg/dL),并且调释氨基酸制剂不含苯丙氨酸。
·轻度高苯丙氨酸血症,定义为苯丙氨酸浓度为300至600微摩尔/L(5至10mg/dL),并且调释氨基酸制剂不含苯丙氨酸。
在本发明的制剂中,以相对量平衡以满足所述对象的生理学需求的氨基酸的每日方案通常包括0.8至1.35g/kg/天。对象可分为如下3个体重&能量类别:55-65.4kg体重的对象优选接受24g氨基酸(剂量),相当于20.0g蛋白质当量,每日三次;65.5-75.4kg体重的对象优选接受28g氨基酸(剂量),相当于23.3g蛋白质当量,每天三次;75.5-85kg体重的对象优选接受32g氨基酸(剂量),相当于26.6g蛋白质当量,每天三次。
在一个亚实施方案中,氨基酸制剂包含以下氨基酸中的5种、10种或全部作为氨基酸:0.47-0.97重量份的L-丙氨酸、0.66-1.26重量份的L-精氨酸、1.04-1.84重量份的L-天冬氨酸、0.28-0.68重量份的L-胱氨酸、4.1-5.6重量份的L-谷氨酰胺、0.9-1.5重量份的L-甘氨酸、0.5-0.85重量份的L-组氨酸、1.0-1.65重量份的L-异亮氨酸、2.25-3.25重量份的L-亮氨酸、1.45-2.0重量份的L-赖氨酸、0.23-0.43重量份的L-蛋氨酸、0.0000重量份的L-苯丙氨酸、1.2-1.8重量份的L-脯氨酸、0.6-1.1重量份的L-丝氨酸、0.9-1.6重量份的L-苏氨酸、0.35-0.65重量份的L-色氨酸、2.0-3.0重量份的L-酪氨酸和0.9-1.6重量份的L-缬氨酸。
在另一个亚实施方案中,氨基酸制剂包含0.7200重量份的L-丙氨酸、0.9600重量份的L-精氨酸、1.4400重量份的L-天冬氨酸、0.4800重量份的L-胱氨酸、4.8000重量份的L-谷氨酰胺、1.2000重量份的L-甘氨酸、0.6710重量份的L-组氨酸、1.3200重量份的L-异亮氨酸、2.7600重量份的L-亮氨酸、1.6800重量份的L-赖氨酸、0.3334重量份的L-蛋氨酸、1.4400重量份的L-脯氨酸、0.8134重量份的L-丝氨酸、1.2000重量份的L-苏氨酸、0.4800重量份的L-色氨酸、2.400重量份的L-酪氨酸和1.2000重量份的L-缬氨酸。
在一个亚实施方案中,所述方法和制剂产生了:(a)基本上如图6中所描绘的氨基酸药物动力学曲线;和/或(b)小于4400、4300、4200、4100、4000、3900、3800、3700或3600μM的氨基酸C
在另一个亚实施方案中,所述制剂包含0.7200g的L-丙氨酸、0.9600g的L-精氨酸、1.4400g的L-天冬氨酸、0.4800g的L-胱氨酸、4.8000g的L-谷氨酰胺、1.2000g的L-甘氨酸、0.6710g的L-组氨酸、1.3200g的L-异亮氨酸、2.7600g的L-亮氨酸、1.6800g的L-赖氨酸、0.3334g的L-蛋氨酸、0.0000g的L-苯丙氨酸、1.4400g的L-脯氨酸、0.8134g的L-丝氨酸、1.2000g的L-苏氨酸、0.4800g的L-色氨酸、2.400g的L-酪氨酸和1.2000g的L-缬氨酸作为氨基酸,产生了:(a)基本上如图6中所描绘的氨基酸药物动力学曲线;和/或(b)小于4400、4300、4200、4100、4000、3900、3800、3700或3600μM的氨基酸C
在另一个亚实施方案中,(a)所述调释氨基酸产生的口服施用后血液中总氨基酸最大浓度比口服施用等同的定性定量剂量(quali-quantitative dose)的速释氨基酸后血液中总氨基酸最大浓度低至少20%;和/或(b)所述调释氨基酸产生的口服施用后血液中总氨基酸曲线下面积(AUC)与口服施用等同的定性定量剂量的速释氨基酸产生的AUC生物等效。药物动力学优选是从给60kg对象单次施用24.0g氨基酸观察的。
在另一个亚实施方案中,氨基酸制剂包含作为必需氨基酸的以下氨基酸中的4种、7种或全部:0.66至1.26重量份的L-精氨酸、0.5至0.85重量份的L-组氨酸、1.0至1.65重量份的L-异亮氨酸、2.25至3.25重量份的L-亮氨酸、1.45至2.0重量份的L-赖氨酸、0.23至0.43重量份的L-蛋氨酸、0.9至1.6重量份的L-苏氨酸、0.35至0.65重量份的L-色氨酸、2.0至3.0重量份的L-酪氨酸和0.9至1.6重量份的L-缬氨酸。
在另一个亚实施方案中,氨基酸制剂包含作为必需氨基酸的0.6710重量份的L-组氨酸、1.3200重量份的L-异亮氨酸、2.7600重量份的L-亮氨酸、1.6800重量份的L-赖氨酸、0.3334重量份的L-蛋氨酸、1.2000重量份的L-苏氨酸、0.4800重量份的L-色氨酸、1.2000重量份的L-缬氨酸、0.9600重量份的L-精氨酸和2.400重量份的L-酪氨酸。
在另一个亚实施方案中,所述制剂产生了:(a)基本上如图2中所描绘的必需氨基酸药物动力学曲线;和/或(b)小于2300、2200、2100、2000、1900或1800μM的必需氨基酸C
在另一个亚实施方案中,包含作为必需氨基酸的0.6710g的L-组氨酸、1.3200g的L-异亮氨酸、2.7600g的L-亮氨酸、1.6800g的L-赖氨酸、0.3334g的L-蛋氨酸、1.2000g的L-苏氨酸、0.4800g的L-色氨酸、1.2000g的L-缬氨酸、0.9600g的L-精氨酸和2.400g的L-酪氨酸的制剂产生了:(a)基本上如图2所描绘的必需氨基酸药物动力学曲线;和/或(b)小于2300、2200、2100、2000、1900或1800μM的必需氨基酸C
在另一个亚实施方案中,(a)所述调释氨基酸产生的口服施用后血液中必需氨基酸最大浓度比口服施用等同的定性定量剂量的速释必需氨基酸后血液中必需氨基酸最大浓度低至少20%;和/或(b)所述调释氨基酸产生的口服施用后血液中必需氨基酸曲线下面积(AUC)与口服施用等同的定性定量剂量的速释必需氨基酸产生的AUC生物等效。药物动力学优选是从给60kg对象单次施用包括13.00g必需氨基酸的24.0g氨基酸观察的。
在另一个亚实施方案中,制剂包含作为大分子中性氨基酸的以下氨基酸中的3种、5种或全部:0.5至0.85重量份的L-组氨酸、1.0至1.65重量份的L-异亮氨酸、2.25至3.25重量份的L-亮氨酸、0.23至0.43重量份的L-蛋氨酸、0.9至1.6重量份的L-苏氨酸、0.35至0.65重量份的L-色氨酸、2.0至3.0重量份的L-酪氨酸和0.9至1.6重量份的L-缬氨酸。
在另一个亚实施方案中,制剂包含作为大分子中性氨基酸的0.6710重量份的L-组氨酸、1.3200重量份的L-异亮氨酸、2.7600重量份的L-亮氨酸、0.3334重量份的L-蛋氨酸、1.2000重量份的L-苏氨酸、0.4800重量份的L-色氨酸、1.200重量份的L-缬氨酸和2.400重量份的L-酪氨酸。
在另一个亚实施方案中,制剂产生了:(a)基本上如图4中所描绘的大分子中性氨基酸药物动力学曲线;和/或(b)小于1700、1600、1500、1400或1300μM的大分子中性氨基酸C
在另一个亚实施方案中,制剂包含作为大分子中性氨基酸的0.6710g的L-组氨酸、1.3200g的L-异亮氨酸、2.7600g的L-亮氨酸、0.3334g的L-蛋氨酸、1.200g的L-苏氨酸、0.4800g的L-色氨酸、1.200g的L-缬氨酸和2.400g的L-酪氨酸,产生了:(a)基本上如图4中所描绘的大分子中性氨基酸药物动力学曲线;和/或(b)小于1700、1600、1500、1400或1300μM的大分子中性氨基酸C
在另一个亚实施方案中,(a)所述调释氨基酸产生的口服施用后血液中大分子中性氨基酸最大浓度比口服施用等同的定性定量剂量的速释大分子中性氨基酸后血液中大分子中性氨基酸最大浓度低至少20%;和/或(b)所述调释氨基酸产生的口服施用后血液中大分子中性氨基酸曲线下面积(AUC)与口服施用等同的定性定量剂量的速释大分子中性氨基酸产生的AUC生物等效。药物动力学优选是从给60kg对象单次施用包括10.36g大分子中性氨基酸的24.0g氨基酸观察的。
在另一个亚实施方案中,氨基酸制剂包含作为支链氨基酸的以下氨基酸中的1种、2种或全部:1.0至1.65重量份的L-异亮氨酸、2.25至3.25重量份的L-亮氨酸和0.9至1.6重量份的L-缬氨酸。在另一个亚实施方案中,氨基酸制剂包含作为支链氨基酸的1.200重量份的L-缬氨酸、2.7600重量份的L-亮氨酸和1.3200重量份的L-异亮氨酸。
在另一个亚实施方案中,所述制剂产生了:(a)基本上如图5所描绘的支链氨基酸药物动力学曲线;和/或(b)小于1100、1000、900、800或700μM的支链氨基酸C
在另一个亚实施方案中,包含作为支链氨基酸的1.200g的L-缬氨酸、2.7600g的L-亮氨酸和1.3200g的L-异亮氨酸的制剂产生了:(a)基本上如图5中所描绘的支链氨基酸药物动力学曲线;和/或(b)小于1100、1000、900、800或700μM的支链氨基酸C
在另一个亚实施方案中,(a)所述调释氨基酸产生的口服施用后血液中支链氨基酸最大浓度比口服施用等同的定性定量剂量的速释支链氨基酸后血液中支链氨基酸最大浓度低至少20%;和/或(b)所述调释氨基酸产生的口服施用后血液中支链氨基酸曲线下面积(AUC)与口服施用等同的定性定量剂量的支链速释氨基酸产生的AUC生物等效。药物动力学优选是从给60kg对象单次施用包括10.36g大分子中性氨基酸的24.0g氨基酸观察的。
在其它亚实施方案中,制剂包含选自L-丙氨酸、L-精氨酸、L-天冬氨酸、L-胱氨酸、L-谷氨酰胺、L-甘氨酸、L-组氨酸、L-异亮氨酸、L-亮氨酸、L-赖氨酸、L-蛋氨酸、L-脯氨酸、L-丝氨酸、L-苏氨酸、L-色氨酸、L-酪氨酸和L-缬氨酸的氨基酸中的一种、全部或任意组合。
在其它亚实施方案中,制剂包含选自L-组氨酸、L-异亮氨酸、L-亮氨酸、L-赖氨酸、L-蛋氨酸、L-苏氨酸、L-色氨酸、L-缬氨酸、L-精氨酸和L-酪氨酸的必需氨基酸中的一种、全部或任意组合。
在其它亚实施方案中,制剂包含选自L-异亮氨酸、L-亮氨酸、L-蛋氨酸、L-苏氨酸、L-色氨酸、L-缬氨酸、L-精氨酸和L-组氨酸的大分子中性氨基酸中的一种、全部或任意组合。
在其它亚实施方案中,制剂包含选自L-缬氨酸、L-亮氨酸和L-异亮氨酸的支链氨基酸中的一种、全部或任意组合。
最终制剂
在一个亚实施方案中,制剂包含被一种或多种释放调节赋形剂包衣的氨基酸颗粒,本文中还称为“用于延缓氨基酸释放速率的包衣方式”或“用于实现所述释放速率的包衣方式”。如上文所讨论,颗粒可以通过湿法或干法制粒技术制备,但是它们优选通过湿法制粒来制备。它们还优选被限制在特定的尺寸范围,例如0.1-3mm、0.5-2.0mm、0.5-1.0mm、0.5-2.0mm或1.0-2.0mm。每种氨基酸可以被包含在其自身的颗粒内,但是调释氨基酸优选混合在颗粒内。
调释性质优选通过将适宜的一种或多种调释包衣以基于氨基酸重量计1wt%至30wt%、或5wt%至25wt%的量应用于颗粒而实现的。适于包衣的延迟释放赋形剂包括乙基纤维素、二山嵛酸甘油酯、乙酸纤维素、乙酸乙烯酯/氯乙烯共聚物、丙烯酸酯/甲基丙烯酸酯共聚物、聚环氧乙烷、羟丙基甲基纤维素、角叉菜胶、海藻酸及其盐、羟乙基纤维素、羟丙基纤维素、刺梧桐树胶、阿拉伯胶、西黄蓍胶、槐豆胶、瓜尔胶、羧甲基纤维素钠、甲基纤维素、蜂蜡、加诺巴蜡、鲸蜡醇、氢化植物油、硬脂醇、丙烯酸共聚物、海藻酸钠、角叉菜胶、海藻酸、果胶、羧甲基纤维素钠或其组合。
一种优选的组合物包含具有前述尺寸范围之一的制粒颗粒和基于氨基酸重量计1wt%至15wt%、2wt%至10wt%、或5wt%至7.5wt%乙基纤维素的包衣。另一种优选的组合物包含具有前述尺寸范围之一的制粒颗粒和第一种乙基纤维素包衣(如上所述)和第二种基于氨基酸重量计5%至15%或约10wt%二山嵛酸甘油酯的包衣。
在其它亚实施方案中,包含2g调释氨基酸的制剂在<711>USP39 NF34桨式装置中、于37℃在450或500mL 0.1N盐酸(pH1.2)中、桨速度50rpm进行的溶出试验的30分钟中释放不超过70%或60%或50%的调释氨基酸。
在其它亚实施方案中,调释氨基酸存在于颗粒中,所述颗粒包含选自聚乙烯吡咯烷酮、淀粉、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素、蔗糖溶液、右旋糖溶液、瓜尔胶、黄原胶、阿拉伯胶、西黄蓍胶、槐豆胶和海藻酸钠或海藻酸盐、优选海藻酸钠或另一种海藻酸盐的粘合剂。在其它亚实施方案中,调释氨基酸存在于包含调释包衣的颗粒中,所述调释包衣包含乙基纤维素或者乙基纤维素与二山嵛酸二甘油酯的组合。
在其它亚实施方案中,调释氨基酸存在于颗粒中,所述颗粒包含:(a)选自海藻酸钠或海藻酸盐的粘合剂;和(b)包含乙基纤维素或者乙基纤维素与二山嵛酸二甘油酯的组合的调释包衣。在其它亚实施方案中,制剂进一步包含未用调释包衣进行包衣的酪氨酸的制粒颗粒,所述颗粒含有选自海藻酸及其盐的粘合剂。
本发明的制剂还可以包含其它营养添加剂。因此,在另一个亚实施方案中,制剂还包含一种或多种选自以下的额外成分:(a)维生素、矿物质和碳水化合物;或(b)胆碱、肌醇、维生素A、维生素D、维生素E、维生素K、维生素C、硫胺、核黄素、尼克酸、维生素B6、叶酸盐、维生素B12、生物素、泛酸、钾、钙、镁、铁、锌、铜、锰、硒、铬、钼、碘、钠、硫、磷、二十二碳六烯酸、二十碳五烯酸、花生四烯酸和叶黄素,及其盐、螯合物、酯和其它衍生物。
制剂还可以包括其它功能性赋形剂以支持剂型的完整性。因此,在进一步的亚实施方案中,制剂进一步包含:
a)填充剂,选自乳糖、蔗糖、右旋糖、山梨醇、果糖和纤维素粉末;
b)崩解剂,选自微晶纤维素、淀粉、交聚维酮、淀粉羟乙酸钠和交联羧甲基纤维素钠;
c)助流剂或润滑剂,选自滑石粉、玉米淀粉、二氧化硅、月桂硫酸钠、硬脂酸镁、硬脂酸钙、硬脂酸钠、硬脂酸、硬脂酰醇富马酸钠、氢化棉籽油、滑石粉、蜡、鲸蜡醇、硬脂酸甘油酯、棕榈酸甘油酯、山嵛酸甘油酯、氢化植物油和硬脂醇;
d)掩味剂,选自纤维素羟丙基醚(HPC);低取代羟丙基醚(L-HPC);纤维素羟丙基甲基醚(HPMC);甲基纤维素聚合物;乙基纤维素(EC)及其混合物;聚乙烯醇(PVA);羟乙基纤维素;羧甲基纤维素和羧甲基纤维素(CMC)盐;聚乙烯醇和聚乙二醇共聚物;甘油单酯、甘油三酯、聚乙二醇、改性食物淀粉、丙烯酸聚合物和丙烯酸聚合物与纤维素醚的混合物;醋酞纤维素;sepifilms,例如HPMC和硬脂酸的混合物,环糊精,及其混合物;和/或
e)矫味剂,选自阿拉伯糖浆、乙酰舒泛K、阿利坦、茴芹、苹果、阿司帕坦、香蕉、巴伐利亚奶油(Bavarian cream)、浆果、黑醋栗、奶油糖果、柠檬酸钙、樟脑、焦糖、樱桃、樱桃奶油、巧克力、肉桂、泡泡胶、柑橘、柑橘汁(citrus punch)、柑橘奶油、棉花糖、可可、可乐、冷樱桃、冷柑橘、环拉酸盐、cylamate、右旋糖、桉树、丁香酚、果糖、果汁(fruit punch)、姜、甘草次酸、甘草糖浆、葡萄、葡萄柚、蜂蜜、异麦芽酮糖醇(isomalt)、柠檬、酸橙、柠檬奶油、甘草酸单铵(monoammonium glyrrhizinate)、麦芽酚、甘露醇、枫树、棉花软糖或药蜀葵(marshmallow)、薄荷醇、薄荷奶油、混合莓、新橙皮苷DC(neohesperidine DC)、纽甜(neotame)、橙子、梨、桃、欧薄荷、欧薄荷奶油、覆盆子、根啤酒、朗姆、糖精、黄樟脑、山梨醇、留兰香、留兰香奶油、草莓、草莓奶油、甜叶菊、三氯蔗糖、蔗糖、糖精钠、糖精、阿司帕坦、纽甜、乙酰舒泛钾、甘露醇、踝蛋白(talin)、木糖醇、三氯蔗糖、山梨醇、瑞士奶油(swisscream)、塔格糖、橘子(tangerine)、非洲竹芋甜素(thaumatin)、什锦水果粉(tuttifruitti)、香草、核桃、西瓜、野樱桃、冬青油、木糖醇或其组合。
制剂可以作为任何适宜的口服剂型存在,但是优选是选自片剂、丸剂、软或硬明胶胶囊、粉末、颗粒、微球、锭剂、包装的粉末或颗粒或微球的小药囊、酏剂、混悬物、乳液、咀嚼片或糖浆的剂型。
在另一个主要实施方案中,本发明提供了氨基酸制剂,其包含酪氨酸和海藻酸或其可药用盐的未用调释包衣进行包衣的制粒颗粒。
实施例
在以下实例中,已经努力确保数字(例如量、温度等)的准确性,但是应当考虑一些误差和偏差。给出以下实施例以向本领域普通技术人员提供如何进行和评价本文要求保护的方法的完整公开内容和描述,并且旨在纯粹是本发明的示例,而不旨在限制发明人认为是其发明的范围。
实施例1.口服摄入三种不含苯丙氨酸的氨基酸混合物(一种采用调释技术)和酪蛋白作为阳性对照后的氨基酸生物利用度比较
研究产品(“测试产品”)的通用名:“APR-1301-01调释氨基酸混合物”,是一种调释的不含苯丙氨酸的合成氨基酸混合物,含有17种氨基酸、肉碱、牛磺酸、维生素、矿物质、其它营养素和食品添加剂。调释混合物基于本文所述的专属技术,所述技术提供了氨基酸调释包衣颗粒以混悬于水中。
*必需氨基酸:L-组氨酸、L-异亮氨酸、L-亮氨酸、L-赖氨酸、L-蛋氨酸、L-苏氨酸、L-色氨酸、L-缬氨酸、L-精氨酸和L-酪氨酸。尽管酪氨酸通常不被认为是必需氨基酸,但是其在PKU个体中被包括在内作为EAA。加入精氨酸(以及酪氨酸)是因为其是婴儿和成长中儿童所需要的。如果不通过饮食引入,则不能获得它们用于蛋白质合成。不包括苯丙氨酸,因为它不包含在APR-1301-01氨基酸混合物中。
-为了比较口服摄入测试产品相对于参比产品后一直到420分钟(7小时)大分子中性氨基酸(LNAAs)**、支链氨基酸(BCAAs)***、个体氨基酸****和总氨基酸****的吸收特性。
-为了在一直到420分钟氨基酸(EAAs、LNAAs**、BCAAs***、个体氨基酸****和总氨基酸****)的吸收特性方面比较测试产品与市售产品和酪蛋白以及比较参比产品与市售产品和酪蛋白,作为二次统计学分析。
-为了探索另外的“功效”参数以评价不同饮食氨基酸摄入(测试产品对比于参比产品、酪蛋白和市售产品)对氨基酸可改变葡萄糖和胰岛素内稳态的方式的影响,在组织水平(合成代谢/分解代谢途径)上使用氨基酸。
**LNAAs:L-异亮氨酸、L-亮氨酸、L-蛋氨酸、L-苏氨酸、L-色氨酸、L-缬氨酸、L-酪氨酸、L-组氨酸。不包括苯丙氨酸,因为它不包含在APR-1301-01氨基酸混合物中。
***BCAAs:L-缬氨酸、L-亮氨酸和L-异亮氨酸。这三种氨基酸不经历肝脏首过代谢,因此对氨基酸真实从肠吸收进入血流而言最具有代表性。
****总氨基酸/个体氨基酸,包括测试产品、参比产品和市售产品中含有的(17种中的)16种氨基酸,即:L-组氨酸、L-异亮氨酸、L-亮氨酸、L-蛋氨酸、L-苏氨酸、L-色氨酸、L-缬氨酸、L-赖氨酸、L-酪氨酸*、L-精氨酸**、L-丙氨酸、L-天冬氨酸、L-谷氨酰胺、甘氨酸、L-脯氨酸和L-丝氨酸。L-胱氨酸(氨基酸半胱氨酸的氧化二聚体形式)没有被评价,因为它在血浆样品中非常不稳定。
测试产品是一种新的不含苯丙氨酸的合成氨基酸混合物,含有17种氨基酸以及维生素、矿物质、其它营养素和食品添加剂。已经对其进行了开发,目的是调节氨基酸从制剂中的释放以更接近地模拟来自食物的天然蛋白质摄入的氨基酸的生理吸收。调释技术允许生产氨基酸调释包衣颗粒用于混悬于水中。测试产品的制造流程图如图1所示。
参比产品是速释的不含苯丙氨酸的氨基酸混合物,含有17种氨基酸、维生素、矿物质、其它营养物和食品添加剂,类似于测试产品。
测试产品和参比产品以相同的定性-定量组成含有氨基酸/维生素/矿物质/其它营养物/食品添加剂。它们之间的唯一区别是在测试产品中应用能够调节氨基酸从制剂中释放的包衣层,因此体内吸收预期被改变。
阳性对照(酪蛋白):酪蛋白是能够在胃中形成凝胶或凝块的乳蛋白质。酪蛋白通常被分类为缓释蛋白质,因为它是提供氨基酸生理吸收进入血流的蛋白质的典型实例。在本研究中,选择食品级酪蛋白(酸性酪蛋白80MESH,A.C.E.F.,意大利)作为阳性对照。
本研究中使用的组合物中的氨基酸含量描述在表1中:
表1:研究中使用的制剂的氨基酸含量
对象将分成如下3个体重&能量类别:55-65.4kg体重-24g氨基酸(剂量),等于20.0g蛋白质当量;65.5-75.4kg体重-28g氨基酸(剂量),等于23.3g蛋白质当量;75.5-85kg体重-32g氨基酸(剂量),等于26.6g蛋白质当量。
除了筛选就诊外,试验将由对应于4个测试天(测试第1天、测试第2天、测试第3天和测试第4天)的4次研究就诊组成,其中研究产品以随机顺序给予对象。预计总共3个洗脱期:在测试第1天和测试第2天之间(洗脱1),在测试第2天和测试第3天之间(洗脱2),和在测试第3天和测试第4天之间(洗脱3)。每个洗脱期将持续最少9天至最多14天。对于每名对象,研究的总持续时间将为大约38-70天(包括7-14天筛选期,4天测试天,3个各自持续9-14天的洗脱期,和当需要时在最后一次研究就诊的数天后的随访就诊)。在包括筛选就诊的整个测试期间,从每名对象采集的血液总量将为475mL,对应于献血期间采集的典型血液量。
从统计学的观点来看,测试产品和参比产品之间的比较将代表主要比较。
作为次要统计学分析,口服摄入测试产品相对于市售产品和酪蛋白、参比产品相对于市售产品和酪蛋白之后EAAs、LNAAs、BCAAs、总氨基酸和个体氨基酸的C
表2:筛选的和随机化的对象
表3:PP群体
对于所有的氨基酸亚组(EAAs、LNAAs、BCAAs和总AAs),测试产品产生了比参比产品低的C
-更稳定的酪氨酸生物利用度
-苯丙氨酸显示更稳定,且波动更小
-在血液中更低的胰岛素峰和更稳定的葡萄糖水平
-更低的血液尿素氮(BUN)和尿素水平
研究结果报道在图2-12和表4-13中。
表4:主要终点:EAAs的C
表5:次要动力学终点:EAAs的AUC
表6:次要动力学终点;LNAAs
表7:次要动力学终点:BCAAs
表8:次要动力学终点;总氨基酸
表9:次要动力学终点;酪氨酸
表10:次要“安全性”终点:苯丙氨酸
表11:次要“功效”终点:胰岛素
表12:次要“功效”终点:葡萄糖
表13:次要“功效”端点:BUN&尿素
实施例2.与人PK试验(实施例1)中使用的测试产品相关的定性-定量制剂和成分列表
表14:在人PK试验中使用的测试产品的成分完整列表
成分名单:L-谷氨酰胺、L-亮氨酸、乙基纤维素、L-酪氨酸、L-赖氨酸乙酸酯、磷酸氢钙二水合物、L-天冬氨酸、L-脯氨酸、L-异亮氨酸、麦芽糊精、L-苏氨酸、L-甘氨酸、L-缬氨酸、碳酸氢钾、L-精氨酸、L-组氨酸、L-丝氨酸、L-丙氨酸、L-胱氨酸、L-色氨酸、L-蛋氨酸、胆碱酒石酸氢盐、氧化镁、海藻酸钠、肌醇、L-牛磺酸、葡糖酸亚铁、L-抗坏血酸-维生素、L-肉碱、硫酸锌七水合物、维生素PP(B3)-烟酰胺-尼克酸、维生素E乙酸酯、氯化铬六水合物、钼酸钠、葡糖酸锰、维生素B5-泛酸钙、葡糖酸铜、维生素A棕榈酸酯(棕榈酸视黄酯)、维生素B6、盐酸吡哆醇、维生素B1盐酸盐(硫胺)、维生素B2、维生素D3-胆钙化醇、叶酸、碘化钾、维生素K1-fitomenadione、亚硒酸钠、维生素H(B8)-生物素、维生素B12-氰钴胺。
实施例3.人PK试验中使用的测试产品和参比产品的溶出试验
重量溶出法的目的是对各时间点溶出的氨基酸的总量进行定量。得到的释放百分比表示所有溶出的氨基酸的总和。
溶出介质:介质pH 1.2±0.1(0.1N盐酸:8.3mL/L)
装置:桨(装置2,USP<711>);50rpm,在开始时轻柔混合
温度:37±0.5℃
介质体积:500mL
样品:2.0g氨基酸
每个时间点都具有其自己的溶出容器。在所述采样时间,过滤样品;将剩余的粉末和过滤器在50℃真空烘箱中干燥±4小时直至恒重。称重样品,计算未溶出的氨基酸百分比。将参比产品和测试产品的重量溶出试验结果分别绘制在图13和14中。
单个氨基酸溶出方法的目的是对所述时间点每种氨基酸的溶出量进行定量。
溶出介质:介质pH 1.2±0.1(0.1N盐酸:8.3mL/L)
装置:桨(装置2,USP<711>);50rpm,在开始时轻柔混合
温度:37±0.5℃
介质体积:500mL
样品:2.0g氨基酸
将从溶出介质收集的等分试样通过具有荧光检测器的高效液相色谱(HPLC)进行分析,例外的是,对于肉碱通过液相色谱-质谱(LC/MS)联用进行分析。
通过评价溶出介质中每种氨基酸的浓度,计算了释放曲线。参比产品和测试产品的个体氨基酸溶出试验结果分别绘制在图15和16中。
实施例4.长期施用采用调释技术配制的氨基酸的效果
在两个连续体内相进行研究。从第1天至第15天(16天),给7/8周龄健康Wistar大鼠喂食,每天两次管饲,总共覆盖2.5g/Kg体重的蛋白质需求(计算为基于50g/Kg体重的维持饮食的蛋白质需求的5%)。每次管饲的组成为:1.694g/Kg体重的测试制剂或安慰剂制剂、0.35mg/Kg体重的游离苯丙氨酸、5%葡萄糖、5%淀粉和矿物质补充剂。除管饲外,给这些组饲喂包括大鼠正常饮食除氮源之外的所有营养物的饲料。除了在每次管饲前后两小时,随意食用该饲料。
比较组为:
·测试制剂(用调释技术配制的氨基酸):
·安慰剂制剂(与未应用调释技术的测试制剂相同的定性-定量组成)
通过标准GRIP计量测定了用测试制剂和安慰剂制剂处置的动物的肌肉强度。强度指数计算为“GRIP值/体重”,处置15天后在测试组中观察到相对于基线显著增加。在安慰剂组中没有观察到相同结果。结果报告在表和图17中。
表15.未配对t检验
在处置结束时相对于T0时观察到的每只动物的强度增加的平均百分比在测试组中为约30%,与之相比,在安慰剂组中为约13%。
在处置15天后,直接通过用于泛素介导的蛋白水解途径的蛋白质印迹研究了测试制剂减缓蛋白质降解(蛋白水解)的能力,包括骨骼肌活组织检查中的MAFbx/Atrogin-1和线粒体BNIP3L。在相同的肌肉样品中测量了蛋白质合成。通过免疫印迹分析、用特异性抗体研究了主要由亮氨酸以及肌抑制素(myostatin)(调节肌肉生长的蛋白质)诱导的蛋白质合成中牵涉的雷帕霉素机制性靶标(mTOR)途径。
Nix(还称为Bnip3L)还牵涉在细胞凋亡和线粒体自噬中。这些细胞质蛋白质易位至线粒体,形成同型二聚物并破坏线粒体膜电位。在骨骼肌中,由Nix瞬时过表达引起的线粒体功能障碍触发自体吞噬和诱导肌肉萎缩。
在测试制剂施用之后通过蛋白质印迹测量的股二头肌中Nix表达显著低于在安慰剂施用之后。参见图18(未配对t检验,p=0.0239)。在股外侧肌中可观察到相同趋势。基于这些结果,可以得出如下结论:由于它们的延长释放特性,测试制剂阻止了肌肉蛋白酶解。
********
在本申请通篇中,参考了各个出版物。这些出版物的整体公开内容在此通过通过援引并入本申请中,以便更全面地描述本发明所属领域的现有技术状态。对于本领域技术人员将显而易见的是,可以对本发明进行各种变通和改变,而不背离本发明的范围或宗旨。通过考虑说明书和实施本文公开的发明,本发明的其它实施方案对于本领域技术人员将是显而易见的。说明书和实施例意欲仅仅是示例性的,本发明的真实范围和宗旨由随后的权利要求书指示。
- 使氨基酸代谢正常化的方法
- 一种使重氧水中氢正常化的方法
