利用纳米针进行有效载荷的基于适体的细胞内递送的系统和方法
文献发布时间:2023-06-19 11:26:00
相关申请
本申请要求于2018年8月6日提交的标题为“利用纳米针进行有效载荷的基于适体的细胞内递送(APTAMER BASED INTRACELLULAR DELIVERY OF A PAYLOAD USINGNANONEEDLES)”的美国临时专利申请第62/715,074号的优先权和利益,所述申请的全部内容出于所有目的通过引用结合于此。
技术领域
本文公开的实施方式大体上针对将有效载荷(payload)递送至细胞的基于适体的系统和方法。更具体地,需要一种用于将任何类型的有效载荷递送至任何类型的细胞的通用平台。
背景技术
尽管在生物学研究和治疗应用中起着至关重要的作用,但外源性化合物和大分子货物的有效细胞内递送仍然是长期存在的挑战。现有的递送技术的局限性阻碍了多个领域的进展,因为令人兴奋的新材料、对疾病机制的洞察以及细胞治疗方法的潜能由于其递送障碍而未能完全实现。可以通过例如两个主要参数来了解这一挑战:细胞类型和靶材料。现有技术主要集中于解决一小类组合,特别是向永生化细胞系和某些原代细胞的核酸递送(即转染)。一些最令人兴奋的靶细胞类型,例如干细胞和免疫细胞,也是最难解决的。非常需要将几乎任何货物分子递送到任何细胞类型的多功能且可靠的方法。
因此,需要如本文所述的通用递送系统和方法。
发明内容
在一个方面,提供了一种将有效载荷递送至细胞的方法,所述方法包括提供纳米针和多核苷酸,其中所述多核苷酸的第一端包含能够结合细胞的内源性分子的适体。此外,所述多核苷酸的第一端缀合至纳米针,并且所述多核苷酸的第二端包含能够与有效载荷杂交的寡核苷酸。所述方法还包括使有效载荷与多核苷酸接触,其中有效载荷包含与寡核苷酸序列互补的核苷酸序列。所述方法还包括将纳米针插入细胞中,其中在将纳米针插入细胞中之后,有效载荷从多核苷酸上释放。
在另一个方面,提供了一种用于将有效载荷递送至细胞的芯片,所述芯片包含固相支持物,以及附接至所述固相支持物并被配置为接收多核苷酸的纳米针。所述多核苷酸的第一端包含能够结合细胞的内源性分子的适体。所述多核苷酸的第一端能够缀合至纳米针。所述多核苷酸的第二端包含能够与有效载荷的多个分子之一杂交的寡核苷酸。
在另一方面,提供了一种用于将有效载荷递送至细胞的系统,所述系统包含多个纳米针和多个多核苷酸,其中所述多个多核苷酸中相应一个的相应多核苷酸的第一端包含能够结合细胞的内源性分子的适体。所述相应多核苷酸的第一端缀合至多个纳米针之一。所述相应多核苷酸的第二端包含能够与有效载荷的多个分子之一杂交的寡核苷酸。所述系统还包含多个孔和在其上容纳多个纳米针的注入装置,所述注入装置被配置为将所述多个纳米针移动到所述多个孔内。
根据下面的详细描述以及所附权利要求书和附图,其他方面将显而易见。
附图说明
为了更完整地理解本文公开的原理及其优点,现在参考以下结合附图进行的描述,其中:
图1A至1D示出了根据各种实施方式的将有效载荷递送至细胞的方法。
图2示出了根据各种实施方式的用于将有效载荷递送至细胞的芯片。
图3示出了根据各种实施方式的用于将有效载荷递送至细胞的系统。
应当理解,附图不一定按比例绘制,附图中的各物也未必相对于彼此按比例绘制。附图的描绘只是为了清楚并理解本文公开的方法、设备和系统的各种实施方式。在所有附图中,将尽可能使用相同的附图标记来指代相同或相似的部件。此外,应当理解,附图无意以任何方式限制本发明教导内容的范围。
具体实施方式
本说明书描述了本公开的示例性实施方式和应用。然而,本公开不限于这些示例性实施方式和应用,也不限于示例性实施方式和应用的操作方式或本文中描述的方式。根据说明书和附图以及权利要求书,本发明教导内容的各种实施方式、特征、目的和优点将显而易见。此外,附图可能示出了简化视图或局部视图,并且附图中的元件的尺寸可以被放大或者以其他方式不成比例。另外,在本文中使用术语“在......上”、“附接至”、“连接至”、“偶联至”或类似的词时,一个元件(例如,材料、层、衬底、托盘、基板、单独的金属结构等)可以“在另一个元件上”、“附接至”、“连接至”或“偶联至”另一个元件,而不管所述一个元件是直接位于另一个元件上、附接至、连接至或偶联至另一个元件,还是在所述一个元件和另一个元件之间存在一个或多个中间元件。另外,在提及元件清单(例如,元件a、b、c)的情况下,这种提及意图包括单独的任一个列出的元件,少于全部的列出的元件的任何组合,和/或所有列出的元件的组合。说明书中的章节划分仅是为了便于阅读,并不限制所讨论元件的任何组合。
如本文所用,术语“包含”、“含有”、“具有”和“包括”及其变型形式并不意在限制性的,是包括性的或开放性的,并且不排除其他未叙述的添加物、组分、整数、元件或方法步骤。例如,包含一系列特征的工艺、方法、系统、组合物、试剂盒或设备并不一定仅限于这些特征,而是可以包含未明确列出或此类工艺、方法、系统、组合物、试剂盒或设备所固有的其他特征。
如本文所用,术语“核酸”可以包括嘧啶和嘌呤碱基(分别优选为胞嘧啶、胸腺嘧啶和尿嘧啶,以及腺嘌呤和鸟嘌呤)的任何聚合物或寡聚物(寡核苷酸)。参见AlbertL.Lehninger,《生物化学原理(PRINCIPLES OF BIOCHEMISTRY)》,第793-800页(沃斯出版社(Worth Pub.)1982)。本公开涵盖任何脱氧核糖核苷酸(DNA)、核糖核苷酸(RNA)或肽核酸组分,及其任何化学变体,例如这些碱基的甲基化、羟甲基化或糖基化形式,等等。聚合物或寡聚物在组成上可以是异质的或同质的,并且可以从天然存在的来源中分离得到,或者可以人工或合成产生。另外,核酸可以是DNA或RNA,或其混合物,并且可以永久性或过渡性地以单链或双链形式存在,包括同质双链、异质双链和杂合态。
如本文所用,术语“适体”是指能够与预期的靶物质形成复合物的寡核苷酸。
如本文所用,术语“纳米针”可以是指用作递送有效载荷的穿透装置的物体。有效载荷可以例如经由所述物体的外表面或通过所述物体的流动通道来递送。所述物体通常将在纳米尺寸范围内。所述物体可以是实心的,被构造成具有任何预期的几何形状。所述物体可以具有例如但不限于圆锥形、管状、正方形、矩形、三角形、五边形、六边形或椭圆形的形状,但本文涵盖了允许有效载荷递送的任何形状。所述物体还可以或替代地具有流动通道,有效载荷将通过所述流动通道。所述流动通道可以具有任何预期的几何形状。所述流动通道可以具有例如但不限于圆锥形、管状、正方形、矩形、三角形、五边形、六边形或椭圆形的形状,但本文涵盖了允许有效载荷递送的任何形状。
除非另有定义,否则与本文所述的教导内容结合使用的科学和技术术语应具有本领域普通技术人员通常理解的含义。
本公开涉及一种通用平台,所述通用平台能够将任何大小和类型的有效载荷精确地离体递送至靶细胞中。本公开提供了一种将有效载荷递送至细胞的方法,所述方法利用了与多核苷酸缀合的可控纳米针阵列,所述多核苷酸包含能够与细胞内发现的分子结合的适体;以及能够识别适体的寡核苷酸。
根据各种实施方式,提供了一种将有效载荷递送至细胞的方法,例如如图1a至1d所示。如图1a中所提供的,可以提供纳米针100和多核苷酸110,其中多核苷酸的第一端包含能够结合细胞150(参见图1c至1d)的内源性分子160(参见图1c至1d)的适体120。多核苷酸的第一端可以通过附接至涂布在纳米针100上的结合粒子170而与纳米针100缀合,并且多核苷酸的第二端可以包含能够与有效载荷140杂交的寡核苷酸130。如图1b中所提供的,所述方法可以包括使有效载荷140与多核苷酸110接触的步骤,其中有效载荷140可以包含与寡核苷酸130互补的核苷酸序列。如图1c至1d所提供的,所述方法还可以包括将纳米针100插入细胞150中的步骤,其中在将纳米针100插入细胞150中之后,有效载荷140从多核苷酸110上释放并递送至细胞150。
下面将讨论其他方法,以及与芯片和系统有关的实施方式。在本文提供的方法、芯片和系统的所有前述和后续实施方式中,本文讨论的与例如纳米针和相关材料、孔特征和孔类型、芯片特征和芯片类型、多核苷酸以及相应的附接和偶联特征、纳米针涂层、适体、寡核苷酸、有效载荷和有效载荷类型以及向靶标(例如细胞)的有效载荷递送技术、细胞特征和细胞类型、可扩展系统和农业应用有关的所有特征适用于本文所述的任何和所有实施方式(包括,例如,本文提供的任何和所有方法、芯片和系统实施方式)。
根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式),通常可以确定纳米针的尖端的大小以将有效载荷递送至细胞或细胞内的特定细胞器(例如细胞核)。在各种实施方式中,纳米针的尖端的直径可以在约10nm至200nm之间。在各种实施方式中,对于大多数所有细胞类型,约50nm的直径足以将有效载荷递送至细胞质和细胞核两者。在各种实施方式中,纳米针的直径可以部分取决于靶细胞或细胞器的大小。在各种实施方式中,直径小于1μm。
根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式),纳米针的更具体的直径可以包括约10nm、约15nm、约16nm、约17nm、约18nm、约19nm、约20nm、约25nm、约30nm、约35nm、约40nm、约45nm、约50nm、约55nm、约60nm、约65nm、约70nm、约75nm、约80nm、约85nm、约90nm、约95nm、约100nm、约110nm、约120nm、约130nm、约140nm、约150nm、约160nm、约170nm、约180nm、约190nm、约200nm、约250nm、约300nm、约350nm、约400nm、约450nm、约500nm、约600nm、约650nm、约700nm、约750nm、约800nm、约850nm、约900nm、约950nm、约1μm,或这些值中任意两者之间的范围。
根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式),可以使用纳米针将有效载荷递送至细胞内的特定隔室(例如,细胞核、线粒体等)。纳米针的直径和长度可以因许多因素而变化,包括例如要靶向的细胞类型和细胞器的相对大小。例如,诱导的多能干细胞(iPS细胞)和类似细胞类型的直径范围大约为约6-10μm。其他细胞类型可以具有更大或更小的尺寸,因此具有相应不同大小的纳米针,如上面详细讨论的。
根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式),纳米针的更具体的长度可以包括约1μm、约2μm、约3μm、约4μm、约5μm、约6μm、约7μm、约8μm、约9μm、约10μm、约11μm、约12μm、约13μm、约14μm、约15μm、约16μm、约17μm、约18μm、约19μm、约20μm、约25μm、约30μm、约35μm、约40μm、约45μm、约50μm、约60μm、约70μm、约80μm、约90μm、约100μm,或上述任意两个值之间。
根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式),纳米针可以由硅构成。硅纳米针可以涂布有各种物质以帮助多核苷酸与纳米针缀合。在各种实施方式中,纳米针涂布有金原子。金纳米粒子涂层因其独特的表面、化学惰性、高电子密度和强光吸收性而可用于附接生物分子。
根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式),纳米针可以涂布有其他材料或由其他材料构成,所述其他材料适合于允许核酸与纳米针缀合。例如,纳米针可以包含Langmuir-Bodgett膜、功能化玻璃、锗、PTFE、聚苯乙烯、砷化镓、银、膜、尼龙、PVP、硅氧化物、金属氧化物、陶瓷或本领域已知的能够在表面上结合官能团例如氨基、羧基、Diels-Alder反应物、硫醇或羟基的任何其他材料。这样的材料允许核酸的附接以及它们与靶分子的相互作用而不受纳米针的阻碍。
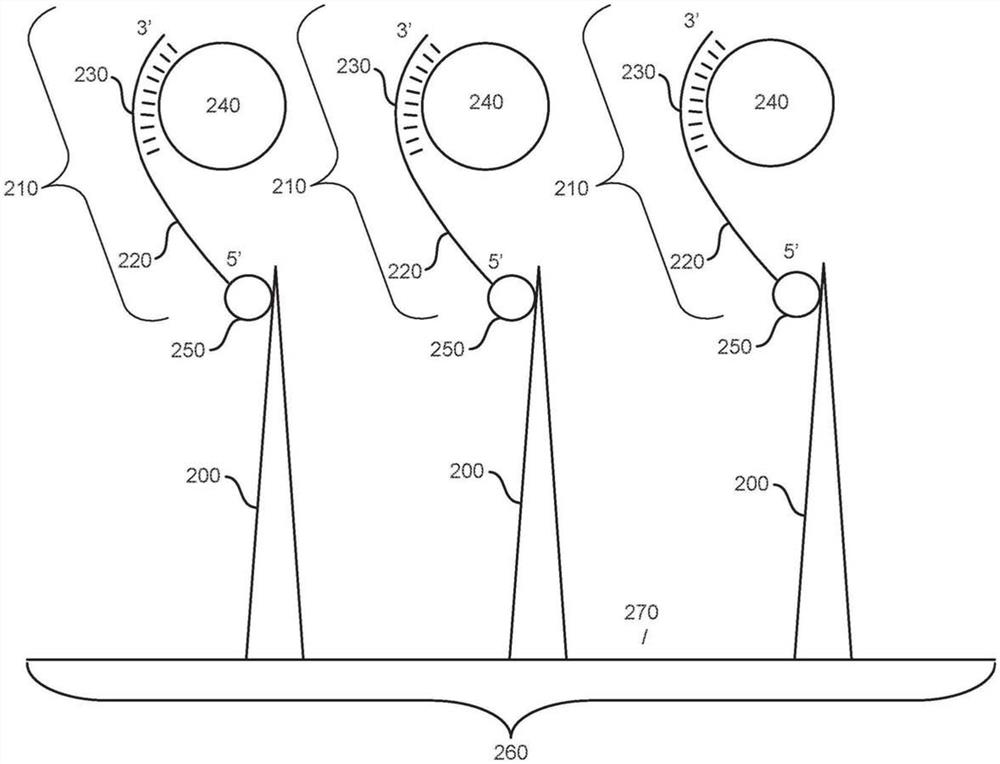
根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式),多核苷酸可以多种方式附接至纳米针。在各种实施方式中,多核苷酸通过共价键缀合至纳米针。在各种实施方式中,硫醇(SH)修饰剂附接至多核苷酸的末端。硫醇(SH)修饰剂可以使多核苷酸共价附接至各种表面。SH修饰剂可以置于多核苷酸的5'端或3'端(有关多核苷酸110/210上5'和3'端的相对位置,参见图2)。SH修饰剂允许与包括金纳米粒子在内的多种表面共价连接。
根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式),可以使用亲和素/生物素偶联化学将多核苷酸偶联至纳米针。在各种实施方式中,亲和素可以通过静电相互作用固定至纳米针(纳米针可以由带负电的材料(例如硅)构成),然后可以将复杂的生物素化的核苷酸固定至经固定的亲和素。在各种实施方式中,通过将生物素氨基己酸酯N-羟基琥珀酰亚胺酯(BCHS)偶联至含有5'氨基的经修饰的多核苷酸来制备生物素化的多核苷酸。可以使用BCHS衍生物,以便在多核苷酸的5'端和生物素部分之间提供6个碳的间隔基。认为间隔基为寡核苷酸在与其他核苷酸杂交时提供了更多的构象灵活性。亲和素可以通过例如物理吸附固定至二氧化硅表面。
根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式),多核苷酸可以通过中间连接子分子附接至纳米针。中间连接子可以用于将适体连接至纳米针上的结合粒子。例如,中间连接子可以是聚乙二醇(PEG)或聚乙烯亚胺(PEI)。根据各种实施方式,PEG或PEI连接子被硫醇化,使得其可以用作连接子以将多核苷酸连接至涂布纳米针表面的金纳米粒子。中间连接子可以起到减少非特异性相互作用并增加缀合物的生物相容性和稳定性的作用。中间连接子例如PEG和PEI也可以增加有效载荷的亲水性。在各种实施方式中,中间连接子例如PEG或PEI可以用于不易溶解的非常疏水的有效载荷或形状非常不规则的有效载荷。
根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式),纳米针可以涂布有如图1a至1d所示的结合粒子(例如,金纳米粒子)(结合粒子170)。在各种实施方式中,涂布有金的纳米针也可以与抗体缀合。使用物理和化学相互作用将抗体附接至金原子。抗体与金原子之间的物理相互作用可以取决于各种现象,包括例如:(a)带负电的金与带正电的抗体之间的离子吸引,(b)抗体与金表面之间的疏水吸引,以及(c)金导电电子与抗体的氨基酸硫原子之间的配位结合。抗体与金纳米粒子之间的化学相互作用可以通过诸如以下的多种方式实现:(i)通过硫醇衍生物的化学吸附,(ii)通过使用双功能连接子,以及(ii)通过使用衔接子分子,如链霉亲和素和生物素。抗体的缀合可以涉及共价和/或非共价方法。
如上面参考图1a至1d所讨论的,多核苷酸110可以由至少一种适体120和至少一种寡核苷酸130构成。适体和寡核苷酸可以以任何顺序布置以缀合至纳米针100。在各种实施方式中,可以将适体的5'端缀合至纳米针100,并且将适体的3'端附接至寡核苷酸的5'端(例如,参见图2的多核苷酸210)。根据各种实施方式,可以将适体的3'端缀合至纳米针,并且将适体的5'端融合至寡核苷酸的3'端。在各种实施方式中,寡核苷酸可以在一端缀合至纳米针,并在另一端缀合至适体。可以以不影响核酸模板杂交或随后的PCR扩增的能力的方式进行缀合。这样的技术在本领域中是常规的并且是众所周知的。
适体,例如根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式)所讨论的那些,可以被设计为结合至特定的靶分子。通常,适体是由核酸构成的大分子。作为核酸的典型,特定的适体可以通过核苷酸(A、U或T、C和G)的线性序列来描述。适体可以由RNA或DNA构成。适体的长度没有物理限制。增加适体的长度可以增加适体本身的稳定性。适体的形状可以有助于其与靶分子表面紧密结合的能力。因为在核苷酸序列的可能性之中存在很大范围的分子形状,所以可以针对各种各样的分子靶标获得适体。
根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式),可以提供能够与细胞内存在的分子结合的适体。这样的分子可以取决于有效载荷被递送到的细胞类型。在各种实施方式中,适体能够结合三磷酸腺苷(ATP)。因为ATP在细胞内是丰富的,所以在各种实施方式中,一旦有效载荷被递送至细胞,ATP将结合至适体,改变多核苷酸的构象,从而使有效载荷释放到细胞中。也可以设计与细胞内发现的其他蛋白质或分子结合的其他适体。例如,在各种实施方式中,适体识别诸如GTP、AKT或Ras的分子。根据本文提供的各种实施方式,任何以足够大的浓度存在于细胞(或靶细胞器)中以与有效载荷竞争结合在多核苷酸上的分子都可以是适合的。在各种实施方式中,结合至细胞(或靶细胞器)中的适体的分子的浓度可以为约0.01mM、约0.5mM、约0.1mM、约0.2mM、约0.4mM、约0.6mM、约0.8mM、约1mM、约2mM、约3mM、约4mM、约5mM、约6mM、约7mM、约8mM、约9mM、约10mM、约20mM或这些值中任意两者之间的范围。细胞中靶标的相对丰度及其对适体的亲和力可以影响有效载荷释放的效率。在各种实施方式中,可以将突变引入适体中,增加或降低其对靶分子的亲和力。
根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式),将多于一种类型的多核苷酸缀合至纳米针。在各种实施方式中,纳米针能够一次性将多于一种的有效载荷递送至细胞。这例如可以通过将多于一种类型的多核苷酸附接至纳米针(即具有独特的寡核苷酸序列的两种肽)来实现。在各种实施方式中,两种独特的多核苷酸包含两种独特的适体和两种独特的寡核苷酸。在各种实施方式中,两种独特的多核苷酸包含两种独特的寡核苷酸但同一种适体。对与纳米针缀合的独特多核苷酸的具体数量没有限制,并且不限于待递送至细胞的独特有效载荷的具体数量。在各种实施方式中,提供了约2种、约3种、约4种、约5种、约6种、约8种或约10种独特的多核苷酸序列,或这些值中任意两者之间的范围。
根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式),寡核苷酸也可以具有可变的长度。根据各种实施方式,寡核苷酸的长度可以是至少10个核苷酸。根据各种实施方式,寡核苷酸的长度可以是至少8个核苷酸(nt)。在各种实施方式中,寡核苷酸的长度可以是约4nt、约5nt、约6nt、约7nt、约8nt、约9nt、约10nt、约11nt、约12nt、约13nt、约14nt、约15nt、约16nt、约17nt、约18nt、约19nt、约20nt、约21nt、约22nt、约23nt、约24nt、约25nt、约26nt、约27nt、约28nt、约29nt、约30nt、约35nt、约40nt、约45nt、约50nt、约55nt、约60nt、约65nt、约70nt、约75nt、约80nt、约85nt、约90nt、约95nt、约100nt,或这些值中任意两者之间的范围。寡核苷酸可以由DNA或RNA构成。寡核苷酸不一定与在有效载荷上发现的核苷酸序列100%互补。在各种实施方式中,寡核苷酸可以包含足够数量的与在有效载荷上发现的碱基互补的碱基,以使得有效载荷与多核苷酸的杂交具有足够的强度以将有效载荷递送至细胞。在各种实施方式中,寡核苷酸上与有效载荷上的互补碱基相对应的核苷酸碱基的百分比为约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约100%,或这些值中任意两者之间的范围。
根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式),有效载荷可以是基于核苷酸的分子。例如,在各种实施方式中,有效载荷由DNA或RNA构成,例如病毒DNA或RNA粒子。在各种实施方式中,有效载荷的一部分包含与寡核苷酸互补的序列,使得有效载荷与寡核苷酸杂交。有效载荷不一定与寡核苷酸100%互补,只要有效载荷能够以足够的强度与寡核苷酸杂交以便递送至细胞即可。例如,有效载荷的8至12个核苷酸能够与寡核苷酸杂交。在各种实施方式中,能够与寡核苷酸杂交(互补)的有效载荷长度可以是约4nt、约5nt、约6nt、约7nt、约8nt、约9nt、约10nt、约11nt、约12nt、约13nt、约14nt、约15nt、约16nt、约17nt、约18nt、约19nt、约20nt、约21nt、约22nt、约23nt、约24nt、约25nt、约26nt、约27nt、约28nt、约29nt、约30nt、约35nt、约40nt、约45nt、约50nt、约55nt、约60nt、约65nt、约70nt、约75nt、约80nt、约85nt、约90nt、约95nt或约100nt,或这些值中任意两者之间的范围。与寡核苷酸杂交的有效载荷的核苷酸可以存在于基于核苷酸的有效载荷上的任何位置(3'端、5'端或介于两者之间的任何位置),只要有效载荷能够以足够的强度杂交以便递送至细胞即可。在各种实施方式中,有效载荷可以是环状核苷酸序列。在各种实施方式中,有效载荷可以是线性核苷酸序列。在各种实施方式中,有效载荷是单链核苷酸。在各种实施方式中,有效载荷是环状DNA(即质粒)。有效载荷也可以是线性DNA。有效载荷也可以是杂合DNA-RNA分子。
根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式),可以使用本文提供的各种实施方式向任何类型的细胞递送任何类型的有效载荷。在各种实施方式中,蛋白质、肽、代谢物、病毒、衣壳纳米粒子、膜不可渗透的药物、外源细胞器、分子探针、纳米装置和纳米粒子都是用于细胞内递送的潜在有效载荷。当此类分子不是“基于核苷酸的”(即,不由DNA或RNA构成)时,有效载荷可以缀合至具有与寡核苷酸链互补的碱基的短核苷酸序列。在各种实施方式中,短核苷酸序列长度可以是约4nt、约5nt、约6nt、约7nt、约8nt、约9nt、约10nt、约11nt、约12nt、约13nt、约14nt、约15nt、约16nt、约17nt、约18nt、约19nt、约20nt、约21nt、约22nt、约23nt、约24nt、约25nt、约26nt、约27nt、约28nt、约29nt、约30nt、约35nt、约40nt、约45nt、约50nt、约55nt、约60nt、约65nt、约70nt、约75nt、约80nt、约85nt、约90nt、约95nt或约100nt,或这些值中任意两者之间的范围。
根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式),提供了用于将蛋白质生物制剂例如抑制性抗体和刺激性转录因子系统递送至活细胞中的方法、芯片和系统。在各种实施方式中,提供了用于沉默DNA的方法、芯片和系统。例如,有效载荷可以包括siRNA、HDAC抑制剂、DNA甲基转移酶抑制剂或其他可以具有增加或减少基因表达的分子。在各种实施方式中,有效载荷是能够抑制或增强特定细胞内信号传导途径的蛋白质(例如抗体或酶)或小分子药物。在各种实施方式中,提供了用于测量细胞内的物理和化学性质的纳米装置、传感器和探针的细胞内递送的方法、芯片和系统。在各种实施方式中,探针可以由功能性材料例如纳米等离子体光开关、碳纳米管和量子点产生。在各种实施方式中,本文提供的方法、芯片和系统可以用于递送对于某些功能(例如,将细胞重编程为干细胞)的效力而言不可或缺的蛋白质。在各种实施方式中,有效载荷是转录因子,例如Oct4和Sox2。在各种实施方式中,有效载荷将转录因子直接递送至细胞核中。这种递送可以提高将细胞重编程为诱导的多能干细胞(iPS细胞)的效率。在某些情况下,蛋白质的递送可能必需在蛋白质转录/翻译之前,后者可能会真正限制重编程效率。在各种实施方式中,本文提供的方法、芯片和系统可以包括将蛋白质直接递送至具有呈现异常表型的突变或非功能性细胞质蛋白的细胞(例如,将功能性Ras分子加入到具有显性阴性Ras的细胞类型)。
根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式),有效载荷包含能够稳定整合至细胞的基因组中的遗传物质。在各种实施方式中,可以利用基于CRISPR的技术。例如,在各种实施方式中,有效载荷是由crRNA和tracrRNA构成的gRNA分子,其能够与细胞内的Cas蛋白(例如,Cas9、Cas12、Cas13a或任何其他Cas分子)复合以介导与gRNA的任何20个核苷酸互补的靶DNA位点的切割(CRISPR-CAS系统)。在各种实施方式中,该gRNA被递送至表达Cas的细胞。在各种实施方式中,首先例如通过首先用表达Cas或Cas类似物或衍生物的慢病毒载体转染细胞来创建表达Cas的细胞。在各种实施方式中,可以将Cas递送至细胞,根据各种实施方式,其中Cas蛋白(或表达Cas的质粒)是有效载荷。在各种实施方式中,用于表达Cas的基因和用于表达gRNA的基因被置于单个载体中。在各种实施方式中,将Cas基因和gRNA基因置于两种不同启动子的控制下。根据各种实施方式,至少两种独特的多核苷酸缀合至纳米针:第一种多核苷酸包含能够与gRNA杂交的寡核苷酸,第二种多核苷酸包含能够与Cas或Cas类似物或衍生物杂交的寡核苷酸。根据各种实施方式,可以将第三种独特的多核苷酸缀合至纳米针,所述多核苷酸可以包含能够与一段供体DNA杂交的寡核苷酸,以便使用CRISPR-CAS系统插入细胞的基因组中。
根据各种实施方式(例如,方法、芯片和系统实施方式),其他基因组编辑技术也可以被递送至细胞。例如,转录激活因子样效应子核酸酶(TALEN)或锌指核酸酶可以作为有效载荷递送至细胞。TALEN和锌指核酸酶两者是识别特定DNA序列的蛋白,可以诱导DNA切割和随后的基因组编辑。TALEN或锌指核酸酶可以缀合至能够与寡核苷酸杂交的独特DNA序列。在各种实施方式中,提供了至少两种独特的多核苷酸:1)第一种多核苷酸包含能够与TALEN或锌指核酸酶蛋白杂交的寡核苷酸,所述TALEN或锌指核酸酶以精确的序列切割细胞的基因组DNA;2)第二种多核苷酸包含能够与一段供体DNA杂交的寡核苷酸,以插入细胞的基因组中。在各种实施方式中,两种多核苷酸可以缀合至同一纳米针。
根据本文提供的各种实施方式(例如,方法、芯片和系统实施方式),基因表达的瞬时变化可能是期望的。例如,在各种实施方式中,有效载荷可以包含能够离体分化以用于细胞疗法的制造的遗传物质。但是,一旦创建了所需的细胞类型并将其部署到患者体内,遗传物质的表达对于治疗应用而言可能就不再是必需的,甚至可能产生不利影响。在这种情况下,基因表达的瞬时变化可能是适当的。在各种实施方式中,有效载荷可以由在靶细胞中瞬时表达但不能稳定整合至细胞的基因组中的遗传物质构成。
本文提供的各种实施方式(例如,方法、芯片和系统实施方式)可以适用于任何细胞类型。例如,在各种实施方式中,靶细胞是免疫细胞(例如,B细胞或T细胞)。在各种实施方式中,靶细胞是干细胞(例如,造血干细胞、胚胎干细胞、诱导的多能干细胞)。靶细胞不限于特定的细胞类型或生物体。细胞可以是例如真核的或原核的;植物或动物或细菌细胞。细胞类型也可以是已经用于操纵的细胞系,例如HeLa、293s、癌症/转化细胞和原代细胞(可以使用任何器官来源的细胞类型)。细胞也可以来自于模型生物体,例如果蝇、秀丽隐杆线虫(C.elegans)、斑马鱼、非洲爪蟾和酵母。所述细胞也可以来自其他植物模型生物,例如拟南芥。
本文提供的各种实施方式(例如,方法、芯片和系统实施方式)可以提供用于基于细胞的疗法的可扩展系统。根据各种实施方式(例如,方法、芯片和系统实施方式),可以提供方法、芯片和系统用于将遗传物质递送至自我更新的造血干细胞和T细胞用于癌症疗法。根据各种实施方式(例如,方法、芯片和系统实施方式),方法、芯片和系统可用于基于细胞的离体基因疗法,例如CAR-T细胞疗法、免疫疗法、自我更新的造血干细胞和T细胞用于免疫疗法。例如,在造血干细胞中,离体基因疗法可用于纠正单基因疾病(例如联合免疫缺陷症(SCID)-X1、Wiskott-Aldrich综合征和β地中海贫血)中的突变。对于T细胞,可以通过特异性T细胞受体和嵌合抗原受体的诱导表达、随后通过过继性细胞转移来离体指导针对肿瘤靶标的新功能。在各种实施方式中,也可以使用本文提供的方法、芯片和系统离体操纵实体组织。例如,本文提供的各种方法、芯片和系统实施方式可用于通过表皮干细胞、骨、脾、肺、结肠或任何其他实体组织细胞类型的离体转导来促进组织工程改造。在各种实施方式中,可以通过离体操纵将细胞因子的诱导式分泌或编程的抗药性和安全性开关工程改造至这些细胞类型中。
本文提供的各种实施方式(例如,方法、芯片和系统实施方式)也可以用于基于农业的方法。例如,本文提供的各种方法、芯片和系统实施方式可以用于研究植物功能潜在的分子机制,抵抗疾病和提高植物生产力。植物的基因工程改造正在成为一个快速发展的领域,其中对植物基因组的操纵可以增强诸如植物育种、植物稳定性以及对有害病毒/细菌的抵抗力等领域。可以递送CRISPR/Cas系统以产生各种结果,包括改变水稻植株的株高,以及在大豆植株的基因中引入突变以增加植物的大小。在植物细胞中递送这些有效载荷有时会更加困难,因为它们具有细胞壁,根据定义这很难穿透。使用本文中的各种实施方式所提供的基于纳米针-适体的方法,可以穿过细胞壁并以更高的效率递送有效载荷。
在各种实施方式中,提供了一种将有效载荷递送至细胞的方法,所述方法包括提供纳米针和多核苷酸。多核苷酸的第一端可以包含能够结合细胞的内源性分子的适体。多核苷酸的第一端可以缀合至纳米针。多核苷酸的第二端可以包含能够与有效载荷杂交的寡核苷酸。所述方法还可以包括对纳米针进行定向,使得其被设计和配置为放置成与有效载荷接触。所述方法还可以包括将纳米针插入到被设计和配置为容纳细胞的孔的内部体积中,其中纳米针被设计和配置为使得在将纳米针插入细胞中之后,有效载荷从多核苷酸上释放并递送至细胞。
根据各种实施方式(例如,方法、芯片和系统实施方式),可以提供孔来容纳细胞,使得可以将纳米针插入细胞中以递送有效载荷。孔可以是任何大小、形状或材料的,只要它能够容纳单个细胞即可。在各种实施方式中,孔可以涂布有物质(例如,聚赖氨酸),所述物质允许细胞粘附到孔上。在各种实施方式中,孔可以是隔板。在各种实施方式中,孔可以是腔室。在各种实施方式中,孔可以是微流体腔室。在各种实施方式中,孔是管。在各种实施方式中,孔可以是微阵列。在各种实施方式中,孔可以是泳道(例如,流动槽上的泳道)。在各种实施方式中,孔可以是细胞捕获装置(例如,通过介电泳)。在各种实施方式中,可以将多个孔布置在微板上。
如上所述,在本文提供的方法、芯片和系统的所有前述和后续的实施方式中,本文讨论的与例如纳米针和相关材料、孔特征和孔类型、芯片特征和芯片类型、多核苷酸以及相应的附接和偶联特征、纳米针涂层、适体、寡核苷酸、有效载荷和有效载荷类型以及向靶标(例如细胞)的有效载荷递送技术、细胞特征和细胞类型、可扩展系统和农业应用有关的所有特征适用于本文所述的任何和所有实施方式(包括,例如,本文提供的任何和所有方法、芯片和系统实施方式)。
根据各种实施方式,提供了一种用于将有效载荷递送至细胞的芯片260,例如由图2所示出的。芯片260可以包含纳米针(或如图所示的多个纳米针200),所述纳米针被配置为接收多核苷酸(或如图所示的多个多核苷酸210,其中每个纳米针被配置为接收相关的多核苷酸。此外,每个多核苷酸的第一端可以包含能够结合细胞的内源性分子的适体220。此外,每个多核苷酸210的第一端可以与相关的纳米针200缀合。另外,每个多核苷酸的第二端可以包含能够与有效载荷240杂交的寡核苷酸230。在各种实施方式中,芯片可以包含单个纳米针。在各种实施方式中,纳米针可以包含固相支持物270,纳米针(或如图所示的多个纳米针)附接至所述固相支持物。
根据各种实施方式(例如,方法、芯片和系统实施方式),芯片可以由能够提供固相支持物270的任何材料制成,针或多个纳米针附接在所述固相支持物上。在各个实施方式中,芯片由硅制成。在各种实施方式中,芯片由玻璃制成。在各个实施方式中,芯片由聚合物构成。在各种实施方式中,芯片由多于一个的衬底构成。
根据各种实施方式(例如,方法、芯片和系统实施方式),多个纳米针附接至芯片。在各个实施方式中,约5个、约10个、约15个、约20个、约25个、约30个、约35个、约40个、约45个、约50个、约55个、约60个、约65个、约70个、约75个、约80个、约85个、约90个、约95个、约100个、约200个、约300个、约400个、约500个、约600个、约700个、约800个、约900个、约1000个、约1100个、约1200个、约1300个、约1400个、约1500个、约1600个、约1700个、约1800个、约1900个、约2000个、约2100个、约2200个、约2300个、约2400个、约2500个、约2600个、约2700个、约2800个、约2900个、约3000个、约3100个、约3200个、约3300个、约3400个、约3500个、约3600个、约3700个、约3800个、约3900个、约4000个、约4100个、约4200个、约4300个、约4400个、约4500个、约4600个、约4700个、约4800个、约4900个、约5000个、约5100个、约5200个、约5300个、约5400个、约5500个、约5600个、约5700个、约5800个、约5900个、约6000个、约6100个、约6200个、约6300个、约6400个、约6500个、约6600个、约6700个、约6800个、约6900个、约7000个、约7100个、约7200个、约7300个、约7400个、约7500个、约7600个、约7700个、约7800个、约7900个、约8000个、约8100个、约8200个、约8300个、约8400个、约8500个、约8600个、约8700个、约8900个、约9000个、约9100个、约9200个、约9300个、约9400个、约9500个、约9600个、约9700个、约9800个、约9900个、约10000个、约1000000个、约2000000个、约3000000个、约4000000个或约5000000个或这些值中任意两者之间的范围的纳米针附接至芯片。
根据各种实施方式(例如,方法、芯片和系统实施方式),可以提供孔来容纳细胞,使得可以将纳米针插入细胞中以递送有效载荷。孔可以是任何大小、形状或材料的,只要它能够容纳单个细胞即可。在各种实施方式中,孔可以涂布有物质(例如,聚赖氨酸),所述物质允许细胞粘附到孔上。在各种实施方式中,孔可以是隔板。在各种实施方式中,孔可以是腔室。在各种实施方式中,孔可以是微流体腔室。在各种实施方式中,孔是管。在各种实施方式中,孔可以是微阵列。在各种实施方式中,孔可以是泳道(例如,流动槽上的泳道)。在各种实施方式中,孔可以是细胞捕获装置(例如,通过介电泳)。在各种实施方式中,可以将多个孔布置在微板上。
如上所述,在本文提供的方法、芯片和系统的所有前述和后续的实施方式中,本文讨论的与例如纳米针和相关材料、孔特征和孔类型、芯片特征和芯片类型、多核苷酸以及相应的附接和偶联特征、纳米针涂层、适体、寡核苷酸、有效载荷和有效载荷类型以及向靶标(例如细胞)的有效载荷递送技术、细胞特征和细胞类型、可扩展系统和农业应用有关的所有特征适用于本文所述的任何和所有实施方式(包括,例如,本文提供的任何和所有方法、芯片和系统实施方式)。
根据各种实施方式,提供了一种用于将有效载荷递送至细胞的系统,如图3所示。所述系统可以包含多个纳米针300和多个多核苷酸310。相应多核苷酸的第一端可以包含能够结合细胞的内源性分子的适体(参见以上关于图1a至1d的讨论)。相应多核苷酸的第一端可以缀合至多个纳米针中相关的一个。此外,多核苷酸的第二端可以包含能够与有效载荷杂交的寡核苷酸(参见以上关于图1a至1d的讨论)。所述系统还可以包含多个孔320,其中每个孔可以被配置为容纳要被多个纳米针中的相应一个穿透的细胞330。所述系统还可以包含注入装置340,其可以被配置为将多个纳米针移动到多个孔的限定范围内。在各种实施方式中,所述系统可以包含单个纳米针和单个孔。纳米针或多个纳米针可以被容纳在注入装置340中或上。例如,如图3所示,多个纳米针300被设置在注入装置340上。
如上所述,在本文提供的方法、芯片和系统的所有实施方式中,本文讨论的与例如纳米针和相关材料、孔特征和孔类型、芯片特征和芯片类型、多核苷酸以及相应的附接和偶联特征、纳米针涂层、适体、寡核苷酸、有效载荷和有效载荷类型以及向靶标(例如细胞)的有效载荷递送技术、细胞特征和细胞类型、可扩展系统和农业应用有关的所有特征适用于本文所述的任何和所有实施方式(包括,例如,本文提供的任何和所有方法、芯片和系统实施方式)。
尽管已经在本说明书中描述了本发明的特定实施方式和应用,但是这些实施方式和应用仅是示例性的,许多变化是可能的。
具体实施方式
实施方式1.一种将有效载荷递送至细胞的方法,所述方法包括提供纳米针和多核苷酸,其中所述多核苷酸的第一端包含能够结合细胞的内源性分子的适体,其中所述多核苷酸的第一端缀合至所述纳米针,并且其中所述多核苷酸的第二端包含能够与有效载荷杂交的寡核苷酸;使所述有效载荷与所述多核苷酸接触,其中所述有效载荷包含与所述寡核苷酸序列互补的核苷酸序列;以及将所述纳米针插入细胞中,其中在将所述纳米针插入所述细胞中之后,所述有效载荷从所述多核苷酸上释放。
实施方式2.根据实施方式1所述的方法,其中所述纳米针涂布有金原子。
实施方式3.根据实施方式2所述的方法,其中将硫醇基附接至所述多核苷酸的第一端,其中所述多核苷酸被硫醇化至涂布有金原子的纳米针。
实施方式4.根据前述实施方式中任一项所述的方法,其中所述适体能够结合三磷酸腺苷。
实施方式5.根据前述实施方式中任一项所述的方法,其中所述有效载荷是基于核苷酸的分子。
实施方式6.根据实施方式5所述的方法,其中所述有效载荷包含DNA。
实施方式7.根据实施方式5所述的方法,其中所述有效载荷包含RNA。
实施方式8.根据实施方式5所述的方法,其中所述有效载荷包含能够稳定整合到所述细胞的基因组中的遗传物质。
实施方式9.根据实施方式5所述的方法,其中所述有效载荷包含能够瞬时表达所需靶蛋白的遗传物质。
实施方式10.根据前述实施方式中任一项所述的方法,其中所述有效载荷抑制靶基因的表达。
实施方式11.根据实施方式10所述的方法,其中所述有效载荷由siRNA构成。
实施方式12.根据前述实施方式中任一项所述的方法,其中所述有效载荷能够在功能上抑制蛋白质。
实施方式13.根据前述实施方式中任一项所述的方法,其中所述有效载荷包含表达能够在功能上抑制所需靶标的蛋白质的遗传物质。
实施方式14.根据实施方式1至13中任一项所述的方法,其中所述有效载荷是环状的。
实施方式15.根据实施方式1至13中任一项所述的方法,其中所述有效载荷是线性核苷酸序列。
实施方式16.根据实施方式1至13中任一项所述的方法,其中所述有效载荷是单链的。
实施方式17.根据实施方式7所述的方法,其中所述有效载荷是RNA质粒。
实施方式18.根据实施方式1至4中任一项所述的方法,其中所述有效载荷是蛋白质。
实施方式19.根据实施方式1至4中任一项所述的方法,其中所述有效载荷是小分子。
实施方式20.根据实施方式18或19所述的方法,其中所述有效载荷缀合至能够与所述寡核苷酸杂交的独特核苷酸序列。
实施方式21.一种将有效载荷递送至细胞的方法,所述方法包括提供纳米针和多核苷酸,其中所述多核苷酸的第一端包含能够结合细胞的内源性分子的适体,其中所述多核苷酸的第一端缀合至纳米针,并且其中所述多核苷酸的第二端包含能够与有效载荷杂交的寡核苷酸;对所述纳米针进行定向,使得其被配置为放置成与有效载荷接触;以及将所述纳米针插入到被配置为容纳细胞的孔的内部体积中,其中所述纳米针被配置为使得在将所述纳米针插入所述细胞中之后,所述有效载荷从所述多核苷酸上释放。
实施方式22.根据实施方式21所述的方法,其中所述纳米针涂布有金原子。
实施方式23.根据实施方式22所述的方法,其中将硫醇基附接至所述多核苷酸的第一端,其中所述多核苷酸被硫醇化至涂布有金原子的纳米针。
实施方式24.根据实施方式21至23中任一项所述的方法,其中所述适体能够结合三磷酸腺苷。
实施方式25.根据实施方式21至24中任一项所述的方法,其中所述有效载荷是基于核苷酸的分子。
实施方式26.根据实施方式25所述的方法,其中所述有效载荷由DNA构成。
实施方式27.根据实施方式25所述的方法,其中所述有效载荷由RNA构成。
实施方式28.根据实施方式25所述的方法,其中所述有效载荷包含能够稳定整合至所述细胞的基因组中的遗传物质。
实施方式29.根据实施方式25所述的方法,其中所述有效载荷包含能够瞬时表达所需靶蛋白的遗传物质。
实施方式30.根据实施方式21至29中任一项所述的方法,其中所述有效载荷抑制靶基因的表达。
实施方式31.根据实施方式30所述的方法,其中所述有效载荷由siRNA构成。
实施方式32.根据实施方式21至31中任一项所述的方法,其中所述有效载荷能够在功能上抑制蛋白质。
实施方式33.根据实施方式21至32中任一项所述的方法,其中所述有效载荷包含表达能够在功能上抑制所需靶标的蛋白质的遗传物质。
实施方式34.根据实施方式21至33中任一项所述的方法,其中所述有效载荷是环状的。
实施方式35.根据实施方式21至33中任一项所述的方法,其中所述有效载荷是线性核苷酸序列。
实施方式36.根据实施方式21至33中任一项所述的方法,其中所述有效载荷是单链的。
实施方式37.根据实施方式27所述的方法,其中所述有效载荷为RNA质粒。
实施方式38.根据实施方式21至24中任一项所述的方法,其中所述有效载荷是蛋白质。
实施方式39.根据实施方式21至24中任一项所述的方法,其中所述有效载荷是小分子。
实施方式40.根据实施方式38或39所述的方法,其中所述有效载荷缀合至能够与所述寡核苷酸杂交的独特核苷酸序列。
实施方式41.一种用于将包含多个分子的有效载荷递送至细胞的芯片,所述芯片包含多个纳米针和多个多核苷酸,其中所述多核苷酸的第一端包含能够结合细胞的内源性分子的适体,其中所述多核苷酸的第一端缀合至所述纳米针,并且其中所述多核苷酸的第二端包含能够与有效载荷的多个分子之一杂交的寡核苷酸。
实施方式42.根据实施方式41所述的芯片,其中所述芯片由硅构成。
实施方式43.根据实施方式41所述的芯片,其中所述纳米针涂布有金原子。
实施方式44.根据实施方式43所述的芯片,其中将硫醇基附接至所述多核苷酸的第一端,其中所述多核苷酸被硫醇化至涂布有金原子的纳米针。
实施方式45.根据实施方式41至44中任一项所述的芯片,其中所述适体能够结合三磷酸腺苷。
实施方式46.根据实施方式41至45中任一项所述的芯片,其中所述有效载荷是基于核苷酸的分子。
实施方式47.根据实施方式46所述的芯片,其中所述有效载荷由DNA构成。
实施方式48.根据实施方式46所述的芯片,其中所述有效载荷由RNA构成。
实施方式49.根据实施方式46所述的芯片,其中所述有效载荷包含能够稳定整合至所述细胞的基因组中的遗传物质。
实施方式50.根据实施方式46所述的芯片,其中所述有效载荷包含能够瞬时表达所需靶蛋白的遗传物质。
实施方式51.根据实施方式41至50中任一项所述的芯片,其中所述有效载荷抑制靶基因的表达。
实施方式52.根据实施方式51所述的芯片,其中所述有效载荷由siRNA构成。
实施方式53.根据实施方式41至52中任一项所述的芯片,其中所述有效载荷能够在功能上抑制蛋白质。
实施方式54.根据实施方式41至53中任一项所述的芯片,其中所述有效载荷包含表达能够在功能上抑制所需靶标的蛋白质的遗传物质。
实施方式55.根据实施方式41至54中任一项所述的芯片,其中所述有效载荷是环状的。
实施方式56.根据实施方式41至54中任一项所述的芯片,其中所述有效载荷是线性核苷酸序列。
实施方式57.根据实施方式41至54中任一项所述的芯片,其中所述有效载荷是单链的。
实施方式58.根据实施方式48所述的芯片,其中所述有效载荷是RNA质粒。
实施方式59.根据实施方式41至45中任一项所述的芯片,其中所述有效载荷是蛋白质。
实施方式60.根据实施方式41至45中任一项所述的方法,其中所述有效载荷是小分子。
实施方式61.根据实施方式59和60中任一项所述的方法,其中所述有效载荷缀合至能够与所述寡核苷酸杂交的独特核苷酸序列。
实施方式62.一种用于将包含多个分子的有效载荷递送至细胞的系统,所述系统包含多个纳米针和多个多核苷酸,其中所述多个多核苷酸中相应一个的相应多核苷酸的第一端包含能够结合细胞的内源性分子的适体,其中相应多核苷酸的第一端缀合至所述多个纳米针之一,并且其中相应多核苷酸的第二端包含能够与有效载荷的多个分子之一杂交的寡核苷酸;多个孔;以及注入装置,所述注入装置被配置为将所述多个纳米针移动到所述多个孔内。
实施方式63.根据实施方式62所述的系统,其中所述纳米针涂布有金原子。
实施方式64.根据实施方式63所述的系统,其中将硫醇基附接至所述多核苷酸的5'端,其中所述多核苷酸被硫醇化至涂布有金原子的纳米针。
实施方式65.根据实施方式62至64中任一项所述的系统,其中所述适体能够结合三磷酸腺苷。
实施方式66.根据实施方式62至65中任一项所述的系统,其中所述有效载荷是基于核苷酸的分子。
实施方式67.根据实施方式66所述的系统,其中所述有效载荷由DNA构成。
实施方式68.根据实施方式66所述的系统,其中所述有效载荷由RNA构成。
实施方式69.根据实施方式66所述的系统,其中所述有效载荷包含能够稳定整合至所述细胞的基因组中的遗传物质。
实施方式70.根据实施方式66所述的系统,其中所述有效载荷包含能够瞬时表达所需靶蛋白的遗传物质。
实施方式71.根据实施方式62至70中任一项所述的系统,其中所述有效载荷抑制靶基因的表达。
实施方式72.根据实施方式71所述的系统,其中所述有效载荷由siRNA构成。
实施方式73.根据实施方式62至72中任一项所述的系统,其中所述有效载荷能够在功能上抑制蛋白质。
实施方式74.根据实施方式62至73中任一项所述的系统,其中所述有效载荷包含表达能够在功能上抑制所需靶标的蛋白质的遗传物质。
实施方式75.根据实施方式62至74中任一项所述的系统,其中所述有效载荷是环状的。
实施方式76.根据实施方式62至74中任一项所述的系统,其中所述有效载荷是线性核苷酸序列。
实施方式77.根据实施方式62至74中任一项所述的系统,其中所述有效载荷是单链的。
实施方式78.根据实施方式68所述的系统,其中所述有效载荷为RNA质粒。
实施方式79.根据实施方式62至65中任一项所述的系统,其中所述有效载荷是蛋白质。
实施方式80.根据实施方式62至65中任一项所述的系统,其中所述有效载荷是小分子。
实施方式81.根据实施方式79或80所述的系统,其中所述有效载荷缀合至能够与所述寡核苷酸杂交的独特核苷酸序列。
实施方式82.根据实施方式62至81中任一项所述的系统,其中所述多个孔中的每一个被配置为容纳将要被纳米针穿透的细胞。
实施方式83.根据实施方式62至82中任一项所述的系统,其中所述注入装置被配置为将所述多个纳米针移动到所述多个孔内。
- 利用纳米针进行有效载荷的基于适体的细胞内递送的系统和方法
- 利用突变型伴侣蛋白复合体的细胞内局部性药物递送系统用纳米胶囊
