基于核酸的检测方法
文献发布时间:2023-06-19 11:39:06
发明的领域
本发明的实施方案涉及检测和/或定量样品中的靶标部分的设备和方法,包括使用基于核酸分子的再捕获事件。具体地但非唯一地,本发明的某些实施方案涉及包括置换固定的核酸分子以形成靶标-核酸分子并且检测靶标-核酸复合物或核酸分子本身的后续再捕获事件的设备和测定。本文描述了其他方面和实施方案。
发明的背景
适体是小的人工配体,包括能够以高亲和力和特异性与感兴趣的特定靶标部分结合的单链DNA、RNA或多肽分子。适体被认为是用作诊断剂和/或治疗剂的抗体的备选物。此外,在环境和食品研究以及临床诊断领域的许多分析应用中,适体也显示出有望作为抗体的替代物。
当前,通过对感兴趣的靶标部分的基于亲和力的分配,反复筛选候选寡核苷酸的部分随机化文库的过程来获得适体。适体在广泛的pH和温度范围内具有高结构稳定性,使其成为广谱体外、体内和离体应用的理想试剂。
1990年,由两个独立小组Tuerk&Gold,1990(Science 249,505-510)和Ellington&Szostak,1990(Nature 346,818-822))开发了模拟进化过程的体外方法,以鉴定高亲和力适体。该过程称为体外选择。该过程利用进化的基本概念,利用变异、选择和复制来从简并核酸分子(即寡核苷酸)的起始库中获得高靶亲和力和特异性。通常,为了选择核酸(DNA或RNA寡核苷酸)适体,通过合成短寡核苷酸(大小范围为约20至约100个核苷酸)的简并文库(约10
当前的适体选择方法包括在允许核酸分子与靶分子结合的条件下将核酸库与固定的靶分子孵育;然后进行彻底洗涤以去除非结合或低亲和力序列。洗脱结合的核酸分子,并使用PCR或其他扩增方法扩增。然后,扩增的核酸分子形成用于下一轮体外选择的起始原料输入。重复该过程多次,直到富集一种或多种核酸适体,所述核酸适体紧密且特异性地与单个靶分子/多个靶分子结合。制备随机文库和基于亲和力的分配方法的最新技术进步已经产生了对抗体具有同等亲和力的适体。
已经针对多种靶分子提出了适体,所述靶分子包括例如无机组分、有机小分子、蛋白质、肽、核酸、碳水化合物和细胞。因此,适体可用于检测和定量给定样品中特定产物的量。
与抗体相比,适体具有若干优点,例如包括:易于体外合成、灵活修饰、靶标范围宽泛、可重复使用性以及热/化学稳定性高。因此,在许多测定和检测方法中,使用适体代替抗体。在一个实例中,目前在诸如ELISA(酶联免疫吸附测定)的测定中使用适体代替抗体。当使用适体代替抗体时,所得测定通常称为“ELONA”(酶联寡核苷酸测定),“ELASA”(酶联适体吸附测定),“ELAA”(酶联适体测定)或类似测定。将适体掺入这些ELISA样测定平台中可以提高灵敏度,使得可以检测更多数量的分析物;包括没有可用抗体和更宽范围的输出的分析物,因为适体可以与多个报告分子(包括荧光团和淬灭分子)缀合。与使用抗体有关的其他缺点包括,例如不适当的聚集和与抗体的标记和/或产生有关的并发症。
也已经将适体用于许多其他测定形式,例如侧向流动装置、生物传感器和类似的测定形式。然而,仍然需要提供具有良好灵敏度和准确性的掺入适体的测定。
本发明的实施方案旨在克服与现有技术有关的问题。
发明的一些实施例方案的总结
本发明涉及利用从支持物置换核酸分子(例如适体)和随后通过与互补寡核苷酸(例如捕获寡核苷酸)杂交而再捕获所述核酸分子的组合的测定。
有利地,较高量的靶分子可导致从支持物置换更多的核酸分子。这进而可导致更大量的核酸分子被再捕获。因此,本发明的某些实施方案提供了利用信号形式的浓度依赖性和/或增益的高度灵敏和准确的测定。
有利地,捕获寡核苷酸可以配置为与从如本文所述的“通用适体选择文库”获得的任何适体共有的核酸序列杂交。因此,本发明的某些实施方案提供了允许取代针对不同靶分子的适体不进行或进行最小程度的重新优化的通用测定。本文描述了各个方面和实施方案。
在本发明的第一方面,提供了用于检测样品中靶分子的存在、不存在或水平的设备,该设备包括:
a)第一区域,包括:
i)支持物;和
ii)固定化寡核苷酸;和
iii)对靶分子具有结合亲和力的核酸分子,
其中核酸分子配置为与靶分子形成复合物,
其中固定化寡核苷酸或核酸分子直接或间接连接至支持物,并且进一步,其中固定化寡核苷酸包含与核酸分子的核酸序列至少部分互补的核酸序列,并且其中核酸分子能够与固定化寡核苷酸杂交;该设备还包括:
b)另一区域,包括:
i)支持物;和
ii)直接或间接连接至支持物的捕获寡核苷酸,其中所述捕获寡核苷酸包含与以下任一种互补的核酸序列:
(1)核酸分子的核酸序列,其中捕获寡核苷酸配置为,当核酸分子和靶分子复合时,与该核酸分子的核酸序列杂交以捕获核酸-分子-靶分子复合物;或
(2)固定化寡核苷酸的核酸序列,其中捕获寡核苷酸配置为与固定化寡核苷酸杂交以捕获该固定化寡核苷酸。
因此,在某些实施例中,该设备利用配置为结合靶分子的核酸分子。适当地,核酸分子以高亲和力和特异性结合靶分子。
适当地,在不存在靶分子的情况下,核酸分子直接或间接固定在支持物上以使其固定。核酸分子可以通过与固定化寡核苷酸杂交的方式连接,该固定化寡核苷酸进而直接或间接地连接到支持物上。或者,核酸分子本身可以直接或间接(例如经由接头)连接到支持物表面上。在该实施方案中,固定化寡核苷酸配置为与核酸分子的一部分杂交。在该实施方案中,测量固定化寡核苷酸与靶结合核酸之间的相互作用的破坏,作为对靶分子的存在的间接测量。
本发明的某些实施方案利用了核酸分子(例如适体)在与其靶分子结合时构象变化的能力。构象变化导致核酸分子与固定化寡核苷酸解离,从而释放固定化寡核苷酸或与靶分子复合的核酸分子,这取决于哪个连接到支持物上。如果不存在靶分子,则核酸分子不经历构象变化并且因此保持与固定化寡核苷酸杂交。
在某些实施方案中,设备包括连接到支持物上的接头分子,其中接头分子配置为与核酸分子杂交,并且进一步地,其中固定化寡核苷酸配置为,当核酸分子与接头分子杂交时,与所述核酸分子杂交。
适当地,将接头分子连接到支持物上,其中接头分子配置为与固定化寡核苷酸杂交,并且进一步地,其中核酸分子配置为,当固定化寡核苷酸与接头分子杂交时,与所述固定化寡核苷酸杂交。
此外,本发明的某些实施方案利用“再捕获”事件,其中核酸分子(当该核酸分子与靶分子复合时)或释放的固定化寡核苷酸被捕获寡核苷酸捕获。然后,再捕获事件能够检测到靶分子的存在以及任选地还能够检测到靶分子的含量。
在某些实施方案中,捕获寡核苷酸包含与核酸分子的核酸序列至少部分互补的核酸序列,其中捕获寡核苷酸配置为与核酸分子(当该核酸分子和靶分子复合时)的核酸序列杂交以捕获核酸-分子-靶分子复合物。在可选的实施方案中,捕获寡核苷酸包含与固定化寡核苷酸的核酸序列至少部分互补的核酸序列,其中捕获寡核苷酸配置为与固定化寡核苷酸的核酸序列杂交。
在某些实施方案中,核酸分子包含至少一个固定核酸序列区域。该固定核酸序列区域可以是引物区域。在某些实施方案中,捕获寡核苷酸包含与核酸分子的固定核酸序列区域互补的核酸序列。
在某些实施方案中,固定核酸序列区域可以是在适体文库的设计中普遍使用的序列,使得选自文库的每个适体都包含固定核酸序列。因此,设备可以设计成具有能够与多个适体杂交的捕获寡核苷酸,每个适体具有一个或多个区域,这些区域具有相同的预定核酸序列,同时对不同靶分子也具有特异性。
在某些实施方案中,核酸分子包含第一固定核酸序列区域和第二核酸序列区域。因此,第一核酸分子可以是正向引物,第二核酸分子可以是反向引物。在某些实施方案中,第一固定核酸序列区域位于核酸分子的5'末端区域,第二固定核酸序列区域位于核酸分子的3'末端区域。
在某些实施方案中,捕获寡核苷酸能够与第一固定核酸序列区域或其一部分或第二固定核酸序列区域或其一部分杂交。
在某些实施方案中,设备进一步包括检测构件,用于检测包含捕获寡核苷酸和固定化寡核苷酸或核酸分子的复合物的形成。在某些实施方案中,接头分子是DNA或RNA分子或混合的DNA/RNA分子,其中任选地,接头分子包含一个或多个修饰的核苷酸。
在某些实施方案中,设备包括侧向流动测定装置。适当地,第一区域包括样品接收区域。在某些实施方案中,设备还包括在第一区域和另一区域之间的流动路径。
在某些实施方案中,流动路径包括膜,例如硝化纤维素、聚乙烯(PE)、聚四氟乙烯(PTFE)、聚丙烯(PP)、醋酸纤维素(CA)、聚丙烯腈(PAN)、聚酰亚胺(PI)、聚砜(PS)、聚醚砜(PES)膜或包含氧化铝(Al2O3)、氧化硅(SiO2)和/或氧化锆(ZrO2)的无机膜。
在某些实施方案中,第一区域包括样品施加区,其中任选地,样品施加区包括样品施加垫。在某些实施方案中,第一区域的支持物包含固定化区,该固定化区包含直接或间接连接的固定化寡核苷酸或核酸分子。
在某些实施方案中,固定化区包括非织造纤维,例如纤维素纤维、玻璃纤维、碳化硅纤维、聚合物纤维、动物纤维(例如羊毛、丝)、碳纤维、矿物纤维和/或微纤维。在某些实施方案中,固定化区包括织造纤维。
在某些实施方案中,第一区域设置在另一区域的上游。在某些实施方案中,另一区域包含捕获区,其中捕获寡核苷酸间接或直接连接到支持物上。
在某些实施方案中,另一区域包含多个捕获区,每个捕获区包含直接或间接连接到支持物上的捕获寡核苷酸,其中每个捕获寡核苷酸可以相同或不同。
在某些实施方案中,设备还包括位于第一区域下游的控制区,其中该控制区包含另一捕获寡核苷酸。在某些实施方案中,设备包括多个控制区,每个控制区包括捕获寡核苷酸,其中每个捕获寡核苷酸相同或不同。
适当地,各个控制区中的每个捕获寡核苷酸配置为结合不同的分子。
在某些实施方案中,设备可包含多个核酸分子,每个核酸分子对不同的靶分子具有特异性。在某些实施方案中,每个核酸分子包含一个或多个(例如2个)固定核酸序列区,其对于一个以上的核酸分子而言是相同的。在某些实施方案中,每个核酸分子包含相同的一个或多个固定核酸序列区域,这使得可以使用相同的捕获寡核苷酸来捕获每个核酸分子,而不管靶分子的性质如何。每个核酸分子可以包含不同的检测构件以实现单独检测,并且使得设备可以适用于多重测定形式。
在某些实施方案中,设备还包括包围第一区域和另一区域的壳体。壳体还可以包括样品引入口。
在某些实施方案中,壳体还包括与检测区以及任选地控制区相邻的窗口。在某些实施方案中,第一区域和/或另一区域的支持物独立地选自珠子、微量滴定板或其他测定板、条带(strip)、膜(membrane)、薄膜(film)、凝胶、芯片、微粒、纳米颗粒、纳米纤维、纳米管、胶束、微孔、纳米孔和生物传感器表面。
在某些实施方案中,第一区域包含在第一容器中,并且另一区域包含在另一容器中。适当地,第一区域和另一区域的固相包含在条带上。适当地,条带还包括在第一区域和另一区域之间的流动路径。
在某些实施方案中,设备还包括以下一项或多项:
a)吸光垫,
b)膜,例如硝化纤维素膜
c)一种或多种竞争分子;以及
d)一种或多种对照分子。
在某些实施方案中,设备还包括容器,该容器配置为容纳条带的至少一个端部和样品。在容器中包括样品引入区域。在某些实施方案中,固定化寡核苷酸和/或捕获寡核苷酸选自DNA分子、RNA分子、混合的DNA/RNA分子、修饰的DNA分子和修饰的RNA分子。
在某些实施方案中,设备包括多个固定化寡核苷酸、多个捕获寡核苷酸和多个核酸分子。
在某些实施方案中,核酸分子是适体。适当地,适体选自双链适体、单链适体和在其长度的至少一部分上为双链的适体。在某些实施方案中,核酸分子和/或固定化分子包含可检测标记。
在某些实施方案中,可检测标记选自荧光团、纳米颗粒、量子点、酶、放射性同位素、预定序列部分、生物素、脱硫生物素、硫醇基、胺基、叠氮化物、氨基烯丙基、地高辛配基(digoxigenin)、抗体、催化剂、胶体金属颗粒、胶体非金属颗粒、有机聚合物、胶乳颗粒、纳米纤维、纳米管、树状聚合物、蛋白质和脂质体。
在某些实施方案中,可检测标记是酶,其中任选地,该酶选自辣根过氧化物酶、碱性磷酸酶、脲酶和β-半乳糖苷酶。
在某些实施方案中,样品是选自全血、白细胞、外周血单核细胞、血浆、血清、痰、呼吸、尿液、精液、唾液、脑膜液(meningial fluid)、羊水、腺液、淋巴液、乳头抽吸物、支气管抽吸物、滑液、关节抽吸物、细胞、细胞提取物、粪便、组织、组织活检和脑脊液的生物样品。
在某些实施方案中,样品衍生自农业或工业产品或副产品、环境样品、水、食品、生产过程的样品、动物产品、植物产品和细菌产品。
在某些实施方案中,靶分子选自有机或无机小分子、细胞、蛋白质、肽、氨基酸、碳水化合物、脂质、病毒、微生物、组织切片、离子、核苷酸、核苷酸衍生物和核酸。
在本发明的另一方面,提供了检测样品中靶分子的存在、不存在或含量的方法,该方法包括:
a)使样品与复合物相互作用,该复合物包括:
i)固定化寡核苷酸;和
ii)核酸分子,其中固定化寡核苷酸和/或核酸分子直接或间接连接到支持物上,固定化寡核苷酸包含与核酸分子的核酸序列至少部分互补的核酸序列,其中所述核酸分子能够与固定化寡核苷酸的一部分杂交;
其中核酸分子对靶分子具有结合亲和力,并且进一步,其中核酸分子配置为与靶分子形成复合物;
b)如果样品中存在靶分子,则使核酸分子从含有固定化寡核苷酸的复合物中解离以形成靶分子-核酸分子复合物;以及
c)提供捕获寡核苷酸,该捕获寡核苷酸包含与核酸分子的核酸序列互补的核酸序列或与固定化寡核苷酸的核酸序列至少部分互补,其中核酸分子或固定化寡核苷酸能够与捕获寡核苷酸的一部分杂交;以及
d)检测靶分子的存在或不存在。
在某些实施方案中,该方法还包括,如果样品中存在靶分子,则形成靶分子-核酸分子-捕获寡核苷酸复合物。在某些实施方案中,该方法还包括定量样品中靶分子的含量。
在某些实施方案中,靶分子的检测包括光子检测、电子检测、声学检测、电化学检测、电光检测、酶检测、化学检测、生化检测或物理检测。
在某些实施方案中,步骤(a)在有效允许靶分子和核酸分子结合的条件下进行。在某些实施方案中,检测靶分子存在或不存在的步骤包括检测核酸分子或固定化寡核苷酸与捕获寡核苷酸的杂交。
在某些实施方案中,该方法包括生物层干涉测量法(BLI)。在某些实施方案中,该方法包括确定从核酸分子-固定化寡核苷酸复合物中置换核酸分子的步骤。在某些实施方案中,该方法进一步包括检测核酸分子-靶分子复合物与捕获寡核苷酸的杂交。在某些实施方案中,该方法包括在检测核酸分子-靶分子复合物与捕获寡核苷酸的杂交的步骤之前,将核酸分子-靶分子复合物和固定的捕获寡核苷酸孵育至少2分钟,例如3分钟、4分钟、5分钟或更长时间。在某些实施方案中,捕获寡核苷酸被固定,例如被固定到BLI探针的表面。
在某些实施方案中,该方法包括表面等离子体共振(SPR)。本发明的某些实施方案可以提供的优点为可以检测通常不能检测到的小分子。特别地,使用诸如BLI(其检测通常可能不够灵敏)的系统,本发明的某些实施方案涉及从固定化寡核苷酸置换核酸分子,其给出的信号比结合小分子所产生的信号大得多。
发明的一些实施方案的详细说明
附图简要说明
下面将参考附图更详细地描述本发明的某些实施方案,其中:
图1是根据本发明的某些实施方案的设备的第一区域的示意图;
图2是根据本发明的某些实施方案的设备的示意图;
图3是用于根据本发明的某些实施方案的设备和方法中的核酸分子的示意图。具体地,核酸分子包含至少一个与固定化寡核苷酸和/或“捕获寡核苷酸”序列互补的固定的‘捕获序列’(黑条)。这些序列用于固定核酸分子,无论是单独还是与靶分子复合,和/或在“再捕获”事件中与捕获寡核苷酸杂交。
在某些实施方案中,‘固定化寡核苷酸’具有接头(虚线)以减少来自第一和/或另外的支持物的空间位阻。适当地,核酸分子还包含2个固定的‘引物序列’(黑条),其用于通过PCR等扩增文库。这些引物区中的一个(或两个)可以用荧光团(圆圈)或其他功能性部分(纳米颗粒、量子点、酶等)修饰,以允许根据测定中的需要检测核酸分子。引物区也可用作“捕获区”,以在“再捕获”事件中与捕获寡核苷酸杂交。
图4是根据本发明的某些实施方案的设备和方法的示意图,其中进行ELONA测定。
图5是说明根据本发明的某些实施方案的适体置换测定的不同步骤的生物层干涉测量法响应曲线的图。第一适体通过生物素化的互补固定化寡核苷酸固定到链霉亲和素包被的探针上。在几个洗涤步骤后,将探针与靶分子一起孵育。靶结合导致被视为‘解离’信号的适体置换。
图6提供显示出适体再捕获测定方法的不同步骤的生物层干涉测量法响应曲线的数据。首先,将生物素化的捕获寡核苷酸revFOR(绿色)和REV(粉红色)分别固定在链霉亲和素包被的探针上。在几个洗涤步骤之后,将探针与从图5中的适体-置换测定获得的适体-靶复合物一起孵育。当适体-靶复合物与固定的捕获寡核苷酸结合时,适体再捕获被视为信号增加。图6表明任一固定引物区均可用于再捕获适体-靶分子复合物。
图7A至D显示了ELISA样测定,表明了浓度依赖性的再捕获。图A至图D中的每一个均显示了来自再捕获(FAM标记的)适体的荧光(y轴),相对于用具有‘捕获寡核苷酸’的预固定板孵育的输入适体的含量(x轴)。当不存在‘捕获寡核苷酸’(‘0’,虚线)时,则没有适体被再捕获。随着‘捕获寡核苷酸’的含量增加,更多的适体被再捕获并产生更多的荧光。用生物素化的‘捕获寡核苷酸’预固定ELISA板允许以浓度依赖性方式再捕获适体。适体可以通过5'或3'末端被再捕获(分别为图A和C和B和D上的正向和反向)。数据还表明,适体可以在置换测定中使用的任一常见缓冲液pH下被再捕获;pH6.8(A和B)和pH7.4(C和D)。
图8A至D还显示了ELISA样测定,表明了浓度依赖性的再捕获。图A至图D中的每一个均显示了来自再捕获的(FAM标记的)适体的荧光(y轴),相对于用板孵育的‘捕获寡核苷酸’的含量(x轴)。每个系列(圆形、菱形、三角形和正方形)是不同含量的荧光标记的适体(分别为50、10、2、0pmol适体)。在最高的适体含量下(50pmol,圆形),在每种缓冲液和两种‘捕获寡核苷酸’中都可以看到明显的趋势。这表明适体的任一‘末端’(A和C中的5'或B和D中的3')可用于再捕获,并且缓冲液pH值对结合无显著影响。随着预固定在板上的生物素化捕获寡核苷酸的含量增加,观察到浓度依赖性再捕获。当适体的含量达到与预固定的生物素化捕获寡核苷酸相同的含量时,达到饱和。
图9A至D显示了ELONA样测定结果。其说明了在4种不同浓度的测试底物/基质(分别为人血浆、牛奶、河水和模拟尿液,浓度为0%、10%、25%、40%v/v)下测量的荧光信号,其代表结合小分子靶标后从表面置换的适体的含量。通过从‘0μM靶分子’对照孔中减去荧光进行校正后,绘制数据。在4种不同浓度的测试底物/基质下,在靶分子与适体之间观察到浓度依赖性结合。
图10A至D说明了在4种不同浓度的测试底物/基质(分别为人血浆、牛奶、河水和模拟尿液,浓度为0%、10%、25%、40%v/v)下测量的荧光信号,其代表固定的‘捕获寡核苷酸’(对于REV)再捕获的荧光适体的含量。曲线图显示了荧光测量的原始数据。
图11A和B显示了在单个测定中组合的置换和再捕获测定的结果。从第一板(A)置换适体,然后再捕获在用生物素化的‘捕获寡核苷酸’预固定的第二板(B)上。在多种常见基质(血浆、河水、牛奶和尿液)中测试相同的适体和靶标,表明了该平台的通用性。
详细说明
下面描述本发明的某些实施方案的其他特征。
除非另有说明,否则本发明实施方案的实施将采用分子生物学、微生物学、重组DNA技术和免疫学的常规技术,其均在本领域技术人员的技术范围内。
大多数通用的分子生物学、微生物重组DNA技术和免疫学技术可以在Sambrook etal,Molecular Cloning,A Laboratory Manual(2001)Cold Harbor-Laboratory Press,Cold SpringHarbor,N.Y.或Ausubel et al.,Current protocols in molecular biology(1990)John Wiley and Sons,N.Y中找到。除非另有定义,否则本文所用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常所理解的相同含义。例如,生物医学与分子生物学简明词典,Juo,Pei-Show,第2版,2002,CRC出版社(the Concise Dictionary ofBiomedicine and Molecular Biology,Juo,Pei-Show,2
单位、前缀和符号以其系统国际联合会(SI)接受的形式表示。数字范围包括定义该范围的数字。除非另有说明,否则氨基酸序列以氨基至羧基的方向从左至右书写,而核酸序列以5'至3'的方向从左至右书写。
在下文中,将通过特定实施方案的非限制性实例来更详细地解释本发明。在示例实验中,使用无污染的标准试剂和缓冲液。
在本发明的第一方面,提供了用于检测样品中靶分子的存在、不存在或水平的设备,该设备包括:
a)第一区域,包括:
i)支持物;和
ii)固定化寡核苷酸;和
iii)对靶分子具有结合亲和力的核酸分子,其中核酸分子配置为与靶分子形成复合物,
其中固定化寡核苷酸或核酸分子直接或间接连接至支持物,并且进一步,其中固定化寡核苷酸包含与核酸分子的核酸序列至少部分互补的核酸序列,并且其中核酸分子能够与固定化寡核苷酸杂交;该设备还包括:
b)另一区域,包括:
i)支持物;和
ii)直接或间接连接至支持物的捕获寡核苷酸,其中所述捕获寡核苷酸包含与以下任一种互补的核酸序列:
(1)核酸分子的核酸序列,其中捕获寡核苷酸配置为,当核酸分子与靶分子复合时,与该核酸分子的核酸序列杂交以捕获核酸-分子-靶分子复合物;或
(2)固定化寡核苷酸的核酸序列,其中捕获寡核苷酸配置为与固定化寡核苷酸杂交以捕获所述固定化寡核苷酸。
在本发明的另一方面,提供了检测样品中靶分子的存在、不存在或含量的方法,该方法包括:
a)使样品与复合物相互作用,该复合物包括:
i)固定化寡核苷酸;和
ii)核酸分子,其中固定化寡核苷酸和/或核酸分子直接或间接连接到支持物上,固定化寡核苷酸包含与核酸分子的核酸序列至少部分互补的核酸序列,且其中核酸分子能够与固定化寡核苷酸的一部分杂交;
其中核酸分子对靶分子具有结合亲和力,并且进一步,其中核酸分子配置为与靶分子形成复合物;
b)如果样品中存在靶分子,则使核酸分子从含有固定化寡核苷酸的复合物中解离以形成靶分子-核酸分子复合物;以及
c)提供捕获寡核苷酸,所述捕获寡核苷酸包含与核酸分子的核酸序列互补的核酸序列或与固定化寡核苷酸的核酸序列至少部分互补,其中核酸分子或固定化寡核苷酸能够与捕获寡核苷酸的一部分杂交;以及
d)检测靶分子的存在或不存在。
在某些实施方案中,该方法包括使杂交的核酸分子与靶分子接触。在某些实施方案中,该方法包括使核酸分子和固定化寡核苷酸与包含靶分子的样品接触。
当核酸分子与靶分子接触时,通过将核酸分子与靶分子结合而形成核酸分子-靶复合物。结合事件导致上述杂交不稳定且被破坏。因此,核酸分子从固定化寡核苷酸被置换出来。在某些实施方案中,核酸分子通过与固定化寡核苷酸杂交而固定在表面上。靶分子的结合引起核酸分子的构象改变,这导致核酸分子从固定化寡核苷酸被置换出来,并因此从表面被置换出来。
本发明的实施方案涉及用于使用核酸分子检测样品中靶分子的存在和/或不存在的设备和方法。如本文所用,“核酸分子”和“适体”可互换使用,是指对靶分子具有所需作用的非天然存在的核酸分子。对于核酸适体,例如,在由单链DNA(ssDNA)形成的DNA适体和由单链RNA(ssRNA)形成的RNA适体之间进行区分。适体可以显示出与靶分子的高结合特性,并且与具有相似功能的抗体相比,其亲和力通常较高。适体的特征在于,取决于核酸序列的特定三维结构的形成。适体的三维结构是由于Watson和Crick分子内碱基配对、Hoogsteen碱基配对(四链体)、摆动对形成或其他非规范碱基相互作用而产生的。这种结构使适体类似于抗原-抗体结合能够准确地结合靶结构。在确定的条件下,适体的特定核酸序列可以具有对确定的靶结构特异的三维结构。
本文所述的核酸适体可包含天然或非天然核苷酸和/或碱基衍生物(或其组合)。在某些实施方案中,核酸分子包含一个或多个修饰,使得其包含除脱氧核糖、核糖、磷酸、腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)、胸腺嘧啶(T)或尿嘧啶(U)以外的化学结构。核酸分子可以在核碱基、戊糖或磷酸骨架上被修饰。
在某些实施方案中,核酸分子包含一个或多个修饰的核苷酸。示例性修饰包括,例如包含烷基化、芳基化或乙酰化、烷氧基化、卤化、氨基或另一官能团的核苷酸。修饰的核苷酸的实例包括用于RNA适体的2'-氟核糖核苷酸、2'-NH2-、2'-OCH3-和2'-O-甲氧基乙基核糖核苷酸。
核酸分子可以全部或部分是硫代磷酸酯或DNA、二硫代磷酸酯或DNA、硒代磷酸酯(phosphoroselenoate)或DNA、二硒代磷酸酯或DNA、锁定核酸(LNA)、肽核酸(PNA)、N3'-P5'氨基磷酸酯RNA/DNA、环己烯核酸(CeNA)、三环DNA(tcDNA)或镜像适配体(spiegelmer)或氨基磷酸酯吗啉(PMO)组分(另参见Chan et al.,Clinical and ExperimentalPharmacology and Physiology(2006)33,533-540)。
一些修饰使得核酸分子对核酸切割酶是稳定的。在适体的稳定化中,通常可以在适体的后续修饰与已经修饰的RNA/DNA的选择之间进行区分。稳定化不会影响修饰的RNA/DNA适体的亲和力,但会防止适体在生物体或生物溶液中被RNA酶/DNA酶快速分解。如果在生物血清中的半衰期大于一分钟,优选地大于一小时,更优选地大于一天,则在本发明的上下文中,认为适体是稳定的。适体还可以用报告分子修饰,所述报告分子除了检测标记的适体外还可以有助于增加稳定性。
期望的作用包括,例如,结合靶分子,催化改变靶分子,以修饰或改变靶标或靶分子的功能活性的方式与靶分子反应,共价连接到靶分子上和促进靶分子与另一分子之间的反应。在本发明的实施方案的上下文中,期望的作用是以高亲和力结合靶分子。
在一个实施方案中,作用是对靶分子的特异性结合亲和力,其中靶分子是除通过不依赖于Watson/Crick碱基配对或三股螺旋形成的机制与核酸配体结合的多核苷酸以外的三维化学结构,其中适体不是具有被靶分子结合的已知生理功能的核酸。
可以使用已知方法选择针对靶分子的适体。例如,可以通过利用SELEX方法及其改进方法来制备适体(例如,Ellington&Szostak,(1990)Nature,346,818-822;Tuerk&Gold,(1990)Science,249,505-510)。在SELEX方法中,通过增加轮次数或使用竞争性物质来设定严格的选择条件,浓缩和选择对靶分子显示出更强结合潜力的适体。因此,通过调节SELEX的轮次数和/或改变竞争条件,在某些情况下可以获得具有不同结合力的适体,具有不同结合模式的适体以及具有相同结合力或结合模式但不同碱基序列的适体。SELEX方法包括PCR扩增过程;通过在该过程中使用锰离子等引起突变,可以进行更高多样性的SELEX。
文库的可变性例如在约10
a)将核酸分子文库与靶标结合;
b)将靶标结合的核酸分子和未结合的核酸分子分离;
c)回收靶标结合的核酸分子;
d)扩增回收的核酸分子(例如用于DNA分子的PCR,用于RNA分子的反转录PCR);和
e)从扩增产物制备相关的单链核酸(例如ssDNA纯化,体外RNA转录)。
在每个循环后,所选择和富集的核酸分子库被用作下一循环的起始材料。通常,运行8到12个循环,尽管该数目根据靶标类型、所选择的方法和效率而变化。
在某些实施方案中,该方法包括分析已经被鉴定为以高结合亲和力结合靶分子的适体的核酸序列。在分析序列后,可以通过本领域技术人员已知的化学DNA和RNA合成的常规技术来制备适体(包括其变体、突变体、片段和衍生物)。此外,可以研究单个适体与靶分子的结合特性。
在某些实施方案中,至少一个随机化区域在5'和3'末端侧接引物区。引物区用作文库和所选择的适体的PCR扩增的引物结合位点。
在某些实施方案中,在设备和方法中使用的核酸分子选自“通用适体选择文库”,该文库设计成使得来自该选择过程的任何适体需要很少或不需要适应就可以转化成任何列出的测定形式。在某些实施方案中,“通用适体选择文库”由以下功能部分组成:5'引物序列、至少一个杂交/捕获区(与“固定化寡核苷酸”互补)、至少一个随机化区和3'引物序列。一旦被选择,核酸分子可以被进一步修饰,例如在使用前去除一个或两个引物序列。在某些实施方案中并且如上所述,固定的引物序列可以用作捕获序列。因此,在某些实施方案中,捕获寡核苷酸包含与核酸分子中的其中一个引物序列互补的核酸序列。这允许开发利用包含相同核酸序列的捕获寡核苷酸的方法和设备,而与待检测的靶分子无关。
适体容易被改变,因为其允许化学合成。对于适体,通过使用MFOLD程序预测二级结构,或通过X射线分析或NMR分析预测空间结构,可以在某种程度上预测哪些核苷酸可以被取代或缺失,在何处插入新核苷酸等。可以容易地化学合成具有新序列的预测的适体,并且可以使用现有的测定系统确定适体是否保留活性。
可以通过本领域本身已知的方法合成用于本发明的某些实施方案的设备和方法中的适体。其中一种合成方法是使用RNA聚合酶的方法。目标RNA可以通过化学合成具有目标序列和RNA聚合酶的启动子序列的DNA,然后使用其作为模板并根据已知方法进行体外转录来获得。
可以使用DNA聚合酶合成适体。化学合成具有目标序列的DNA,并使用其作为模板,通过已知的聚合酶链式反应(PCR)方法进行扩增。通过已知的聚丙烯酰胺电泳方法或酶处理方法将其转化为单链。当合成修饰的适体时,可以通过使用在特定位点引入突变的聚合酶来提高延伸反应的效率。由此获得的适体可以通过已知方法容易地纯化。
可以通过化学合成方法如亚酰胺(amidite)法、亚磷酰胺法等大量合成适体。合成方法是公知的方法,如Nucleic Acid(Vol.2)1]Synthesis and Analysis of NucleicAcid(编辑:Yukio Sugiura,Hirokawa Publishing Company)等中所述。实际上,使用诸如由通用电气医疗集团生命科学(GE Healthcare Bioscience)制造的OligoPilot100、OligoProcess等的合成器。通过本身已知的方法(例如色谱法等)进行纯化。
靶分子
本文所述的设备和方法用于检测样品中靶分子的存在或不存在和/或含量的量化。本文所用的术语“靶分子”表示可以在测试样品中发现并能够与本文所述的核酸分子结合的分子。
根据一些实施方案,靶分子是有机分子。在一些实施方案中,靶分子是可溶性抗原、细胞表面抗原或与胶束、脂质体或颗粒相关的抗原。在一个实施方案中,靶分子是抗原。
在一些实施方案中,靶分子可以是蛋白质、多肽、肽、神经节苷脂、脂质、磷脂、碳水化合物、小分子或核酸分子。
在某些实施方案中,可溶性抗原可以是蛋白质、肽、酶、细胞因子、可溶性癌症标记物、炎症相关标记物、激素和/或源自病毒、细菌或真菌的可溶性分子,例如毒素或过敏原。
在一些实施方案中,抗原是微生物相关抗原。如本文所用,术语“微生物相关抗原”应理解为由病毒、细菌或真菌基因组编码的蛋白质或其片段。
在某些实施方案中,抗原是癌症(或肿瘤)标记物。通常,肿瘤标记物可以在体液中被发现,例如在血液或尿液中,或在身体组织中。肿瘤标记物可以在癌症中表达或过度表达,并且通常指示特定的疾病过程。
根据本发明的细胞表面抗原的非限制性实例是受体、细胞表面标记物、微生物相关抗原或受体配体。
在某些实施方案中,靶分子是小分子。在某些实施方案中,小分子是治疗剂,例如用于治疗癌症的化学治疗剂。
样品
靶分子可以包含在样品中。样品可包含全血、白细胞、外周血单核细胞、血浆、血清、痰、呼吸、尿液、精液、唾液、脑膜液、羊水、腺液、淋巴液、乳头抽吸物、支气管抽吸物、滑液、关节抽吸物、细胞、细胞提取物、粪便、组织、组织活检和脑脊液。
样品可以包括血液、血清、间质液、脊髓液、脑液、组织渗出液、浸渍组织样品、细胞溶液、细胞内隔室、地下水或其他生物和环境样品。样品可以保持不变或可以在分析之前预处理,例如进行过滤、稀释、浓缩、缓冲或以其它方式处理。
样品适当地是所提供或取样的材料,其被认为含有一种或多种感兴趣的靶分子,例如感兴趣的一种或多种小分子分析物,并且应检查靶标的存在。
样品可以是,例如临床样品、食品样品、水样品或其他环境采样材料的样品。在某些实施方案中,样品包含靶分子和缓冲溶液。在某些实施方案中,样品被预处理,例如通过混合、添加酶或标记物或纯化进行预处理。
在某些实施方案中,样品可以进一步是从个体分离的任何生物材料,例如生物组织和流体,包括但不限于:计数血液、皮肤、血浆、血清、淋巴、尿液、脑脊液、泪液、拭子、组织样品、器官和肿瘤。在某些实施方案中,细胞培养物的组分也包括在样品中。
本文描述了其他示例性靶分子和样品。
固定化寡核苷酸
适当地,固定化寡核苷酸包含核酸序列,该核酸序列配置为在其长度的至少一部分上与核酸分子的核酸序列杂交。
在某些实施方案中,核酸分子的固定化区域在其至少一部分上与固定化寡核苷酸的区域杂交。如本文所用,术语“杂交(hybridizes)”和“杂交(hybridization)”是指在常规杂交条件下,优选在严格的条件下,基于适体文库内的固定区域和固定化寡核苷酸内的互补序列之间的Watson-crick碱基配对形成相互作用,例如Sambrook et al.,MolecularCloning,A Laboratory Manual,3.Ed.(2001)Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NY中所述。
固定化寡核苷酸或其部分配置为与核酸分子的固定化区域或其一部分形成双链双链体结构。在某些实施方案中,固定化寡核苷酸的长度为约10个核苷酸至约20个核苷酸,例如长度为10、11、12、13、14、15、16、1、18、19或20个核苷酸。固定化寡核苷酸可包含与核酸分子的固定序列互补的核酸序列。因此,在一些实施方案中,固定化寡核苷酸可以是“通用”寡核苷酸,因为其可以配置为与可以包含在多个核酸分子中的序列杂交。图3提供了示意图。
在某些实施方案中,将核酸分子和固定化寡核苷酸在足以使核酸分子或其部分与固定化寡核苷酸杂交的条件下孵育。
本领域技术人员将理解,发生杂交所需的条件将在反应之间变化。在某些实施方案中,该方法包括加热核酸分子和固定化寡核苷酸的混合物,例如加热到至少约80℃,例如85℃、86℃、87℃、88℃、89℃或90℃,持续至少约1分钟,例如2分钟、3分钟、4分钟、5分钟或更长时间。该方法还可以包括将核酸分子和固定化寡核苷酸冷却至低于约10℃的温度,例如9℃、8℃、7℃、6℃、5℃、4℃或更低。
在某些实施方案中,杂交是在将固定化寡核苷酸固定到支持物上之前进行的。在另一个实施方案中,在核酸分子与固定化寡核苷酸杂交之前,将固定化寡核苷酸连接到支持物上。
固定化寡核苷酸和/或核酸分子可以连接到第一区域的支持物上。连接可以是直接或间接的,例如,通过接头或其他连接部分。
在某些实施方案中,固定化寡核苷酸包含接头部分。接头部分可以选自生物素、硫醇和胺。固定化寡核苷酸可进一步包含间隔分子,例如选自多核苷酸分子、C6间隔分子、C12间隔分子、另一长度C间隔分子、六甘醇分子、己二醇和/或聚乙二醇的间隔分子。
接头可以是,例如生物素接头。在某些实施方案中,适体可以与抗生物素蛋白缀合。在本文中找到关于接头的其他细节。在某些实施方案中,接头和/或间隔分子是光可裂解分子,例如5-溴尿嘧啶和/或5-碘尿嘧啶。
在某些实施方案中,可以修饰固定化寡核苷酸和/或核酸分子以连接到支持物表面上。例如,固定化寡核苷酸可以通过硅烷键连接。可选地或另外,固定化寡核苷酸/核酸分子可以被琥珀酰化(例如,以将固定化寡核苷酸连接到氨基苯基或氨基丙基衍生的玻璃上)。适当地,支持物是氨基苯基或氨基丙基衍生的。在某些实施方案中,固定化寡核苷酸/核酸分子包含NH
支持物
某些实施方案的设备包括第一区域,该第一区域包括支持物。支持物可以包括固态支持物,例如膜或珠子。支持物可以是二维支持物(例如微孔板)或三维支持物(例如珠子)。因此,在某些实施方案中,支持物可包括至少一个磁珠。在可选的实施方案中,支持物可以包含至少一个纳米颗粒,例如金纳米颗粒等。在又另外的实施方案中,第一区域的支持物包括微量滴定板或其他测定板、条带、膜、薄膜、凝胶、芯片、微粒、纳米纤维、纳米管、胶束、微孔、纳米孔和生物传感器表面。在某些实施方案中,生物传感器表面可以是探针尖端表面,生物传感器流动通道或类似物。在某些实施方案中,另一区域包括支持物。第一区域和另一区域的支持物可以是连续的元件。可选地,第一区域和另一区域的支持物可以是分开的元件。
可以制成支持物的特别合适的材料包括,例如无机聚合物、有机聚合物、玻璃、有机和无机晶体、矿物、氧化物、陶瓷、金属,尤其是贵金属、碳和半导体。特别合适的有机聚合物是基于聚苯乙烯的聚合物。生物聚合物,例如纤维素、葡聚糖、琼脂、琼脂糖和葡聚糖凝胶(Sephadex),可以被官能化,特别是作为硝化纤维素或溴化氰葡聚糖凝胶,可以用作提供固体支持物的聚合物。
在某些实施方案中,固定化寡核苷酸可以直接或间接连接到磁珠上,所述磁珠可以是例如羧基封端的、抗生物素蛋白修饰的或环氧活化的,或以其他方式用相容的反应性基团修饰的。聚合物的实例不是限制性的,并且可以想到其他分子。
可以以多种方式和本领域技术人员已知的用于将DNA或RNA固定到固体上的任何方式来将寡核苷酸固定到支持物上,例如固相支持物。将适体固定到纳米颗粒上例如在WO2005/13817中有描述。例如,纸或多孔材料的固相可用液相适体润湿,随后使液相挥发,将适体留在纸或多孔材料中。
在某些实施方案中,第一区域和/或另一区域的支持物包括膜,例如硝化纤维素、聚乙烯(PE)、聚四氟乙烯(PTFE)、聚丙烯(PP)、醋酸纤维素(CA)、聚丙烯腈(PAN)、聚酰亚胺(PI)、聚砜(PS)、聚醚砜(PES)膜或包含氧化铝(Al2O3)、氧化硅(SiO2)和/或氧化锆(ZrO2)的无机膜。
可以制成支持物的特别合适的材料包括,例如无机聚合物、有机聚合物、玻璃、有机和无机晶体、矿物、氧化物、陶瓷、金属,尤其是贵金属、碳和半导体。特别合适的有机聚合物是基于聚苯乙烯的聚合物。生物聚合物,例如纤维素、葡聚糖、琼脂、琼脂糖和葡聚糖凝胶,可以被官能化,特别是作为硝化纤维素或溴化氰葡聚糖凝胶,可以用作提供固体支持物的聚合物。
另一区域
设备还包括另一区域,该另一区域包括支持物。另一区域的支持物可以与第一区域的支持物相同或不同。另一区域可以包括在与第一区域不同的容器或设备中。
另一区域也包括直接或间接连接到另一支持物上的捕获寡核苷酸。捕获寡核苷酸可包含与固定化寡核苷酸相同的序列。可选地,捕获寡核苷酸可包含与固定化寡核苷酸不同的序列。另一区域可以包含多个捕获寡核苷酸,其以其不同的序列结合核酸分子。
捕获寡核苷酸或其部分配置为与核酸分子或固定化寡核苷酸的序列形成双链双链体结构。在某些实施方案中,捕获寡核苷酸的长度为约10个核苷酸至约20个核苷酸,例如长度为10、11、12、13、14、15、16、17、18、19或20个核苷酸。捕获寡核苷酸可包含与核酸分子或固定化寡核苷酸的固定序列互补的核酸序列。因此,在一些实施方案中,固定化寡核苷酸可以是“通用”寡核苷酸,因为其可以配置为与可以包含在多个核酸分子中的序列杂交。在另一可选的实施方案中,捕获寡核苷酸可包含与固定化寡核苷酸的序列互补的核酸序列。
可检测标记
在某些实施方案中,核酸分子包含可检测标记。在某些实施方案中,捕获寡核苷酸包含可检测分子。在某些实施方案中,可检测标记是荧光部分,例如荧光/猝灭剂化合物。荧光/猝灭剂化合物是本领域已知的,参见例如Mary Katherine Johansson,Methods inMolecular Biol.335:Fluorescent Energy Transfer Nucleic Acid Probes:Designsand Protocols,2006,Didenko,ed.,Humana Press,Totowa,NJ和Marras et al.,2002,Nucl.Acids Res.30,el22(两者均通过引用并入本文)。
此外,例如由于荧光共振能量转移(“FRET”),当彼此接近时导致可检测信号增加的部分可以用作本文所述的设备和方法中的可选标记;合适的对包括但不限于荧光素和四甲基罗丹明;罗丹明6G和孔雀绿,以及FITC和硫代氨基咔唑(thiosemicarbazole),仅举几个例子。
在某些实施方案中,可检测标记选自荧光团、纳米颗粒、量子点、酶、放射性同位素、预定序列部分、生物素、脱硫生物素、硫醇基、胺基、叠氮化物、氨基烯丙基、地高辛配基、抗体、催化剂、胶体金属颗粒、胶体非金属颗粒、有机聚合物、胶乳颗粒、纳米纤维、纳米管、树状聚合物、蛋白质和脂质体。
在某些实施方案中,可检测标记是酶,其中任选地,该酶选自辣根过氧化物酶、碱性磷酸酶、脲酶和β-半乳糖苷酶。
在某些实施方案中,检测构件的性质将取决于所使用的可检测标记。例如,在某些实施方案中,标记可以通过其颜色被检测到,例如金纳米颗粒。可以通过光学读取器或照相机(例如具有成像软件的照相机)定量地检测颜色。在某些实施方案中,如果可检测标记是荧光标记(例如量子点),则检测构件可以包括配置为例如记录荧光强度的荧光条带读取器。
在其中可检测标记是酶标记的实施方案中,检测手段可以是电化学检测器。检测标记可以进一步包含酶,例如辣根过氧化物酶(HRP)、碱性磷酸酶(APP)或类似物,以催化地转化底物以产生放大的信号。
在某些实施方案中,该方法包括检测核酸分子-靶分子复合物的形成。如本文所述,当适体与靶标接触时,通过将适体结合到靶标而形成适体-靶标复合物。结合或结合事件可以例如以视觉、光学、光子、电子、声学、光声学、质量、电化学、电光、光谱、酶学或其他化学、生物化学或物理方式检测。
在某些实施方案中,核酸分子可包含检测分子,例如标记。示例性标记是可视觉、光学、光子、电子、声学、光声学、质量、电化学、电光、光谱、酶学或其他物理、化学或生物化学检测的。在该方法的一个实施方案中,通过发光、UV/VIS光谱学、酶学、电化学或放射性来检测标记。发光是指光的发射。在根据本发明的某些实施方案的方法中,例如,使用光致发光、化学发光和生物发光来检测标记。在光致发光或荧光中,激发是通过吸收光子而发生的。示例性荧光团包括但不限于双苯并咪唑、荧光素、吖啶橙、Cy5、Cy3或碘化丙啶(其可以与适体共价偶联)、四甲基-6-羧基罗丹明(TAMRA)、德克萨斯红(TR)、罗丹明、Alexa Fluor染料(不同波长的荧光染料来自不同公司)。
其他标签是具有信号产生物质的催化剂、胶体金属颗粒,例如金纳米颗粒、胶体非金属颗粒、量子点、有机聚合物、胶乳颗粒、纳米纤维(特别是碳)、纳米管、特别是碳(碳纳米管)、树状聚合物、蛋白质或脂质体。可以通过量热法检测胶体颗粒。
在某些实施方案中,可检测分子是酶。在某些实施方案中,酶可以将底物转化为有色产物,例如过氧化物酶、绿色荧光蛋白(GFP)、荧光素酶、β-半乳糖苷酶或碱性磷酸酶。例如,无色底物X-gal通过β-半乳糖苷酶的活性转化为蓝色产物,其颜色可目视检测。
上述酶标记物和检测系统使用碱性磷酸酶。使用碱性磷酸酶(APP),可以进行各种检测,如下例所示:电化学检测:底物磷酸苯酯,APP的酶促反应形成苯酚,连接到苯酚传感器上(例如,电化学检测显色反应的测量:底物对硝基苯基磷酸酯,APP的酶促反应形成对硝基苯酚,呈黄色荧光检测:底物4-甲基伞形酮磷酸酯(4-methylumbelliferonylphosphate):APP的酶促反应形成甲基伞形酮残基,在激发荧光后释放用于化学发光检测。
此外,APP选择性地转化5-溴-4-氯-3-吲哚基磷酸酯(BCIP或X-磷酸酯)和硝基蓝四唑盐(NBT)。染料沉淀在AP分子的附近,并使结合化合物的周围染成深紫色。
过氧化物酶催化,例如ABTS(2,2'-连氮基-双-[3-乙基苯并噻唑啉-6-磺酸])在H
在某些实施方案中,可检测分子是放射性同位素。该检测还可以借助标记有适体的放射性同位素进行,优选为3H、14C、32P、33P、35S或125I,更优选为32P、33P或125I。在闪烁计数中,间接测量由放射性标记的适体-靶标复合物发射的放射性辐射。闪烁体物质被放射性辐射激发。在过渡到基态期间,激发能再次以闪光的形式释放出来并由光电倍增器放大和计数。
在某些实施方案中,可检测分子选自地高辛配基和生物素。因此,适体还可以用地高辛配基或生物素标记,其被抗体或链霉亲和素结合,而抗体或链霉亲和素又可以携带标记,例如酶缀合物。适体与酶的先前共价连接(缀合)可以以几种已知的方式完成。适体结合的检测也可以在RIA(放射性免疫测定)中用放射性同位素,优选125I进行放射性检测,或者在FIA(荧光免疫测定)中用荧光团,优选荧光素或FITC进行荧光检测。
设备还可以包括样品引入区域。样品引入区域可以包括端口,并且可以设置在第一区域的上游。
在某些实施方案中,设备还可以包括:
a)一种或多种竞争分子;和
b)一种或多种对照分子。
在某些实施方案中,竞争分子是能够与样品区分的确定量的非特异性和/或阴性靶分子。
在某些实施方案中,对照分子是能够与样品比较的确定量的靶分子。
在另一个实施方案中,对照分子可以是与位于对照区(如下所述)中的对照捕获分子互补的非功能性DNA/RNA序列(对照DNA/RNA序列)。对照DNA/RNA序列与对照捕获分子的杂交将证明测定的主要功能。
设备
根据本发明的第一方面的设备可以以多种不同的形式来提供。在某些实施例中,设备可以是生物传感器。生物传感器有许多不同的形式。在另一方面,本发明涉及包括根据本发明的适体的生物传感器。
在某些实施方案中,生物传感器包括以下元件:包含核酸分子的第一区域和将核酸分子与靶分子之间的结合事件转化为电可定量信号的换能器。第一区域可以包括在容器或探针等中。
另外,设备还可以包括其他元件,例如信号处理装置、输出电子器件、显示装置、数据处理装置、数据存储装置以及与其他装置的接口。
从与生物传感器接触的样品,例如含有靶分子的复合混合物中,可以通过核酸分子的特异性结合来鉴定靶分子。
传感器的灵敏度可能会受所使用的换能器的影响。换能器可以将与捕获寡核苷酸结合的核酸分子-靶分子复合物(或在其他实施例中,固定化寡核苷酸与捕获寡核苷酸的结合)转化为电可用信号。换能器将来自结合事件的与样品中靶分子的浓度成比例的信号转化为电可量化的测量信号。信号传导由于核酸分子之间的分子相互作用而发生。
利用根据本发明的某些实施方案的生物传感器,可以获得定性、定量和/或半定量的分析信息。根据某些实施方案的设备可以特别适用于食品、水和环境分析以及水处理(尤其是饮用水和废水处理),用于诊断以及用于医院和护理机构。
在某些实施方案中,第一区域和/或另一区域可以包括换能器表面,并且本文所述的释放和再捕获事件可以通过换能器检测。
可以例如通过光学、微重力、热或声换能器,诸如通过光学或微重力换能器,测量靶标-分子-核酸分子复合物的重捕获。光学换能器中的测量可以基于光度原理,由此例如检测颜色或发光强度变化。光学方法包括荧光、磷光、生物发光和化学发光、红外跃迁和光散射的测量。光学方法还包括当靶标结合适体时测量层厚度变化。层厚度变化可以例如通过表面等离子体共振(SPR)、生物层干涉测量法(BLI)或反射干涉光谱(RlfS)进行。此外,可以测量薄层上的干涉(反射干涉光谱)和渐逝场的变化。
声换能器利用压电石英晶体的频率变化,其检测当靶标与适体结合时发生的高灵敏度的质量变化。将使用的石英晶体置于振荡电场中,并测量晶体的共振频率。石英晶体表面上的质量变化(例如由分析物与先前固定在晶体表面受体上的反应导致)会引起共振频率变化,该变化可以被量化。
电化学换能器可以,例如测量电极表面上氧化还原活性标记物浓度的变化,或改变氧化还原活性底物或产物的浓度,例如在酶标记物的酶促反应中消耗或形成的那些。热换能器测量适体-靶标结合反应的热量。
在某些实施方案中,设备是BLI(生物层干涉法)设备或类似设备。在某些实施方案中,第一区域包含在生物传感器探针上。含有捕获寡核苷酸的另一区域包含在第二生物传感器探针上。将第一探针与样品一起孵育。如果样品中存在靶分子,则核酸分子从含有固定化寡核苷酸的复合物中置换,以形成靶分子-核酸分子复合物。因此,核酸序列从探针中置换并存在于样品中。核酸分子的置换产生可定量的信号降低,并可通过BLI进行测量。然后将第二探针与含有核酸分子-靶标复合物的样品一起孵育。核酸分子或核酸分子-靶标复合物的再捕获产生可定量的结合信号并且可以通过BLI测量。
根据设计,可以通过测量装置获得关于待测量的靶标的定性、定量和/或半定量分析信息。检测构件可以是,例如可以在现场使用的便携式仪表,例如袖珍型轻型仪表。
在某些实施方案中,设备包括侧向流动装置。例如,生物传感器可以是侧向流动装置。侧向流动装置也可以称为侧向流动测试、侧向流动测定和侧向流动免疫测定。
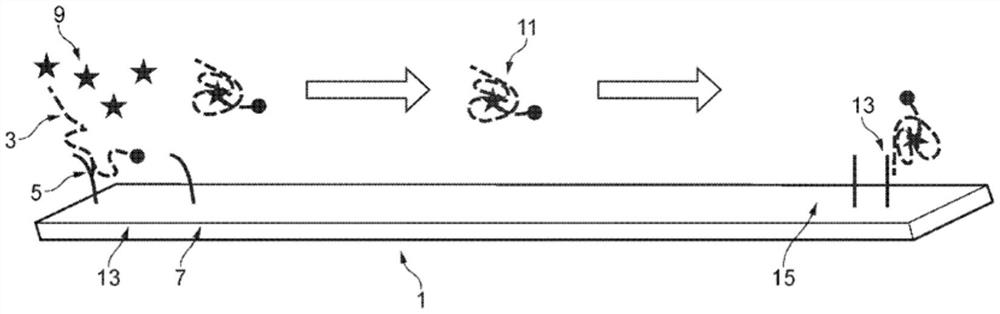
图2是侧向流动装置1的示意图。侧向流动装置包括第一区域13,第一区域13包括支持物7,支持物7上连接有固定化寡核苷酸5。固定化寡核苷酸配置为在其序列的一部分上与核酸分子(例如适体3)杂交。
将样品引入第一区域。样品适当地是液体。如果样品包含靶分子9,则适体与靶分子结合并发生构象变化,这导致适体与固定化寡核苷酸解离。然后,靶分子-适体复合物11在溶液中是游离的。适当地,侧向流动装置包括从第一区域到另一区域15的流动路径。靶分子-适体复合物从第一区域流向另一区域。
另一区域15适当地包括测试区域,所述测试区域包括捕获寡核苷酸13。捕获寡核苷酸13包含当适体与靶分子复合时与适体序列互补的核酸序列。然后将适体(当该适体与靶分子复合时)再捕获到测试区域中。然后可以检测并任选地定量测试区域中适体-靶分子复合物的存在,从而测量样品中靶分子的存在和(任选地)含量。
适当地,侧向流动装置包括控制区域,例如控制线,控制线配置为确认测试正在进行。此外,侧向流动装置适当地包括一条或多条靶标测试线。
侧向流动装置可以是条带的形式。适当地,支持物包括膜,例如硝化纤维素膜。膜可以由非织造或织造材料形成。支持物还可以包括垫,例如可以将样品施加到其上的吸收垫。适当地,吸收垫配置为通过膜芯吸(wick)样品。在某些实施方案中,吸收垫包括纤维素纤维。
在某些实施方案中,设备还可以包括与支持物相邻的背衬元件。
侧向流动测定可以如下工作:
通过与固定化寡核苷酸中的互补序列杂交,将选择的适体固定在支持物(例如‘缀合垫’)上。适体或固定化寡核苷酸连接到支持物上。
靶分子的结合引起适体的构象变化,这导致杂交被破坏,并随后使其从固定化寡核苷酸中被置换出来。在样品基质中,与靶分子复合的置换适体(或在另一可选的实施方案中,固定化寡核苷酸)沿LFD条带携带。通过与第二固定的互补寡核苷酸杂交,在LFD上形成‘测试线’来再捕获置换的适体或固定化寡核苷酸。针对其他靶分子的其他适体也可以在同一样品中运行,并捕获在其他‘测试线’中的其他固定的互补寡核苷酸序列上,产生多重LFD测定。
将疑似含有使用本发明的某些实施方案的方法鉴定的适体的靶标的液体样品施加到第一区域的一个位置,或在一个位点用样品润湿条带。该位置可以是条带的所谓‘样品施加垫/区’。条带包含基质材料,液体样品介质和悬浮或溶解在其中的靶分子可通过毛细管作用从样品施加垫/区流过该基质材料进入检测区,检测区中存在或不存在可检测信号指示靶标的存在或不存在。
如本文所述,使用标记适体,其中可以使用上文已经描述的任何标记。优选地,使用在测试条的检测区中产生视觉上可检测的信号的标记。样品中靶标的存在或不存在可以通过检测区中的标记适体的存在或不存在来检测。
在一实施方案中,支持物包括测试条带。在某些实施方案中,使用酶标记的适体。如果样品中存在靶分子,则靶分子与酶标记的适体形成复合物,其沿着条带流向含有酶标记底物的检测区,所述酶标记底物能够在酶标记存在下产生有色反应。在某些实施方案中,条带含有另一个区,其中靶标被固定,从而检测到由于样品中缺乏足够的靶标而不与靶标联合的标记适体,从而防止其到达检测区。
支持物,例如测试条可由可被样品润湿并可向其中引入根据某些实施方案的适体的任何材料制成。特别优选的是其中包含的样品和靶标可以通过毛细作用流过的材料。实例是硝化纤维素、硝化纤维素与聚酯或纤维素的混合物、未经涂布的纸、多孔纸、粘胶长丝、玻璃纤维、丙烯腈共聚物或尼龙、以及侧向流动测定中常用的所有其他材料。
测试条带可以用于检测样品中靶标的存在。为了使用,在侧向流动测定的情况下,例如,可以仅将条带的一端浸入样品中,然后用作第一区域,即样品施加区。
本发明的某些实施方案涉及包括上述测试条带的侧向流动测定装置。除了测试条带之外,装置可以包括,例如测试条嵌入其中的外壳,并且该外壳具有通向测试条带的样品施加区的优选可关闭的开口。在某些实施方案中,设备包括控制区(与检测区不同的区,其证明了测试条带的一般功能)。
在某些实施方案中,控制区可以包括与非靶标结合对照DNA/RNA序列互补的对照捕获序列。对照DNA/RNA序列与对照捕获分子的杂交将产生不同于测试信号并证明了测定的基本功能的阳性信号。
在某些实施方案中,设备包括至少一个容器。第一区域可以包含在第一容器中,并且另一区域可以包含在另一容器中。在某些实施方案中,设备可适用于ELONA测定。图4示出了ELONA设备的示意图。设备100可包括第一区域110,所述第一区域110包含在容器120中。另一区域120包含在另一容器130中。对靶分子170特异的核酸分子150通过与第一区域中的固定化寡核苷酸160杂交而固定化。在某些实施方案中,将固定化寡核苷酸固定到容器120的表面上。将可能含有靶分子的样品加入容器中。如果样品含有靶分子,则靶分子与适体结合,导致构象变化,这进而导致适体从固定化寡核苷酸置换出来。这在图4上部的第二张图中进行了描述。在足以允许发生置换的预定时间段之后,将测定样品转移至另一容器130,容器130包括固定在孔表面上的捕获寡核苷酸。捕获寡核苷酸包含与适体的核酸序列互补的序列。检测分子140,例如链霉亲和素缀合的酶如HRP,被捕获在适体上(当适体被生物素化时),从而允许用酶底物(例如TMB)进行检测。
图4的下半部分说明了样品中不存在靶分子时的ELONA测定。通过与固定化寡核苷酸中的互补序列杂交,将选择的适体固定在测定孔上(适体进而固定在第一容器的表面上)。样品中加入非靶分子对保持固定在固定化寡核苷酸上的适体没有影响。将测定样品转移到另一容器中,并且在捕获寡核苷酸上没有捕获到适体。链霉亲和素缀合的酶(例如HRP)未被捕获,因此用酶底物(例如TMB)未检测到信号。
在另一个具体的实施方案中,固体支持物和适体形成微阵列或所谓的“DNA或RNA适体芯片”,其可以是单通道或多通道的。在微阵列中,可将一个或多个适体以及用于基本信号补偿的参考材料布置在几个阵列形状的测量点上。在多通道芯片中,这种布置发生在各个通道中。因此,可以进行样品的平行多重测量,或使用不同的适体对样品中的不同分析物进行平行测量。
在另一方面,本发明还涉及包含根据本发明的某些实施方案的适体的试剂盒。
适当地,试剂盒包含适体,例如根据本发明的某些实施方案的标记适体或适体探针,以及试剂盒或方法预期进行的反应的其它组分,例如用于富集、分离和/或隔离程序的预期检测的组分。实例是缓冲溶液、用于显色反应的底物、染料或酶底物。在试剂盒中,适体可以以多种形式提供,例如冻干或在液体介质中。
实施例
在下文中,将通过特定实施方案的非限制性实例来更详细地解释本发明。在实施例实验中,使用无污染的标准试剂和缓冲液。
实施例1:生物传感器测定(使用生物层干涉测量法-BLI检测小分子的基于适体的测定)
寡核苷酸和适体
使用对化疗药物伊马替尼具有特异性的核酸分子(DNA适体)进行测定。适体A的长度为100个核苷酸,并包含5'FAM(荧光素)标记。适体A的核苷酸序列如下所示:
适体在使用前经HPLC纯化,由比利时IDT制造。对于该测定,适体通过包含5'生物素标记和内部HEGL间隔物ISP18的生物素化固定化寡核苷酸固定在链霉亲和素包被的传感器探针上。固定化寡核苷酸在使用前经HPLC纯化,也由比利时IDT制造。固定化寡核苷酸含有12个核苷酸的限定区域(GATCGAGCCTCA,SEQ ID NO:2),其与使两个分子之间杂交的适体区域(以斜体显示)反向互补。此外,固定化寡核苷酸携带经由六甘醇(HEGL)残基结合的5'生物素,该残基负责将固定化寡核苷酸偶联至链霉亲和素修饰的磁珠。
为了再捕获适体-靶标复合物,使用了两种不同的捕获寡核苷酸:寡核苷酸revFOR和REV。两种捕获寡核苷酸均含有19个核苷酸的限定区域,其分别与适体的第一个和最后一个区域互补,并能够使适体和捕获寡核苷酸之间杂交。revFOR的长度为19个核苷酸,并包含5'生物素标记。捕获寡核苷酸在使用前经HPLC纯化,并由比利时IDT制造。REV的长度为19个核苷酸,并包含3'生物素标记。捕获寡核苷酸在使用前经HPLC纯化,并由比利时IDT制造。捕获寡核苷酸的核苷酸序列如下所示:
revFOR-5’-GGAGAAAAAGAGCGTGGAT-3’(SEQ ID NO:3)
REV-5’-CCTATGTCACCCTCAATGC-3'(SEQ ID NO:4)。
缓冲液,靶标
缓冲液BB(20mM Tris-HCl pH 7.6、100mM NaCl、5mM KCl、2mM MgCl
生物层干涉测量法(BLI)测量
BLI是用于测量生物分子相互作用的无标记技术。其是一种光学分析技术,用于分析从两个表面反射的白光的干涉图案的变化:生物传感器尖端上的固定配体层和内部参考层。结合到生物传感器尖端的分子数量的任何变化都会引起可实时测量的干涉图案移位。只有与生物传感器结合或从生物传感器解离的分子能够使干涉图案移位并在BLI传感器上产生响应曲线。未结合的分子、周围介质的折射率变化或流速的变化均不会影响干涉图案。置换选择原理提供了基于所选适体的固定序列和固定化寡核苷酸之间的双链体形成来开发检测测定的可能性。靶标依赖性构象变化导致适体从双链体结构释放。从杂交双链体到适体的置换阶段的这种转换可用于产生可记录的信号。使用BLItz或Octet QK仪器(ForteBio,Pall Life Sciences,USA)进行文中描述的实验。
通过BLI的适体置换测定
为了将适体固定在生物传感器探针上(Streptavidin-SA Dip&Read Biosensors,ForteBio,Pall Life Sciences,USA),将1.5μM适体和1μM固定化寡核苷酸在缓冲液BB中预杂交,方法是将混合物加热至95℃,持续10分钟,然后立即冷却至4℃,持续5分钟,然后以1:1的比率与2×B&W缓冲液混合。将链霉亲和素包被的探针与该预杂交混合物一起孵育5分钟。用缓冲液PBS6进行三个洗涤步骤(30秒、120秒、30秒)以除去松散固定的DNA材料。然后将探针与靶溶液(20μM,在PBS6中)孵育5分钟。靶标结合导致适体置换,这被视为信号减少。回收洗脱的适体-靶标复合物,用于‘再捕获测定’中的后续步骤。
通过BLI测定适体-靶标复合物的再捕获
通过将链霉亲和素包被的探针分别与寡核苷酸revFOR和REV(1μM,在缓冲液B&W中)孵育3分钟,将生物素化的捕获寡核苷酸‘revFOR’和‘REV’固定在单独的生物传感器探针上。用缓冲液PBS6进行三个洗涤步骤(30秒、60秒、30秒)以除去松散固定的寡核苷酸材料。然后将探针与获自适体置换测定(见上文)的靶标洗脱材料(适体-靶标复合物)一起孵育5分钟。当适体-靶标复合物再捕获在固定的捕获寡核苷酸上时,记录阳性反应。
实例2:使用适体检测不同基质/底物中的小分子的基于微量滴定板的荧光测定(ELISA样测定)
寡核苷酸和适体:
使用对抗生素莫西沙星具有特异性的核酸分子(DNA适体)进行测定。
适体包含与上述伊马替尼适体相同的第一和第二引物位点,并用于扩增适体,还用于再捕获置换的适体。适体还包括能够结合至少一部分固定序列的核酸序列。
固定化寡核苷酸(与适体的一部分互补)包含5'生物素标记和内部HEGL间隔物ISP18。固定化寡核苷酸在使用前经HPLC纯化,并也由比利时IDT制造。对于该测定,将适体通过固定化寡核苷酸固定在链霉亲和素包被的微量滴定板(MTP)上。固定化寡核苷酸含有12个核苷酸的限定区域(GATCGAGCCTCA,SEQ ID NO:2),其与使两个分子之间杂交的适体区域互补。此外,固定化寡核苷酸携带经由六甘醇(HEGL)残基结合的5'生物素,该残基负责将固定化寡核苷酸偶联至链霉亲和素修饰的MTP。为了再捕获适体-靶标复合物,使用捕获寡核苷酸revFOR。捕获寡核苷酸含有19个核苷酸的限定区域(SEQ ID NO:3),其与适体的第一个区域互补,并能够使适体和捕获寡核苷酸之间杂交(revFOR的长度为19个核苷酸,并包含5'生物素标记。捕获寡核苷酸在使用前经HPLC纯化,并由比利时IDT制造)。在可选的实施方案中,捕获寡核苷酸包含SEQ ID NO:4所示的序列。
缓冲液、靶标、基质/底物
缓冲液BB(20mM Tris-HCl pH 7.6、100mM NaCl,2mM MgCl
荧光测量
掺入适体中的荧光标记允许在该方法的不同步骤之后通过荧光读板仪测定对适体DNA进行定量。
荧光素(FAM)标记的DNA的荧光测量在BMG荧光读板仪(FLUOstar OPTIMA,BMG,UK)中使用以下测量条件进行:激发485nm/发射520nm。
适体置换测定(基于微量滴定板的荧光测定)
为了将适体固定在链霉亲和素包被的MTP上(Pierce链霉亲和素包被,HBC,具有SuperBlock封闭缓冲液的黑色96孔板,Thermo Scientific,USA),将0.75μM适体和0.5μM固定化寡核苷酸在缓冲液BB中预杂交,方法是将混合物加热至95℃,持续10分钟,然后立即冷却至4℃,持续5分钟,然后以1:1的比率与2×B&W缓冲液混合。将微量滴定板MTP1与该预杂交混合物在室温下孵育1小时,同时在MTP振荡器(IKA Schüttler MTS 4,IKA Werke GmbH&Co.KG,德国)上以1000rpm振荡。通过分别比较孵育前后的荧光输入和输出来测定固定化效率。这允许通过荧光测量来计算负载的适体的近似量。
用缓冲液BB充分洗涤负载适体的板(MTP 1),以除去松散固定的DNA,然后在室温(在MTP振荡器上1000rpm)下与在4种不同基质(血浆、牛奶、河水和模拟尿液)中以4种浓度(在缓冲液BB中的0%、10%、25%和40%v/v基质)制备的靶抗生素的梯度(200μM、40μM、8μM、1.6μM、0.32μM、0μM)一起孵育1h。回收靶标-洗脱材料(来自MTP 1),并通过荧光测量测定靶标-结合适体的含量。
结果
血浆和牛奶的校正数据显示出良好的抗生素浓度依赖性反应。还观察到在较高的基质浓度下潜在非特异性结合的元素。这不会影响测定或数据的有效性,但表明如果该测定用于准确定量这些基质中的残留物,则需要正确的校准标准。数据还表明,对于不同浓度的河水,几乎没有信号差异;表明河水对测定完全没有影响。模拟尿液的校正数据确实显示了抗生素依赖性信号增加,但信号随样品浓度的增加而降低。如果制备了正确的校准标准,这不会影响测定的有效性。
适体-靶标复合物的再捕获(基于微量滴定板的荧光测定)
通过在室温下与0.5μ.捕获寡核苷酸revFOR的固定化缓冲液一起孵育1小时,同时在MTP振荡器上以1000rpm振荡,将生物素化的捕获寡核苷酸'revFOR'固定在链霉亲和素包被的MTP 2表面上。用缓冲液BB充分洗涤负载捕获寡核苷酸的板(MTP 2),以除去松散固定的DNA。在适体置换测定(见上文)后,将来自MTP1的靶标-洗脱材料转移至MTP2(用捕获寡核苷酸固定),并在室温下孵育1小时,同时在MTP振荡器上以1000rpm振荡。从MTP2除去未捕获的材料,并通过荧光测量测定再捕获适体的含量(在洗涤以除去释放的适体和任何剩余的基质后)。
结果
数据显示,按照与输入物质相同的靶标浓度依赖性趋势,在每种基质中再捕获适体。在血浆和牛奶中,可以看到清晰的基质浓度效应。在较高基质浓度下以较低含量再捕获适体。这不影响测定或数据的有效性,只是表明,如果该测定用于准确定量这些基质中的残留物,则需要正确的校准标准曲线。
实例3-浓度依赖性再捕获测定
如上所述,使用生物素标记的莫西沙星适体(1500pmol)和再捕获寡核苷酸(revFOR或REV,3400pmol)进行测定。
在步骤1中,通过首先向每个孔中加入200μL 1×缓冲液B&W,将再捕获寡核苷酸固定在96孔板上。然后将生物素化的寡核苷酸混合物的连续稀释液(340ul 5בB&W’缓冲液,3400pmol生物素标记的寡核苷酸(正向或反向),加水至1700ul)加入孔中,并将板在定轨振荡器(1000rpm,室温,1小时)上孵育。
在步骤2中,在BB缓冲液中,在pH 6.8或pH 7.4下,在96孔板中制备适体梯度,并测定输入荧光。将步骤(1)的板在合适的pH(6.8或7.4)下在3×200ul的1×BB中洗涤。将来自步骤(2)的板的每个孔的100ul混合物添加到步骤(3)的洗涤板的相应孔中,并将该板在定轨振荡器上孵育(1000rpm,室温,1小时)。
回收步骤(4)的板,并将100ul未结合材料转移至新鲜的96孔板上,并使用BMG读板仪测量“未结合”材料的荧光。用3×200ul冰冷的1×BB缓冲液(pH 6.8,孵育2分钟)洗涤步骤(4)的板,并测定残留在板表面上的材料的荧光。
结果
绘制数据以证明增加预固定的生物素化寡核苷酸对结合的适体含量(荧光)的影响。图8显示固定的正向和反向寡核苷酸都能够分别通过5'端或3'端捕获FAM标记的适体。图8还显示了杂交缓冲液的pH影响很小。每个图还显示板达到‘饱和点’。例如,当加入50pmol FAM标记的适体时,发现负载增加到50pmol生物素化的寡核苷酸。在此之上,没有其它适体被结合。2pmol的输入适体不足以看到趋势。
还绘制了数据以证明增加适体输入量对结合的适体量(荧光)的影响。同样,结果表明固定的正向和反向寡核苷酸都能够捕获FAM标记的适体(图7)。他们还表明,杂交缓冲液的pH影响很小。每个图还显示增加适体输入导致信号增加(并因此结合)。同样,数据集之间的比较表明板达到了‘饱和点’。在每组的最高点最清楚地看到这一点(50pmol输入),其中在约50pmol固定的寡核苷酸下清楚地看到饱和。
·在pH6.8和pH7.4的选择缓冲液(用于小分子选择的最常用缓冲液)中可再捕获适体。
·当每孔使用50pmol生物素化的捕获寡核苷酸时,再捕获是浓度依赖性的且呈线性。
·如果需要,可以进行其他优化以改善负载。
实例4-置换和再捕获测定
将置换和再捕获测定相结合,以在单一测定中证明两种组分。在该实验中,将适体与固定化寡核苷酸杂交并固定在微量滴定板表面(板A)上。然后将适体从第一板(A)置换出来,然后再捕获在用生物素化的‘捕获寡核苷酸’预固定的第二板(B)上。在各种常见基质(血浆、河水、牛奶和尿液)中测试相同适体和靶标,以证明该平台的通用性。
结果
在该测定中,定量保留在板上的荧光标记的适体的含量(在靶标诱导置换后),并相对于靶标浓度作图(图11)。数据显示,来自第一板(A)的荧光信号具有明显的靶浓度依赖性损失,表明适体已被靶标置换(在每种不同基质中)。
然后将置换的适体再捕获在用生物素化的‘捕获寡核苷酸’预固定的第二板(B)上。同样,对于每种基质,都可以看到信号的浓度依赖性增加,这表明基质不会干扰再捕获。
结论
·适体置换显示了几种不同基质中的浓度依赖性反应。
·置换的适体可随后被再捕获在用生物素化的‘捕获寡核苷酸’预固定的第二ELISA板上。
·基质(血浆等)或靶分子的存在不会干扰再捕获。
在本说明的整个说明书和权利要求书中,词语“包括”和“含有”及其变型意指“包括但不限于”,并且不旨在(并且不)排除其他部分、添加物、组分、整数或步骤。在本说明的整个说明书和权利要求书中,单数涵盖复数,除非上下文另有要求。特别地,在使用不定冠词的情况下,说明书应理解为涵盖复数以及单数,除非上下文另有要求。
结合本发明的特定方面,实施方案或实施例描述的特征、整数、特性或群组应理解为适用于本文描述的任何其它方面、实施方案或实施例,除非与其不相容。本说明书(包括任何所附权利要求、摘要和附图)中公开的所有特征和/或如公开的任何方法或过程的所有步骤可以以任何组合进行组合,除了至少一些特征和/或步骤相互排斥的组合。本发明不受限于任何前述实施方案的任何细节。本发明扩展到本说明书(包括任何所附权利要求、摘要和附图)中公开的特征的任何新颖特征或新颖组合,或者扩展到所公开的任何方法或过程的步骤的任何新颖步骤或任何新颖组合。
读者的注意力应集中于与本申请相关且与本说明书同时提交或在本说明书之前提交的并且与本说明书一起向公众公开的所有论文和文献,并且所有这些论文和文献的内容通过引用并入本文。
序列表
<110> 适体诊断有限公司
<120> 基于核酸的检测方法
<130> P03133OWO
<150> GB 1813789.3
<151> 2018-08-23
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 100
<212> DNA
<213> 人工序列
<220>
<223> 适体 A
<400> 1
atccacgctc tttttctccc cccgctatgt gaggctcgat cgttcggtgt gtttttaaag 60
ggtacagatc ctgggcgggg ggcattgagg gtgacatagg 100
<210> 2
<211> 12
<212> DNA
<213> 人工序列
<220>
<223> 固定化寡核苷酸
<400> 2
gatcgagcct ca 12
<210> 3
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 捕捉寡核苷酸 (revFOR)
<400> 3
ggagaaaaag agcgtggat 19
<210> 4
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 捕捉寡核苷酸 (REV)
<400> 4
cctatgtcac cctcaatgc 19
- 一种基于短链核酸探针和双链特异性核酸内切酶的高特异性microRNA荧光检测方法
- 一种基于核酸适配体耦合球型核酸的邻苯二甲酸二(2-乙基)己酯的荧光检测方法
