药物组合物、培养基和诱导肿瘤细胞成脂分化的方法
文献发布时间:2023-06-19 18:29:06
技术领域
本发明涉及细胞诱导技术领域,具体涉及一种药物组合物、培养基和诱导肿瘤细胞成脂分化的方法。
背景技术
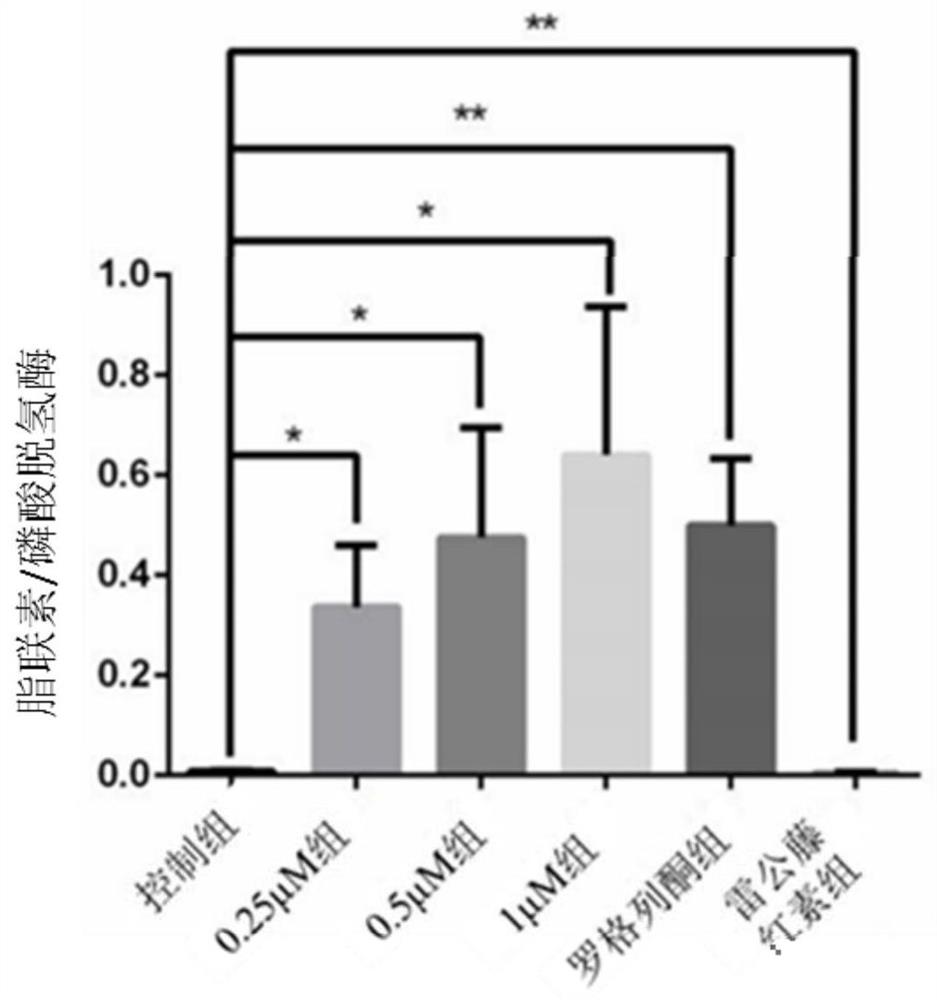
肾癌(renal cell carcinoma,RCC)患者多伴随转移,有20%-30%的患者初次就诊时已为转移性肾癌,同时超过20%的肾癌患者在接受手术后发生转移,预后不良且对放射治疗和化学治疗均不敏感,而这一特性与肿瘤细胞可塑性(cancer cell plasticity)密切相关。肿瘤细胞可塑性是指肿瘤细胞对外界信号触发的动态变化的适应能力,并常常伴随着细胞干性及分化潜能增强。近期研究表明,肿瘤细胞可塑性在肿瘤细胞生存、侵袭和转移过程中发挥关键作用,并通过激活去分化进程介导肿瘤细胞逃避化疗和靶向治疗。因而,一方面,我们可以通过降低肿瘤细胞可塑性,抑制肿瘤细胞侵袭转移能力;另一方面,利用肿瘤细胞高可塑性的特点,进一步定向诱导肿瘤细胞分化将其转化为正常细胞将为肾癌治疗提供新的治疗思路。《cancer cell》及《cancer research》于今年报道在细胞水平和动物水平上成功诱导乳腺肿瘤细胞转化为脂肪细胞,而该分化疗法还显著降低了乳腺肿瘤细胞的侵袭转移能力。
在过去的十年,基于实体瘤的分化诱导模型已经成功建立,提供了分化疗法用于治疗各种实体瘤的理论基础,以及相应重新激活的分化途径靶点的鉴定。截止目前,已报导包括类维A酸(Retinoids),组蛋白脱乙酰基酶抑制剂(HDACI)等多种药物可诱导实体瘤细胞分化。在常规方法(例如常规细胞毒剂,靶向抗体或小分子抑制剂)不足以有效治愈大部分癌症患者的今天,以诱导肾肿瘤细胞转分化为基础的肿瘤治疗方案具有广阔前景。
已有研究表明,来自天然产物中的大黄属的芦荟蒽醌和蛇麻草衍生的异戊二烯类黄酮可用于血液类癌症的治疗,并通过诱导高恶性级别肿瘤组织中肿瘤细胞的分化/转分化过程将其部分转化为正常细胞,进而限制肿瘤进展并增强对化疗药物敏感性。雷公藤(Tripterygium wilfordii Hook.f.)为卫矛科雷公藤的干燥根及根茎,气特异、味苦,有大毒,其功效为祛风除湿,活血通络,消肿止痛,解毒,杀虫。雷公藤红素又名南蛇藤素,分子式为C
目前关于成脂分化的研究主要集中于以间充质前脂肪细胞系3T3-L1诱导构建成熟脂肪细胞模型,而关于肿瘤细胞成脂分化的研究则多集中于以3T3-L1细胞成脂方案为基础进行的方案筛选与优化。传统成脂诱导方案包括——鸡尾酒法、罗格列酮(ROSI)法。以上两种成脂诱导方案均为包含三个阶段:诱导期(2day)、分化期(2day)、分化维持期(4day)。其中,鸡尾酒法与ROSI法两种诱导方案的主要差异在于,ROSI法采用了效果更为确切的过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptorγ,PPAR-γ)激动剂ROSI,替代了鸡尾酒法中用于启动细胞成脂分化的3-异丁基-1-甲基黄嘌呤(3-ISOBUTYL-1-METHYLXANTHINE,IBMX)(有研究报导,IBMX可上调3T3-L1细胞系内PPAR-γ表达)。而PPAR-γ在细胞成脂分化过程中充当主转录激活因子。有研究表明,在完全敲除细胞内PPAR-γ的情况下,其他成脂诱导因素刺激均无法诱导脂肪细胞分化。
而我们的前期研究结果表明,传统成脂诱导方案仅是针对3T3细胞系,应用于其它肿瘤细胞时,其介导细胞内脂质蓄积增加效果并不明显。而且,传统成脂诱导方案诱导周期复杂,时间漫长等特点也严重影响了后续研究的进行及可能的临床应用。
发明内容
本发明所要解决的技术问题是提供一种药物组合物、培养基和诱导肿瘤细胞成脂分化的方法,该药物组合物诱导时间快且肿瘤细胞的成脂率更高。
为了实现上述目的,本发明第一方面提供一种用于诱导肿瘤细胞成脂分化的药物组合物,含有雷公藤红素、地塞米松和胰岛素,所述雷公藤红素、所述胰岛素和所述地塞米松的摩尔比为0.25-1:0.8-1:1。
优选地,所述雷公藤红素、所述胰岛素和所述地塞米松的摩尔比为0.5-1:0.8-1:1。
第二方面,本发明提供一种用于诱导肿瘤细胞成脂分化的培养基,该培养基含有上述第一方面所述的用于诱导肿瘤细胞成脂分化的药物组合物,且所述雷公藤红素的浓度为0.25-1μΜ。
第三方面,本发明提供一种诱导肿瘤细胞成脂分化的方法,包括如下步骤:
(1)提供含有诱导剂的培养基;
体外培养肿瘤细胞,进行接触抑制;
(2)在所述肿瘤细胞中加入所述含有诱导剂的培养基进行诱导;
其中,所述含有诱导剂的培养基为上述第二方面所述的用于诱导肿瘤细胞成脂分化的培养基。
优选地,在步骤(1)中,所述含有诱导剂的培养基的制备方法包括:提供雷公藤红素二甲基亚砜溶液以及地塞米松乙醇溶液,将所述雷公藤红素二甲基亚砜溶液、所述地塞米松乙醇溶液、胰岛素和基础培养基混合。
优选地,所述基础培养基为RPMI-1640培养基。
优选地,在步骤(1)中,所述接触抑制的时间为24-72h。
优选地,在步骤(2)中,所述诱导的时间为5-10天。
优选地,所述诱导的条件至少满足:所述诱导的次数为3-8次。
优选地,所述肿瘤细胞为人肾肿瘤细胞。
通过上述技术方案,本发明的有益效果为:
通过采用含有本发明的药物组合物的培养基,雷公藤红素、地塞米松和胰岛素三者配合,能够有效提高肿瘤细胞的成脂率(即肿瘤细胞成脂分化的转化率),而且也能够有效降低肿瘤细胞成脂分化时间。
附图说明
图1是实施例1-3和对比例1-3提供的方法诱导结束后经油红O染色后的显微镜图;
图2是实施例1-3和对比例1-3提供的方法诱导结束后的氟硼二吡咯(BODIPY)荧光标记图;
图3是实施例1-3和对比例1-3提供的方法诱导结束后经BODIPY荧光标记后的荧光强度统计图;
图4是实施例1-3和对比例1-3提供的方法诱导结束后经蛋白质免疫印迹后的脂联素蛋白(Adiponectin,APN)表达图;
图5是实施例1-3和对比例1-3提供的方法诱导结束后经蛋白质免疫印迹后的脂联素蛋白表达统计图;
图6是实施例1-3和对比例1-3提供的方法诱导结束后经蛋白质免疫印迹后的PPAR-γ蛋白表达图;
图7是实施例1-3和对比例1-3提供的方法诱导结束后经蛋白质免疫印迹后的PPAR-γ蛋白表达统计图;
图8是实施例1-3和对比例1-3提供的方法诱导并经动物体内种瘤,肿瘤组织冷冻切片经油红O染色后的显微镜图;
图9是实施例1-3和对比例1-3提供的方法诱导得到的细胞经动物体内种瘤,肿瘤组织石蜡切片经HE染色后的显微镜图;
图10是实施例1-3和对比例1-3提供的方法诱导得到的细胞经动物体内种瘤,肿瘤组织经蛋白质免疫印迹后的脂联素蛋白表达图;
图11是实施例1-3和对比例1-3提供的方法诱导得到的细胞经动物体内种瘤,肿瘤组织经蛋白质免疫印迹后的脂联素蛋白表达统计图;
图12是实施例1-3和对比例1-3提供的方法诱导得到的细胞经动物体内种瘤,肿瘤组织经蛋白质免疫印迹后的PPAR-γ蛋白表达图;
图13是实施例1-3和对比例1-3提供的方法诱导得到的细胞经动物体内种瘤,肿瘤组织经蛋白质免疫印迹后的PPAR-γ蛋白表达统计图;
其中,控制组对应对比例3,0.25μM组对应实施例3,0.5μM组对应实施例2,1μM组组对应实施例1,罗格列酮组对应对比例1,雷公藤红素组对应对比例2。
具体实施方式
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
本发明提供一种用于诱导肿瘤细胞成脂分化的药物组合物,含有雷公藤红素、地塞米松和胰岛素,所述雷公藤红素、所述胰岛素和所述地塞米松的摩尔比为0.25-1:0.8-1:1。
发明人在研究过程中发现,将雷公藤红素、地塞米松和胰岛素三者配合得到的诱导剂,在使用过程中,本发明保护范围内的雷公藤红素、地塞米松和胰岛素相互作用,能够有效提高肿瘤细胞的成脂率,而且也能够有效降低肿瘤细胞成脂分化时间。
为了进一步提高肿瘤细胞成脂分化的转化率,优选地,所述雷公藤红素、所述胰岛素和所述地塞米松的摩尔比为0.5-1:0.8-1:1。
为了更进一步提高肿瘤细胞成脂分化的转化率,优选地,所述雷公藤红素、所述胰岛素和所述地塞米松的摩尔比为0.5-1:0.9:1。
此外,本发明还提供一种用于诱导肿瘤细胞成脂分化的培养基,该培养基含有雷公藤红素、地塞米松和胰岛素,所述雷公藤红素、所述胰岛素和所述地塞米松的摩尔比为0.25-1:0.8-1:1,且所述雷公藤红素的浓度为0.25-1μΜ。
具体地,该用于诱导肿瘤细胞成脂分化的培养基可以是上述用于诱导肿瘤细胞成脂分化的药物组合物和基础培养基的混合物,其中,基础培养基可以是现有技术中任意一种能够用于培养细胞的培养基。如RPMI-1640培养基、DMEM培养基等。
药物组合物中的三个组分可以以任意一种可行的方式分散于基础培养基中。
发明人在研究过程中发现,采用含有上述浓度的药物组合物的培养基,能够促进在培养过程中雷公藤红素、地塞米松和胰岛素三者对肿瘤细胞的诱导成脂分化作用,进而有效提高肿瘤细胞的成脂率以及降低肿瘤细胞成脂分化时间。
为了进一步提高肿瘤细胞成脂分化的转化率,优选地,所述雷公藤红素、所述胰岛素和所述地塞米松的摩尔比为0.5-1:0.8-1:1。
为了更进一步提高肿瘤细胞成脂分化的转化率,优选地,所述雷公藤红素、所述胰岛素和所述地塞米松的摩尔比为0.5-1:0.9:1。
为了进一步提高肿瘤细胞成脂分化的转化率,优选地,所述雷公藤红素的浓度为0.5-1μΜ。
本发明还提供一种诱导肿瘤细胞成脂分化的方法,包括如下步骤:
(1)提供含有诱导剂的培养基;
体外培养肿瘤细胞,进行接触抑制;
(2)在所述肿瘤细胞中加入所述含有诱导剂的培养基进行诱导;
其中,所述含有诱导剂的培养基含有雷公藤红素、地塞米松和胰岛素,0.25-1:0.8-1:1,且所述雷公藤红素的浓度为0.25-1μΜ。
具体地,含有诱导剂的培养基的配置方法可以是先按照比例配置好诱导剂,然后将诱导剂溶解于基础培养基中,也可以是分别将诱导剂的各个成分溶解于基础培养基内。体外培养肿瘤细胞的方法可以是现有技术中公开的任意一种体外培养肿瘤细胞的方式,可以在任意能够实现体外细胞培养的基础培养基中。在本发明的一个具体实施方式中,肿瘤细胞采用人肾肿瘤细胞,该细胞的体外培养方法为:将人肾肿瘤细胞在含有10%胎牛血清、100单位/ml青霉素、0.1mg/L链霉素的RPMI-1640培养基,并在含5%CO
在肿瘤细胞中加入含有诱导剂的培养基的方式是:在含有肿瘤细胞的培养皿中缓慢注入含有诱导剂的培养基。所述含有诱导剂的培养基的注入次数和每次的注入量可以是本领域技术人员根据实际情况确定。
所述方法还包括在步骤(2)前,用磷酸缓冲液对接触抑制后的肿瘤细胞进行洗涤。磷酸缓冲溶液的浓度可以是本领域技术人员根据实际情况确定。
为了进一步提高肿瘤细胞成脂分化的转化率,优选地,所述雷公藤红素、所述地塞米松和所述胰岛素的摩尔比为0.5-1:0.8-1:1。
为了更进一步提高肿瘤细胞成脂分化的转化率,优选地,所述雷公藤红素、所述胰岛素和所述地塞米松的摩尔比为0.5-1:0.9:1。
为了进一步提高肿瘤细胞成脂分化的转化率,优选地,所述雷公藤红素的浓度为0.5-1μΜ。
优选地,在步骤(1)中,所述含有诱导剂的培养基的制备方法包括:提供雷公藤红素二甲基亚砜溶液以及地塞米松乙醇溶液,将所述雷公藤红素二甲基亚砜溶液、所述地塞米松乙醇溶液、胰岛素和基础培养基混合。先提供雷公藤红素二甲基亚砜溶液以及地塞米松乙醇溶液,然后再将雷公藤红素二甲基亚砜溶液、地塞米松乙醇溶液、胰岛素和基础培养基混合,能够提高雷公藤红素和地塞米松在基础培养基中分散效果,进而提高肿瘤细胞的成脂率以及降低肿瘤细胞成脂分化时间。
雷公藤红素二甲基亚砜溶液以及地塞米松乙醇溶液的浓度可以是本领域技术人员根据实际情况确定,在本发明的一个具体实施方式中,雷公藤红素二甲基亚砜溶液的浓度为0.25-1mM,地塞米松乙醇溶液的浓度为0.8-1.2mM。在不使用过程中,雷公藤红素二甲基亚砜溶液和地塞米松乙醇溶液避光保存在-20℃冰箱内,且含有诱导剂的培养基溶液为现配现用。
所述基础培养基可以是现有技术中公开的能够用于细胞培养的培养基。优选地,所述基础培养基为RPMI-1640培养基。本发明的发明人研究过程中发现,采用RPMI-1640培养基作为基础培养基,能够进一步提高肿瘤细胞的成脂率以及进一步降低肿瘤细胞成脂分化时间。
根据本发明,优选地,在步骤(1)中,所述接触抑制的时间为24-72h。
为了能够进一步提高肿瘤细胞的成脂率以及进一步降低肿瘤细胞成脂分化时间,优选地,在步骤(2)中,所述诱导的时间为5-10天。
为了能够进一步提高肿瘤细胞的成脂率以及进一步降低肿瘤细胞成脂分化时间,优选地,所述诱导的条件至少满足:所述诱导的次数为3-8次。
具体地,每次诱导过程中添加的含有诱导剂的培养基的使用量可以本领域技术人员根据培养皿的型号确定。作为本发明的一个具体实施方式,所述含有诱导剂的培养基的使用量为2-10mL。
所述肿瘤细胞可以是现有技术中公开的任意一种肿瘤细胞,如乳腺肿瘤细胞、胃肿瘤细胞等。优选地,所述肿瘤细胞为人肾肿瘤细胞。进一步优选地,所述肿瘤细胞为人肾肿瘤细胞786-O细胞株。发明人在研究过程中发现,将本发明提供的药物组合物以及培养基使用在人肾肿瘤细胞786-O细胞株上,其成脂转化率更高。
以下讲通过实施例对本发明进行详细描述。以下实施例中,
RPMI 1640培养基购于Gibco公司,产品编号为C11875500BT;胎牛血清(FBS)购于Gibco公司,产品编号为2232580;青霉素-链霉素双抗购于Hyclone公司,产品编号为SV30010;雷公藤红素购于Sigma公司,产品编号为34157830;地塞米松购于Sigma公司,产品编号为D4902;胰岛素购于万邦制药有限公司,产品编号为H32020614;二甲基亚砜购于Sigma-Aldrich公司,产品编号为D5879-500ML;无水乙醇购于国药集团;脂联素检测抗体购买于Proteintech,产品编号为21613-1-AP;PPAR-γ检测抗体购买于Proteintech,产品编号为16643-1-AP;油红O染色试剂盒(细胞专用,包括油红固定液、O Stain A、ORO Stain B和Mayer苏木素染色液)购于Solarbio公司,产品编号为G1262-4×50ml;改良油红O染色试剂盒(包括油红固定液、O Stain A、ORO Stain B和Mayer苏木素染色液)购于Solarbio公司,产品编号为G1261-2×100ml;苏木精购于Sigma-Aldrich公司,产品编号为51275;异丙醇购于MACKLIN公司,产品编号为C11520041;氟硼二吡咯(BODIPY)染色液购于GlpBio公司,产品编号为GC42964;胰酶购于Hyclone公司,产品编号为SH30042.01;裂解缓冲液(RIPALysis Buffer)购于康为世纪公司,产品编号为CW2333S;磷酸酶抑制剂(phosphataseinhibitors)购于康为世纪公司,产品编号为CW2383S;蛋白酶抑制剂(proteaseinhibitor)购于康为世纪公司,产品编号为CW2200S;上样缓冲液(loading buffer)购于康为世纪公司,产品编号为CW0027S;10%福尔马林购于江苏维尔生物科技(Wellbioscience)有限公司,产品编号为WB03004A;DAB Kit购于北京中杉金桥生物技术有限公司,产品编号为ZLI-9018;BCA蛋白定量试剂盒(包括A液和B液)购于康为世纪,产品编号为CW0014S;增强化学发光液(Enhanced Chemiluminescent,ECL)购于源叶生物公司,产品编号为RP10200;预先染色的蛋白质阶梯(Prestained Protein Ladder)购于Thermo scientific公司;Tris-HCl缓冲盐溶液+吐温20(TBST)购于Solarbio,产品编号为T1081。雷公藤红素二甲基亚砜溶液为雷公藤红素溶于二甲基亚砜得到,地塞米松乙醇溶液为地塞米松溶解于乙醇得到。以下实施例、对比例和测试例中采用的水均为蒸馏水,磷酸缓冲溶液的浓度为0.1M,pH为7.4。
倒置荧光显微镜购于OLYMPUS公司,仪器型号为IX73;高速冷冻离心机购于Thermoscientific公司,仪器型号为Sorvall ST 8R;酶标仪购于Biotek公司,仪器型号为ELX800;全自动化学发光图像分析仪购于Tanon,仪器型号为5200;电泳槽购于Bio-RAD公司,仪器型号为Mini Trans-Blot;转印槽购于Bio-RAD公司,仪器型号为Mini PROTEAN;超低温冰箱购于赛默飞世尔科技(中国)有限公司,仪器型号为902;干式恒温器(干式恒温金属浴)购于上海比朗仪器制造有限公司,仪器型号为BL150-2。
实施例1
(1)提供雷公藤红素二甲基亚砜溶液(100mM)以及地塞米松乙醇溶液(1mM),将所述雷公藤红素二甲基亚砜溶液、所述地塞米松乙醇溶液、胰岛素和RPMI 1640培养基混合,得到含有诱导剂的培养基,其中,雷公藤红素的摩尔浓度为1μΜ,地塞米松的摩尔浓度为1μΜ,胰岛素的摩尔浓度为0.9μΜ;
将人肾肿瘤细胞786-O接种于100mm培养皿内,待细胞长满后,接触抑制2天,使细胞退出生长周期;
(2)使用磷酸缓冲液将接触抑制后的人肾肿瘤细胞786-O清洗两次,并向其中加入8mL的含有诱导剂的培养基,每间隔两天替换一次含有诱导剂的培养基(8mL),8天后结束诱导。
实施例2
(1)提供雷公藤红素二甲基亚砜溶液(100mM)以及地塞米松乙醇溶液(1mM),将所述雷公藤红素二甲基亚砜溶液、所述地塞米松乙醇溶液、胰岛素和RPMI 1640培养基混合,得到含有诱导剂的培养基,其中,雷公藤红素的摩尔浓度为0.5μΜ,地塞米松的摩尔浓度为1μΜ,胰岛素的摩尔浓度为0.9μΜ;
将人肾肿瘤细胞786-O接种于100mm培养皿内,待细胞长满后,接触抑制2天,使细胞退出生长周期;
(2)使用磷酸缓冲液将接触抑制后的人肾肿瘤细胞786-O清洗两次,并向其中加入8mL的含有诱导剂的培养基,每间隔两天替换一次含有诱导剂的培养基(8mL),8天后结束诱导。
实施例3
(1)提供雷公藤红素二甲基亚砜溶液(100mM)以及地塞米松乙醇溶液(1mM),将所述雷公藤红素二甲基亚砜溶液、所述地塞米松乙醇溶液、胰岛素和RPMI 1640培养基混合,得到含有诱导剂的培养基,其中,雷公藤红素的摩尔浓度为0.25μΜ,地塞米松的摩尔浓度为1μΜ,胰岛素的摩尔浓度为0.9μΜ;
将人肾肿瘤细胞786-O接种于100mm培养皿内,待细胞长满后,接触抑制2天,使细胞退出生长周期;
(2)使用磷酸缓冲液将接触抑制后的人肾肿瘤细胞786-O清洗两次,并向其中加入8mL的含有诱导剂的培养基,每间隔两天替换一次含有诱导剂的培养基(8mL),8天后结束诱导。
对比例1
(1)提供罗格列酮二甲基亚砜溶液(100mM)以及地塞米松乙醇溶液(1mM),将所述罗格列酮二甲基亚砜溶液、所述地塞米松乙醇溶液、胰岛素和RPMI 1640培养基混合,得到含有诱导剂的培养基,其中,罗格列酮的摩尔浓度为1μΜ,地塞米松的摩尔浓度为1μΜ,胰岛素的摩尔浓度为0.9μΜ;
将人肾肿瘤细胞786-O接种于100mm培养皿内,待细胞长满后,接触抑制2天,使细胞退出生长周期;
(2)使用磷酸缓冲液将接触抑制后的人肾肿瘤细胞786-O清洗两次,并向其中加入8mL的含有诱导剂的培养基,每间隔两天替换一次含有诱导剂的培养基(8mL),8天后结束诱导。
对比例2
(1)提供雷公藤红素二甲基亚砜溶液(100mM),将所述雷公藤红素二甲基亚砜溶液和RPMI 1640培养基混合,得到含有诱导剂的培养基,其中,雷公藤红素的摩尔浓度为1μΜ;
将人肾肿瘤细胞786-O接种于100mm培养皿内,待细胞长满后,接触抑制2天,使细胞退出生长周期;
(2)使用磷酸缓冲液将接触抑制后的人肾肿瘤细胞786-O清洗两次,并向其中加入8mL的含有诱导剂的培养基,每间隔两天替换一次含有诱导剂的培养基(8mL),8天后结束诱导。
对比例3
(1)提供RPMI 1640培养基;
将人肾肿瘤细胞786-O接种于100mm培养皿内,待细胞长满后,接触抑制2天,使细胞退出生长周期;
(2)使用磷酸缓冲液将接触抑制后的人肾肿瘤细胞786-O清洗两次,并向其中加入8mL的培养基,每间隔两天替换一次培养基(8mL),8天后结束诱导。
测试例1
然后通过油红O染色、BODIPY荧光标记及蛋白质免疫印迹方法检测检测成脂诱导剂对786-O成脂分化的影响,具体操作步骤如下:
I、油红O染色
(1)上述实施例1-3和对比例1-3中得到的细胞分别用PBS洗3次,进而加入油红O固定液(ORO Fixative),固定孔内细胞20-30min。
(2)细胞固定完全后,弃去固定液,采用移液枪吸取水洗涤2次,采用60(体积)%异丙醇-水溶剂浸洗各孔5min。
(3)按照O Stain A:ORO Stain B=3:2比例配置油红O染液,染液均匀混匀后于37℃水浴锅中隔水加热10min,加热后进一步过滤杂质收集得到油红O染液,弃去60%异丙醇-水溶剂后加入油红O染液浸染10-20min。
(4)采用移液枪吸走染色后孔内剩余溶液染色液,每个孔内加入1mL水,洗涤至孔内无红色剩余。
(5)加入Mayer苏木素染色液,复染核1-2min,弃去染液后水洗2-4次。
(6)弃去孔内液体后,加入水覆盖细胞于倒置荧光显微镜下观察,结果如图1所示。
从图1中可以看出,本发明提供的药物组合物可增加786-O细胞内脂质蓄积,油红O染色能够将细胞中的脂质染成红色(图1中深色部分为红色),即红色越多,细胞内脂质蓄积越多。
II、BODIPY荧光标记
上述实施例1-3和对比例1-3中得到的细胞分别用PBS洗涤3次,每皿加入采用RPMI-1640培养基溶解后浓度为5μM的BODIPY染色液,于细胞培养箱中孵育过夜。弃去染色液,采用移液枪吸取PBS洗涤细胞3次。通过显微镜观察,结果如图2所示。
从图2和图3中可以看出,成脂诱导剂可增加786-O细胞内脂质蓄积,BODIPY荧光标记能够将细胞内的脂质标记为绿色荧光(图2中浅色部分为绿色荧光区域),即荧光强度越大,细胞内脂质蓄积越多。
III、蛋白质免疫印迹
(1)上述实施例1-3和对比例1-3中得到的细胞分别用PBS洗涤2次,洗涤后细胞加入2ml胰酶进行消化处理,终止消化后均匀吹打培养皿,确保消化完全。
(2)吸取细胞悬液进行离心(1000rpm,3min),第一次离心后弃去液体,加入新的PBS吹打均匀后进行二次离心。
(3)弃去离心管中PBS后,加入70μL蛋白裂解液(RIPA Lysis Buffer:phosphataseinhibitors:protease inhibitor=100:1:1),将相应体积蛋白裂解液与待测组细胞团块充分打散后,置于冰盒中进行裂解30min。
(4)裂解结束后,高速冷冻离心机中在预冷4℃条件下,12000rpm离心30min。吸取上清液。
(5)以A液:B液=50:1比例,制备BCA蛋白定量试剂。
(6)取96孔板,每组待测组设置三组复孔,同时设置相应空白孔;待测组加入2.5μL待测蛋白样本,22.5μL PBS以及BAC定量工作液200μL;空白孔加入25μL PBS及BAC定量工作液200μL,加入完成后置于37℃烘箱中恒温反应30min。
(7)反应结束后,取96孔板采用酶标仪于570nm波长处检测吸光度,并根据BCA试剂盒标准品计算蛋白曲线测定其相应蛋白浓度。
(8)按照蛋白清液+PBS:5×loading buffer=4:1的比例将各蛋白样品配制为体积相同,蛋白含量相同混合液(例:体积15μL蛋白总量40μg体系),涡旋,金属浴100℃加热5min。加热完成自然冷却后,若暂时不进行后续实验可直接暂存于超低温冰箱。
(9)根据说明书,将分离胶和浓缩胶按照比例制胶,取15μL蛋白样品上样,以78V进行电泳,当预先染色的蛋白质阶梯开始分离时,调整为98V电压进行电泳直至蛋白跑出胶最底部。
(10)按照(转膜夹黑板-滤纸-分离胶-PVDF膜-滤纸-转膜夹白板)顺序将分离胶转移至PVDF膜上(PVDF膜预先于甲醇中饱和化处理5min),在290mA的条件下转膜70min(注意加入冰袋以避免转膜温度过高)。
(11)转膜完成后,取出PVDF膜于5(体积)%的脱脂牛奶溶液中进行封闭,置于脱色摇床上封闭2h,以掩盖非特异性的结合位点。
(12)根据Marker反映的各蛋白位点,加入相应一抗4℃冰箱孵育过夜。
(13)一抗封闭结束后Tris-HCl缓冲盐溶液+吐温20(TBST)洗膜,5-10min/次,共3次。
(14)加入据一抗相应的种属二抗常温下孵育2h,TBST洗膜3次,每次5-10min。
(15)洗涤后相应蛋白条带可滴加ECL发光液,于显影仪进行显影。
从图4、图5、图6和图7中可以看出,脂肪细胞标志蛋白PPAR-γ及成熟脂肪细胞特异性脂联素蛋白表达上调,且呈现一定剂量依赖性,而单用雷公藤红素处理及控制组均几无APN表达。
测试例2
将上述实施例1-3、对比例1和对比例3得到的细胞分别注入动物体内以形成肿瘤,通过油红O染色、免疫组化及蛋白质免疫印迹方法检测检测成脂诱导剂对786-O成脂分化的影响,具体操作步骤如下:
I、油红O染色
(1)取动物新鲜肿瘤组织块投入预先配好的固定液中(10%福尔马林)使组织、细胞的蛋白质变性凝固,以防止细胞死后的自溶或细菌的分解,从而保持细胞本来的形态结构。
(2)对肿瘤组织进行冷冻切片,厚度为10μm,10%福尔马林固定10min后水洗,然后置于60%的异丙醇-水中洗20-30s。
(3)向切片加入改良油红O染色液(O Stain A:ORO Stain B=3:2)中(加盖),密闭染色10-15min。
(4)再次置于60(体积)%的异丙醇-水内清洗以便去除染液,然后水洗。
(5)加入Mayer苏木素染色液,复染核1-2min,弃去染液后水洗2-4次。
(6)用滤纸吸干周围水分,并通过甘油明胶封固。
观察,结果如图8所示。表明相比于控制组,成脂诱导组肿瘤组织出现了脂质蓄积,油红O染色能够将细胞中的脂质染成红色(图8中深色部分为红色),即红色越多,细胞内脂质蓄积越多。
II、HE染色
(1)取动物新鲜组织块(一般厚度不超过0.5厘米)投入预先配好的固定液中(10%福尔马林,Bouin氏固定液)使组织、细胞的蛋白质变性凝固,以防止细胞死后的自溶或细菌的分解,从而保持细胞本来的形态结构。
(2)由低浓度到高浓度酒精脱水,逐渐脱去组织块中的水份。再将组织块置于二甲苯中透明,才能浸蜡包埋。
(3)将已透明的组织块置于已溶化的石蜡中,放入溶蜡箱保温。待石蜡完全浸入组织块后进行包埋:先制备好容器(如折叠一小纸盒),倒入已溶化的石蜡,迅速夹取已浸透石蜡的组织块放入其中。冷却凝固成块即成。包埋好的组织块变硬,才能在切片机上切成很薄的切片。
(4)将包埋好的蜡块固定于切片机上,切成8微米厚薄片。切下的薄片往往皱折,要放到加热的水中烫平,再贴到载玻片上,放45℃恒温箱中烘干。
(5)染色前须用二甲苯脱去切片中的石蜡,再经100(体积)%乙醇浸泡5min,100(体积)%乙醇浸泡5min,80(体积)%乙醇浸泡5min,最后加入蒸馏水,就可染色。
(6)将已加入蒸馏水后的切片放入0.2(质量)%苏木精水溶液中染色5min。
(7)水洗10min或流水冲洗5min,1(体积)%盐酸乙醇溶液浸泡30s,水洗30s,再通过水洗5s。
(8)加入0.5%酒精伊红染色液染色2-3min。
(9)蒸馏水清洗30s,80(体积)%乙醇清洗30s,95(体积)%乙醇清洗1min,95(体积)%乙醇清洗1min,无水乙醇清洗3min。
(10)染色后的切片经纯酒精脱水,再经二甲苯使切片透明。
(11)将已透明的切片滴上加拿大树胶,盖上盖玻片封固。
观察,结果如图9所示。细胞浆被伊红染成深浅不同的粉红色至桃红色,胞浆内嗜酸性颗粒呈反光强的鲜红色。控制组肿瘤组织结构紊乱,细胞形态不规则,细胞核大,核染为深蓝色形态不一,表现为典型肿瘤组织特征;成脂诱导各组组织切片则表现为核染色较浅,以及随雷公藤红素剂量上升出现的类脂肪组织空泡增加。
III、免疫组化
(1)石蜡切片脱蜡暴露组织:取石蜡切片完全浸没于二甲苯中10min/次,浸泡两次,以保证脱蜡充分;
(2)切片复水:脱蜡后切片稍晾后,依次浸入100(体积)%,95(体积)%,85(体积)%,75(体积)%乙醇溶液中3min/次,浸泡后转入水中洗涤3min;
(3)内源性过氧化物酶阻断:将切片从纯水中取出后,室温条件下滴加阻断剂覆盖切片孵育10min;结束后切片入PBS洗涤3次,3min/次。
(4)抗原修复:切片入PBS中加热至沸腾5-8min,加热结束后取出切片,隔水冷却,冷却后切片入PBS洗涤2min/次,共洗涤两次。
(5)一抗孵育:将相应免疫组化用一抗采用PBS稀释至说明书中建议的浓度,滴加覆盖切片,在湿盒中4℃条件孵育过夜或37℃孵育2小时;一抗孵育结束后,PBS洗涤切片3次,3min/次;
(6)二抗孵育:切片上滴加反应增强液覆盖待测组织,室温条件下孵育20ming;反应增强结束后,切片入PBS洗涤,3min/次,共两次;进而滴加增强酶标山羊抗小鼠/兔IgG聚合物至切片,覆盖组织并孵育20min;结束后PBS洗涤切片2次,3min/次。
(7)DAB显色:以DAB底物液:浓缩DAB试剂=1000:50配置DAB显色液,遵循现配现用原则对组织进行染色,并于显微镜下观察,当观察到视野内出现明显棕色染色时,迅速滴加蒸馏水覆盖切片以终止反应;
(8)苏木素染色:滴加苏木素覆盖组织进一步复染2min,低速流水冲洗,切片出现蓝色时立即取出,于1(体积)%盐酸酒精中分化数秒,流水冲洗;
(9)脱水、透明化、封片:切片依次入75(体积)%、85(体积)%、95(体积)%酒精中各3min,无水酒精3min一次,共三次;切片最后入二甲苯中透明化处理10min 2次,采用中性树脂进行封片;
观察,结果如图10、图11、图12和图13所示。免疫组化的切片显示的棕色越深,表明所测试的蛋白表达量越高。各剂量雷公藤红素诱导组(0.25μM组、0.50μM组、1.0μM组)及罗格列酮组,均表现为表达大量脂肪细胞标志蛋白APN、PPAR-γ。此外,雷公藤红素诱导组上述蛋白的阳性棕褐色颗粒显著增加,该作用强于罗格列酮组,并呈现浓度依赖性。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
- 诱导脐带间充质干细胞成脂分化的培养方法,以及该方法所用的培养基
- 一种健肝消脂的药物组合物及其制备方法、制剂与应用
- 一种诱导骨骼肌肌源性干细胞成脂分化的培养基及其应用和成脂分化方法
- 一种诱导骨骼肌肌源性干细胞成脂分化的培养基及其应用和成脂分化方法
