一种Cornelia de Lange综合征1型的致病基因、引物对及其应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及基因诊断领域,特别是涉及一种Cornelia de Lange综合征1型的致病基因、引物对及其应用。
背景技术
Cornelia de Lange综合征(Cornelia de Lange syndrome,CdLS)是一种较为罕见的遗传性疾病,1933年荷兰的儿科医生Cornelia de Lange对有相同临床特征的患儿进行了首次归纳总结,并以其名命名该类疾病。该病是一种多器官系统受累的遗传性疾病,其表现出显著的遗传异质性,临床表现轻重不一,典型患者具有特殊面容、严重生长落后及肢体畸形等特点。据估计,CdLS的发病率为1.6/10万~2.2/10万,但轻型患者可能未被诊断出,故确切的发病率尚不清楚。CdLS为显性遗传,大多为散发,亦有家族性发病的报道。其主要由黏连蛋白复合体的相关基因变异导致。CdLS 可分为1至5型,临床主要特征表现为:
1)头面部特征:CdLS患儿头面部特征最为典型,可以在新生儿时期很容易辨别出,主要表现为低发际线、多毛、连眉、长睫毛、高腭弓、鼻梁低陷、短鼻、鼻孔前倾、长并突出的人中、缺齿、宽齿缝、唇腭裂、口唇薄、口角下垂、低耳位,有报道患儿存在中耳内耳畸形,为中耳炎易发人群,因发育异常,患儿存在传导性听力损伤及感音神经性听力损伤等;
2)骨骼及肌肉系统特征:CdLS患儿多有上肢异常,比例约占90%,主要表现为双手短小、第一掌骨短、小指内弯畸形、贯通掌、桡骨头脱位、缺指。躯干部多见髋部脱位、脊柱侧凸、颈部畸形及漏斗胸,下肢异常较少,可见足部较正常比例偏小,偶见并趾畸形;
3)消化系统异常:CdLS患儿胃食管反流情况较多见,反流误吸为其主要致死因素,其中幽门梗阻导致的消化道梗阻诱发胃食管反流情况最为多见,偶可见环状胰腺、肠道异常旋转、梅克尔憩室、肛门闭锁及先天性膈疝;
4)循环系统异常:部分CdLS患儿存在心血管异常,主要表现为室间隔缺损、肺动脉狭窄及房间隔缺损等;
5)泌尿及生殖系统异常:CdLS患儿主要的泌尿系统畸形包括肾发育不全及膀胱输尿管返流,男性可见隐睾、尿道下裂及阴茎短小,女性可见异常子宫及小阴唇畸形;
6)智力发育障碍及行为异常:该疾病患儿只有3%~4%语言能力接近正常,34.6%存在表达性语言障碍。65.2%的患者出现行为异常,主要的行为异常包括了睡眠障碍、烦躁易怒、注意力不集中等。
目前发现,至少有7个基因(包括NIPBL、SMC1A、SMC3、RAD21、BRD4、 HDAC8和ANKRD11基因等)与CdLS相关,其中SMC1A、SMC3、RAD21基因编码黏连蛋白的构成组分,NIPBL、HDAC8基因是黏连蛋白的调控因子,最常见突变基因为NIPBL基因突变。
NIPBL基因(MIM 608667)变异被首次鉴定出的Cornelia de Lange综合征1型(MIM 122470)的致病原因。NIPBL基因长189.6kb,定位于染色体5p13.2,包括 47个外显子和46个内含子,编码2804个氨基酸的NIPBL蛋白,该蛋白属于染色体黏附素家族,参与构成黏连蛋白加载到染色体上所需的异二聚体复合物。约70%的 CdLS患者中存在NIPBL基因变异。目前已报道三百多种变异,包括错义变异、无义变异、剪接变异、插入、缺失/重复等。NIPBL基因剂量效应对人类的发育极为重要,基因表达减少15%可导致CdLS表型。而对NIPBL基因变异致病机制中,NIPBL基因影响转录调控可能通过两种途径:通过对黏连蛋白的加载作用来间接影响调控或直接与启动子作用。
因此,基因突变是导致疾病发生发展的重要遗传基础,基因诊断是确诊Corneliade Lange综合征1型的重要遗传学标准。临床上需要针对不同突变建立相应的检测技术并用于明确病因和疾病诊断。但目前并没有能特异性区分Cornelia de Lange综合征 1型的突变患者、携带者和正常人群的诊断试剂的报道。
发明内容
为了解决上述问题,本发明提供了Cornelia de Lange综合征1型的致病基因、引物对及其应用。利用本发明所述致病基因能够助力Cornelia de Lange综合征1型基因突变的筛查和诊断,并为其药物筛选、药效评价及靶向治疗提供新的技术支持。
为了实现上述目的,本发明提供如下技术方案:
本发明提供了一种Cornelia de Lange综合征1型的致病基因,在登录号为NIPBL:NM_133433.4的基因的31号外显子的第5773位存在G>A突变形成致病基因。
本发明提供了用于扩增上述的致病基因的引物对,其特征在于,所述引物对包括NIPBL-F和NIPBL-R;
所述NIPBL-F的核苷酸序列如SEQ ID NO.1所示;所述NIPBL-R的核苷酸序列如SEQID NO.2所示。
本发提供了上述的致病基因作为靶标基因在制备预测或诊断Cornelia de Lange综合征1型的试剂中的应用。
本发明提供了一种预测或诊断Cornelia de Lange综合征1型的试剂,所述试剂包括上述的引物对。
优选的,所述试剂还包括测序引物对;所述测序引物对包括NIPBL-SeqF和 NIPBL-SeqR;
所述NIPBL-SeqF的核苷酸序列如SEQ ID NO.3所示;所述NIPBL-SeqR的核苷酸序列如SEQ ID NO.4所示。
优选的,所述试剂盒还包括阳性突变参考品DNA;所述阳性突变参考品DNA 的核苷酸序列如SEQ ID NO.5所示。
本发明提供了上述的致病基因作为靶标基因或上述的试剂在制备预测或诊断Cornelia de Lange综合征1型的试剂盒中的应用。
本发明提供了一种预测或诊断诊断Cornelia de Lange综合征1型的试剂盒,所述试剂盒包括上述的试剂。
本发明提供了一种鉴定NIPBL:NM_133433.4:exon31:c.5773位点的基因型的方法,包括以下步骤:
以待测样品DNA为模板,利用上述的引物对进行PCR扩增,得到扩增产物;
将扩增产物进行测序,确定NIPBL:NM_133433.4:exon31:c.5773位点的基因型。
优选的,所述待测样本包括血液或流产引产胎儿组织。
有益效果:
本发明提供了一种Cornelia de Lange综合征1型的致病基因,在登录号为NIPBL:NM_133433.4的基因的31号外显子的第5773位存在G>A突变形成致病基因。本发明通过外显子组测序技术首次发现了 NIPBL:NM_133433.4:exon31:c.5773G>A:p.A1925T位点突变可以导致Cornelia de Lange综合征1型发病。一方面,通过检测受试者是否携带有上述突变,用于筛查或诊断Cornelia de Lange综合征1型的遗传学诊断,以指导治疗。另一方面,本发明为Cornelia de Lange综合征1型的发病机制研究奠定了重要基础,为Corneliade Lange 综合征1型患者的治疗提供全新的理论依据。第三方面,本发明可以为治疗Cornelia de Lange综合征1型提供可能的药物靶点。
而且,本发明所提供的诊断试剂盒可用于快速、有效地预测或诊断Cornelia deLange综合征1型;本发明的研究成果可以用于Cornelia de Lange综合征1型的遗传学诊断和优生优育。
附图说明
图1显示Cornelia de Lange综合征1型家系1遗传图谱,其中,□表示男性正常个体,○表示女性正常个体,
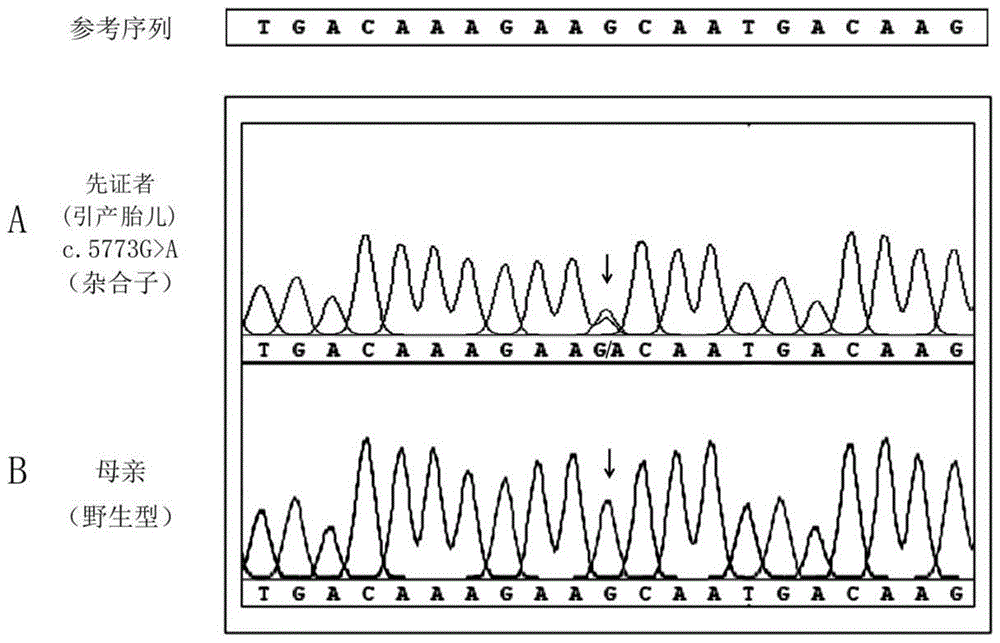
图2显示利用Sanger测序检测NIPBL:NM_133433.4:exon31:c.5773G>A:p.A1925 T位点基因型的结果图,家系1中先证者为患者(测序图中箭头所指为突变发生位置),其中A为先证者测序结果,B为母亲测序结果;
图3显示Cornelia de Lange综合征1型家系2遗传图谱,其中,□表示男性正常个体,○表示女性正常个体,■表示男性患者,
图4显示利用试剂盒检测NIPBL:NM_133433.4:exon31:c.5773G>A:p.A1925T位点基因型的结果图,家系2中先证者为患者(测序图中箭头所指为突变发生位置),其中A为患者检测结果,B为母亲检测结果。
具体实施方式
在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的分子遗传学、核酸化学和分子生物学相关术语和实验室操作步骤均为相应领域内的广泛使用的术语和常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
文中术语“诊断”包括疾病风险的预测、疾病发病与否的诊断、还包括对疾病预后的评估。
文中术语“突变”是指野生型的多核苷酸序列发生改变,成为变异体,变异体可以是天然发生的或非天然发生的。
在本发明中,术语“杂合子突变”/“杂合突变”是指是等位基因中只有其中一个基因出现突变。
在本发明中,“引物”指用于在PCR反应中扩增靶标核酸的多核苷酸片段,其通常为寡核苷酸,例如含有至少5个碱基,例如5、6、7、8、9、10、11、12、13、14、 15、16、17、18、19、20、21、22、23、24、25个或者更多个碱基的多核苷酸片段。引物不必与待扩增的目的基因或其互补链完全互补,只要其能够特异性扩增目的基因。如本文中所使用的,术语“特异性扩增”是指引物能够通过PCR反应扩增目的基因,而不扩增其他基因。例如,特异性扩增NIPBL基因是指,在PCR反应中引物只扩增NIPBL基因,而不扩增其他基因。
本发明提供了一种Cornelia de Lange综合征1型的致病基因,在登录号为NIPBL:NM_133433.4的基因的31号外显子的第5773位存在G>A突变形成致病基因,本发明当在登录号为NIPBL:NM_133433.4的基因的31号外显子的第5773位碱基由 G突变为A,则会到第1925位氨基酸由丙氨酸变为苏氨酸。
本发明所述c.5773G>A突变指野生型NIPBL基因的第5773位碱基G突变为A,形成NIPBL基因突变体,所述NIPBL基因突变体的核苷酸序列优选如SEQ ID NO.34 (具体为:AAACAAGTATT)所示。本发明所述NIPBL突变体蛋白与野生型NIPBL 基因编码的蛋白相比,第1925位氨基酸由丙氨酸(A)突变为苏氨酸(T),即所述 NIPBL突变体蛋白含有p.A1925T的突变,所述突变是由于c.5773G>A的错义突变引起的;所述NIPBL突变体蛋白的氨基酸序列如SEQ ID NO.35(具体为:DKETMTR) 所示。
本发明还提供了用于扩增上述的致病基因的引物对,所述引物对包括NIPBL-F 和NIPBL-R;所述NIPBL-F的核苷酸序列如SEQ ID NO.1所示;所述NIPBL-R的核苷酸序列如SEQID NO.2所示。本发明提供的用于扩增上述致病基因的引物对引物特异性好,PCR扩增时不会产生非特异性产物;引物内部及引物之间没有出现3个及以上的连续互补碱基,避免引物二聚体的形成;引物G+C含量适中,不妨碍PCR 的扩增效果,并使得扩增效果最佳;引物长度合适,能满足PCR引物的特异“抓取”DNA模板,同时使得退火温度(Tm)适中,引物长度一般与Tm成正比,过长过短的引物都会造成Tm值过大或过小。
通过检测受试者是否携带有本发明所述的致病基因,用于筛查或诊断Corneliade Lange综合征1型的遗传学诊断,以指导治疗。因此,利用本发明所述致病基因能够制备预测或诊断Cornelia de Lange综合征1型的试剂或试剂盒。
本发明还提供了上述的致病基因作为靶标基因在制备预测或诊断Cornelia deLange综合征1型的试剂中的应用。利用本发明所述试剂能够准确预测或诊断试受者是否为Cornelia de Lange综合征1型患者。
本发明还提供了一种预测或诊断Cornelia de Lange综合征1型的试剂,所述试剂包用于扩增本发明所述致病基因的引物对。本发明在前文对所述引物对进行了详细的描述,因此在此处不做赘述。本发明所述试剂还优选包括测序引物对。本发明所述测序引物对优选包括NIPBL-SeqF和NIPBL-SeqR;所述NIPBL-SeqF的核苷酸序列优选如SEQ ID NO.3所示;所述NIPBL-SeqR的核苷酸序列优选如SEQ ID NO.4 所示。本发明所述测序引物对是在上述用于扩增本发明所述致病基因的基础上设计的巢式引物,即该引物是以PCR扩增产物DNA为模板进行测序反应;该引物能满足相应的特异性要求,测序反应时,引物可以特异性地“抓取”DNA模板;该引物的长度和G+C含量适中,能满足酶反应体系中退火温度的合适匹配。在本发明中,所述试剂盒优选还包括阳性突变参考品DNA;所述阳性突变参考品DNA的核苷酸序列优选如SEQ ID NO.5所示。在本发明中,所述试剂盒优选还包括PCR扩增反应中的常规试剂和/或DNA测序过程中使用的试剂;所述PCR扩增反应中的常规试剂优选以20μL计,优选包括10×PCR缓冲液2μL、10mmol/LdNTPs 0.4μL、100ng/μL NIPBL-F0.5μL、100ng/μLNIPBL-R0.5μL、模板1μL、5u/μLTaq酶0.2μL和余量的ddH
本发明还提供了上述的致病基因作为靶标基因或上述的试剂在制备预测或诊断Cornelia de Lange综合征1型的试剂盒中的应用。利用本发明所述试剂盒能够准确区分Cornelia de Lange综合征1型患者和正常人。
本发明还提供了一种预测或诊断Cornelia de Lange综合征1型的试剂盒,所述试剂盒包括上述的试剂。本发明在前文对所述试剂进行了详细的描述,因此在此次不做赘述。
本发明还提供了一种鉴定NIPBL:NM_133433.4:exon31:c.5773位点的基因型的方法,包括以下步骤:
以待测样品DNA为模板,利用上述的引物对进行PCR扩增,得到扩增产物;
将扩增产物进行测序,确定NIPBL:NM_133433.4:exon31:c.5773位点的基因型。
在本发明中,所述待测样本优选包括血液或流产引产胎儿组织;本发明对所述血液没有特殊要求,优选包括新鲜血液、陈旧血液、血斑或血痕迹等,即只要含有 DNA的血都可以。因申请人是医院,患者家属需要明确遗传学原因时,会常规将病理组织提交到遗传科室进行检测,在检测前后签署知情同意书。因此在本发明中,所述对流产引产胎儿组织进行检测前,同样家属会签署知情同意书,是合法来源。
在本发明中,所述PCR扩增的反应程序优选包括:95℃预变性5min;95℃变性 30s,48℃退火30s,72℃延伸60s,30个循环;72℃反应7min。
在本发明中,所述PCR扩增的反应体系以20μL计,优选包括10×PCR缓冲液 2μL、10mmol/LdNTPs 0.4μL、100ng/μL NIPBL-F0.5μL、100ng/μL NIPBL-R0.5μL、模板1μL、5u/μLTaq酶0.2μL和余量的ddH
在本发明中,所述NIPBL:NM_133433.4:exon31:c.5773位点的基因型具体优选为“c.5773G>A杂合子”或“c.5773G/G纯合子”;当所述的 NIPBL:NM_133433.4:exon31:c.5773位点的基因型为“c.5773G>A杂合子”,则判断 NIPBL基因存在突变,个体为患者;当所述的NIPBL:NM_133433.4:exon31:c.5773位点的基因型为“c.5773G/G纯合子”,则判断NIPBL基因不存在突变,为野生型,个体为正常人。
为了进一步说明本发明,下面结合附图和实施例对本发明提供的一种Corneliade Lange综合征1型的致病基因、引物对及其应用进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
下列实施例中未注明具体条件的实验方法,通常按照常规条件如Sambrook等人,分子克隆实验室手册(NewYork:Cold Spring HarborLaboratoryPress,1989)中所述的条件,或按照制造厂商所建议的条件。
实施例1
样本获取
发明人发现了1个Cornelia de Lange综合征1型家系(简称家系1),该家系部分成员的临床信息见表2。图1显示了1号家系图谱,其中,□表示男性正常个体,○表示女性正常个体,
1.诊断标准:
可参照《人类单基因遗传疾病》2010年版和《CdLS国际共识》2018年版:
将CdLS的表型区分为临床特点和体征,表型分为了主要特征和提示性特征。主要特征指的是CdLS患者最具典型意义的特征,每一项在评分中积分2分,主要特征包括连眉或者浓眉、鼻梁低陷、鼻短小及鼻孔向前、浅人中或长人中、口唇薄和口角下垂、少指或者无指、先天性膈疝。提示特征指的是这些表现并不够典型,每项积分1分,提示性特征主要包括宫内发育迟缓、出生后发育迟缓、智力障碍、小头畸形、小手足、第5指较短、多毛。在表型积分的基础上,制定了CdLS的临床诊断标准(见表1)。
表1 Cornelia de Lange综合征1型临床诊断标准
表2 Cornelia de Lange综合征1型家系1成员的临床信息
如图1所示,编号采用Ⅰ(第一代)、Ⅱ(第二代)。
1号家系人员Ⅰ:1(父亲)、Ⅰ:2(母亲)外周血DNA和Ⅱ:1(先证者)引产组织DNA用于测序分析。
外显子测序
2.仪器设备如表3所示。
表3仪器设备一览表
3.试剂耗材
人类全外显子测序试剂盒(Agilent)、DNA 1000试剂盒(Agilent)、96孔板(Axygen)、不同型号枪头(Axygen)、200μL离心管(Eppendorf)、1.5mL离心管(Eppendorf)、毛细管电泳缓冲液(Thermo)、测序标准物(Thermo)、无水乙醇 (Thermo)、BigDyeTerminatorV3.1(Thermo)、外周血gDNA提取试剂盒(TIANGEN)、琼脂糖(TIANGEN)和EB染液(Amresco)。
4.试剂配方
5×TBE电泳液贮存液按照表4配制。
表4 5×TBE电泳液配方
用ddH
0.5×TBE电泳液工作液,用ddH
10×红细胞裂解液按照表5配制。
表5 10×红细胞裂解液配方
高压灭菌,4℃保存。
1×细胞核裂解液按照表6配制。
表6 1×细胞核裂解液配方
5.实验步骤
签署知情同意书后,采集家系1中Ⅰ:1(父亲)、Ⅰ:2(母亲)外周血3~5mL和Ⅱ:2(引产胎儿)组织3~5g。
5.1样本DNA提取
1)对于肝素抗凝外周血样本,则将外周血3~5mL装入15mL离心管中,加2~3 倍体积的1×红细胞裂解液,混匀,冰上静置30分钟,直至溶液变透明。组织标本则碾磨磨碎后直接进入下一步;
2)4℃,3000转/分钟离心10分钟,小心去上清液。沉淀中加1mL 1×细胞核裂解液,混匀,再加2mL 1×细胞核裂解液和150μL 20%SDS,摇匀,至出现粘稠透明状。加10μL20mg/mL蛋白酶K,摇匀。37℃消化6小时以上或过夜。
3)加等体积饱和酚,轻摇混匀,室温3000转/分钟离心10分钟;
4)小心移上清至另一离心管,添加与离心管中上清液等体积的酚和氯仿的混合液(酚:氯仿=1:1(v/v))混匀,室温3000转/分钟离心10分钟;
5)小心移上清,若上清不清亮透明,则用等体积氯仿再抽提一次;
6)将上清移入另一离心管中,加二倍体积无水乙醇,摇匀,见白色絮状DNA。用火焰灭菌的玻璃钩针将DNA钩出,70%乙醇洗二次,室温干燥5分钟,再将DNA 溶于200μL 1×TE中,转鼓溶解过夜。紫外测OD值。
7)TE溶解的DNA,在4℃下可保存一年,如要求长期保存,则需加2倍体积无水乙醇置-70℃保存。
5.2外显子测序
1)取2μg DNA,机械打断,使片段大小在200bp左右,切胶回收150-250bp片段;
2)DNA片段做末端修复和3’末端加A;
3)连接测序接头,对连接产物进行纯化,再行PCR扩增,扩增产物纯化;
4)Agilent试剂盒探针加入纯化后的扩增产物进行杂交捕获,杂交产物经洗脱回收后做PCR扩增,再行最终产物回收,取小样行琼脂糖凝胶电泳进行质控分析;
5)NextSeq500测序仪测序和数据分析。
6.3结果
最终得到1个具有致病意义的基因突变NIPBL:NM_133433.4:exon31:c.5773G>A:p.A1925T。c.5773G>A是第5773位碱基由G 突变为A,导致第1925位氨基酸由丙氨酸变为苏氨酸。在家系1患者个体中 NIPBL:NM_133433.4:exon31:c.5773G>A:p.A1925T位点的基因型是“c.5773G>A杂合子”突变,在NIPBL家系正常个体中基因型是无突变的野生型。
实施例2
Sanger测序验证
对于外显子组测序结果进一步利用Sanger测序法,对 NIPBL:NM_133433.4:exon31:c.5773G>A:p.A1925T位点进行验证。分别对实施例1 中的家系1成员(Ⅰ:1、Ⅰ:2、Ⅱ:1)和100名家系外正常人进行 NIPBL:NM_133433.4:exon31:c.5773G>A:p.A1925T位点基因型检测。
具体方法步骤如下:
1、DNA提取
按照实施例1的方法提基因组DNA。
2、候选引物设计、验证及优选
2.1候选引物设计参考人类基因组序列数据库hg19/build36.3。
2.2针对c.5773G>A突变位点分别设计15对候选引物(见表7),并利用PCR实验来验证和评价各对候选引物的优劣情况
表7各对候选引物基本情况和验证实验结果一览表
/>
/>
注:正常PCR扩增结果电泳后只有一条特异性条带,若出现引物二聚体条带、非特异产物条带均是引物异常反应的结果;目标引物尽可能避免这类情况。另外参考如下原则来综合评价和选择最优引物对:
①引物长度为15~30nt,常用为20nt左右;
②G+C含量以40-60%为宜,G+C太少扩增效果不佳,G+C过多易出现非特异条带,ATGC最好随机分布;
③避免5个以上的嘌呤或嘧啶核苷酸的成串排列参照;
④引物内部不应出现互补序列;
⑤两个引物之间不应存在互补序列,尤其是避免3`端的互补重叠;
⑥引物与非特异扩增区的序列的同源性不要超过70%,引物3`末端连续8个碱基在待扩增区以外不能有完全互补序列,否则易导致非特异性扩增。
2.3候选引物PCR验证反应
按照表8中的反应体系进行PCR并保持反应体系在冰上;每对引物设置8个反应测试管(表8中序号1至8)。
表8引物检测PCR反应体系
/>
反应条件:将上述测试反应管放入PCR仪,执行以下反应程序:
第一步:95℃,5分钟;
第二步:30个循环(95℃,30秒→Tm,30秒→72℃,60秒);(根据表7中各引物Tm值设置PCR扩增参数,如为双引物则取Tm平均值)。
第三步:72℃,7分钟;
第四步:4℃直至取样时。
2.4候选引物PCR结果进行琼脂糖凝胶电泳检测,以评估引物反应的有效性、特异性:
1)用胶带将洗净干燥的凝胶成样器两端封好,置于一水平台面上,在成样器的一端约1cm处放置梳子。
2)称量2g琼脂粉末于一锥形瓶中,加入100mL 0.5×TBE电泳缓冲液,摇匀后置微波炉或电炉上(加石棉网)加热,沸腾后取出摇匀,再加热,直至凝胶完全熔解,取出室温冷却。
3)待凝胶冷却至50℃左右,倒入封好的凝胶成样器,使厚度在5mm左右。
4)凝胶凝固拆除胶带,将凝胶与成样器一起放入电泳槽中。
5)加入电泳缓冲液,使液面高于胶面1~2mm,向上拔出梳子;用微量移液器将样品和DNA大小标准品分别与载样液混匀后,加入各加样孔内,由于载样液中蔗糖比重较大,DNA沉入孔底。
6)盖上电泳槽,接通电源,调至适当电压,开始电泳。根据载样液中溴酚蓝的指示,判断样品的大概位置,决定是否终止电泳。
7)切断电源,取出凝胶,放入0.5g/mL的EB水溶液中染色10~15分钟。
8)将凝胶放到透射式紫外照射仪下观察结果,波长254nm,并用加红色滤色片的相机照相或用凝胶扫描系统记录电泳结果。
2.5结果评价:
1)如果7号管仅出现一条明亮清晰目的条带,无其它条带,则判断该对引物和发应体系有效性好和特异性强;
2)如果7号管没有出现目的条带,则判断该对引物和反应体系无效;
3)如果7号管出现目的条带外的引物引物二聚体带,并在2、3、4、5、6号部分管中也同样出现引物二聚体带,则判断该对引物和反应体系有效性差;
4)如果7号管出现目的条带外的非特异性带,并在5、6号部分管中也同样出现非特异性带,则判断该对引物和反应体系特异性差;
5)如果7号管出现目的条带外的引物二聚体和非特异性带,并在2、3、4、5、 6号部分管中也同样出现引物二聚体和非特异性带,则判断该对引物和反应体系有效性和特异性差。
2.6根据表7验证测试后统计的结果,选择其中最优一对(表7中1号)作为突变家系检测用引物,引物序列如下所示:
针对NIPBL:NM_133433.4:exon31:c.5773G>A:p.A1925T位点的PCR引物序列如下所示:
5’-ATTCCTGGCAGTTTGTG-3’(SEQ ID NO.1)
5’-ATTTCTCCTTTCCCTCC-3’(SEQ ID NO.2)
3、1号家系人员和100名家系外人员突变位点PCR扩增
按照表9中的反应体系进行PCR并保持反应体系在冰上。
表9突变位点PCR反应体系
反应条件:将反应体系放入PCR仪,
对于c.5773G>A位点PCR扩增,执行以下反应程序:
第一步:95℃,5分钟;
第二步:30个循环(95℃,30秒→48℃,30秒→72℃,60秒);
第三步:72℃,7分钟;
第四步:4℃直至取样时。
4、琼脂糖凝胶电泳检测
参照上述2.4步骤。
5、PCR产物酶解法纯化:5μL PCR产物中分别加入0.5μL核酸外切酶I(Exo I), 1μL碱性磷酸酶(AIP),37℃消化15分钟,85℃使酶失活15分钟。
6、BigDye反应
BigDye反应体系见表10。
表10 BigDye反应体系
测序PCR循环条件:
第一步:96℃,1分钟;
第二步:33个循环(96℃,30秒→55℃,15秒→60℃,4分钟);
第三步:4℃直至取样时。
7、BigDye反应产物纯化:
1)每管加入1μL 125mM EDTA(pH8.0),加到管底,再加入1μL 3mol/L NaAc(pH5.2);
2)加入70μL 70%酒精,震荡混匀4次,室温放置15分钟;
3)3000g,4℃离心30分钟;马上倒置96孔板,185g离心1分钟;
4)室温放置5分钟,让残余的酒精在室温挥发干,加入10μL Hi-Di甲酰胺溶解DNA,96℃变性4分钟,迅速置冰上4分钟,上机测序。
8、测序
将纯化后的BigDye反应产物进行DNA测序,测序引物则在上述PCR优选引物的基础上设计巢式引物(第二组引物是在第一组引物扩增得到的产物序列范围内设计的)作为测序引物,c.5773G>A位点引测序物序列如下所示:
5’-ATTCCTGGCAGTTTGTG-3’(SEQ ID NO.3)
5’-GCATCCCTTCAGCATCTC-3’(SEQ ID NO.4)
9、结果分析
图2的Sanger测序结果显示,家系1中流产胎儿NIPBL:NM_133433.4: exon31:c.5773G>A:p.A1925T位点基因型是“c.5773G>A杂合子”。图2测序图中箭头所指位置显示A层Cornelia de Lange综合征1型患者 NIPBL:NM_133433.4:exon31:c.5773G>A:p.A1925T位点基因型是“c.5773G>A杂合子”突变,图2测序图中箭头所指位置显示B层该位点的基因型是野生型,为正常个体。
实施例3NIPBL基因c.5773G>A突变(也称为NIPBL:NM_133433.4:exon31:c. 5773G>A:p.A1925T)诊断试剂盒及应用
1、试剂盒组成:
1)扩增引物(每条引物1.2μg):如实施例2所示;
2)缓冲液(500μL的10×PCR缓冲液,500mmol/L KCl,100mmol/L Tris.Cl(pH8.3),15mmol/L MgCl2);
3)Taq酶(20U);
4)dNTPs(四种dNTP各4mM);
5)NIPBL:c.5773G>A阳性突变参考品DNA,该参考品为一段双链DNA, c.5773G>A阳性突变参考品DNA具体序列如下所示:
其中,单下划线碱基为上游PCR扩增引物和上游测序引物位置,方框内碱基为点突变位点,双下划线碱基下游测序引物位置,波浪下划线为下游PCR扩增引物位置。
6)测序引物:如实施例2所示;
2、使用方法:
应用于家系2患者的检测。
表11 Cornelia de Lange综合征1型家系2成员的临床信息
如图3所示,编号采用Ⅰ(第一代)、Ⅱ(第二代)、Ⅲ(第三代)。
家系2人员Ⅰ:1(母亲)Ⅱ:1(患者)外周血DNA用于检测。
1)基因组DNA提取:提取样本基因组DNA。
2)先采用上述PCR扩增引物、Taq酶、缓冲液、dNTPs、样本基因组DNA等进行PCR扩增反应(每个PCR反应的体积为20μL:含10×PCR缓冲液2μL、四种 dNTP各200uM、单条引物60ng、模板DNA 100ng、Taq酶1U,用ddH
3)对PCR扩增产物进行纯化;
4)采用上述测序引物对纯化的PCR产物进行BigDye反应;
5)对BiyDye反应产物纯化;
6)对BiyDye反应产物测序,测序序列与正常序列相比较。
图4的试剂盒检测结果显示,家系2中1名患者儿NIPBL:NM_133433.4: exon31:c.5773G>A:p.A1925T位点基因型是“c.5773G>A杂合子”。图4测序图中箭头所指位置显示A层Cornelia de Lange综合征1型患者 NIPBL:NM_133433.4:exon31:c.5773G>A:p.A1925T位点基因型是“c.5773G>A杂合子”突变,B层显示的是患者母亲该位点基因型均为野生型,为正常人。
由以上实施例结果可以看出,本发明发现了新的NIPBL基因突变体,且确认了新突变体与Cornelia de Lange综合征1型的发病密切相关,所述致病突变体可用于 Corneliade Lange综合征1型的分子诊断及与相关疾病的鉴别诊断。
综上所述可知,通过检测受试者是否携带有本发明所述致病基因,用于筛查或诊断Cornelia de Lange综合征1型的遗传学诊断,同时本发明所提供的试剂和诊断试剂盒可用于快速、有效地预测或诊断患者是否为Cornelia de Lange综合征1型患者。
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可以做各种改动和修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 一种基于高通量测序技术用于检测甲状腺癌致病相关基因变异的引物及其应用
- 一种SATB2相关综合征的致病基因、引物对及其应用和鉴定基因型的方法
- 一种Turner型X连锁综合征性智力低下的致病基因、引物对及其应用
