基于EAT1基因构建水稻显性核不育材料的方法及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及育种和植物基因工程技术领域,具体涉及一种基于EAT1基因构建水稻显性核不育材料的方法及其应用。
背景技术
水稻(
实践证明,充分利用现代分子生物学研究手段,不断挖掘新的水稻雄性不育基因资源、创制各类雄性不育系,是提高水稻产量的有效手段。然而,绝大部分水稻雄性不育系是隐性核不育,需要与之配套的保持系和繁殖技术体系,在实际生产中还存在诸多困难。与之相比,显性核不育材料的不育性受显性基因控制,用可育材料与它杂交,后代的可育株与不育株各占一半,这对于杂交制种有非常重要的意义。利用显性核不育系,可以进行大规模的轮回选择育种,以高效聚合多种优异性状和基因(如高产、抗病和抗逆等)。因此,针对显性核不育材料的相关研究一直是个热点。
近年来,超过40个水稻雄性育性相关基因被克隆,如OsMS1、GAMYB、UDT1、TDR和EAT1等。这些基因很多编码转录因子,通过调节下游相关基因的表达,影响花粉和绒毡层的发育。其中,EAT1基因编码bHLH类转录因子,通过激活两个编码天冬氨酸蛋白酶的基因OsAP25和OsAP37的表达,启动花药绒毡层细胞程序性死亡(参考文献:Niu N, Liang W,Yang X, et al. EAT1 promotes tapetal cell death by regulating asparticproteases during male reproductive development in rice[J]. NatureCommunications, 2013, 4: 1445)。通过基因敲除创制的EAT1功能缺失突变体表现为隐性核雄性不育,其杂合体后代呈简单的孟德尔式分离,并不能使不育性保持,因此在生产应用上受到了很大的限制。另一方面,已有研究通过创制过表达载体,发现bHLH类转录因子TIP2、TDR等过量表达会导致水稻植株出现雄性不育表型,且该性状可能为显性遗传(参考文献:Ko S S, Li M J, Ho Y C, et al. Rice transcription factor GAMYB modulatesbHLH142 and is homeostatically regulated by TDR during anther tapetal andpollen development[J]. Journal of Experimental Botany, 2021, 72(13): 4888–4903)。但目前尚未有这些基因在育种上应用的报道,也没有针对EAT1基因构建过表达材料的研究。本发明旨在基于EAT1基因的过表达,为创制显性核不育材料提供新的方法。
发明内容
针对现有技术存在的问题和缺陷,本发明提供一种基于EAT1基因构建水稻显性核不育材料的方法及其应用。利用该方法可创制水稻显性核雄性不育系,以及利用该显性核不育系进行轮回选择育种,可快速淘汰非目标材料,高效聚合多种优异性状和基因,有效提高育种效率。本发明的技术方案为:
第一方面,本发明提供一种基于EAT1基因构建的水稻显性核不育表达载体,所述表达载体由
水稻雄花发育基因EAT1具有启动绒毡层细胞程序性死亡的功能,其序列如SEQ IDNO.2所示。目前仅发现EAT1的功能丧失会影响水稻花粉发育,证实水稻维持正常育性需要EAT1的参与。而本发明还进一步证实EAT1基因的过量表达也会导致水稻雄性不育。经过一系列分析发现,EAT1的过量表达会导致花药绒毡层提前降解,这一发现在之前从未被报道。
Ubiquitin
获取水稻cDNA,并以其为模板,采用EAT1基因的特异引物扩增EAT1基因,得到PCR产物片段;
将PCR产物片段连入带有
进一步地,所述特异引物包括上游引物EAT1-OE-F和下游引物EAT1-OE-R,序列分别如SEQ ID NO.3和SEQ ID NO.4所示。
第三方面,本发明提供上述表达载体在调控水稻植株育性上的应用。
第四方面,本发明提供一种水稻显性核雄性不育植株的构建方法,是采用上述表达载体,构建方法包括:
步骤1,将所述表达载体转化到农杆菌中并培养;
步骤2,将获得的含有表达载体的农杆菌浸染水稻愈伤组织,然后进行脱分化和再分化处理;
步骤3,炼苗并移栽培养,即得。
第五方面,本发明提供一种水稻显性核雄性不育系的构建方法,是以上述构建方法获得的水稻显性核雄性不育植株为母本,以可育水稻作为父本,通过杂交方法获得。
第六方面,本发明提供上述水稻显性核雄性不育系的鉴定方法,是将上述构建方法获得的水稻显性核雄性不育系植物的叶片提取RNA并反转录为cDNA,以该cDNA为模板,利用
进一步地,所述叶片取自水稻显性核雄性不育系种子从苗期到成熟期生长阶段的任一时期。
进一步地,所述鉴定引物包括上游引物EAT1-RT-F1和下游引物EAT1-RT-R1,序列分别如SEQ ID NO.5和SEQ ID NO.6所示。
进一步地,所述鉴定方法以OsActin1基因为内参基因,内参引物包括上游引物Actin1-RT-F1和下游引物Actin1-RT-R1,序列分别如SEQ ID NO.7和SEQ ID NO.8所示。
第七方面,本发明提供利用水稻显性核雄性不育植株进行轮回选择育种的方法,包括:
(1)以上述水稻显性核雄性不育植株为母本,具有优良性状和基因的水稻为父本,进行杂交,收获F1种子;
(2)将F1种子种植并人工隔离,抽穗期分离出不育株和可育株;以不育株作为母本,授以可育株的花粉,收获不育株上的种子,作为第1轮轮回选择群体种子;
(3)将第1轮轮回选择群体种子进行种植并人工隔离,抽穗期分离出不育株和可育株;同样以不育株作为母本,授以可育株的花粉,收获不育株上的种子,作为第2轮轮回选择群体种子;
(4)根据育种需求重复步骤(3)若干次,即可得到若干轮轮回选择群体。
本发明首次发现EAT1过量表达会导致水稻花药绒毡层提前降解,这为进一步认识相关基因的表达稳态与绒毡层发育的关系提供了新的理论参考。并利用组成型启动子Ubiquitin驱动EAT1基因的表达,在转基因水稻植株中提高了EAT1基因的表达量,创制了显性雄性不育的遗传材料。
通过本发明获得的转基因植株可在其生长发育的任何时期通过叶片qPCR快速、准确地检测EAT1基因的过表达阳性,而无需基于特定时期和组织部位进行检测,极大地节省了时间。
此外,本发明创制的显性雄性不育系材料作为媒介,可以在轮回选择育种中快速淘汰非目标材料,高效聚合多种优异性状和基因(如高产、抗病和抗逆等),有效提高育种效率;同时,由于含pUbi-EAT1载体的水稻均表现为不育,从可育植株收获的种子不含有转基因成分,有助于绿色、安全地推广应用。
附图说明
图1为显性核雄性不育水稻的遗传转化载体pUbi-EAT1的质粒图谱。
图2为本发明实施例2中EAT1基因在野生型与pUbi-EAT1转基因植株幼嫩小花中的相对表达量。
图3为本发明实施例2中野生型植株与pUbi-EAT1转基因植株的小花和花粉对比图,其中,图a、图b、图c分别为野生型植株的小花、花器官表型图以及花粉碘染图;图d、图e、图f分别为pUbi-EAT1转基因植株的小花、花器官表型图以及花粉碘染图。
图4为本发明实施例2中野生型植株与pUbi-EAT1转基因植株花药半薄切片对比图,其中,图a、图b、图c分别为野生型植株的8a期、8b期、9期的花粉结构图;图d、图e、图f分别为pUbi-EAT1转基因植株的8a期、8b期、9期的花粉结构图;图g、图h、图i分别为野生型植株的10期、11期、12期的花粉结构图;图j、图k、图l分别为pUbi-EAT1转基因植株的10期、11期、12期的花粉结构图。
图5为本发明实施例3中通过叶片qPCR快速鉴定EAT1基因的过表达阳性。
图6为本发明实施例3中鉴定到的EAT1基因的过表达阳性单株的花粉育性,其中,图a为野生型植株的花粉碘染图;图b、图c、图d、图e、图f、图g、图h、图i、图j、图k、图l、图m、图n、图o、图p分别为过表达阳性单株编号#7、#8、#15、#28、#31、#33、#34、#38、#42、#43、#44、#47、#48、#49、#50的花粉碘染图。
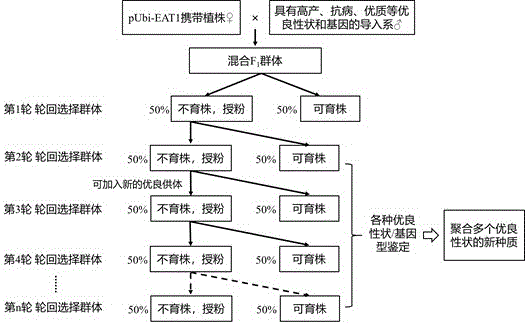
图7为本发明实施例4中基于显性核不育载体pUbi-EAT1的水稻轮回选择育种方法的技术流程图。
具体实施方式
骨架载体pRHV由四川农业大学陈学伟课题组提供,在前人论文中已公开(He F,Zhang F, Sun W, et al. A Versatile vector toolkit for functional analysis ofrice genes[J]. Rice, 2018, 11(1):27)。
在本发明的描述中,需要说明的是,实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面结合附图和具体的实施例对本发明做进一步详细说明,所述是对本发明的解释而不是限定。
实施例1
显性核不育载体pUbi-EAT1的构建及遗传转化
1.1 以粳稻品种日本晴为材料,用试剂盒Plant Total RNA Isolation Kit(Foregene)提取水稻总RNA(所有 EP 管、枪头均进行无DNA/RNA酶处理)。随后用HiScriptII Reverse Transcriptase(Vazyme)试剂盒,按说明书配制反应体系进行反转录,获得cDNA。
1.2 以上一步的cDNA作为模板,用
EAT1-OE-F:SEQ ID NO.3
tccccgggtgagctcggtaccATGATTGTTGGGGCTGGTTACT(小写为载体同源臂序列;ggtacc为KpnI酶切位点);
EAT1-OE-R:SEQ ID NO.4
agcggccgcactagtaagcttTTAGTTGAATATGTCGAGGGCCT(小写为载体同源臂序列;aagctt为HindⅢ酶切位点)。
水稻雄花发育基因EAT1序列如SEQ ID NO.2所示。
1.3 将扩增产物胶回收后连入带有
1.4 参照Hiei(Hiei Y, Ohta S, Komari T, et al. Efficienttransformation of rice (
1.5 通过农杆菌介导的侵染转化法导入受体水稻材料日本晴的愈伤组织中,具体参照现有研究中的方法进行(Nishimura, et al. A protocol for
实施例2
pUbi-EAT1转基因植株表型观察
2.1
取幼嫩小花样品于液氮中磨碎,用试剂盒Plant Total RNA Isolation Kit(Foregene)提取总RNA(所有 EP 管、枪头均进行无DNA/RNA酶处理)。随后用HiScript IIReverse Transcriptase(Vazyme)试剂盒,按说明书配制反应体系进行反转录,获得cDNA。进一步利用
EAT1-RT-F1:SEQ ID NO.5
CAGAGGAGGTCAAAGGAATG
EAT1-RT-R1:SEQ ID NO.6
CCGAACCTTCTGATACCTTAGT
2.2 表型观察
选取抽穗期各水稻材料的颖花,用镊子剥开观察花药形态。在载玻片上滴加一滴蒸馏水,将雄蕊用镊子捣碎,并滴加碘-碘化钾(iodine-potassium iodide,I
进一步对花药进行半薄切片观察。如图4所示,WT和pUbi-EAT1载体转化植株的花药均分化出了花粉母细胞、表皮层、内皮层、中间层和绒毡层,并在第8a期出现椭圆形的减数分裂细胞。然而,在第8b期,pUbi-EAT1转化植株的绒毡层出现异常肿胀(图4 e)。随着小花继续发育,WT的绒毡层逐步降解,在第12期完全消失,而pUbi-EAT1转化植株的绒毡层在第11期便已提前降解完毕(图4 k),明显早于WT。在水稻花粉发育过程中,绒毡层会逐渐退化为小孢子提供发育所需的营养,这一过程必须精确进行。前人研究表明
实施例3
pUbi-EAT1显性核不育系的创制及快速鉴定方法
3.1 pUbi-EAT1显性核不育系的创制
以pUbi-EAT1转化的水稻植株作为母本,其他相同或不同遗传背景的可育水稻作为父本,通过杂交创制不育系。F
表1 F
/>
/>
/>
3.2 快速鉴定
将上述杂交产生的种子种于温室,在所述种子从苗期到成熟期生长阶段的任一时期取叶片提取RNA并反转录为cDNA。利用
EAT1-RT-F1:SEQ ID NO.5
CAGAGGAGGTCAAAGGAATG
EAT1-RT-R1:SEQ ID NO.6
CCGAACCTTCTGATACCTTAGT
所述内参引物:
Actin1-RT-F:CCTTCAACACCCCTGCTATG(SEQ ID NO.7)
Actin1-RT-R:CAATGCCAGGGAACATAGTG(SEQ ID NO.8)
本实施例选取拔节期叶片,所有携带pUbi-EAT1载体植株的qPCR结果如图5所示,
为了验证qPCR的结果,在抽穗期通过直接观察或花粉碘染判断植株的育性。育性统计结果如表2所述,部分花粉碘染结果如图6所示,所有经过叶片鉴定为过表达阳性的植株均表现出花粉败育,准确度100%。
表2 叶片中的
实施例4
基于显性核不育载体pUbi-EAT1的水稻轮回选择育种方法
一种基于显性核不育载体pUbi-EAT1的水稻轮回选择育种方法,具体步骤如下(如图7所示):
(1)以携带pUbi-EAT1载体的水稻显性核雄性不育材料为母本,具有高产、抗病、优质等优良性状和基因的水稻品种或材料为父本,进行杂交,收获F
(2)将F
(3)将上一步得到的种子进行种植并人工隔离,抽穗期继续分离出50%不育植株和50%可育植株;同样,以农艺性状优良的不育株作为母本,授以可育株的花粉,收获不育株上的种子,作为第2轮轮回选择群体种子;
(4)重复步骤(3),可以得到第3轮至第n轮轮回选择群体,并可根据育种需求在轮回选择群体中添加具有目标性状和基因的供体;
(5)收获上述步骤中性状优良的可育单株,并结合基因型鉴定、分子标记辅助选择等鉴定出符合育种目标的植株,即为聚合多个优良性状和基因的新种质。同时,由于含pUbi-EAT1载体的水稻均表现为不育,在收获可育植株种子的同时也就筛除了转基因成分,有助于绿色、安全地推广应用。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- EAT1基因的应用及恢复EAT1基因缺失导致水稻雄性不育的方法
- EAT1基因的应用及恢复EAT1基因缺失导致水稻雄性不育的方法
