用于使用电泳后处理增强与电泳分离的分析物相关联的信号的方法
文献发布时间:2024-01-17 01:27:33
相关申请交叉引用
本申请要求于2021年1月21日提交的美国临时专利申请号63/140,075的优先权,其全部公开内容通过引用结合于此。
技术领域
本文所述的实施方案总体上涉及用于分离和分析分析物的蛋白免疫印迹式技术。本文所述的实施方案特别良好地适合于增强单个细胞的内容物的基于芯片的电泳中的信噪比。
背景技术
单细胞蛋白免疫是测量细胞群体中的蛋白质表达异质性的强大方法。美国专利号10,267,795公开了通过其分离和分析各个细胞的内容物的系统和方法,该专利的全部公开内容通过引用结合于此。MiloTM单细胞蛋白免疫平台是由
根据已知技术,微流体装置(也称为“芯片”)利用含有细胞的样品润湿。芯片包括或限定形成在薄聚丙烯酰胺凝胶层中的微孔阵列。微孔的大小被确定为使得它们各自被配置为容纳单个细胞。允许来自样品的细胞沉降到孔中,并且将未捕获在微孔阵列中的细胞冲洗掉。然后,阵列暴露于快速裂解所捕获的细胞的组合运行缓冲剂/裂解剂。施加电场然后使得细胞裂解物(例如,蛋白质)从容纳单个细胞的微孔迁移到凝胶层中。凝胶层还包括光活化的官能团。在分离分析物之后,将凝胶层暴露于光源,该光源活化官能团以将分离的蛋白质共价键结合至凝胶。所结合的蛋白质随后利用经标记的一种或多种免疫试剂(例如一种或多种抗体)探测并且使用免疫荧光或任何其他合适的技术检测,从而提供关于每个单细胞裂解物的蛋白质大小和免疫反应性的信息。
在标准蛋白免疫印迹上通常检测到的一些蛋白质可能不容易在根据已知方法执行的单细胞蛋白免疫上检测到。因此,期望的是找到对已知单细胞蛋白免疫方法的、可以增强使用已知方法不容易检测的蛋白质的检测的改进。
附图说明
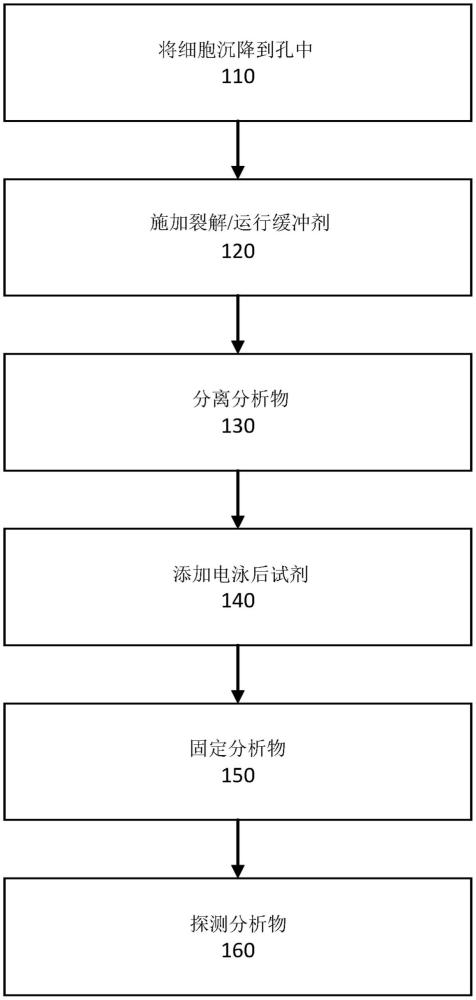
图1是根据实施方案的用于执行单细胞蛋白免疫的方法的流程图。
图2A是示出来自根据已知方法分离和探测的单细胞的β肌动蛋白的芯片的图像。
图2B是示出来自根据实例分离和探测的单细胞的β肌动蛋白的芯片的图像。
图3A和图3B示出了本文所述的电泳后试剂的作用的模式的实例。
图4示出了根据实验数据的信噪比(SNR)对电泳后试剂的施加和分析物固定的影响。
图5描绘了实验数据,其示出了用于两种电泳后处理的β肌动蛋白、β微管蛋白和GAPDH以及其中不施加电泳后试剂的对照组的SNR。
具体实施方式
本文所述的一些实施方案涉及一种方法,该方法包括利用含有生物细胞的样品润湿微流体装置(也称为“芯片”)。芯片可以包含多个孔,该多个孔中的每个孔具有被设计成容纳单个细胞的大小和形状。可以允许样品“沉降”,使得各个细胞迁移到各种孔中和/或由各种孔捕获。然后可以从芯片洗涤样品和未被孔捕获的任何细胞。来自细胞的分析物可以被电泳分离。例如,芯片可以容纳分离介质并且利用缓冲剂润湿。可以在芯片上施加电压,使得分析物在电动力下从孔迁移并进入分离介质中,其中它们可以例如基于其迁移率而分离。在分离后,可以将试剂施加到芯片上。试剂可以被配置为增加探针结合到至少分析物的子集的能力,并且促进分析物的检测和/或定量。然后可以例如利用抗体探测分析物。
本文所述的一些实施方案涉及一种方法,该方法包括通过在微流体装置暴露于运行缓冲剂和/或利用运行缓冲剂润湿的同时在越微流体装置上施加电压,以电泳分离安置在微流体装置的孔中的分析物。芯片包括分离介质,使得当施加电压时,孔内的分析物迁移到与孔相邻的分离介质的一部分中。在分离后,可以将试剂施加到芯片上。试剂可以被配置为增加探针结合到至少分析物的子集的能力,并且促进分析物的检测和/或定量。施用试剂后,分析物可以固定在分离介质中,并且可以施加探针。
本文所述的一些实施方案涉及一种方法,该方法包括裂解安置在微孔中、由分离介质限定和/或由分离介质包围的细胞(例如,一个细胞)。可以在分离介质上施加电压,使得来自细胞的蛋白质从孔迁移并进入和/或通过分离介质。在施加电压和/或分离蛋白质之后,可以利用变性剂或其它合适的试剂处理分离介质。蛋白质可以固定在分离介质内。然后,可以利用经标记的免疫试剂探测分离介质,该经标记的免疫试剂被配置为结合到蛋白质表位并且有利于检测具有该表位的蛋白质。例如,免疫试剂可以包括光学可检测标记(例如,荧光染料),可以经由吸光度检测,可以经由天然荧光检测,被配置为结合到另一(例如,二级)经标记的单体试剂等。
图1是根据实施方案的用于执行单细胞蛋白免疫的方法的流程图。在110处,微流体装置(例如,芯片)可以通过含有生物细胞的样品润湿或以其它方式暴露于含有生物细胞的样品。微流体装置可包括和/或限定一系列孔。孔可以是具有例如20至40微米的中值直径和/或5至100pL的中值体积的微孔。在其它实施方案中,微孔可以具有10至100微米的中值直径和/或1至1000pL的中值体积。每个孔可以被配置为捕获单个细胞或细胞大小的含有分析物的物体,诸如珠。以这样的方式,可以将各个细胞(或珠)被隔离到各个孔中,使得可以通过对每个孔的内容物执行免疫测定(或任何其它合适类型的测定)来评估样品异质性。在一些情况下,沉降可以是重力驱动的。在一些其它实例中,细胞可以具有合适的特性,这些特性可以用于使用任何合适的物理力操纵和/或引导细胞进入特定孔中。例如,细胞(或选定细胞)可以被暴露以捕获带磁性或静态电荷的结合剂。在此类情况下,可以生成一个或多个磁场或电场,并且将其用于将具有磁性和/或电特性的细胞引导到孔。
在120处,可以将裂解剂和/或运行缓冲剂施加到芯片。在一些情况下,运行缓冲剂-被配置为在分离阶段期间在芯片中和芯片上传导电力的缓冲剂-可以含有裂解剂。在其它情况下,可以将不同于运行缓冲器的裂解剂施加到芯片。裂解剂可以被配置为使安置在孔中的细胞的膜破裂,从而释放分析物。分析物通常是蛋白质,但可以是任何合适的细胞内容物或可以结合到细胞样珠的其它部分。通常,裂解在小于10秒和环境温度下实行。
在130处,可以分离分析物。分离分析物可以包括在芯片上施加电位差(即,电压),使得分析物被电泳分离。电压诱导电场,该电场向分析物施加电致作用力,从而使它们从孔迁移到邻近和/或围绕孔的分离介质中。例如,芯片可以包括孔形成到其中的聚丙烯酰胺凝胶层。当施加电压时,分析物可以在通道中在电压的方向上迁移(例如,平行于芯片的平面;垂直于孔的轴线),例如如图2A和图2B所示。可以通过电泳迁移率、等电点或任何其他合适的参数来分离分析物。
在140处,可以施加电泳后试剂。试剂可以是变性剂(即,可操作以使蛋白质变性的试剂)或配置成增加探针结合到至少分析物的子集的能力的任何其它合适的化合物。据信,在不包括添加电泳后试剂的已知单细胞蛋白免疫技术中,某些蛋白质未完全变性和/或以其它方式可接近检测抗体/探针。例如,与传统蛋白免疫(其中样品通常在高温(例如,70至100℃)下变性)相比,在一些或全部已知的单细胞蛋白免疫中,高温变性是不可行的。在单细胞蛋白免疫中,期望或需要的是细胞保持完整,直到沉降到孔中,在沉淀之前该高温变性应防止。附加地,在沉降后施加的高温变性步骤将产生分析物的显著对流混合和/或扩散,从而使内容物从孔分散并降低将内容物从一个孔到另一孔进行区分的能力。另外,在传统的蛋白免疫中,通常引入破坏二硫键的还原剂。然而,此类试剂倾向于增加缓冲剂的电导率,因此可能不适合单细胞蛋白免疫(其中芯片的增加的加热可能对分析物分离和/或检测不利)。总而言之,根据已知方法,通过已知单细胞蛋白免疫技术分离的蛋白质可能比通过传统蛋白质技术分离的相同蛋白质更不完全变性。因此,本文所述的电泳后试剂通过例如进一步的变性蛋白来增加探针和分析物之间的亲和力。此外或替代性地,电泳后试剂可以增加分离介质的捕获。例如,如下文进一步详细讨论那样,分离介质可以被配置为固定分析物。电泳后试剂可以能够增加安置在分离介质内的官能团的捕获效率,使得较大百分比和/或量的分析物被捕获并固定在分离介质中,并且因此可以存在高浓度和/或量的分析物以使探针结合,这可以增加与探针相关联的信号。电泳后试剂可以以其他方式操作以修改分析物和/或分离介质以增加与探针相关联的信号和/或减少背景噪声。
电泳后试剂可以添加到运行缓冲剂中,或者可以从芯片洗涤运行缓冲剂,并且可以将电泳后试剂施加到芯片上。在一些情况下,可能期望的是仅在130处的分离完成之后添加电泳后试剂,因为电泳后试剂可以具有比运行缓冲剂更高的电导率和/或增加运行缓冲剂的电导率。因此,在分离完成之前添加电泳后试剂可以由于例如增加的加热而对分离有害。然而,应理解的是,尽管被称为电泳后试剂,但在一些情况下,可以在分离之前或分离期间添加试剂。
在150处,可以固定分析物。例如,分离介质可以含有在活化时共价键结合至分析物的官能团。例如,官能团可以被光激活,并且被配置为在暴露于紫外(UV)辐射时结合到蛋白质和将蛋白质固定在分离介质内。
在160处,可以探测分析物。例如,一个或多个探针(例如,一抗、适体、纳米体、抗体衍生物、天然配体、合成配体、反结构或其它合适的部分)可以施加于芯片以选择性地结合到分析物、分析物的子集和/或分析物的特定位置。在一些实施方案中,二抗可以应用于芯片以结合一抗,包括选择性结合至分析物的子集和/或分析物的特定位置的一抗。(多个)探针可以包括染料或其它可检测标记。例如,(多个)探针可以包括荧光染料或被配置为发射光学信号使得可以确定(多个)探针结合到其的分析物的位置和/或数量的其它合适的化学发光剂。例如,为了检测分析物的数量和/或浓度,可以激发经标记的免疫试剂,使得其发射荧光发射信号,该荧光发射信号可以与探针被配置为选择性地结合到其并且可以由相机或其它合适的光学装置检测的表位相关联。也可以采用其它已知的标记技术,诸如使用酶选择性地沉积视觉上显而易见或吸收光的不透明化合物、放射标记的探针、具有可检测的天然荧光和/或吸光度特性的探针等。
图2B是示出来自根据上文参考图1描述的方法分离和探测的单个NALM细胞中的β肌动蛋白的芯片的图像。图2A是示出来自根据已知的单细胞蛋白免疫技术分离和探测的单个NALM细胞的β肌动蛋白的芯片的图像,并且不包括电泳后试剂的施加。每个白色圆形区210为被配置为捕获单个细胞的孔。在图2A和图2B中的每个的芯片中,微孔被布置成相隔200微米的竖直列和相隔900微米的水平列。通过在芯片上施加240V的分离电压75秒,将来自细胞的蛋白质在Milo仪器中分离,使得蛋白质从孔移动到分离培介质中。在分离并将芯片暴露于UV辐射四分钟以固定分析物之后,施加对β肌动蛋白敏感的探针。选择性结合至β肌动蛋白的探针的浓度通过增加的暗度来指示。虽然在大多数细胞中,β肌动蛋白是丰富的,但是在图2A,仅较弱地检测到β肌动蛋白。
相比之下,图2B中示出的芯片通过在电泳后去除15mL的裂解运行缓冲剂并且在固定分析物之前利用15mL的0.25M甘氨酸HCl缓冲剂(pH~2)替换来制备。与图2A相比,在图2B中更强地检测到β肌动蛋白。类似地,图2B证明,参照图1所示和描述的方法大大增加了用于检测β肌动蛋白的探针的信号强度和/或信噪比。
图3A示出了本文所述的电泳后试剂的作用的模式的实例。根据已知的单细胞蛋白免疫技术,当施加裂解剂时(例如,在步骤120处),蛋白质401(例如,样品中的一些或全部蛋白质)可能未完全变性。一旦被固定(例如,在步骤150处),蛋白质的构型就被冷冻,并且一抗403被配置为结合到的表位402可能不可接近。
施加如本文所述的电泳后试剂(例如,在步骤140处)可以更完全地使得蛋白质404变性,从而暴露表位,并且增加蛋白质与一抗之间的亲和力,从而增加结合405的发生。
图4示出了根据实验数据的来自电泳后试剂(电泳后处理(PET))的施加和分析物固定的信噪比(SNR)的影响。因为将分离介质暴露于UV光会冻结蛋白质的构象,所以在施加电泳后试剂之前增加UV暴露的持续时间降低电泳后处理的有效性。具体而言,当在施加UV光之前施加电泳后试剂时,SNR超过100。然而,在具有施加电泳后试剂之前的15秒的UV曝光的情况下,SNR下降到大约15,并且在具有施加电泳后试剂之前的30秒的UV曝光的情况下,不存在与噪声可区分的特定信号,等同于无电泳后处理。因此,期望的是在分析物固定之前将变性剂或其它合适的电泳后试剂施加到芯片。
当采用已知的单细胞蛋白免疫技术时,本文所述的实施方案能够增加具有不良可检测性的某些分析物(例如蛋白质)的SNR。例如,虽然在具有高丰度的许多细胞中出现β肌动蛋白,但当使用已知的单细胞蛋白免疫技术时,尽管通常以较低丰度(相对于β肌动蛋白)出现的其它蛋白质容易地可检测,但未检测到β肌动蛋白或仅微弱地出现β肌动蛋白。表1呈现了各种电泳后试剂和试剂溶液的实验数据。
表1
实验数据表明,甘氨酸-HCl和HCl溶液在增加了根据已知的单细胞蛋白免疫技术检测起来具有挑战性的某些蛋白质的SNR方面是有效的。表1进一步表明,仅运行缓冲剂置换在增加β肌动蛋白的可检测性方面是无效的,并且所测试的中性/轻微碱性试剂是无效的。因此,IT可能期望分离后试剂/缓冲剂具有低于4且在一些情况下低于3的pH。其中碱性Tris-甘氨酸和甘氨酸游离酸一般不增加β肌动蛋白的SNR或产生可检测的峰的实验。
表2列出了对于增加其它靶蛋白(包括β微管蛋白(BTUB)、GAPDH、AML1和CASP7)的SNR有效的附加电泳后试剂。表2中列出的电泳后试剂相对于其中不施加电泳后试剂的已知方法在将所标识的靶的SNR提高至少20%方面是有效的。表2中标识的电泳后试剂通过降低背景信号、增加峰面积或两者有效地增加了SNR。例如,TCEP溶液相对于对照组倾向于降低背景信号,并且即使所检测到的峰面积可能不显著增加,所得到的SNR改善。相比之下,1M甘氨酸HCl溶液和纯HCl或HCl+KCl溶液倾向于增加背景信号,但峰面积更显著地增加,从而导致更高的SNR。当计算表2中的SNR时所评估噪声与背景不同(例如,噪声是背景周围的波动,但噪声通常在背景增加时增加)。最后,表2还示出了其中电泳后处理包括向裂解/运行缓冲剂添加试剂,而不是去除裂解/运行缓冲剂和利用电泳后试剂/缓冲剂进行替换的一些情况。例如,将5mL 1M甘氨酸HCl或15mL 0.5M甘氨酸HCl添加到现有的15mL裂解/运行缓冲剂中导致SNR增加7.8倍。
表2
图5描绘了实验数据,其示出了用于两种电泳后处理的β肌动蛋白、β微管蛋白和GAPDH以及其中不施加电泳后试剂的对照组的SNR。两种处理是0.25M甘氨酸-HCl和0.1MHCl。在β肌动蛋白的情况下,对照组未显示可检测的峰,但群体中值SNR在0.25M甘氨酸-HCl或0.1M HCl的电泳后处理的情况下增加~50X。在对照组中检测到β微管蛋白和GAPDH两者,其中中值β微管蛋白SNR随着0.25M甘氨酸-HCl的电泳后处理而增加,并且随着0.1M HCl略微降低。对于两种电泳后治疗,GAPDH的SNR显著增加。
尽管在上面已经描述了不同的实施方案,但是应当理解,它们仅仅作为示例且非限制性地呈现。例如,虽然本文描述的实施方案通常描述基于芯片/微流体装置的技术,但应当理解,可以使用任何合适的电泳技术。
在上述示意图和/或实施方案指示以某些取向或位置布置的某些部件的情况下,可以修改部件的布置。尽管已经特别地显示和描述了实施方案,但是应该理解,可以做出形式和细节的多种变化。尽管已经将各种实施方案描述为具有特定特征和/或部件的组合,但是其它实施方案可能具有来自如上面讨论的任何实施方案的任何特征和/或部件的组合。
在上述方法和/或事件指示以某种顺序发生的某些事件和/或程序的情况下,可以修改某些事件和/或程序的顺序。此外,某些事件和/或程序在可能时可以在平行过程中同时执行,以及如上所述依次执行。
本文中使用的术语“分析物”表示要通过电泳技术分离和/或用本文提供的方法、设备和系统检测的任何分子或化合物。尽管本文所述的实施方案大体上指蛋白质分析物,但应理解,可以根据本文所述的方法检测任何其它合适的分析物。例如,合适的分析物可以包括但不限于小化学分子,诸如例如环境分子、临床分子、化学物质、污染物质和/或生物分子。更具体地,这样的化学分子可以包括、但不限于杀虫剂、杀昆虫剂、毒素、治疗和/或滥用药物、抗生素、有机材料、激素、抗体、抗体片段、抗体-分子缀合物(例如,抗体-药物缀合物)、抗原、细胞膜抗原、蛋白(例如,酶、免疫球蛋白和/或糖蛋白)、核酸(例如,DNA和/或RNA)、脂质、凝集素、碳水化合物、全细胞(例如,原核细胞诸如病原性细菌和/或真核细胞诸如哺乳动物肿瘤细胞)、病毒、孢子、多糖、糖蛋白、代谢物、辅因子、核苷酸、多核苷酸(包含核糖核酸和/或脱氧核糖核酸)、过渡态类似物、抑制剂、受体、受体配体(例如,神经受体或其配体、激素受体或其配体、营养物受体或其配体和/或细胞表面受体或其配体)、受体-配体复合物、营养物、电解质、生长因子和其它生物分子和/或非生物分子、以及它们的片段和组合。在某些实施方案中,所述分析物是蛋白或蛋白复合物,并且所述样品是细胞的裂解物或纯化的蛋白。其它合适的分析物可以包括胶体和/或乳剂的聚集体、附聚物、絮状物和/或分散相微滴或颗粒。所分离的分析物种类可以被称为“带”。
本文中使用的术语“样品”表示含有待检测的一种或多种分析物的组合物。在某些实施方案中,样品是异质的,即含有多种组分(例如,不同的蛋白),或同质的,即含有一种组分(例如,一种蛋白的群体)。本文所述的实施方案大体上指生物细胞的异质性混合物的分析,其中各个细胞由微流体装置的孔捕获。然而,应当理解,样品可以含有分析物的任何合适的组成成分。例如,分析物可以选择性地结合至细胞大小的珠。在此类实施方案中,“裂解”步骤或裂解步骤类似物可以从珠中释放分析物。
在某些情况下,样品可以是天然存在的、生物材料和/或人造材料。此外,样品可以处于天然(例如,细胞悬浮液)或变性形式(例如,裂解物)。在某些情况下,样品可以是单个细胞(或单个细胞的内容物,例如,作为来自单个细胞的细胞裂解物,或纯化的蛋白)或多个细胞(或多个细胞的内容物,例如,作为来自多个细胞的细胞裂解物,或来自多个细胞的纯化的蛋白)、血液样品、组织样品、皮肤样品、尿样品、水样品和/或土壤样品。在某些情况下,样品可以来自活生物体,诸如真核生物、原核生物、哺乳动物、人、酵母和/或细菌,或者样品可以来自病毒。
- 用于分析物的电泳分离和分析的系统和方法
- 用于分析物的电泳分离和分析的系统和方法
