颈环寡核苷酸及其在含有Z碱基的制备方法中的应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及基因测序领域,尤其涉及颈环寡核苷酸及其在含有Z碱基的制备方法中的应用。
背景技术
2-氨基腺嘌呤(Z碱基)是一种天然存在的非经典核苷酸碱基,1997年Kirnos等人首次报道了蓝藻S-2L基因组中腺嘌呤(A碱基)被2-氨基腺嘌呤(Z碱基)完全取代的情况。与A碱基相比,Z碱基的2位具有额外的氨基。Z、G、C、T组成的DNA(Z-DNA)中,Z与T配对,形成三个氢键,将双链DNA的稳定性提高了1~2℃。研究表明,含有这种碱基的寡核苷酸探针利于对已知的碱基突变进行临床的基因分型。
目前,制备寡核苷酸链的方法主要有化学合成法和酶促合成法。化学合成具有高度的稳定性和保真度,是当前寡核苷酸商业合成的主要途径。但是由于原料合成困难,价格昂贵等因素,合成Z-DNA寡核苷酸链成本较高,周期较长。酶促合成是一种低成本、快速、稳定的合成方法,常用的酶促合成法有末端脱氧核苷酸转移酶(Terminal deoxynucleotidetransferase,TdT)法、体外转录和反向转录(Invitro transcription andreversetranscription,ivTRT)、不对称聚合酶链式反应(Asymmetricpolymerase chainreaction,aPCR)、滚圈扩增(Rolling circle amplification,RCA)、环介导的等温扩增(loop-mediated isothermal amplification,LAMP)或链置换扩增(strand displacementamplification,SDA)等。1)TdT:TdT是利用聚合酶不加选择地将脱氧核苷酸三磷酸(dNTPs)添加到ssDNA的3’端,具有底物特异性低和不依赖模板聚合的特点,但并不适用于单个碱基的添加。2)ivTRT:ivTRT通过转录将dsDNA模板转化为RNA,然后使用逆转录酶将RNA还原为ssDNA。这种方法既劳动密集又昂贵。此外,核酸酶的使用会限制产物的产量。3)aPCR:在aPCR反应体系中,有两种浓度不等的扩增引物,通过两次扩增用于产生所需的ssDNA。第一个阶段是dsDNA模板的指数扩增,第二个阶段是线性扩增,用于产生ssDNA。aPCR的操作虽然简单,但容易产生非特异性扩增,通常需要大量的实验来优化,且产生副产物和未分离的条带。4)RCA:RCA依靠等温聚合酶,以环状单链DNA为模板,进行边取代边聚合的恒温扩增,合成一长段重复的ssDNA序列。这种方法扩增效率较低,反应时间较长。5)LAMP:LAMP通常使用4~6条引物特异性识别靶基因的6~8个不同区域,利用DNA聚合酶在一小时内将几个DNA拷贝扩增到十亿份,从而实现高效、精准的基因扩增。但由于其对引物的设计要求较高,且反应容易产生非特异性扩增,使得LAMP技术的使用受到了一些限制。6)SDA:SDA是利用切口酶和具有链置换功能的聚合酶如Bst DNA polymerase或者Klenow Fragment(3’→5’exo-),边聚合,边酶切,进行恒温扩增反应,从而产生ssDNA的过程。在单次SDA反应中,不到一个小时就可以产生109个目标DNA拷贝,该方法简单易行。
链置换反应是基于碱基互补配对发生的,它是指一条单链DNA或利用具有链置换功能的聚合酶边合成单链DNA边置换掉DNA双链中原绑定链的反应过程。Toehold是指一段悬挂的、短的单链DNA(6-8nt)。Toehold介导的链置换反应是一种受吉布斯自由能变控制的、竞争性结合的反应,其主要过程是入侵的单链核酸首先结合于双链DNA悬挂的toehold区域,进而通过链迁移过程取代双链DNA中的保护链形成新的双链DNA。根据链置换反应前后吉布斯自由能变是否有变化,可将toehold介导的链置换细分为toehold链置换和toehold链交换反应。
基于核酸检测的分子诊断技术已广泛的用于临床预测、诊断以及治疗。循环肿瘤DNA(ctDNA)就是肿瘤细胞释放到血液中DNA,随血液在全身循环;而cfDNA包含的范围则更广,包括ctDNA在内,加上其他正常细胞释放到血液中的DNA都被统称为cfDNA。cfDNA在生物医学的诊断和治疗中具有重要的潜在应用,包括可用于癌症的早期诊断、评估肿瘤的分期和预后、指导用药等。然而,片段化DNA的长度通常在160-180bp,且会根据生理和病理条件而发生动态变化。此外,ctDNA比cfDNA短,其中在某些肿瘤类型中特别小的DNA片段显著增加。
单核苷酸多态性(single nucleotidepolymorphism,SNP),指由单个核苷酸发生转换、颠换、插入或缺失引起的DNA序列多样性,变异频率>1%。
目前,对片段化DNA的检测主要有PCR技术和二代测序,根据检测通量可将检测方法分为低通量和高通量两大类。低通量的方法,包括Sanger测序、Taqman探针和质谱仪检测等方法。高通量方法多以二代测序技术为基础,主要包括:全基因组重测序、全外显子捕获测序、简化基因组测序和基因芯片等方法。1)Sanger测序:Sanger测序是依赖于双脱氧核苷酸终止反应,产生不同长度片段进行测序的,是SNV检测的“金标准”,Sanger测序不仅可以确定突变的类型和位置,还能发现未知SNP位点。但Sanger测序成本相对较高,通量较低,适用于位点少,样本少的情况。2)Taqman探针法:Taqman探针法是一项基于qPCR平台的,具有速度快、特异性好、灵敏度高、准确性高等特点的SNP分型技术。3)质谱仪检测法:质谱法是基于基质辅助激光解析电离飞行时间质谱技术(MALDI-TOF MS)的检测方法。该方法需要对样品进行多步纯化,操作较为复杂,多用于医学领域。4)二代测序:二代测序是最为准确的鉴定方法,但其耗时较长,通常需要4-7天的中转时间,不利于做出快速的医疗鉴定反应,且在经济成本和人力成本上消耗较大。
连接酶链反应(Ligase chainreaction,LCR)最早由Barany于1991年提出用于检测点突变,是一种序列特异性连接方法,基于连接反应依赖型核酸检测原理,开发了灵敏的夹板等温RNA检测方法,用于检测包括非典型肺炎病毒SARS-CoV和中东呼吸综合征相关冠状病毒MERS在内的多种病原体和RNA病毒,甚至识别SARS-CoV-2变体的点突变。LCR使用耐热DNA连接酶将两个合成探针序列杂交到特定的ssDNA序列上进行连接,当鉴别引物的3'端不匹配时,会阻止DNA连接酶将两个片段连接在一起。然而,这些基于连接酶的识别能力的检测方法在很大程度上取决于连接酶的保真度,这可能会导致假阴性结果。LCR是已知单核苷酸多态性(SNP)检测中最敏感、特异度高的方法。
开发用于片段化的DNA的快速且灵敏的检测方法,对人类健康至关重要。而toehold介导的链置换反应适合短片段DNA的检测及分型,所以,开发基于toehold介导的链置换反应的生物传感器用于片段化DNA的精准基因分型具有很大的潜力。新型的分子检测系统也扩展了用于即时检测的工具包,为新兴的病原菌、病毒的即时检测提供另一种可能。同时,Z碱基的加入,增强了探针的选择性和结合强度,有助于提高检测灵敏度。
发明内容
有鉴于此,本发明提供了颈环寡核苷酸及其在含有Z碱基的制备方法中的应用。本发明开发了一种低成本、快速、简单、高效的含有Z碱基的寡核苷酸链制备方法。由于原料采购困难、价格昂贵等因素,商业合成带有Z碱基的寡核苷酸链成本较高,周期较长。酶促合成是一种低成本、快速、稳定的方法。我们基于酶促反应中链置换反应开发了一种低成本、快速、简单、高效的含有Z碱基的寡核苷酸链制备方法。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了颈环寡核苷酸,包括:目标结合区、颈环区和切口酶识别区;
所述目标结合区与目的片段的序列互补;
所述切口酶识别区识别切口酶,所述切口酶包括:Nt.BspQI。
在本发明的一些实施方案中,上述颈环寡核苷酸中,所述颈环寡核苷酸的5’端携带生物素。
在本发明的一些实施方案中,上述颈环寡核苷酸中,所述切口酶识别区具有:如SEQ ID NO:1所示的序列:5’-GCTCTTCN-3’。
在本发明的一些实施方案中,上述颈环寡核苷酸中,所述颈环区包括环区和直区;所述环区的长度不小于3nt。
本发明还提供了上述颈环寡核苷酸在制备含有Z碱基的核苷酸链中的应用。
本发明还提供了含有Z碱基的核苷酸链的制备方法,包括如下步骤:取上述颈环寡核苷酸经聚合反应,酶切,磁珠分离后,获得所述含有Z碱基的核苷酸链;
所述聚合反应的原料包括:dZTP。
在本发明的一些实施方案中,上述制备方法中,所述聚合反应的原料还包括:dCTP、dGTP、dTTP和DNA聚合酶。
本发明还提供了探针,包括:线性探针1、线性探针2和上述制备方法获得的含有Z碱基的核苷酸链;
所述线性探针1包括:启动子区和toehold区1;
所述线性探针2包括:toehold区2和RNA适配体;
所述含有Z碱基的核苷酸链与目的片段的序列互补;
所述toehold区1和所述toehold区2连接后,与所述目的片段的序列互补。
在本发明的一些实施方案中,上述探针中,所述含有Z碱基的核苷酸链为阻遏链。
在本发明的一些实施方案中,上述探针中,所述含有Z碱基的核苷酸链的长度约为10~20nt,所述线性探针1除启动子区外与目的片段序列互补的部分约为8~15nt,所述线性探针2除RNA适配体外与目的片段序列互补的部分约为8~15nt。
在本发明的一些实施方案中,上述探针在设计时需参考吉布斯自由能,所述含有Z碱基的核苷酸链结合于目的片段序列的吉布斯自由能与线性探针1和线性探针2结合于目的片段序列的吉布斯自由能相等,该置换过程处于一个动态平衡状态。
在本发明的一些实施方案中,上述探针中所述启动子区具有:
(4)、如SEQ ID NO:2所示的核苷酸序列;或
(5)、如(4)所示的核苷酸序列经取代、缺失或添加一个或多个碱基获得的核苷酸序列,且与(4)所示的核苷酸序列功能相同或相似的核苷酸序列;或
(6)、与(4)或(5)所示的核苷酸序列至少有80%同一性的核苷酸序列;或
所述RNA适配体具有:
(7)、如SEQ ID NO:3所示的核苷酸序列;或
(8)、如(7)所示的核苷酸序列经取代、缺失或添加一个或多个碱基获得的核苷酸序列,且与(7)所示的核苷酸序列功能相同或相似的核苷酸序列;或
(9)、与(7)或(8)所示的核苷酸序列至少有80%同一性的核苷酸序列。
在本发明的一些实施方案中,上述探针中,SEQ ID NO:2的序列为:ccctatagtgagtcgtattaatttcgcgacaacacgcgaaattaatacgactcactataggg;
SEQ ID NO:3的序列为:ggatccattcgttacctggctctcgccagtcgggatcc。
在本发明的一些实施方案中,上述探针中,所述线性探针1的序列:5’PO4-(与靶标互补序列)TTccctatagtgagtcgtattaatttcgcgacaacacgcgaaattaatacgact cactataggg3’。
加粗部分为保护碱基,1-2个碱基,一般为A或T,加粗斜体部分为T7启动子序列。
在本发明的一些实施方案中,上述探针中,所述线性探针2的序列:5’ggatccattcgttacctggctctcgccagtcgggatccACG(与靶标互补序列)3’
加粗斜体部分为适配体,加粗部分为保护碱基,2-3个碱基,一般为ACG。
本发明还提供了颈环寡核苷酸、上述制备方法获得的含有Z碱基的核苷酸链和/或上述探针在基因测序中的应用。
在本发明的一些实施方案中,上述应用中所述基因测序包括:检测单碱基突变和/或基因分型。
本发明还提供了基因的测序方法,包括如下步骤:
S1:取上述探针与所述基因混合;
所述含有Z碱基的核苷酸链与所述基因结合后,所述线性探针1和所述线性探针2通过链置换反应将所述含有Z碱基的核苷酸链置换下来;
S2:将所述线性探针1和所述线性探针2连接,所述线性探针1的所述启动子区转录所述线性探针2的所述RNA适配体,获得转录产物;
S3:所述转录产物与荧光标记结合,检测荧光信号的强度,获得连接产率,进而获得所述基因的序列和/或分型结果。
在本发明的一些实施方案中,上述测序方法具体为:
当所述基因为野生型时,由于所述含有Z碱基的核苷酸链与所述基因完全互补配对,在所述基因上的分支迁移倾向于朝一个方向不断移动,形成DNA连接复合体;
当所述基因为突变型时,由于所述含有Z碱基的核苷酸链与所述基因不完全匹配,所述含有Z碱基的核苷酸链容易被所述线性探针1和所述线性探针2移位,所述含有Z碱基的核苷酸链继续与未和所述线性探针1和所述线性探针2结合的突变型基因结合;
根据荧光信号的强度,获得分型结果。
在本发明的一些实施方案中,上述测序方法包括如下步骤:
S1:获得含有Z碱基的核苷酸链的野生型和突变型的荧光曲线斜率,分别为k
S2:获得野生型和突变型的荧光曲线的斜率,分别为k
S3:根据公式:f
S4:f
本发明提供了颈环寡核苷酸,包括:目标结合区、颈环区和切口酶识别区;所述目标结合区与目的片段的序列互补;所述切口酶识别区识别切口酶,所述切口酶包括:Nt.BspQI。
本发明的有益效果包括:
(1)、本发明开发了一种低成本、快速、简单、高效的含有Z碱基的寡核苷酸链制备方法。由于原料采购困难、价格昂贵等因素,商业合成带有Z碱基的寡核苷酸链成本较高,周期较长。酶促合成是一种低成本、快速、稳定的方法。我们基于酶促反应中链置换反应开发了一种低成本、快速、简单、高效的含有Z碱基的寡核苷酸链制备方法。
(2)、本发明适用于片段化DNA的检测,尤其是cfDNA的检测。PCR技术尤其荧光定量PCR技术在核酸检测扩增的片段长度在150bp-250bp左右,且对引物的设计需要靶标序列已知。但由于cfDNA高度片段化,且基因组在片段化的位置不确定,所以对于cfDNA而言,其长度和序列均是未知。这对于设计PCR引物与探针具有很大的挑战性,造成较高的假阳性或假阴性。但本发明中,线性序列和blocker序列与靶标互补序列均在变异位点附近,且它们的长度在20-30nt,所以对于所要检测的核酸序列只需要有约40bp左右即可,这对于临床上cfDNA的检测具有重大的意义。
(3)、本发明通过设计blocker结合野生型模板,并且将blocker中的A碱基替换为Z碱基,有利于blocker结合野生型模板,这对于含极微量突变型序列的检测具有重要的作用,提高检测的灵敏性和特异性。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
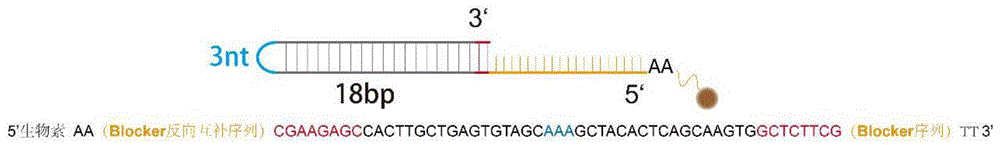
图1示制备Blocker所用颈环结构示意图;
图2示含Z碱基的寡核苷酸链的制备和表征;其中:a示含Z碱基的寡核苷酸链的制备过程,用DNA聚合酶I Klenow片段(3'→5'外切)从短发夹环状DNA(SHPL-DNA)3'端延伸形成双链DNA,得到含Z碱基的长发夹环状DNA(Z-LHPL-DNA),同时,用Nt.BspQI来裂解Z-LHPL-DNA;随后,使用DNA聚合酶从缺口处进一步延伸SHPL-DNA,取代目标含Z的单链DNA(Z-ssDNA);最后,在5'端用生物素修饰的SHPL-DNA被链霉菌素磁珠沉淀,目标Z-ssDNA可以从上清液中纯化出来;b示合成的A-ssDNA和Z-ssDNA的长度分布;c示A-ssDNA和Z-ssDNA的紫外线吸附光谱;d示含有A或Z的LHPL-DNA的熔解曲线;
图3示Toehold辅助的链置换反应结合线性探针的连接反应原理示意图;
图4示Toehold辅助的链置换反应用于单核苷酸变异检测原理示意图,当靶标为野生型靶标(WT)时,blocker与WT完全互补,靶标WT分别与blocker和线性探针的结合处于动态平衡。当靶标为突变型靶标(SNV)时,blocker与SNV有一个碱基的错配,线性探针更容易置换与SNV结合的blocker,反应趋向于线性探针和靶标SNV结合,有利于线性探针的连接;
图5示线性探针连接后的转录产物与孔雀石绿(MG)结合后,RNA核酸适配体将产生荧光,通过荧光信号的强度来检测转录产物的多少;
图6示在toehold控制的连接和转录反应(toehold-controlled ligation andtranscriptional reaction,TLT)单核苷酸变异检测方法中引入Z碱基,以提高基因分型的敏感性;其中:a示用toehold探针和blocker与靶标组装的连接复合物示意图,线性探针的toehold用浅蓝色标记,与blocker重复的序列用绿色标记,blocker的toehold用黄色标记,单碱基突变位点(红点),blocker被表示为B(T-p,探针toehold的核苷酸数量;T-B,blocker的toehold核苷酸数量);b和c示在存在或不存在所制备的A-blocker或Z-blocker的情况下,连接到野生型靶标(WT)和突变型靶标(SNV)的两个线性探针的荧光增长曲线;
图7示Z含量和位置对基因分型敏感性的影响;其中:a示四种不同Z含量和不同Z到突变位点距离的blocker组装的连接复合物示意图;b示不同突变的A-blocker和Z-blockerTLT检测的fold change;c示不同突变的A-blocker和Z-blocker的TLT检测f
具体实施方式
本发明公开了颈环寡核苷酸及其在含有Z碱基的制备方法中的应用。
应该理解,表述“……中的一种或多种”单独地包括每个在所述表述后叙述的物体以及所述叙述的物体中的两者或更多者的各种不同组合,除非从上下文和用法中另有理解。与三个或更多个叙述的物体相结合的表述“和/或”应该被理解为具有相同的含义,除非从上下文另有理解。
术语“包括”、“具有”或“含有”,包括其语法同义语的使用,通常应该被理解为开放性和非限制性的,例如不排除其他未叙述的要素或步骤,除非另有具体陈述或从上下文另有理解。
应该理解,只要本发明仍可操作,步骤的顺序或执行某些行动的顺序并不重要。此外,两个或更多个步骤或行动可以同时进行。
本文中的任何和所有实例或示例性语言如“例如”或“包括”的使用,仅仅打算更好地说明本发明,并且除非提出权利要求,否则不对本发明的范围构成限制。本说明书中的任何语言都不应解释为指示任何未要求保护的要素对于本发明的实践是必不可少的。
此外,用以界定本发明的数值范围与参数皆是约略的数值,此处已尽可能精确地呈现具体实施例中的相关数值。然而,任何数值本质上不可避免地含有因个别测试方法所致的标准偏差。因此,除非另有明确的说明,应当理解本公开所用的所有范围、数量、数值与百分比均经过“约”的修饰。在此处,“约”通常是指实际数值在一特定数值或范围的正负10%、5%、1%或0.5%之内。
本发明提供了一种基于链置换反应生成含有Z碱基寡核苷酸链(blocker)的方法。制备blocker所用颈环结构说明:一个短发夹环状DNA(SHPL-DNA)是由NUPACK(http://www.nupack.org)设计的,该软件是用于设计和分析核酸结构的网络版。SHPL-DNA包括三个部分:与要制备的目标序列互补的目标结合区(黄色)、环状序列(灰色和蓝色)和含有Nt.BspQI识别位点(红色)的一般序列。序列见表1,DNA结构见图1,所制备的序列见表2。
在含有dZTP的dNTP混合物(dZTP、dTTP、dCTP和dGTP)存在下,使用DNA聚合酶IKlenow片段(3'→5'外切)从3'端延伸SHPL-DNA,生成含有Z的目标序列区,并产生含有Z的长发夹环状DNA(Z-LHPL-DNA)。同时,Nt.BspQI被用来识别裂解位点(5'-GCTCTTCN-3'如SEQID NO:1所示),并裂解了Z-LHPL-DNA。使用Nt.BspQI的好处是,裂解的结果是在限制性位点的3'端有一个缺口,这避免了在目标序列区域引入任何额外的核苷酸。随后,用DNA聚合酶从缺口部位进一步延伸SHPL-DNA,取代目标含Z的单链DNA(Z-ssDNA)。最后,在5'端用生物素修饰的SHPL-DNA被链霉菌素磁珠沉淀,目标Z-ssDNA可以从上清液中纯化出来。用含dATP的dNTP混合物(dATP、dTTP、dCTP和dGTP)以同样的方法制备含A的单链DNA(A-ssDNA)作为对照。整个制备过程的总反应时间只有120分钟。制备流程见图2a。用Qsep1生物片段分析仪(BiOptic,Inc.,New Taipei City,Taiwan,China)分析所制备产品的质量。使用QuantStudio 6Flex Real-Time PCR系统(Thermo Fisher Scientific,美国)测试LHPL-DNA的熔解温度。
如图2b所示,合成的A-ssDNA和Z-ssDNA具有正确的长度(14nt)和高纯度,没有可检测的杂质存在。此外,我们研究中合成的Z-ssDNA的紫外吸附光谱与现有技术一致,并再次确认成功合成了含有Z的单链DNA(图2c)。此外,Z-LHPL-DNA显示的熔解温度比A-LHPL-DNA高1.17℃(图2d)。这一结果表明,Z和T之间的三个氢键大大增加了合成的ssDNA与其互补链结合的热稳定性。因此,合成的Z-ssDNA可以作为TLT单核苷酸变异检测方法中的阻断剂,以改善阻断剂-目标序列相互作用的热稳定性,提高检测灵敏度。这种改进的热稳定性也可以使其他依赖DNA链之间特定杂交和结合的生物应用受益,如基因分型、靶向治疗、生物传感和药物输送。
本发明还提供了一种基于toehold辅助的链置换反应结合线性探针的连接反应提供一种在恒温下实现核酸序列特异性识别的系统。针对单链靶基因设计两个线性探针以及blocker探针(图3),然后使用DNA连接酶(如T4 DNA连接酶)对线性探针进行连接。
所述的blocker探针为单链DNA寡核苷酸,由3’→5’方向分为a和b两个区域序列。两个线性探针(I和II),线性探针I编码了3’端含有T7启动子的颈环结构1(深蓝色),5’端具有磷酸化与靶标序列部分互补的区域2(浅蓝色)为toehold区,线性探针II作为报告探针,3’端编码了与靶标序列部分互补的区域3(浅绿色)为toehold区,5’端编码了一个特殊的RNA适配体4(GGATCCATTCGTTACCTGGCTCTCGCCAGTCGGGATCC)(如SEQ ID NO:2所示)(深绿色)。其中2,3区域序列与靶基因互补,可通过DNA连接酶连接。blocker探针序列(a+b区域序列)或其b区域序列与线性探针I上区域2序列相同,a+b区域序列与靶基因互补(区域2为线性探针上与靶标序列互补的部分,blocker与靶标互补,与线性探针序列部分相同(线性探针区域2))。其中b区域(红色)是blocker的toehold区域,可参考图3。
线性探针1的序列:5’PO4-(与靶标互补序列)TTccctatagtgagtcgtattaattt cgcgacaacacgcgaaattaatacgactcactataggg 3’
加粗部分为保护碱基,1-2个碱基,一般为A或T,加粗斜体部分为T7启动子序列。
线性探针2的序列:5’ggatccattcgttacctggctctcgccagtcgggatccACG(与靶标互补序列)3’
加粗斜体部分为适配体,加粗部分为保护碱基,2-3个碱基,一般为ACG。
其作用原理是:首先blocker探针(B)结合到靶标DNA序列上,接着两条线性探针(I和II)会通过其toehold区域结合于靶标DNA序列(WT)上,然后线性探针通过链置换将B从靶标DNA序列上置换下来,最后T4 DNA连接酶会将线性探针(I和II)连接成单链线状产物。通过热动力学计算,我们设计的blocker结合于靶标DNA序列的吉布斯自由能与线性探针结合于靶标DNA序列的吉布斯自由能相等,导致该置换过程处于一个动态平衡状态。
当其用于单核苷酸变异的检测时,两个线性探针在没有B的情况下连接野生型靶标(WT)和突变型靶标(SNV)的效率几乎相同。然而,当B加入连接反应时,由于我们设计的B与WT完全互补配对,线性探针(I和II)的toehold序列引发B在WT上的分支迁移,最终线性探针(I和II)与WT形成DNA连接复合体,从而释放B,反之亦然,这个反应是一个可逆过程。而当模板是有一个单碱基突变的靶标SNV时,由于SNV与B不完全匹配,B很容易被线性探针(I和II)移位(B序列与WT完全互补,与SNV有一个碱基不互补,所以在WT上更容易结合,但线性探针是与靶标没有突变位点的部分结合,所以线性探针在WT和SNV靶标上结合能力相同),形成大量的DNA连接复合体,参考图4。从而,线性探针I上的T7启动子可以转录线性探针II上的RNA核酸适配体。转录产物与孔雀石绿(MG)结合后,RNA核酸适配体将产生荧光,因此,可通过荧光信号的强度来检测转录产物的多少,从而测定连接产率,参考图5。
blocker与野生型靶标(WT)间结合的稳定性成为基因分型检测的关键,为了提高blocker与野生型靶标(WT)结合的稳定性,我们将blocker中的A碱基全部替换为Z碱基,由于Z-T碱基对间形成三氢键,较A-T碱基对形成的二氢键更为稳定,所以含Z碱基的blocker较含A碱基的blocker能够更稳定和野生型靶标(WT)结合,影响线性探针的连接,从而具有更好的检测效果。
本发明所用到的所有颈环结构序列、寡核苷酸探针和靶标序列都是在苏州金唯智生物科技有限公司合成,见表1。Nt.BspQI、T4 DNA连接酶、链霉亲和素磁珠和10×NEBBuffer 2购自New England Biolabs(Ipswich,MA,USA)。DNA polymerase I Klenowfragment(3’→5’exo-)、Murine RNase Inhibitor、SYBR green I、50x ROX购自南京诺唯赞生物科技股份有限公司。孔雀石绿染料购自Sigma-Aldrich(Darmstadt,Germany)。Bovine Serum Albumin和T7 RNA Polymerase购自宝日医生物技术(中国北京)有限公司。ATP、NTPs、dATP、dTTP、dCTP、dGTP、1×TE Buffer购自生工生物工程(中国上海)股份有限公司。dZTP购自TriLink BioTechnologies(San Diego,CA,USA)。Tris-HCL(pH值7.5)购自赛默飞世尔科技(中国)有限公司。QIAquick Nucleotide Removal Kit购自QIAGEN GmbH(德国)。氯化镁溶液购买自北京百灵威科技有限公司。无酶水购自北京索莱宝科技有限公司。所使用的移液管尖端和管是无酶的,不需要预处理。本发明举例的突变体是在SARS-CoV-2的基础上获得的。
表1本发明所用到的颈环序列、寡核苷酸探针、靶标序列
表2合成的Blocker序列
本发明实施例1~实施例5中,所用原料及试剂均可由市场购得。
下面结合实施例,进一步阐述本发明:
实施例1制备含z碱基的ssDNA(blocker)
设计5’端含有生物素,带有blocker互补链和切口酶识别位点的颈环寡核苷酸结构,加入DNA聚合酶及dZTP、dTTP、dCTP、dGTP,进行聚合反应后用切口酶进行酶切,再利用磁珠将带有生物素的颈环寡核苷酸与扩增片段分离,从而产生含Z碱基的ssDNA。
颈环寡核苷酸GENEWIZ公司(中国苏州)合成(表1B001)用无酶水溶解至终浓度为1μM/μL。将1μL链霉亲和素磁珠(NEB)用10μL Binding Buffer(0.5M NaCl,20mM Tris-HCl,1mM EDTA)洗涤两次,用100μL Binding Buffer重悬后,加入1μM 5’端含生物素的颈环寡核苷酸。混合物在摇床中室温孵育30min。之后,用磁铁将吸附着颈环寡核苷酸的链霉亲和素磁珠沉降下来,去除上清。使用100μL Binding Buffer再将吸附有DNA的链霉素亲和的磁珠漂洗两次,然后用5μL的1xTE缓冲液重悬。反应体系为含有1μM附着在链霉亲和素磁珠上的颈环寡核苷酸模板,0.25U/μL Nt.BspQⅠ,0.125U/μL DNA polymerase I Klenow fragmentexo-,0.2mg/mL Bovine Serum Albumin,0.25mM dNTPs(dZTP、dCTP、dGTP、dTTP混合物),10×NEB Buffer2的25μL的反应体系。混合物在37℃温育30min后80℃温育20min热失活缺口酶和聚合酶。反应结束后,使用磁铁吸附将磁珠上的颈环寡核苷酸链沉降下来,使其与上清中的扩增产物分离。上清中的扩增产物即为含Z碱基的blocker(Z-blocker)。使用同样的方法制备含A碱基的blocker(A-blocker)作为对照。使用纯化试剂盒(QIAquickNucleotideRemoval Kit购买自QIAGEN GmbH(德国))对上清中的扩增产物纯化后进行毛细管电泳分析。图2b分别为A-blocker和Z-blocker的毛细管电泳图。合成的A-blocker和Z-blocker具有正确的长度(14nt)和高纯度,没有可检测的杂质存在。
实施例2连接反应和转录反应
为了验证本设计对单碱基变异的检测,我们人工设计了野生型(WT)/突变型(SNV)的靶标序列、线性探针(I和II)(表1位点E484K)以及按照上述方法制备blocker序列(表1B001)进行实验,参考图6a。将靶标序列、线下探针(I和II)以及按照实施例1含Z碱基的ssDNA制备方法所制备的blocker进行退火,之后加入连接酶,37℃温育3h。之后加入T7 RNA聚合酶、孔雀石绿染料(MG)及NTPs,对连接产物进行转录,37℃进行温育,并使用QuantStudio 6Flex Real-Time PCR系统(美国赛默飞世尔科学公司)每1分钟测量一次荧光。实验结果如图6b和6c所示,根据测定的实时荧光曲线,对于WT,不存在blocker时荧光曲线斜率明显高于存在blocker的情况,而相较于含A-blocker的情况,含Z-blocker时荧光曲线斜率更低,说明Z-blocker能够与WT更稳定的结合,更加有效的阻断了两个线性探针的连接。对于SNV,加入blocker后荧光曲线斜率反而高于不存在blocker的情况,blocker促进了SNV的循环使用。证明该方法能够对WT和SNV进行区分,且Z碱基的存在提高了blocker对靶标的区分能力,对该方法有一定的优化。
实施例3Z碱基含量和位置对单核苷酸变异检测的影响
Z的含量和位置是可以影响基因分型敏感性的潜在因素。为了更好地了解Z在基因分型灵敏度中的作用,我们从SARS-CoV-2变体中选择了四个特色突变(E484K、Y789Y、K837N和V172L),设计了四个具有不同Z含量和与突变位点距离的blocker,研究Z含量和位置对TLT单核苷酸变异检测方法灵敏度的影响(表1、图7a)。四个位点分别为001E484Kblocker含有七个A碱基,002Y789Yblocker含有三个A碱基,且均在突变位点3’端、003K837N blocker含有三个A碱基均匀分布于blocker序列上、004V172L blocker含有一个A碱基,且在突变点附近。
按照实施例1的方法分别制备A-blocker和Z-blocker,并进行线性探针连接反应和体外转录信号放大反应,同时进行三次平行实验。为量化不存在blocker或存在含不同碱基的blocker对靶标上线性探针连接的影响,我们根据荧光曲线斜率k定义了fold change,数学上表示为:fold change(WA)=k
同时定义了fw/fs,数学表示为fw/fs(A)=fold change(WA)/fold change(SA),fw/fs(Z)=fold change(WZ)/fold change(SZ)。理论上fw/fs(Z)小于fw/fs(A),说明Z-blocker较A-blocker对两种靶标的区分能力更强,灵敏度更高。
荧光信号的测定结果证明了这一点,如图7b所示,通过计算四个不同突变荧光曲线的fold change,可以看到,四个位点的fold change(SA)、fold change(SZ)均接近或大于1,明显高于fold change(WA)、fold change(WZ)。对比fold change(WA)位点001、002、003的fold change(WZ)值均有所降低,而位点004 fold change(WZ)值与fold change(WA)值基本接近。如图7c所示,位点001、002、003的fw/fs(Z)均小于fw/fs(A),位点004fw/fs(Z)与fw/fs(A)接近。考虑到位点004阻遏链中只含有一个A碱基,替换为Z碱基后对实验结果影响不大,符合预期。实验结果表明,Z碱基的加入增强了阻遏链与野生型靶标的结合强度,提高了线性探针的选择性。使用这种碱基类似物有利于筛选已知的碱基突变并进行临床的基因分型。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 含有二氮杂螺环片段的咪唑并1,2-a吡啶-3-酰胺类化合物及其制备方法和应用
- 一种含有过渡层的类金刚石涂层活塞环及制备方法
- 一种含有异羟肟酸的取代杂环类化合物及其制备方法和用途
- 氧化铝载体及其制备方法、乙烯环氧化反应用银催化剂及乙烯环氧化制备环氧乙烷的方法
- 含有假异胞嘧啶核碱基衍生物的3’修饰寡核苷酸及其作为引物或探针的应用
- 一种含通用碱基寡核苷酸序列及其在DNA杂交分析中的应用
