源于黄金芽的多酚氧化酶同工酶、基因、粗酶液及应用
文献发布时间:2024-04-18 19:58:30
技术领域
本发明属于茶叶加工技术领域,具体涉及一种源于黄金芽的多酚氧化酶同工酶、编码基因、粗酶液及应用。
背景技术
发酵茶是在加工过程中,充分发挥和利用多种酶的生物催化作用,生成不同的生物活性物质及风味物质的茶叶。其中,红茶主要是通过多酚氧化酶及过氧化物酶的作用,由儿茶素类化合物(L-EC、L-ECG、L-EGC、L-EGCG)产生茶黄素及茶红素类化合物。其中茶黄素类化合物主要为TF、TF2A、TF2B和TF3,其合成方式分别为:(L)-EGC+(L)-EC→TF、(L)-EGCG+(L)-EC→TF2A、(L)-ECG+(L)-EGC→TF2B和(L)-EGCG+(L)-ECG→TF3。
茶黄素对红茶的色、香、味及品质起着决定性的作用,是红茶汤色“亮”的主要成分,也是汤味强度和鲜爽度的重要成分,同时还是形成茶汤“金圈”的最主要物质。此外,研究表明茶黄素还具有显著的生物活性,如抗癌、抗炎、抗病毒、抗高脂、降糖作用、抗代谢综合征特性、预防骨质疏松和调节神经等功能。因此茶黄素含量的高低是决定红茶品质的关键因素之一。
茶黄素的产生从制茶的揉捻阶段持续到发酵阶段。然而茶黄素在成品茶中的含量一般不高,高品质的红茶含量一般也仅为1%左右。如何提高制茶过程中茶黄素的生物合成效率,或者如何采用体外合成的方式获得高产茶黄素对提高红茶等发酵茶的品质以及推动其在医疗保健领域的应用具有重要价值。
目前,多酚氧化酶(PPO)和过氧化物酶(POD)被认为是在红茶制造生产中生产茶黄素的关键酶,但仅有少数几种茶树中的多酚氧化酶PPO研究的较为透彻。公开日为2015年4月8日的中国发明专利《茶叶多酚氧化酶同工酶单体PPO1和PPO2及其制备方法》(公开号CN104498448 A)采用一芽二叶的政和大白、福云6号、桃源大叶茶树品种茶树鲜叶,依次通过丙酮粉富集酶蛋白、硫酸铵分级沉淀、强阴离子交换色谱、凝胶介质层析、分子鉴定、酶学性质分析等技术及优化工艺,分离制备了氨基酸序列结构、分子量、等电点、酶学性质明确的两种茶叶多酚氧化酶同工酶单体PPO1和PPO2的制备方法。该专利涉及的PPO1和PPO2并无提供具体碱基序列与蛋白序列,其所给Gene ID也无法对应到相应的PPO同工酶,其蛋白分子量大小也与本发明序列有较大差异。公开日为2015年5月27日的中国发明专利《一种利用茶多酚氧化酶同工酶PPO1酶促合茶黄素TF的方法》(公开号为CN 104651426A)公布了一种利用茶多酚氧化酶同工酶PPO1开展酶促合成茶黄素TF的方法。该方法是介绍以茶多酚氧化酶同工酶PPO1为酶源,以茶多酚中的儿茶素EC和EGC组分为主要反应底物,以一定pH值的缓冲液作为反应体系,经摇床振荡酶促反应以及后续的萃取、离心、浓缩、冷冻干燥等步骤,定向酶促合成单一茶黄素组分TF(theaflavin)的技术及工艺优化。
黄金芽(Camellia sinensis(L.)O.Kuntze cv.Huangjinya(Hjy Cs))茶树品种属于黄色系变异茶树品种,对光敏感,在光照下顶部叶片因叶绿素的合成受到抑制而呈现金黄色。其鲜叶色泽金黄、口感滋味丰富,因为稀有,也被称为“茶中大熊猫”。
发明内容
本发明的目的在于克服现有技术问题,并提供一种源于黄金芽的多酚氧化酶同工酶、核苷酸序列与粗酶液及其应用。
本发明所采用的具体技术方案如下:
第一方面,本发明提供了一种源于黄金芽的多酚氧化酶同工酶,所述多酚氧化酶同工酶为HJY-PPO1蛋白或HJY-PPO3蛋白,所述HJY-PPO1蛋白氨基酸序列结构如SEQ IDNo.1所示,所述HJY-PPO3蛋白氨基酸序列结构如SEQ ID No.2所示。
第二方面,本发明提供了一种编码第一方面所述的多酚氧化酶同工酶的基因,所述基因为用于编码HJY-PPO1蛋白的HJY-PPO1基因或用于编码HJY-PPO3蛋白的HJY-PPO3基因,所述HJY-PPO1基因的核苷酸序列如SEQ ID NO.3所示,所述HJY-PPO3基因的核苷酸序列如SEQ ID NO.4所示。
第三方面,本发明提供了一种含有第一方面所述的多酚氧化酶同工酶的粗酶液,所述粗酶液制备方法可采用从黄金芽茶树鲜叶中自然提取;优选的,所述自然提取是采用黄金芽茶树鲜叶经磷酸氢二钠-柠檬酸缓冲液提取、过滤、离心后获得含有所述多酚氧化酶同工酶的粗酶液。
第四方面,本发明提供了一种含有第一方面所述的多酚氧化酶同工酶的粗酶液,所述粗酶液通过人工合成制备,人工合成方法是将SEQ ID NO.3或SEQ IDNO.4所示的核苷酸序列作为目的基因序列导入重组大肠杆菌BL21进行体外表达,随后用柠檬酸-磷酸氢二钠缓冲液提取,获得含有所述多酚氧化酶同工酶的粗酶液。
第五方面,本发明提供了一种第一方面所述多酚氧化酶同工酶的应用,所述多酚氧化酶用于催化儿茶素类物质合成茶黄素和茶红素。
作为上述第五方面的优选,所述儿茶素类物质为儿茶素C、表儿茶素EC、儿茶素没食子酸酯CG、表没食子儿茶素EGC、表没食子儿茶素没食子酸酯EGCG和表儿茶素没食子酸酯ECG中的一种或多种;所述催化合成方式为:(L)-EGC+(L)-EC→TF、(L)-EGCG+(L)-EC→TF2A、(L)-ECG+(L)-EGC→TF2B、(L)-EGCG+(L)-ECG→TF3。
作为上述第五方面的优选,所述多酚氧化酶同工酶催化儿茶素类物质合成茶黄素和茶红素的功能在茶叶鲜叶体内或体外完成。
第六方面,本发明提供了一种第一方面所述的多酚氧化酶同工酶或第二方面所述的基因在茶树育种中的应用。
作为上述第六方面的优选,所述应用为通过培育低表达HJY-PPO1基因或HJY-PPO3基因的茶树品种,从而筛选适宜制作高茶多酚含量的绿茶茶树品系。
作为上述第六方面的优选,所述应用为培育高表达HJY-PPO1基因或HJY-PPO3基因的茶树品种,从而筛选适宜制作红茶的茶树品系。
本发明相对于现有技术而言,具有以下有益效果:
(1)本发明提供的HJY-PPO1蛋白或HJY-PPO3蛋白或其片段可以是天然纯化的产物,或是化学合成的产物,或使用重组技术从原核或真核宿主(例如,细菌、酵母、植物)中产生;
(2)本发明提供的多酚氧化酶同工酶或核苷酸序列可作为指标,通过客观数据设置红茶发酵参数(茶叶加工过程中的温度、湿度、pH、时间等),得到具有预期茶黄素含量的红茶;或是体外以儿茶素类化合物不同单体或混合物为底物,催化合成得到不同类别的茶黄素。
(3)本发明提供的HJY-PPO1蛋白或HJY-PPO3蛋白还可以用于体外高效合成单体茶黄素或筛选优良茶树品种、或调整茶叶中茶黄素类化合物含量、或作为标志物筛选适合制作绿茶的茶树品种和/或适合制作红茶的茶树品种。本发明能有效推进茶叶加工的标准化、自动化和机械化。
附图说明
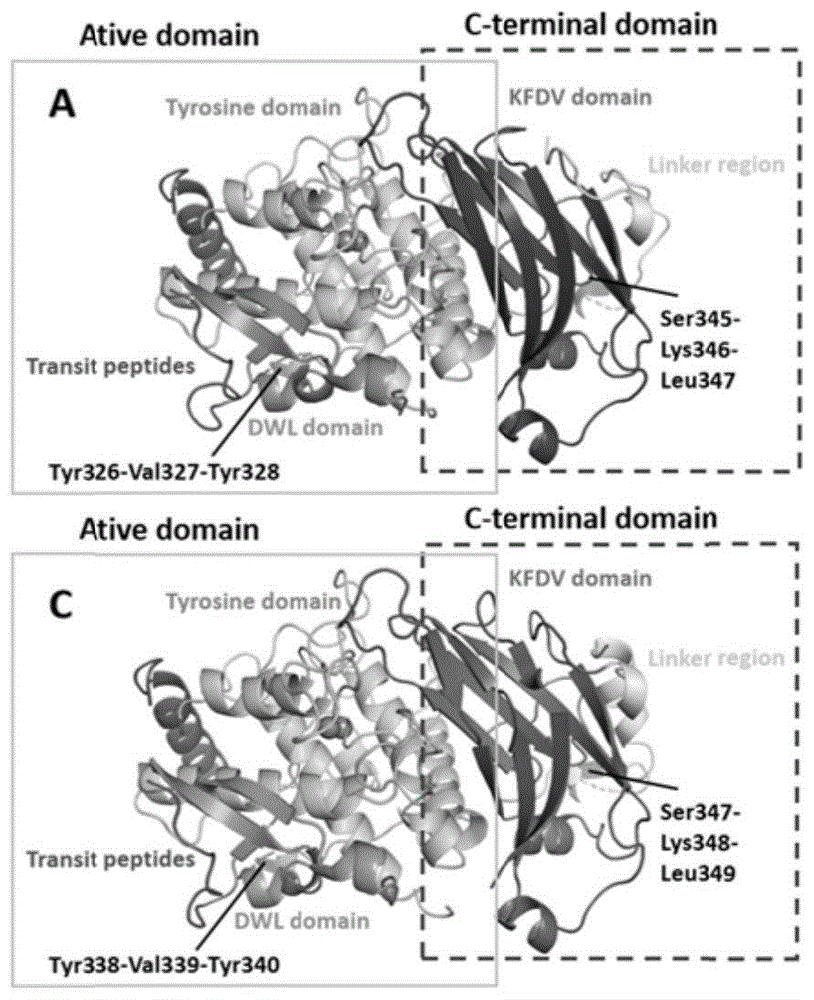
图1为本发明提供的HJY-PPO1蛋白(a)和HJY-PPO3蛋白(c)的分子结构图;
图2为实施例2中黄金芽鲜叶制作红茶不同阶段样本提取的多酚氧化酶粗酶活性图;
图3为实施例2中黄金芽鲜叶制作红茶不同阶段样本儿茶素类化合物含量的变化图;
图4为实施例3中重组菌进行目的蛋白表达和纯化过程中的聚丙烯酰氨凝胶电泳图;
图5为实施例3中HJY-PPO1和HJY-PPO3蛋白酶学性质的研究结果,其中图5(a)为不同pH值条件,图5(b)为不同温度条件;
图6为实施例3中HJY-PPO1和HJY-PPO3蛋白与儿茶素底物反应后溶液的颜色变化图;
图7为实施例3中HJY-PPO1和HJY-PPO3蛋白对儿茶素底物催化反应的HPLC检测色谱图;
图8为实施例3中步骤(5)中反应时,反应体系中不同儿茶素浓度和茶黄素含量的结果,图中每一组4条柱从左到右依次为TF1、TF2A、TF2B、TF3。
具体实施方式
下面结合附图和具体实施方式对本发明做进一步阐述和说明。本发明中各个实施方式的技术特征在没有相互冲突的前提下,均可进行相应组合。
本发明的具体实施方式中涉及的蛋白或其片段可以是天然纯化的产物,或是化学合成的产物,或使用重组技术从原核或真核宿主(例如,细菌、酵母、植物)中产生。
本发明公开了一种多酚氧化酶同工酶、编码多酚氧化酶PPO同工酶的DNA分子及其应用,具体如下实施例所示。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。本发明中后续实施例涉及的黄金芽茶树品种,植株种植于江苏省无锡市宜兴九香茶业基地,叶片采摘条件为25-28℃。
实施例1多酚氧化酶PPO1蛋白和PPO3蛋白的发现及鉴定
本实施例中,展示了多酚氧化酶同工酶HJY-PPO1蛋白和HJY-PPO3蛋白的发现及鉴定过程,具体如下:
选择黄金芽(Camellia sinensis(L.)O.Kuntze cv.Huangjinya(Hjy Cs))作为茶叶品种,从上述黄金芽茶基因库中筛选多酚氧化酶(PPO)相关基因,结合原核表达和功能验证,从黄金芽中发现了两个能够催化儿茶素类化合物合成茶黄素的多酚氧化酶同工酶,分别命名为HJY-PPO1蛋白和HJY-PPO3蛋白,氨基酸序列分别见SEQ ID NO.1和SEQ ID NO.2所示。将编码HJY-PPO1蛋白的基因命名为HJY-PPO1基因,其开放阅读框见SEQ ID NO.3所示;将编码HJY-PPO3蛋白的基因命名为HJY-PPO3基因,开放阅读框见SEQ ID NO.4所示。
在NCBI网站https://www.ncbi.nlm.nih.gov/分别对HJY-PPO1蛋白和HJY-PPO3蛋白进行blastn和blastp分析,二者的DNA和蛋白质序列比对结果分别为78.4%和74.2%。使用SWISS-MODEL对HJY-PPO1和HJY-PPO3进行建模,并且用EBI(https://www.ebi.ac.uk/interpro/)进行蛋白家族分析,HJY-PPO1和HJY-PPO3均属于植物多酚氧化酶家族,且具有特征性结构Tyrosine domain、DWL domain和KFDV domain,结果见图1。
实施例2红茶制作过程中多酚氧化酶活性的变化、基因表达的变化
本实施例中,展示了红茶制作过程中多酚氧化酶活性的变化、基因表达的变化,具体如下:
1、红茶制作过程不同阶段样本的获得
红茶的制作过程主要为鲜叶采摘、萎凋、揉捻、发酵、干燥五道工序。各工序阶段均需要获取样本。
采摘黄金芽植株的一芽一叶,作为鲜叶样本。将上述鲜叶样本在室温通风摊放16h左右,得到萎凋样本。用专业揉捻机械揉捻茶叶,得到揉捻样本。在发酵房中将茶叶30℃发酵3h,其中发酵1.5h时取样一次作为发酵中样本,发酵结束后得到发酵样本。将上述发酵样本于110℃条件下干燥15min左右,进行两次干燥,得到干燥样本。
2、不同样本酶活测定
将步骤1中得到的各样本(包括鲜叶样本、萎凋样本、揉捻样本、发酵中样本、发酵样本和干燥样本),利用常规方法提取蛋白,得到含有总蛋白的蛋白提取溶液。将上述蛋白提取溶液或其稀释液(采用pH值为5.5、浓度为0.1M的柠檬酸-磷酸缓冲液进行稀释)作为待测样本,检测多酚氧化酶酶活,计算得到总蛋白的多酚氧化酶酶活。
图2为黄金芽鲜叶制作红茶不同阶段样本提取的多酚氧化酶粗酶活性图。如图2所示,红茶加工过程中,发酵阶段的多酚氧化酶(PPO)活性达到最高。
3、儿茶素类化合物含量
将步骤1中得到的各样本(包括鲜叶样本、萎凋样本、揉捻样本、发酵中样本、发酵样本和干燥样本),检测儿茶素类化合物含量,具体方法如下:
精密称取0.2g均匀磨碎的上述样本于10mL离心管中,加入在70℃中预热过的70%甲醇溶液5mL,用玻璃棒充分搅拌均匀湿润,立即移入70℃水浴中,浸提10分钟(隔5分钟搅拌一次),浸提后冷却至室温,转入离心机在10000r/min转速下离心10min,将上清液转移至10mL容量瓶。残渣再用5mL的70%甲醇溶液重复提取一次。合并提取液定容至10mL,摇匀(该提取液在4℃下可至多保存24小时)。上述提取液过0.22μm滤膜后得到滤液待测。
取上述滤液,采用HPLC检测,标准品分别为:EC、EGC、ECG、EGCG。在相同色谱条件下,与标准品出峰位置±0.5min以内的峰,判断为同一物质。在相同色谱条件下,制作标准品含量与峰面积的标准曲线,通过对照标准曲线,通过计算,得到样品中各个儿茶素类化合物的浓度(每mg样本中含多少μg儿茶素类化合物)。
HPLC检测参数设置为:Waters e2695高效液相色谱,2489紫外可见检测器,Empower2色谱工作站,色谱柱为5C18-AR-II(250mm×4.6mm,5μm);进样量为20μL;流动相为A相(0.1%甲酸水溶液)、B相(纯乙腈),流动相流速为1mL/min。梯度洗脱程序:0min,92%A;12min,87% A;17min,80% A;42min,65% A;52-57min,10% A;67-72min 92% A。
图3为黄金芽鲜叶制作红茶不同阶段样本儿茶素类化合物含量的变化图。如图3所示,红茶加工过程中,各个阶段儿茶素类化合物含量均下降,说明部分儿茶素类化合物在加工过程中生成了茶黄素类化合物。
4、HJY-PPO1基因和HJY-PPO3基因的表达量
将步骤1中得到的鲜叶样本、萎凋样本、揉捻样本、发酵中样本、发酵样本和干燥样本,分别检测HJY-PPO1基因和HJY-PPO3基因的表达量,提取总RNA并反转录为cDNA,采用CsNADPH基因为内参基因,采用实时定量PCR检测HJY-PPO1基因和偏颇基因的相对水平。
用于检测HJY-PPO1基因和HJY-PPO3基因的引物对如下:
上游引物(PPO1qF):CCGAGACACAACCAACCTTC,SEQ ID NO.5;
下游引物(PPO1qR):ACTGGCTCATCTCCGTCATTA,SEQ ID NO.6。
上游引物(PPO3qF):ATGGCTTCTTTTCCACCTTC,SEQ ID NO.7;
下游引物(PPO3qR):TCAAGAATCAAACTCTATCT,SEQ ID NO.8。
结果见图4,结果中显示黄金芽鲜叶中HJY-PPO3表达量强于HJY-PPO1的表达量。
实施例3HJY-PPO1蛋白和HJY-PPO3蛋白的纯化和功能验证
本实施例展示了HJY-PPO1蛋白和HJY-PPO3蛋白的纯化和功能验证,具体如下:
1、构建重组质粒
(1)取黄金芽的鲜叶,常规方法提取总RNA,反转录得到cDNA。
(2)以步骤(1)得到的cDNA为模板,采用F1和R1组成的引物对进行PCR扩增。
PPO1F:ATGCCGATCTCCCCACCG,SEQ ID NO.9;
PPO1R:TTAGGAATCAAACTCAATCTTG,SEQ ID NO.10。
PPO3F:ATGGCTCCGGTCACTGCAC,SEQ ID NO.11;
PPO3R:TCAAGAATCAAACTCTATCT,SEQ ID NO.12;
(3)取步骤(2)得到的PCR扩增产物,用限制性内切酶BamHⅠ和SalⅠ进行双酶切,回收酶切产物。
(4)取pET-28a(+)载体,用限制性内切酶BamHⅠ和SalⅠ进行双酶切,回收载体骨架。
(5)将步骤(3)的酶切产物和步骤(4)的载体骨架连接,得到重组质粒。根据测序结果,对重组质粒进行结构描述如下:在pET-28a(+)载体的BamHⅠ和SalⅠ酶切位点之间插入了序列表的SEQ ID NO.3和SEQ ID NO.4所示的双链DNA分子。重组质粒中,具有序列表的SEQID NO.3和SEQ ID NO.4所示的融合基因。该融合蛋白又称为具有6×His标签的PPO1蛋白和PPO3蛋白。
2、制备重组菌
将步骤1构建的重组质粒利用热激转化法导入大肠杆菌BL21(DE3),得到重组菌甲和乙。
将pET-28a(+)载体导入大肠杆菌BL21(DE3),得到重组菌丙。
3、目的蛋白的表达和纯化
(1)将重组菌接种至含50mg/L卡那霉素的液体LB培养基中,37℃、200rpm振荡培养至OD600nm=0.6。
(2)完成步骤(1)后,在体系中加入IPTG并使其在体系中的浓度为0.5mmol/L,16℃、200rpm振荡培养16h。
(3)完成步骤(2)后,12000rpm离心10min,收集菌体沉淀。
(4)取步骤(3)得到的菌体沉淀,用柠檬酸-磷酸缓冲液(0.1M,pH5.5)缓冲液悬浮,然后冰浴中进行超声破碎(60W,每超声5s停5s,超声5min),然后10000rpm离心30min,收集沉淀和上清液。
(5)取步骤(4)得到的上清液,采用Ni-NTA琼脂胶进行纯化,纯化过程中采用WashBuffer洗涤以去除杂蛋白,采用Elution Buffer洗涤以收集目的蛋白,得到蛋白溶液。
Wash Buffer:由25mL 1M Tris水溶液、30mL 5M NaCl水溶液、3mL 5Mimidazole水溶液和942mL ddH2O组成。
Elution Buffer:由25mL 1M Tris水溶液、20mL 5M imidazole水溶液和955mLddH2O组成。
采用重组菌甲进行上述步骤,得到的蛋白溶液命名为PPO1蛋白溶液。
采用重组菌乙进行上述步骤,得到的蛋白溶液命名为PPO3蛋白溶液。
采用重组菌丙进行上述步骤,得到的蛋白溶液命名为对照溶液。
分别取重组菌甲和重组菌乙进行上述步骤过程中的如下样品进行聚丙烯酰氨凝胶电泳。所有井的加载量均为10μL,M:蛋白大小标记;1:非IPTG诱导HJY-PPO1;2:IPTG诱导HJY PPO1;3:非IPTG诱导HJY-PPO3;4:IPTG诱导HJY-PPO3;5:IPTG诱导His标签(5.4kDa);6:非IPTG诱导的pET28a(+)作为对照;7:纯化的HJY-PPO3;8:纯化的HJY-PPO1。电泳图见图4。
4、酶学性质检测
多酚氧化酶酶活测定方法采用比色法:反应体系为500μL;初始体系由50μL待测样本(含有PPO蛋白)、邻苯二酚(作为底物)、脯氨酸和pH值为5.5、浓度为0.1mM的柠檬酸-磷酸盐缓冲液组成,邻苯二酚的浓度为10g/L,L-脯氨酸浓度为10g/L;缓冲液:邻苯二酚:脯氨酸溶液为10:3:2作为反应液。初始体系室温静置反应30min,即为终止体系;采用分光光度计分别检测初始体系和终止体系在420nm的吸光值,终止体系的吸光值-初始体系的吸光值=吸光度差值;多酚氧化酶酶活=吸光度差值÷(总蛋白含量×反应时间),总蛋白的单位为mg,反应时间的单位为min。
由于儿茶素和茶黄素在碱性条件下不稳定,柠檬酸-磷酸缓冲液分别采用如下pH:pH3.5、4、4.5、5、5.5、6.0、6.5和7。反应温度为室温。结果见图5(a)。
分别采用如下反应温度:20、25、30、35、40、45、50、55、60、65。柠檬酸-磷酸缓冲液分别采用pH5.5和pH6.0。结果见图5(b)。
如图5所示,HJY-PPO1蛋白在pH为6.0和温度为35℃时活性最高;而HJY-PPO3蛋白在pH为5.5和温度为30℃时活性最高。
5、催化合成茶黄素类化合物的能力
反应体系(200μL):在pH5.5的磷酸氢二钠-柠檬酸缓冲液(含0.1mM Cu
反应条件:室温静置反应30min。反应结束时刻的照片见图6。反应结束后,采用0.22μm孔径滤网过滤,收集滤液。分别将滤液进行HPLC检测。
HPLC检测参数:Waters e2695高效液相色谱,2489紫外可见检测器,Empower2色谱工作站,色谱柱为5C18-AR-II(250mm×4.6mm,5μm);进样量为20μL;流动相为A相(0.1%甲酸水溶液)、B相(纯乙腈),流动相流速为1mL/min。标准品为表儿茶素标准品或茶黄素标准品。在相同色谱条件下,与标准品出峰位置±1min以内的峰,判断为同一物质。在相同色谱条件下,制作标准品含量与峰面积的标准曲线,通过对照标准曲线,通过计算,得到反应结束的体系中相应化合物的浓度。
梯度洗脱程序:0min,92% A;12min,87% A;17min,80% A;42min,65% A;52-57min,10% A;67-72min 92% A.
HPLC检测的色谱图(278nm的色谱图)见图7。反应结束时刻,反应体系中茶黄素浓度的结果见图8。结果表明,PPO1蛋白和PPO3蛋白均能催化单体茶黄素生成。
以上所述的实施例只是本发明的一种较佳的方案,然其并非用以限制本发明。有关技术领域的普通技术人员,在不脱离本发明的精神和范围的情况下,还可以做出各种变化和变型。因此凡采取等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。
- 小麦籽粒多酚氧化酶基因Ppo1突变体及其应用
- 多酚氧化酶及其编码基因和应用
