一种靶向MYC的siRNA、基于其的组合物及应用
文献发布时间:2024-04-18 19:58:30
技术领域
本发明属于抗肿瘤药物制备技术领域,具体涉及一种靶向MYC的siRNA、基于其的组合物及应用。
背景技术
血管,主要由内皮细胞(endothelial cell,EC)和周细胞等细胞组成,其中,EC是血管生成中最为关键的细胞。相比于正常组织,肿瘤组织中的EC在多种促血管生成因子的作用下,由静息状态转变为高度活化状态,表现为增殖、迁移能力强以及糖酵解等代谢途径活跃等。
血管生成是肿瘤发生发展的重要特征之一,一方面,血管生成能够为肿瘤生长提供营养物质及氧气,另一方面,血管生成可通过旁分泌因子促进肿瘤生长及转移。目前,抗血管生成疗法是多种肿瘤治疗的重要方式之一,临床上利用的药物主要是基于血管内皮生长因子(vascular endothelial growth factor,VEGF)等促进血管生成信号通路开发的单克隆抗体或小分子抑制剂,如贝伐单抗,这些药物一方面抑制血管形成达到饥饿肿瘤的目的,另一方面促进肿瘤血管正常化,从而有效提升放化疗以及免疫疗法的疗效。然而,现阶段这些药物在临床上的疗效均不佳,主要表现为①针对VEGF信号通路发挥作用,因而会出现其他促血管生成通路替代的情况,使肿瘤容易对这些抗血管药物产生耐药,从而导致药物失效;②通过降低血管密度发挥作用,该方法会导致血管生成过度抑制,从而可能会导致肿瘤内缺氧加重,进而出现肿瘤恶性程度增强等不良反应。因此,亟待探索新的干预肿瘤血管形成的靶点及策略,在推动抗血管生成疗法进展中具有重要理论意义及实际应用价值。
发明内容
为了克服上述现有技术的缺点,本发明的目的在于提供一种靶向MYC的siRNA、基于其的组合物及应用,提供有效的抗肿瘤血管生成药物。
为了达到上述目的,本发明采用以下技术方案予以实现:
本发明公开了一种靶向MYC的siRNA,所述靶向MYC的siRNA的sense序列如SEQ IDNO.5所示,所述靶向MYC的siRNA的antisense序列如SEQID NO.6所示。
本发明还公开了上述靶向MYC的siRNA在制备抗肿瘤血管生成药物中的应用。
本发明还公开了一种纳米材料包裹的靶向MYC的siRNA,由上述靶向MYC的siRNA与靶向内皮细胞的纳米材料混合得到。
优选地,所述靶向内皮细胞的纳米材料由NHS-PEG2K-cRGD与cy5.5-PEI25K溶于DMF反应12h,在截留分子量为1000的透析袋中透析24h后冷冻干燥得到。
优选地,靶向MYC的siRNA与靶向内皮细胞的纳米材料的质量比为1:3。
本发明还公开了上述纳米材料包裹的靶向MYC的siRNA在制备抗肿瘤血管生成药物中的应用。
本发明还公开了一种靶向MYC的药物组合物,包括上述靶向MYC的siRNA和化疗药物。
优选地,所述化疗药物为顺铂。
优选地,所述靶向MYC的siRNA包裹有靶向内皮细胞的纳米材料。
优选地,还包括其他可药用辅料或赋形剂。
与现有技术相比,本发明具有以下有益效果:
本发明公开了一种靶向MYC的siRNA,根据MYC在细胞增殖、分化等过程中发挥着重要作用的特点,提出一种新的抗血管生成策略—靶向MYC的siRNA,以MYC作为靶点,干预多种信号通路下游,引起多种促血管生成因子通路失活,通过促进内皮细胞由活化状态转变为静息状态,促进肿瘤血管正常化。该靶向MYC的siRNA能够在不降低血管密度的基础上,显著下调MYC的mRNA及蛋白水平,达到接近90%的抑制效率,有效改善血管的结构和灌流功能,从而改善肿瘤内部的缺氧程度,促进肿瘤血管正常化,应用于抗肿瘤血管生成的治疗中,提升化疗药物的疗效。
本发明还公开了一种纳米材料包裹的靶向MYC的siRNA,将靶向MYC的siRNA与靶向内皮细胞的纳米材料(Nano)偶联,得到siMYC+Nano,将其通过尾静脉给予肺癌肿瘤模型小鼠,结合免疫荧光染色等手段分析肿瘤生长、内部坏死、缺氧以及血管结构、功能等情况,发现siMYC+Nano可以有效地递送至肿瘤血管内皮细胞中,同时发挥抑制MYC表达的作用。同时,siMYC+Nano对肿瘤整体生长无明显影响,但是可以显著改善肿瘤内部的缺氧及坏死程度,进一步染色分析发现该策略能显著提升血管壁细胞覆盖程度及血管灌流能力,从而促进肿瘤血管正常化。
本发明还公开了一种靶向MYC的药物组合物,将siMYC与化疗药物顺铂联合使用,发现该策略可以显著提升化疗药物顺铂对肿瘤的生长抑制作用,并提高其对肿瘤的杀伤作用。更为重要的是,该策略对心脏、肾脏、肝脏以及肺脏等器官形态无明显损伤,同时对肝脏和肾脏的功能无明显损害。该策略为通过靶向干预内皮细胞中MYC表达从而促进肿瘤血管正常化,达到抗肿瘤的目的提供了可能性。
附图说明
图1为各组siRNA在体外鼠脑微血管内皮细胞中敲低效率的验证结果图;其中,A为MYC的mRNA水平检测;B为MYC的蛋白凝胶电泳图;C为MYC的蛋白水平检测;P值小于0.05被视作有统计学差异,**,p<0.01;***,P<0.001;****,P<0.0001;n.s,not significant.n=3;
图2为包裹或未包裹Nano的siNC和siMYC的大小以及包裹效率的检测图;其中,A为纳米颗粒的大体图,从左到右分别为Nano、siMYC+Nano和siNC+Nano;B为纳米颗粒的粒径分析结果图,b1为Nano,b2为siNC+Nano,b3为siMYC+Nano;C为纳米材料对siRNA的包裹效率;
图3为siMYC+Nano或siNC+Nano的体内抑制效率检测图;其中,A为激光共聚焦显微镜分析Nano在CD31+血管内皮细胞中的富集情况;B为肿瘤内皮细胞中MYC mRNA水平分析;C为肿瘤内皮细胞中的MYC蛋白凝胶电泳图;D为肿瘤内皮细胞中的MYC蛋白水平分析;P值小于0.05被视作有统计学差异,*,p<0.05;**,P<0.01.n=4or 5;
图4为包裹Nano的siMYC或siNC毒性作用的分析结果图;其中,A为生化分析血清中肝肾功能指标变化情况,a1为ALT,a2为AST,a3为BUN,a4为CR;B为H&E染色分析心、肾、肝和肺的组织形态变化情况;P值小于0.05被视作有统计学差异,*,p<0.05;n.s,notsignificant.n=5or 4;
图5为包裹Nano的siMYC或siNC对肿瘤生长影响的检测图;其中,A为肿瘤大体情况拍照;B为肿瘤重量和体积的比较分析统计图,b1为重量,b2为体积,n.s,not significant,n=8or 9;
图6为包裹Nano的siMYC或siNC对肿瘤内坏死影响的检测图;其中,A为H&E染色分析肿瘤坏死情况;B为A的统计分析图;P值小于0.05被视作有统计学差异,**,P<0.01.n=6;
图7为包裹Nano的siMYC或siNC对肿瘤内缺氧情况影响的检测图;其中,A为激光共聚焦分析瘤内PIMO+区域情况;B为A的统计分析图;P值小于0.05被视作有统计学差异,*,P<0.05.n=5;
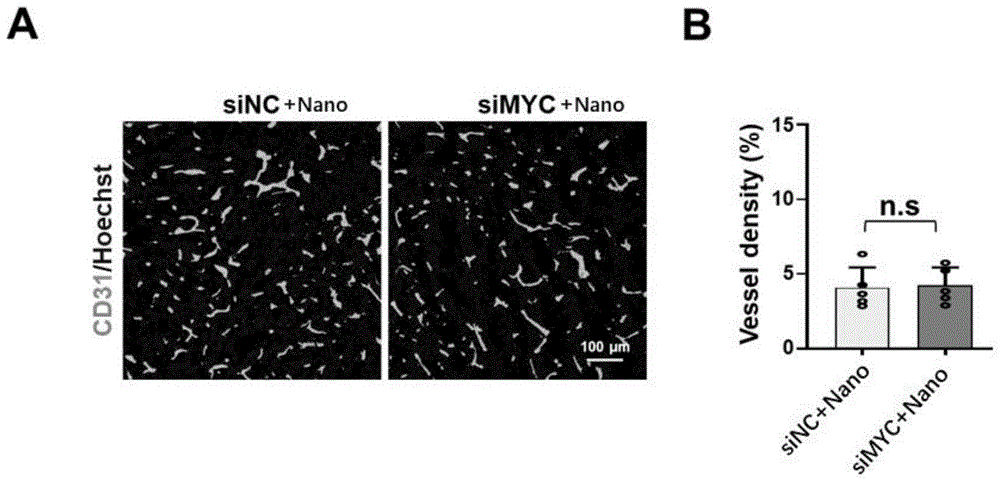
图8为包裹Nano的siMYC或siNC对肿瘤内血管密度影响的检测图;其中,A为激光共聚焦分析瘤内CD31+区域情况;B为A的统计分析图;P值小于0.05被视作有统计学差异,*,p<0.05;****,P<0.0001;n.s,not significant.n=5;
图9为包裹Nano的siMYC或siNC对肿瘤内皮细胞周围的α-SMA+血管壁细胞覆盖情况影响的检测图;其中,A为激光共聚焦分析瘤内CD31+以及α-SMA+区域情况;B为A的统计分析图;P值小于0.05被视作有统计学差异,*,p<0.05;****,P<0.0001;n.s,notsignificant.n=5;
图10为包裹Nano的siMYC或siNC对肿瘤内皮细胞周围的SM22+血管壁细胞覆盖情况影响的检测图;其中,A为激光共聚焦分析瘤内CD31+以及SM22+区域情况;B为A的统计分析图;P值小于0.05被视作有统计学差异,**,p<0.01.n=5;
图11为包裹Nano的siMYC或siNC对肿瘤内血管灌流情况影响的检测图;其中,A为激光共聚焦分析瘤内CD31+以及Dextran-2MD+区域情况;B为A的统计分析图;
图12为包裹Nano的siMYC联合CDDP对肿瘤的治疗效果图;其中,A为肿瘤的大体直观图;B为肿瘤的重量及体积的统计分析图,b1为重量,b2为体积;P值小于0.05被视作有统计学差异,*,p<0.05;**,P<0.01.n=7;
图13为肿瘤组织内坏死情况分析检测图;其中,A为明场观察H&E染色结果,从左到右依次为;B为A的统计分析图;P值小于0.05被视作有统计学差异,*,p<0.05.n=5。
具体实施方式
为使本领域技术人员可了解本发明的特点及效果,以下仅就说明书及权利要求书中提及的术语及用语进行一般性的说明及定义。除非另有指明,否则文中使用的所有技术及科学上的字词,均为本领域技术人员对于本发明所了解的通常意义,当有冲突情形时,应以本说明书的定义为准。
本文描述和公开的理论或机制,无论是对或错,均不应以任何方式限制本发明的范围,即本发明内容可以在不为任何特定的理论或机制所限制的情况下实施。
本文中,所有以数值范围或百分比范围形式界定的特征如数值、数量、含量与浓度仅是为了简洁及方便。据此,数值范围或百分比范围的描述应视为已涵盖且具体公开所有可能的次级范围及范围内的个别数值(包括整数与分数)。
本文中,若无特别说明,“包含”、“包括”、“含有”、“具有”或类似用语涵盖了“由……组成”和“主要由……组成”的意思,例如“A包含a”涵盖了“A包含a和其他”和“A仅包含a”的意思。
本文中,为使描述简洁,未对各个实施方案或实施例中的各个技术特征的所有可能的组合都进行描述。因此,只要这些技术特征的组合不存在矛盾,各个实施方案或实施例中的各个技术特征可以进行任意的组合,所有可能的组合都应当认为是本说明书记载的范围。
本文中,若无特别说明,核苷酸序列的方向从5’末端到3’末端的方向。
本发明提供了一种靶向MYC的siRNA,命名为siMYC,siMYC的sense序列如表1中的SEQ ID NO.5所示,siMYC的antisense序列如表1中的SEQID NO.6所示。经过体外实验证实,制得的siMYC可以有效降低内皮细胞中MYC的mRNA水平,继而降低MYC的蛋白质水平。
表1序列表
本发明提供了一种包裹纳米材料的靶向MYC的siRNA,命名为siMYC+Nano,将siMYC与靶向内皮细胞纳米材料(Nano,由西安瑞禧生物技术公司合成)以质量比为1:3混合得到。将包裹Nano的siMYC通过尾静脉注射递送至肺癌肿瘤模型小鼠的肿瘤组织中,发现可以有效降低肿瘤内皮细胞中MYC的表达水平。对正常组织进行苏木精-伊红染色(H&E)以及对血清进行生化分析结果表明,siMYC+Nano对正常组织无明显损伤作用;进一步对肿瘤组织进行苏木精-伊红染色、免疫荧光染色分析发现,siMYC+Nano可以有效促进肿瘤血管正常化,表现为血管壁细胞覆盖显著增多,血管灌流能力显著增强,从而有效降低肿瘤内部缺氧及坏死程度。
本发明提供了一种靶向MYC的药物组合物,将siMYC与化疗药物顺铂联合使用,发现可以显著提升化疗药物对肿瘤生长的抑制作用,并提升肿瘤内部坏死情况。
通过在体及离体结果均表明,siMYC可以有效降低内皮细胞中的MYC表达水平,通过与Nano联合使用可以有效递送至肿瘤内皮细胞中,从而有效促进肿瘤血管的结构和功能正常化;siMYC还表现出提高化疗药物疗效的作用,表明其具备与临床其他药物联合使用的潜力。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
下列实施例中使用本领域常规的仪器设备。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。下列实施例中使用的NHS-PEG2K-cRGD和cy5.5-PEI25K,均购于陕西西安瑞禧生物技术有限公司。使用的顺铂可与“顺式-二氯二氨合铂”、“Cisplatin”或“CDDP”互换使用,购于MCE公司,CAS号:HY-17394。“NS”可与“生理盐水”或“Saline”互换使用。其他各种原料,除非另作说明,都使用常规市售产品,其规格为本领域常规规格。在本发明的说明书以及下述实施例中,如没有特别说明,“%”都表示重量百分比,“份”都表示重量份,比例都表示重量比。
1、设计靶向小鼠MYC的siRNA,并在体外验证其对MYC表达水平的降低情况。
(1)针对鼠源MYC(GeneID:17869),利用BLOCK-iTTM RNAi Designer网站在线设计siRNA,获得三对排名靠前的siRNA序列:siMYC1#(sense序列如表1中的SEQ ID NO.1所示,antisense序列如表1中的SEQ ID NO.2所示)、siMYC2#(sense序列如表1中的SEQ ID NO.3所示,antisense序列如表1中的SEQ ID NO.4所示)和siMYC(sense序列如表1中的SEQ IDNO.5所示,antisense序列如表1中的SEQ ID NO.6所示),并交由上海吉玛生物技术有限公司合成。
(2)体外培养鼠脑微血管内皮细胞系(bEnd.3),传代至12孔板中(1×10
结果如图1中A、B和C所示,siMYC的抑制效率最为显著,mRNA及蛋白水平均能达到90%作用。
下面均以siMYC作为靶向MYC的siRNA进行实验。
2、将siMYC与Nano混合,进行在体注射,检测其对体内肿瘤内皮细胞中MYC的敲低情况。
(1)siMYC与Nano混合孵育的特性验证:称取100mg NHS-PEG2K-cRGD溶于3mL DMF中,加入cy5.5-PEI25K(1.1eq.)溶解完全,室温下反应12h;将反应液转移至透析袋(截留分子量1000Da),于纯水中透析24h,收集透析液冷冻干燥,得到Nano。其中,短肽cRGD可以与内皮细胞中的凝集素结合,从而实现内皮细胞靶向,包裹的荧光基团cy5.5可以对纳米材料进行体内示踪。用无菌、无RNA酶的PBS缓冲液稀释Nano的浓度至1mg/mL。随后以质量比为3:1混合Nano与siMYC,室温孵育10min,得到siMYC+Nano。同时,以质量比为3:1混合Nano与siNC,其他条件相同,获得包裹的对照siRNA(即,siNC+Nano),作为对照。
①扫描电镜观察纳米材料的形状:将Nano、siMYC+Nano以及siNC+Nano的溶液利用PBS稀释至终浓度为10ng/mL,分别于圆形玻片上分“上中下左右”五个点滴加液体,待水分挥发完全后,送至中国人民解放军空军军医大学军事医学创新中心的电镜中心进行后续的喷金以及观察记录分析。
结果如图2中A所示,Nano、siMYC+Nano以及siNC+Nano均可以聚合成圆形状态,表明纳米材料Nano可以在溶液中与siMYC或siNC形成良好的聚合形态。
②ZETA分析纳米材料平均粒径大小:按照①中的方法制备三种纳米材料溶液,然后送至中国人民解放军空军军医大学军事医学创新中心利用纳米颗粒跟踪分析仪对纳米材料的粒径大小进行分析。
结果如图2中B所示,Nano、siMYC+Nano以及siNC+Nano的平均直径约为150nm,大小相似,表明该纳米材料Nano的粒径大小适于体内递送药物。
③分别将siNC、siMYC、siNC+Nano以及siMYC+Nano按照顺序加入浓度为1%的琼脂糖凝胶的不同泳道中,在140V电压驱动下进行电泳,15min后利用凝胶成像系统对凝胶进行拍照分析。
结果如图2中C所示,包裹Nano的纳米材料组所有RNA均在上样孔中,说明相比于单纯的siMYC或siNC,Nano可以很好地将siMYC或siNC包裹起来,而不至于泄露至溶液中。
(2)验证siMYC+Nano对小鼠体内肿瘤内皮细胞中MYC的敲低情况:体外用含10%胎牛血清(FBS)的DMEM培养基培养扩增LLC(lewis lung cancer)细胞系,待长至70%~80%后,使用胰蛋白酶于37℃条件下消化,1200rpm离心4min后,利用无血清DMEM培养基重悬并计数,将细胞密度调整至2×10
①作用终点的小鼠经过10%水合氯醛麻醉后,经心脏灌注PBS后,将肿瘤组织取出,于4%多聚甲醛中4℃条件下固定3h,然后利用30%蔗糖溶液进行脱水,4℃条件下脱水12h后,用OCT包埋并于-20℃条件下冻存。将组织于冰冻切片机上进行切片,获得厚度为8μm的肿瘤组织切片,于室温晾干2h后,于PBS中洗涤5min,然后用含1%BSA以及0.3%TritonX-100的PBS溶液室温封闭1h,随后加入大鼠源性的抗CD31单克隆抗体(1:200稀释),4℃条件下孵育12h;PBS室温洗涤3遍,加入驴抗大鼠的-Alexa594荧光二抗(1:400稀释),室温孵育2h后,加入Hoechst溶液,室温核染15min;PBS室温洗涤3遍,加入50%甘油封片,并于激光共聚焦显微镜下观察CD31+血管内皮细胞中Nano的Cy5.5富集情况。
结果如图3中A所示,Nano颗粒能够很好地富集于CD31+血管中。
②作用终点的小鼠按照上述步骤灌注,取出肿瘤组织,加入含I型胶原酶(终浓度为1mg/mL)和DNAse(终浓度为100ng/mL)的Hanks’溶液,剪碎后于37℃恒温箱中消化40min;取出后利用70μm筛网进行过滤,1300rpm离心4min后,弃上清加入3mL红细胞裂解液,冰上孵育5min后,1300rpm离心4min;加入90μL磁珠缓冲液(含BSA以及EDTA的PBS缓冲液)以及10μL抗CD31免疫磁珠(购于美天旎公司),4℃条件下孵育30min;加入2mL磁珠缓冲液重悬,1300rpm离心4min后,弃上清重新加入2mL磁珠缓冲液,然后于含有磁力架的磁珠上进行磁珠分选,获得CD31+肿瘤内皮细胞,分别提取细胞内总RNA和蛋白质,并利用qRT-PCR以及western blotting对细胞中的MYC的mRNA和蛋白水平进行测定。
结果如图3中B、C和D所示,相比注射siNC+Nano的小鼠,注射siMYC+Nano的小鼠体内肿瘤内皮细胞中MYC的mRNA水平以及蛋白水平均显著降低。
3、靶向内皮细胞中MYC的siRNA对体内肿瘤生长、血管结构功能的影响。
(1)按照上述2中的方案对C57BL/6小鼠进行肿瘤接种,并从第7天开始每隔两天尾静脉注射siMYC+Nano,同时以注射siNC+Nano的小鼠作为阴性对照组,以野生型C57BL/6小鼠(WT)作为空白对照组,21天后,对各组小鼠腹腔注射10%水合氯醛,以麻醉小鼠。
①小鼠眼球取血(约750μL/只),然后将取到的血液于室温放置20min后,于4℃条件下12000rpm离心10min,小心吸取血清,交由武汉谷歌生物技术有限公司进行生化分析ALT(谷丙转氨酶)、AST(谷草转氨酶)、BUN(尿素氮)以及CR(肌酐)四个指标,分别代表肝脏功能(ALT和AST)以及肾脏功能(BUN和CR)。
结果如图4中A所示,siNC+Nano组或siMYC+Nano组,相比于WT组,副作用较小,对肝脏和肾脏的功能无显著影响。
②对小鼠进行心脏灌注PBS,随后将正常组织(心、肝、肺和肾)放入4%多聚甲醛中固定,然后交由武汉谷歌生物技术有限公司进行石蜡包埋及H&E染色,对组织切片在明场显微镜下进行拍照,分别选取上中下左右五个视野进行后续分析。
结果如图4中B所示,相比于WT组小鼠,这些组织的大体形态上无明显改变,表明siMYC+Nano以及siNC+Nano对正常组织无明显毒副作用。
③取小鼠肿瘤组织进行重量以及体积测定。体积的计算公式为:肿瘤体积=(a×b
结果如图5中A和B所示,siMYC对肿瘤生长无明显抑制作用。
④将肿瘤组织放入4%多聚甲醛中固定,然后交由武汉谷歌生物技术有限公司进行石蜡包埋及H&E染色,对组织切片在明场显微镜下进行拍照,分别选取上中下左右五个视野进行后续分析。
结果如图6中A和B所示,siMYC组肿瘤坏死情况显著减轻,表明siMYC可以明显改善肿瘤坏死情况。
(2)对肿瘤组织中的缺氧情况进行分析:小鼠终点取材前,腹腔注射缺氧探针PIMO(60mg/kg),1h后,麻醉小鼠,心脏灌注PBS后,取肿瘤组织于4%多聚甲醛中4℃条件下固定3h,随后放入30%蔗糖溶液中脱水过夜,然后将组织包埋于OCT中。包埋的肿瘤组织进行组织切片,获得厚度为8μm的肿瘤组织切片,于室温晾干2h后,于PBS中洗涤5min,然后用含1%BSA以及0.3%Triton X-100的PBS溶液室温封闭1h,随后加入兔源抗PIMO的单克隆抗体(1:200稀释),4℃条件下孵育12h;PBS室温洗涤3遍,加入驴抗兔的-Alexa594荧光二抗(1:400稀释),室温孵育2h后,加入Hoechst溶液,室温核染15min;PBS室温洗涤3遍,加入50%甘油封片,并于激光共聚焦显微镜下观察肿瘤组织中PIMO+组织区域,利用Image Pro Plus 6.0以及Graphpad8.0软件对PIMO区域进行统计分析。
结果如图7中A和B所示,siMYC可以显著改善肿瘤内部缺氧程度。
(3)对肿瘤组织中的血管结构进行分析:在上述肿瘤组织中,将组织切片于室温晾干2h后,于PBS中洗涤5min,然后封闭液室温封闭1h,随后加入Anti-CD31抗体(1:200)或Anti-CD31抗体+Anti-α-SMA(1:200)抗体或Anti-CD31抗体+Anti-SM22(1:200)抗体(α-SMA以及SM22指示血管壁细胞,包括周细胞或平滑肌细胞),4℃条件下孵育12h,PBS室温洗涤3遍,加入抗大鼠-Alexa488(1:400)以及抗兔的-Alexa594(1:400)的荧光二抗,室温孵育2h,PBS室温洗涤3遍,加入Hoechst核染液,室温孵育15min;PBS室温洗涤3遍,加入50%甘油封片,于激光共聚焦显微镜下观察CD31+血管内皮细胞周围的α-SMA+以及SM22+血管壁细胞覆盖情况;利用Image Pro Plus 6.0以及Graphpad8.0软件对血管壁细胞覆盖情况进行统计分析。
结果如图8中A和B所示,siMYC对肿瘤血管密度无明显抑制作用,表现为CD31+血管面积无显著减少;图9中A和B以及图10中A和B显示,siMYC可以显著提升壁细胞的覆盖程度,表现为α-SMA+以及SM22+血管壁细胞比例显著增加。
(4)对肿瘤组织血管的功能进行分析:作用终点小鼠取材前尾静脉注射100μL含Dextran-2MD(浓度为25mg/mL)溶液,15min后,按照上述方法对小鼠进行灌注、肿瘤组织取材、固定、脱水、包埋以及切片。随后对肿瘤组织切片按照上述的方法进行Anti-CD31一抗及对应的二抗染色分析,并利用激光共聚焦显微镜观察Dextran-2MD阳性的CD31+血管内皮细胞比例;利用Image Pro Plus 6.0以及Graphpad8.0软件对血管灌流情况进行统计分析。
结果如图11中A和B所示,siMYC可以显著提升血管的灌流能力,表现为Dextran-2MD+血管比例显著增加。
4、靶向内皮细胞中MYC的siRNA对化疗药物疗效的提升作用。
将C57BL/6小鼠(雄性,6~8周龄,购于中国人民解放军空军军医大学动物中心)分为四组:siNC+Nano+NS、siNC+Nano+CDDP、siMYC+Nano+NS以及siMYC+Nano+CDDP。siNC+Nano+NS组小鼠腹腔注射生理盐水,尾静脉注射siNC+Nano;siNC+Nano+CDDP组小鼠腹腔注射顺铂,尾静脉注射siNC+Nano;siMYC+Nano+NS组小鼠腹腔注射生理盐水,尾静脉注射siMYC+Nano;siMYC+Nano+CDDP组小鼠腹腔注射顺铂,尾静脉注射siMYC+Nano。在各组小鼠背部皮下接种LLC肿瘤细胞系(2×10
①将小鼠心脏灌注PBS后,将肿瘤组织取出进行重量和体积测定。体积的计算公式为:肿瘤体积=(a×b
结果如图12中A和B所示,siMYC+Nano可以显著提升化疗药物顺铂(CDDP)对肿瘤的生长抑制作用,表现为二者联合使用后,肿瘤的重量以及体积更进一步减小。
②肿瘤组织测定完重量以及体积后,放入4%多聚甲醛中固定,随后送至武汉谷歌生物技术有限公司进行石蜡包埋及H&E染色,于明场显微镜下观察肿瘤组织的坏死情况;利用Image Pro Plus 6.0以及Graphpad8.0软件对肿瘤组织坏死情况进行统计分析。
结果如图13中A和B所示,siMYC+Nano和顺铂(CDDP)联合使用后,肿瘤的坏死程度更进一步增加,说明siMYC可以显著提升顺铂对肿瘤的杀伤作用。
以上内容仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明权利要求书的保护范围之内。
- 一种多靶向miRNA海绵体序列质粒载体及其构建方法、引物组合物
- 一种兼具肺癌靶向及增强光动力治疗效果的介孔过氧化钛纳米药物组合物及其制备方法
- 一种siRNA药物载体聚合物及其制备方法和在siRNA靶向输送中的应用
- 一种siRNA药物载体聚合物及其制备方法和在siRNA靶向输送中的应用
