抗菌肽KR-121在制备调节肠道微生态平衡的药物中的应用
文献发布时间:2024-04-18 20:01:23
技术领域
本发明涉及医药技术领域,具体涉及抗菌肽KR-121在制备调节肠道微生态平衡的药物中的应用。
背景技术
肠道屏障是指由肠道上皮细胞组成的屏障结构,它的主要功能是阻止有害物质进入体内,同时允许营养物质吸收。紧密连接蛋白是肠道上皮细胞间连接的重要组成部分,其中的ZO-1和occludin是两种常见的紧密连接蛋白。ZO-1和occludin在肠道屏障功能中发挥着重要的作用。它们的表达和功能异常可能导致肠道屏障的破坏,使有害物质和微生物能够穿过肠道壁进入体内,引发全身炎症。研究表明,脓毒症患者中ZO-1和occludin的表达水平下调,与肠道屏障功能受损相关。维持正常的ZO-1和occludin的表达和功能对于保护肠道屏障的完整性和功能至关重要。
肠道微生态是一个复杂的生态系统,包括100万亿个细菌,数千种微生物,主要以放线菌门、拟杆菌门、厚壁菌门、变形菌门为主,占肠道细菌总数的90%以上。共生菌具有个体差异,受到基因和环境等多种因素影响,在调节宿主健康和疾病发生发展中发挥重要作用。例如:作为第一信使,调控基因表达,从而调节免疫反应,维持肠道促炎细胞和抑炎细胞的平衡。共生菌还能刺激肠上皮细胞合成释放抗菌肽、促进肠道黏膜屏障成熟。但是细菌感染会导致肠道共生菌结构和功能紊乱,影响肠道屏障功能,如果不能及时恢复改善,会造成肠道细菌移位,引起肠源性菌血症,进一步加重诱发脓毒症,形成恶性循环。
综上,肠道屏障和肠道菌群之间是相互依存的关系。肠道菌群对肠道屏障的功能和免疫调节至关重要,而肠道屏障的稳定性和功能也可以影响肠道菌群的组成。发生致病微生物感染时,机体处于应激状态,肠上皮缺血缺氧,细胞功能障碍,分泌抗菌肽能力减弱,导致肠道微生态破坏;而肠道菌群失调,导致肠黏膜屏障破坏,上皮细胞凋亡,影响抗菌肽的合成。保持肠道屏障的健康和促进肠道微生态平衡对于疾病预后至关重要。基于调节肠道菌群的研究为疾病的预防和治疗提供新思路。
肠道菌群在细菌感染的发生和发展中起着重要作用,阿克曼式菌(Akkermansiacea)被认为是有益菌。阿克曼式菌可以通过以下几种方式对细菌感染产生积极影响:①增强肠道屏障的完整性,减少肠道的通透性。它促进肠道上皮细胞的紧密连接蛋白的表达,维护肠道屏障的完整性,减少有害物质和细菌的转移入血,避免加重感染。②具有抗炎特性,可以减轻炎症反应。它能够抑制炎症介质的产生,并调节免疫细胞的活性,减少感染引起的炎症反应。因此,阿克曼式菌对细菌感染的预后和炎症反应起到积极作用。
抗菌肽与肠道菌群之间存在复杂的关联:肠道抗菌肽的表达需要肠道菌群的参与,而肠道菌群诱导产生的抗菌肽又能杀灭病原菌,维持肠道微生态,如:HD5和CRAMP可以塑造肠道菌群结构组分并维持肠黏膜屏障功能。
专利文献CN 114181293 A公开了一种人源抗菌肽LL-37改造体KR-121,该改造体保留人源抗菌肽LL-37的活性结构,并对其N端进行延伸,连接脂肪酸链,使其形成两亲性自组装纳米颗粒,具体的,氨基酸序列为GGGKRIVQRIKDFLR,肽链N端连接肉豆蔻酸。通过上述改造显著提升杀菌活性,然而其在肠道菌群和肠道屏障中的作用仍属于空白领域。
发明内容
本发明的目的在于提供一种能够改善肠道菌群结构,增强肠道屏障功能的抗菌肽,为细菌等病原微生物感染导致肠道损伤的临床治疗和预后提供新的思路。
为实现上述目的,本发明采用如下技术方案:
本发明提供了抗菌肽KR-121在制备调节肠道微生态平衡的药物或功能食品中的应用,所述抗菌肽KR-121的氨基酸序列如SEQ ID NO.1所示,其中第1位氨基酸的氨基上连接肉豆蔻酰基。
具体的,抗菌肽KR-121不影响肠道菌群的α-多样性,改变肠道菌群的β-多样性,增加阿克曼式菌科(Akkermansiaceae)在肠道菌群中的占比,减少机会致病菌葡萄球菌科(Staphylococcaceae)和链球菌科(Streptococcaceae)在肠道菌群中的占比。
本发明研究表明,针对健康群体,抗菌肽KR-121在不改变肠道菌群的丰富度的前提下,显著改变肠道菌群的微生物群组成,其中阿克曼式菌相对丰度显著增加,葡萄球菌科和链球菌科相对丰度显著降低。针对脓毒症,抗菌肽KR-121预处理后,显著增强了对细菌感染的抵抗能力,提高生存率。
肠道屏障发生损伤后肠上皮紧密连接蛋白ZO-1、occludin等相关蛋白的表达水平显著降低,肠上皮细胞发生凋亡。研究表明,利用抗菌肽KR-121处理可有效增加肠道屏障相关蛋白ZO-1、occludin的表达水平,改善肠道屏障损伤。
进一步的,所述药物为改善微生物感染引起的肠道屏障损伤和/或肠道菌群改变的药物。病原微生物感染会造成肠道屏障功能受损,肠道菌群结构显著变化。
所述肠道屏障损伤的表现包括:肠上皮细胞凋亡增加,肠道屏障相关蛋白ZO-1、occludin的表达水平降低;以及肠绒毛明显脱落、大量炎症细胞浸润和肠壁变薄等组织病理损伤。研究表明,利用抗菌肽KR-121治疗可显著改善上述症状。
病原微生物感染导致肠道菌群结构改变,如Clostridia UCG-014等促炎相关细菌数量增加,阿克曼式菌(Akkermansiaceae)数量减少。研究表明,利用抗菌肽KR-121治疗可以促进肠道菌群结构恢复正常,增加有益菌比例。具体的,阿克曼菌科(Akkermansiaceae)在肠道菌群中显著上调。
进一步的,所述微生物感染为腹腔源性细菌感染。细菌感染可以为但不限于由鲍曼不动杆菌导致。
细菌等病原微生物感染导致的疾病可以为但不限于肠源性菌血症、脓毒症。
进一步的,所述药物为预防和治疗继发感染的药物。研究表明,利用抗菌肽KR-121治疗感染时,不仅有效杀菌,同时调节肠道屏障功能和肠道菌群稳态,改善长期预后,提高对继发感染的抵抗能力。具体的,继发感染可以为但不限于脓毒症二次感染。
本发明还提供了一种治疗微生物感染导致肠道屏障损伤和/或肠道菌群结构改变的药物组合物,包括有效剂量的抗菌肽KR-121和药学上可接受的载体。
抗菌肽KR-121作为药物时,可参照现有方式进行制剂制备。
本发明具备的有益效果:
本发明首次公开抗菌肽KR-121可以调控肠道屏障和肠道菌群稳态,在不影响肠道菌群α-多样性前提下,改变了肠道菌群β-多样性。进一步机理研究表明抗菌肽KR-121可以促进阿克曼式菌(Akkermansiaceae)生长,进而改善肠道屏障功能,改善疾病预后,为治疗感染性疾病提供了一种新的思路和手段。
附图说明
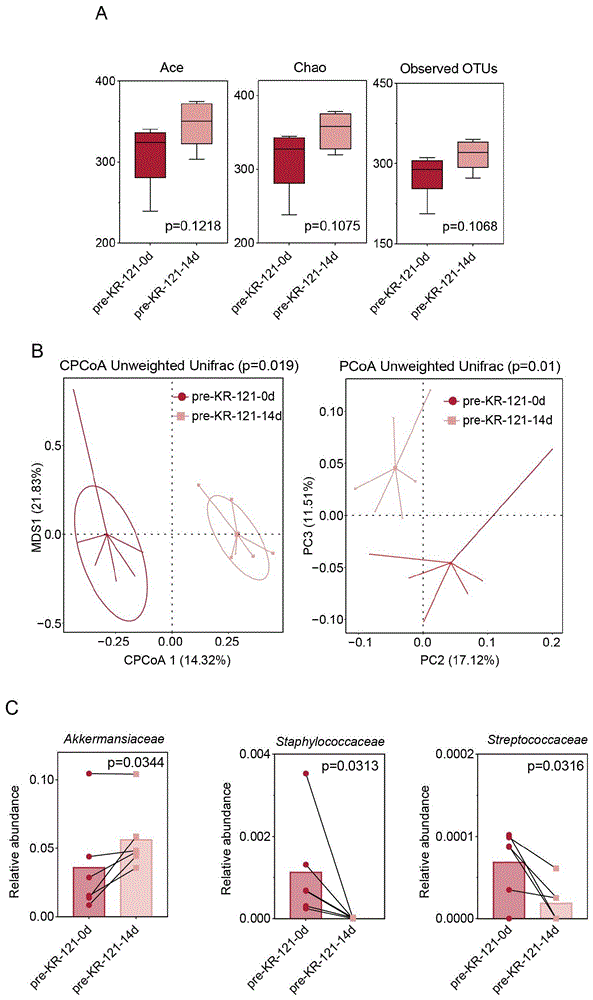
图1为KR-121腹腔注射14天后健康小鼠肠道菌群α-多样性、β-多样性以及显著性差异菌群分析,其中A为α-多样性;B为β-多样性;C为肠道阿克曼式菌科(Akkermansiaceae),葡萄球菌科(Staphylococcaceae)和链球菌科(Streptococcaceae)相对丰度。图中,p值小于0.05,表明具有统计学差异;pre-KR-121-0d:KR-121处理前的健康小鼠;pre-KR-121-14d:KR-121腹腔注射14d后的健康小鼠。
图2为KR-121预处理对细菌感染抵抗能力的作用,其中A为KR-121腹腔注射14天后,细菌感染小鼠生存率;B为KR-121腹腔注射14天后,细菌感染小鼠血浆异硫氰酸荧光素葡聚糖(FITC-dextran)水平,反映肠道通透性;C为KR-121腹腔注射14天后,细菌感染小鼠肠上皮tunnel染色检测肠上皮细胞凋亡;D为KR-121腹腔注射14天后,细菌感染小鼠肠上皮ZO-1、occludin免疫荧光染色检测蛋白表达水平;E为KR-121腹腔注射14天后,细菌感染小鼠肠上皮ZO-1、occludin的Western blot结果。图中,p值小于0.05,表明具有统计学差异;control组为亚致死剂量的鲍曼不动杆菌感染小鼠;pre-KR-121-14d组为KR-121腹腔注射14天后感染亚致死剂量鲍曼不动杆菌的小鼠;ZO-1:紧密连接蛋白;Occludin:紧密连接蛋白;β-actin:内参蛋白。
图3为KR-121长期应用对细菌感染小鼠肠道屏障和肠道菌群改善,其中A为细菌感染小鼠体重恢复情况;B为细菌感染小鼠血浆异硫氰酸荧光素葡聚糖(FITC-dextran)水平,反映肠道通透性;C为肠道菌群α-多样性;D为肠道菌群β-多样性。
图4为在菌门水平分析KR-121长期应用对细菌感染小鼠肠道菌群的影响。
图5为在菌科水平分析KR-121长期应用对细菌感染小鼠肠道菌群的影响。
图6为KR-121长期治疗对继发感染生存率影响。
图7为KR-121长期治疗对继发感染的肠道充血水肿作用。
图8为KR-121长期治疗对继发感染后全身组织器官细菌负荷影响,图中,PLF:腹腔灌洗液、Liver:肝脏、Spleen:脾脏、Lung:肺脏、Kidney:肾脏。
图9为KR-121长期治疗后继发感染炎症因子检测。
图10为KR-121长期治疗对继发感染小鼠血浆异硫氰酸荧光素葡聚糖(FITC-dextran)水平。
图11为KR-121长期治疗对继发感染肠道屏障的影响,其中A为肠上皮tunnel染色检测肠上皮细胞凋亡;B为肠上皮ZO-1、occludin免疫荧光染色检测蛋白表达水平;C为肠上皮ZO-1、occludin的Western blot结果。
具体实施方式
下面结合具体实施例对本发明做进一步说明。以下实施例仅用于说明本发明,不用来限制本发明的适用范围。在不背离本发明精神和本质的情况下,对本发明方法、步骤或条件所做的修改或替换,均属于本发明的范围。
下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
下述实施例中采用的KR-121的氨基酸序列如SEQ ID NO.1所示,具体为:Gly
实施例1:KR-121对肠道菌群α-多样性和β-多样性的影响
1、实验动物
SPF级6-8周健康雄性C57BL/6J小鼠。
2、实验方法
所有动物自由进食、饮水,适应性喂养1周后,收集小鼠粪便,记为pre-KR-121-0d,液氮冻存,待后续行肠道菌群16S rDNA扩增子高通量测序。然后,对小鼠进行每天KR-121腹腔注射(3mg/kg),连续腹腔注射14天后,收集小鼠粪便,记为pre-KR-121-14d,液氮冻存,待后续行肠道菌群16S rDNA扩增子高通量测序,比较pre-KR-121-0d组和pre-KR-121-14d组小鼠的粪便DNA样本中菌群组成差异。
16S rDNA扩增子高通量测序步骤简述:①DNA提取:使用微生物DNA提取试剂盒从样本中提取总DNA。②16S rDNA扩增:选择16S rRNA基因的通用引物对对细菌16S rDNA可变区(V3-V4)进行PCR扩增16SrDNA。③PCR产物纯化:使用凝胶电泳检查PCR产物的大小和纯度。④文库构建与定量:使用Illumina平台进行文库构建。使用实时PCR方法定量纯化后的文库。⑤高通量测序:将多个带有不同barcode的文库混合,进行高通量测序。⑥数据分析:对原始测序数据进行质控。
基于OUT(Operational Taxonomic Units)进行微生物分类,对样品进行微生物α多样性、β多样性和相对丰度等分析。Ace指数、Chao指数和OTUs反映KR-121处理前后的健康小鼠肠道菌群α-多样性;限制性主坐标分析(CPCoA)和主坐标分析(PCoA)反映KR-121处理前后的健康小鼠肠道菌群β-多样性。
接下来,分析pre-KR-121-0d组和pre-KR-121-14d组小鼠肠道菌群中显著性差异的菌群。
3、实验结果
3.1如图1的A所示,通过样本间α多样性分析(Ace指数、Chao指数和OTUs)比较两组小鼠肠道菌群差异,α多样性没有统计学差异.
如图1的B所示,通过样本间β多样性分析(限制性主坐标分析CPCoA和主坐标分析PCoA)发现pre-KR-121-0d组(红色圆点)集中分布于坐标图的左侧,而pre-KR-121-14d组(粉色圆点)集中分布于坐标图右侧,与pre-KR-121-0d组之间没有交叉重叠,说明pre-KR-121-0d组和pre-KR-121-14d组小鼠组间肠道菌群结构存在显著差异。
α-多样性和β-多样性分析结果表明KR-121腹腔注射没有改变肠道菌群的丰富度,但是显著改变了肠道菌群的微生物群组成,说明KR-121腹腔注射改变了健康小鼠肠道菌群的微生物群组成。
3.2如图1的C所示,分析pre-KR121-0d组和pre-KR121-14d组小鼠肠道菌群中显著性差异的菌群,pre-KR121-14d组阿克曼菌科(Akkermansiaceae)在肠道菌群中显著上调,葡萄球菌科(Staphylococcaceae)和链球菌科(Streptococcaceae)在肠道菌群中显著下调。
实施例2:KR-121预处理对细菌感染抵抗能力的作用
1、实验动物
SPF级6-8周健康雄性C57BL/6J小鼠,给小鼠腹腔注射亚致死剂量(2×10
2、实验方法
所有动物自由进食、饮水,适应性喂养1周后,对小鼠进行每天KR-121腹腔注射(3mg/kg),连续腹腔注射14天后,给小鼠腹腔注射亚致死剂量鲍曼不动杆菌(ATCC 19606)(2×10
对未进行KR-121腹腔注射的健康小鼠腹腔注射亚致死剂量鲍曼不动杆菌(ATCC19606)(2×10
感染后两组小鼠分别经口灌入600mg/kg异硫氰酸荧光素葡聚糖(FITC-dextran),4h后经眼眶静脉丛采血,检测血中FITC-dextran水平,判断肠道通透性。
每隔12小时观察小鼠的存活情况。感染后8-12小时,小鼠麻醉后,取血至抗凝管。固定小鼠,打开腹腔,距离回盲瓣4-5cm处剪取部分回肠,一部分放至4%多聚甲醛固定,另一部分液氮冻存。
将4%多聚甲醛固定的回肠进行石蜡包埋、切片,进行tunnel染色,观察肠上皮凋亡情况。
将4%多聚甲醛固定的回肠进行石蜡包埋、切片,进行ZO-1、occludin的免疫荧光染色,观察肠上皮ZO1、occludin蛋白水平。
剪取部分液氮冻存的回肠组织,提取蛋白,进行ZO-1、occludin的Western blot检测。
3、实验结果
生存率统计结果如图2的A所示,pre-KR-121-14d组小鼠的存活率显著高于control组。
肠道通透性结果如图2的B所示,pre-KR-121-14d组小鼠血浆FITC-dextran水平显著低于control组,表明KR-121预处理减轻了感染引起的肠道通透性增加。
小肠tunnel染色结果如图2的C所示,蓝色荧光表示细胞核,绿色荧光表示凋亡的肠上皮细胞,pre-KR-121-14d组肠上皮凋亡显著少于control组,表明KR-121预处理减轻了感染引起的肠上皮细胞凋亡。
小肠ZO-1、occludin免疫荧光染色结果如图2的D所示,蓝色荧光表示细胞核,绿色荧光表示ZO-1,红色荧光表示occludin,荧光强度越强表明蛋白水平越高。pre-KR-121-14d组肠上皮ZO-1、occludin的表达水平显著高于control组,表明KR-121预处理增加了肠道屏障相关蛋白的表达,减轻了感染引起肠道屏障破坏。
小肠ZO-1、occludin的Western blot结果如图2的E所示,pre-KR-121-14d组肠上皮ZO-1、occludin的表达水平显著高于control组,表明KR-121预处理增加了肠道屏障相关蛋白的表达,减轻了感染引起肠道屏障破坏。
上述结果表明,KR-121腹腔注射14天后,显著提升了小鼠对细菌感染的抵抗能力。
实施例3:KR-121长期应用对细菌感染肠道屏障和肠道菌群改善
1、实验方法
适应性喂养1周后将实验小鼠随机分为4组,即致死剂量细菌感染模型组(Untreated组)(n=7)、致死剂量细菌感染KR-121治疗组(KR-121-14d组)(n=8)、致死剂量细菌感染美罗培南(MEM)治疗组(MEM-14d组)(n=7)、健康组(H组)(n=7),具体的:
Untreated组:0h腹腔注射最小致死剂量的鲍曼不动杆菌(2.8×10
KR-121-14d组:0h腹腔注射最小致死剂量的鲍曼不动杆菌(2.8×10
MEM-14d组:0h腹腔注射最小致死剂量的鲍曼不动杆菌(2.8×10
H组:7只:0h腹腔注射生理盐水+连续14天腹腔注射生理盐水;
所有动物自由进食、饮水,Untreated组在48小时内全部死亡。KR-121-14d组、MEM-14d组、H组每天称重,在第14天收集粪便样本,液氮冻存,待后续行肠道菌群16S rDNA扩增子高通量测序。
在第14天,KR-121-14d组、MEM-14d组、H组小鼠经口灌入600mg/kg异硫氰酸荧光素葡聚糖(FITC-dextran),4h后经眼眶静脉丛采血,检测血中FITC-dextran水平。
2、实验结果
如图3的A所示,KR-121-14d组体重恢复显著快于MEM-14d组。
如图3的B所示,KR-121-14d组血中FITC-dextran水平显著低于MEM-14d组,与H组相当,表明和MEM-14d治疗相比,KR-121-14d治疗显著恢复了细菌感染小鼠肠道屏障功能。
如图3的C所示,肠道菌群分析结果显示,与H组相比,MEM-14d治疗组的细菌感染小鼠肠道菌群样本间α多样性(Ace指数、Chao指数、OTUs)显著降低,而KR-121-14d治疗组的α多样性(Ace指数、Chao指数、OTUs)有所恢复,与H组没有统计学差异。
如图3的D所示,通过样本间多样性(β-diversity)分析比较KR-121-14d组、MEM-14d组、H组小鼠肠道菌群的差异。三组小鼠肠道菌群基于非权重Unifrac的CPCoA和PCoA分析结果显示,H组、MEM-14d组、KR-121-14d组(紫色、蓝色、红色圆点)之间没有交叉重叠,说明KR-121-14d组、MEM-14d组、H组小鼠组间肠道菌群结构存在显著差异。
如图4所示,在菌门水平对三组小鼠肠道菌群进行分析,查找KR-121-14d组、MEM-14d组、H组小鼠中显著性差异的菌群。KR-121-14d组疣微菌门(Verrucomicrobiota)在肠道菌群中显著上调,MEM-14d组变形菌门(Proteobacteria)在肠道菌群中显著下调,这是因为MEM在治疗细菌感染的同时也杀死了大量肠道内革兰氏阴性的变形菌门。
如图5所示,在菌科水平进一步分析,发现KR-121-14d治疗组的阿克曼菌科(Akkermansiaceae)显著上调,而MEM-14d治疗组的肠杆菌科(Enterobacteriaceae)显著下调,肠球菌科(Enterococcaceae)显著上调,这是因为MEM无差别攻击革兰氏阴性菌,不仅杀灭了鲍曼不动杆菌,也杀灭了肠杆菌科,造成肠道菌群结构紊乱,肠球菌成为优势菌,加重了发生继发感染的可能。而KR-121-14的治疗组,在治疗鲍曼不动杆菌感染的同时,平衡了肠道菌群,增加了肠道屏障相关的益生菌阿克曼菌科(Akkermansiaceae)。
实施例4:KR-121长期治疗对继发感染具有保护作用
1、实验方法
按照实施例3建立致死剂量细菌感染及治疗模型,治疗结束后3天分别给H组、KR-121-14d组、MEM-14d组腹腔注射大肠杆菌E.coil(1×10
所有动物自由进食、饮水,观察三组小鼠12h生存率。
在感染后,分别给三组小鼠经口灌入600mg/kg异硫氰酸荧光素葡聚糖(FITC-dextran),4h后经眼眶静脉丛采血,检测血中FITC-dextran水平。此外,在感染后8小时,麻醉小鼠,腹腔注射3mL预冷PBS,充分轻柔按摩腹部后抽取腹腔灌洗液,用于后续细菌计数和炎症因子检测。然后,打开腹腔,观察三组小鼠肠道充血水肿情况。剪取部分肝脏、脾脏、肺脏和肾脏,称重后研磨,用PBS梯度稀释后接种在LB固体培养基上,培养16-18h后进行细菌计数。剪取三组小鼠回肠用4%多聚甲醛固定,固定的回肠进行石蜡包埋、切片,进行tunnel染色,观察肠上皮凋亡情况。
将腹腔灌洗液离心后取上清,按照ELISA试剂盒检测说明,分别检测腹腔灌洗液中炎症因子TNF-α、IL-1β和IL-10水平。
2、实验结果
如图6所示,与H+E.coil组和MEM-14d+E.coil组相比,KR-121-14d+E.coil组继发感染小鼠生存率显著增加。
如图7所示,与H+E.coil组和MEM-14d+E.coil组相比,KR-121-14d+E.coil组继发感染小鼠肠道充血水肿显著减轻。
如图8所示,KR-121-14d+E.coil组腹腔灌洗液、肝脏、脾脏、肺脏、肾脏全身组织器官细菌负荷显著低于H+E.coil组和MEM-14d+E.coil组。
如图9所示,KR-121-14d+E.coil组腹腔灌洗液TNF-α、IL-1β和IL-10水平显著降低。
如图10所示,KR-121-14d+E.coil组血中FITC-dextran水平显著低于H+E.coil组和MEM-14d+E.coil组,表明KR-121-14d+E.coil肠道通透性显著低于H+E.coil组和MEM-14d+E.coil组。
如图11的A所示,小肠tunnel染色结果,蓝色荧光表示细胞核,绿色荧光表示凋亡的肠上皮细胞,KR-121-14d+E.coil组肠上皮凋亡显著少于H+E.coil组和MEM-14d+E.coil组,表明KR-121-14d治疗细菌感染小鼠后,显著减轻了继发感染引起的肠上皮细胞凋亡。
如图11的B所示,小肠ZO-1、occludin免疫荧光染色结果,蓝色荧光表示细胞核,绿色荧光表示ZO-1,红色荧光表示occludin,荧光强度越强表明蛋白水平越高。KR-121-14d+E.coil组肠上皮ZO-1、occludin的表达水平显著高于H+E.coil组和MEM-14d+E.coil组,表明KR-121-14d治疗脓毒症小鼠后,增加了肠道屏障相关蛋白的表达,减轻了继发感染引起肠道屏障破坏。
如图11的C所示,小肠ZO-1、occludin的Western blot结果,KR-121-14d+E.coil组肠上皮ZO-1、occludin的表达水平显著高于H+E.coil组和MEM-14d+E.coil组,表明KR-121-14d治疗继发感染小鼠后,增加了肠道屏障相关蛋白的表达,减轻了二次感染引起肠道屏障破坏。
以上结果说明,和MEM相比,KR-121长期应用能够改善细菌感染小鼠的肠道菌群结构,促进恢复正常,并增加有益菌比例,改善对继发感染的抵抗力,增强肠道屏障功能。
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
- 一种4-二烃氧基膦酰基-2-甲基-2-丁烯酸烃基酯的合成方法
- 用于制造1,1,4,4-四甲氧基-2-丁烯的可持续方法
- 一种缩醛化催化剂及其制备方法以及用于制备1,1,4,4-四甲氧基-2-丁烯的方法
