PRKN作为预测肿瘤对化疗敏感性的标志物的应用
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及生物医学技术和生物医药领域,特别涉及PRKN作为预测肿瘤对化疗敏感性的标志物的应用。
背景技术
恶性肿瘤是全球范围内威胁人类健康的首要原因之一。传统的恶性肿瘤治疗手段包括手术切除、化疗和放疗。其中,化疗属于全身性的治疗手段,是综合性恶性肿瘤治疗最有效的方法之一。目前,化疗在肿瘤治疗中应用十分广泛。可手术的肿瘤患者通常接受新辅助化疗或辅助化疗,用于在术前缩小肿瘤或在术后控制肿瘤复发和转移。对于不可手术的肿瘤患者,化疗的地位则更为重要,常作为I级推荐的治疗手段。
目前临床上使用的化疗药物可以按照其来源分为六种类型:第一种是抗肿瘤抗生素药物,其作用机制为抑制DNA和RNA的合成,代表药物为蒽环类药物如阿霉素等。第二种是抗代谢药物,其作用机制为抑制叶酸、嘧啶和嘌呤代谢过程,代表药物为甲氨蝶呤、氟尿嘧啶和阿糖胞苷等。第三种是拓扑异构酶抑制剂,可抑制DNA复制,代表药物为依托泊苷等。第四种为烷化剂,此类药物可以烷基化DNA,造成DNA脱嘌呤和断裂,代表药物为环磷酰胺等。第五种其他类化疗药物,主要包括铂类化疗药物,可引起DNA交联,代表药物为顺铂和奥沙利铂等。第六种为植物类抗肿瘤药物,主要包括紫杉类和长春碱类药物,通过抑制有丝分裂纺锤体微管的聚合和解聚,激活细胞凋亡,代表药物为长春新碱、紫杉醇和多西他赛等。从作用机制来说,前五种化疗药物属于DNA损伤类化疗药物,都通过抑制DNA合成、造成DNA损伤发挥作用。第六种属于抗微管类化疗药物,通过靶向微管,造成有丝分裂阻滞和细胞凋亡。DNA损伤类化疗药物和抗微管类化疗药物在临床上都广泛应用。
肿瘤患者对上述化疗药物的敏感性存在个体化差异。自化疗药物应用于临床以来,始终存在一个瓶颈,即如何预判肿瘤患者对哪种化疗药物敏感。因此,临床上亟需可靠的生物标志物指导肿瘤化疗药物的选择。
发明内容
本发明的目的在于克服现有技术的缺点与不足,提供检测肿瘤中PRKN的基因变异和/或PRKN蛋白表达水平的试剂在制备用于预测肿瘤患者对化疗药物的敏感性和/或反应性的产品中的应用。
本发明的目的通过下述技术方案实现:
检测肿瘤中PRKN基因变异(情况)和/或PRKN蛋白表达水平的试剂在制备用于预测肿瘤患者对化疗药物的敏感性和/或反应性的产品中的应用。
所述的PRKN蛋白序列如SEQ ID NO.1所示。
所述的PRKN基因,其在NCBI数据库的登录号为5071。
所述的肿瘤为恶性肿瘤,包括乳腺癌等。
所述的化疗药物为DNA损伤类化疗药物和/或抗微管类化疗药物。
所述的DNA损伤类化疗药物包括阿霉素、甲氨蝶呤、氟尿嘧啶、吉西他滨、阿糖胞苷、依托泊苷、环磷酰胺、顺铂和奥沙利铂,以及以上药物的衍生物中的至少一种。
所述的抗微管类化疗药物包括多西他赛、多西紫杉醇、紫杉醇、长春瑞滨和长春新碱,以及以上药物的衍生物中的至少一种。
所述的PRKN基因变异包括PRKN基因点突变、PRKN基因拷贝数增加、PRKN基因拷贝数缺失(低表达)等;其中,当检测到PRKN基因拷贝数缺失时,则预测该肿瘤对抗微管类化疗药物响应低或无响应,化疗时肿瘤患者应接受DNA损伤类化疗药物治疗;当检测到PRKN基因拷贝数增加(PRKN基因扩增)时,则预测该肿瘤对抗微管类化疗药物敏感,化疗时肿瘤患者应接受含抗微管类化疗药物的化疗方案。
所述的PRKN基因拷贝数增加优选为PRKN拷贝数大于2。
所述的PRKN基因拷贝数缺失优选为PRKN拷贝数小于2。
所述的检测肿瘤中PRKN基因变异的方法包括但不限于基因组杂交芯片和/或全外显子测序。
所述的检测肿瘤中PRKN基因变异的取样样本包括手术切除的肿瘤、穿刺活检取样的肿瘤、和/或血液循环肿瘤DNA等肿瘤相关样本。
所述的检测PRKN蛋白表达水平包括但不限于使用免疫组织化学方法,检测肿瘤组织中PRKN蛋白染色阳性的肿瘤细胞占肿瘤细胞总数的百分比(Tumor cell proportionscore,TPS);其中,若TPS小于或等于50%(优选为小于或等于10%),则预测该肿瘤对抗微管类化疗药物响应低或无响应,化疗时肿瘤患者应接受DNA损伤类化疗药物治疗;若TPS大于50%(优选为大于75%),则预测肿瘤对抗微管类化疗药物敏感,化疗时肿瘤患者应接受含抗微管类化疗药物的化疗方案。
所述的检测PRKN蛋白表达水平的取样样本包括手术切除的肿瘤和/或穿刺活检取样的肿瘤等。
所述的检测PRKN蛋白表达水平的方法为免疫组织化学染色。
所述产品包括试剂盒、芯片、试纸和高通量测序平台等。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明通过整合分析公共数据库数据和实验发现:PRKN在肿瘤中缺失或低表达提示肿瘤对抗微管类化疗药物响应低,因此若需化疗,建议患者以接受DNA损伤类化疗药物治疗为主;而肿瘤中PRKN基因的拷贝数扩增或PRKN的蛋白表达增加,都可以预测肿瘤对抗微管类化疗方案敏感,因此当肿瘤患者肿瘤组织标本中PRKN的表达高时,建议考虑化疗,且使用含有抗微管类化疗药物的化疗方案。因此,检测PRKN在肿瘤组织中的基因变异和表达水平,可以作为肿瘤患者化疗方案选择的标志物,以弥补现有的技术中指导肿瘤化疗方案选择的生物标志物的空白,为临床合理选择化疗方案提供指导。
(2)本发明提供的可用于预测肿瘤患者对特定化疗药物的反应性或敏感性的生物标志物,其可以根据PRKN的基因变异和表达水平预测肿瘤对化疗药物的敏感性,进而作为肿瘤化疗方案选择的判断标准,用于开发指导化疗方案选择的试剂盒。
附图说明
图1是乳腺癌细胞中PRKN的基因变异与抗微管类化疗药物(多西他赛、紫杉醇、长春瑞滨、长春新碱)敏感性的关系图;其中,A为根据抗微管类化疗药物的半抑制浓度(将肿瘤细胞分为敏感和耐药两组,柱状图中每个点都代表一个肿瘤细胞);B为在抗微管类化疗药物敏感或耐药的肿瘤细胞中的PRKN基因拷贝数(在抗微管类化疗药物敏感的肿瘤细胞中,PRKN基因拷贝数扩增的比例更高;在抗微管类化疗药物耐药的肿瘤细胞中,PRKN基因拷贝数缺失的比例更高);C为PRKN拷贝数扩增的肿瘤细胞对抗微管类化疗药物敏感性情况(结果具有统计学意义,p<0.05)。
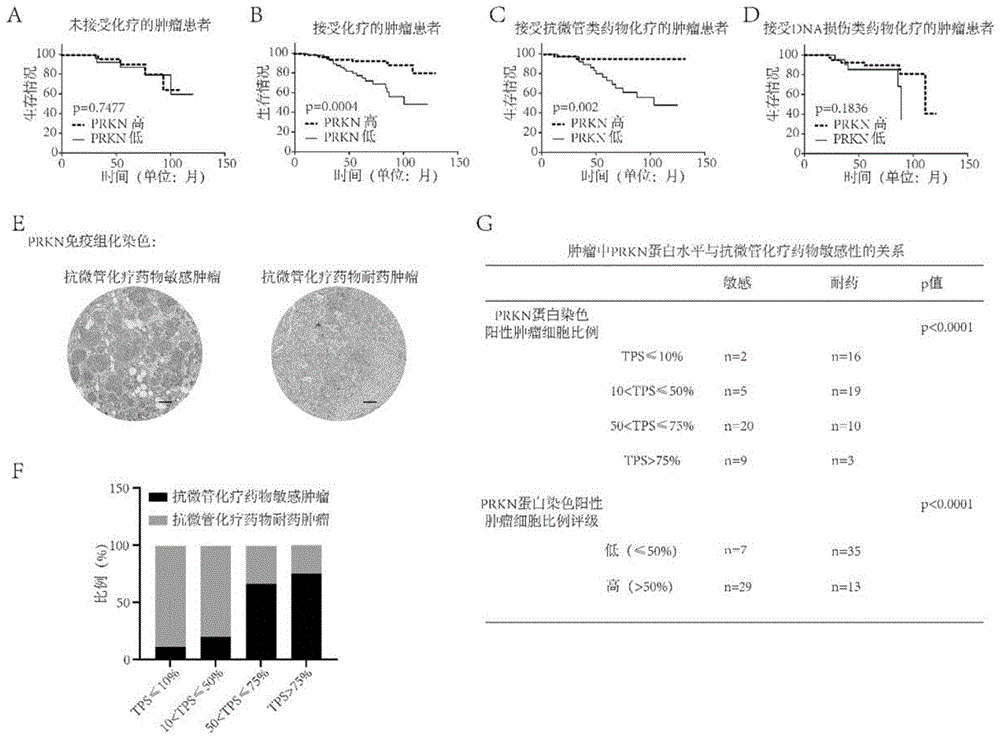
图2是乳腺癌中PRKN的蛋白表达水平与化疗药物治疗效果的关系图;其中,A为未接受化疗的患者的肿瘤中PRKN蛋白的表达高低与患者生存时间的关系图;B为接受化疗的患者的肿瘤中PRKN蛋白表达高的患者的生存时间(结果显示患者生存时间更长,结果具有统计学意义,p<0.05);C为接受抗微管类药物化疗的患者的肿瘤中PRKN蛋白表达高的患者的生存时间(结果显示患者生存时间更长,结果具有统计学意义,p<0.05);D为接受DNA损伤类药物化疗的患者的肿瘤中PRKN蛋白的表达高低与患者生存时间的关系图(结果具有统计学意义,p<0.05);E为在对抗微管类化疗药物敏感或耐药的肿瘤细胞中的PRKN蛋白的表达情况(在对抗微管类化疗药物敏感的肿瘤中,PRKN蛋白高表达,TPS>75%;在对抗微管类化疗药物耐药的肿瘤中,PRKN蛋白低表达,TPS<10%);F为在PRKN蛋白染色阳性细胞比例高的肿瘤中的抗微管类化疗药物敏感的比例;G为PRKN蛋白表达高的肿瘤对抗微管类化疗药物敏感性情况(结果具有统计学意义,p<0.05)。
具体实施方式
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。除非特别说明,本发明所用试剂和原材料均可通过市售获得。
本发明实施例中使用卡方检验进行差异显著性分析(p值均已在附图中标注)。
本发明实施例中涉及的PRKN基因位于人类基因组chr6:161,768,449-163,148,798,其氨基酸序列如SEQ ID NO.1所示,基因序列在NCBI的登录号为:Gene ID:5071。
实施例1 PRKN的基因变异与肿瘤细胞对抗微管类化疗药物敏感性的相关性研究
抗微管类化疗药物(多西他赛、紫杉醇、长春瑞滨、长春新碱)的半抑制浓度数据来自Genomics of Drug Sensitivity in Cancer数据库(GDSC)。肿瘤细胞的PRKN基因变异数据来自Cancer Cell Line Encyclopedia数据库(CCLE)。先根据抗微管类化疗药物的半抑制浓度数据定义敏感的肿瘤细胞和耐药的肿瘤细胞。然后根据PRKN的基因变异情况将肿瘤细胞分为两组:PRKN拷贝数扩增组、PRKN拷贝数缺失组。再在PRKN拷贝数扩增组和PRKN拷贝数缺失组中,分别分析敏感肿瘤细胞和耐药肿瘤细胞的比例。
本实施例以乳腺癌细胞为例,展示肿瘤细胞中PRKN的基因变异与抗微管类化疗药物(多西他赛、紫杉醇、长春瑞滨、长春新碱)敏感性的关系。具体为:
(1)先根据GDSC数据库获取抗微管类化疗药物多西他赛、紫杉醇、长春瑞滨、长春新碱对不同乳腺癌患者的乳腺癌细胞的半抑制浓度数据。其中,74个乳腺癌细胞记录了多西他赛的半抑制浓度,44个乳腺癌细胞记录了紫杉醇的半抑制浓度,32个乳腺癌细胞记录了长春瑞滨的半抑制浓度,37个乳腺癌细胞记录了长春瑞滨的半抑制浓度。根据半抑制浓度数据的中位数定义敏感的肿瘤细胞和耐药的肿瘤细胞。将半抑制浓度数据位于中位数以下(不包含中位数)的肿瘤细胞定义为敏感,将半抑制浓度数据位于中位数以上(包含中位数)的肿瘤细胞定义为耐药。
(2)根据CCLE数据库获取上述乳腺癌细胞中的PRKN基因的拷贝数。将PRKN拷贝数大于2的肿瘤细胞定义为PRKN拷贝数扩增组,PRKN拷贝数小于2的肿瘤细胞定义为PRKN拷贝数缺失组(本实验不考虑PRKN拷贝数等于2的情况)。
(3)分别在PRKN拷贝数扩增组和PRKN拷贝数缺失组中,分析敏感肿瘤细胞和耐药肿瘤细胞的比例。经卡方检验分析,结果如图1所示(图中不包含RKN基因拷贝数等于2的数据):结果显示PRKN拷贝数扩增的肿瘤细胞多数对抗微管类化疗药物敏感,PRKN拷贝数缺失的肿瘤细胞多数对抗微管类化疗药物耐药。
实施例2 PRKN的表达水平与肿瘤对抗微管类化疗药物敏感性的相关性研究
为了验证PRKN的表达与不同化疗方案的肿瘤治疗效果之间的关系,本研究以乳腺癌为例,纳入了205例乳腺癌患者,其中62例患者没有接受化疗,143例患者接受了化疗;其中在143例接受化疗的肿瘤患者中,84例患者接受了抗微管类药物化疗方案,59例患者接受了DNA损伤类药物化疗方案。具体治疗方案如下:
(1)在84例接受含抗微管类药物化疗方案的患者中:
①57例患者接受含多西他赛的化疗方案(多西他赛+卡培他滨),其中多西他赛的药物剂量为75mg/m
②24例患者接受含多西紫杉醇的化疗方案(多西紫杉醇+阿霉素),其中多西紫杉醇的药物剂量为75mg/m
③3例患者接受含长春瑞滨的化疗方案(长春瑞滨+卡培他滨),其中长春瑞滨的药物剂量为60mg/m
(2)在59例患者接受DNA损伤类药物化疗方案的患者中:
①26例患者接受顺铂+吉西他滨的化疗方案,其中顺铂的药物剂量为75mg/m
②14例患者接受氟尿嘧啶+阿霉素+环磷酰胺的化疗方案,其中氟尿嘧啶的药物剂量为600mg/m
③12例患者接受阿霉素+环磷酰胺的化疗方案,其中阿霉素的药物剂量为60mg/m
④7例患者接受环磷酰胺+甲氨蝶呤+氟尿嘧啶的化疗方案,其中环磷酰胺的药物剂量为100mg/m
我们利用PRKN抗体(ab15494)对这些患者的肿瘤组织进行免疫组化染色,检测PRKN蛋白的表达情况。根据PRKN染色阳性细胞比例(TPS)判读PRKN表达分级,将PRKN染色TPS≤50%的肿瘤定义为低表达肿瘤,PRKN染色TPS>50%的肿瘤定义为高表达肿瘤。分析肿瘤中PRKN的表达与患者生存时间的关系。
经log-rank检验分析,结果显示对于没有接受化疗的患者,肿瘤中PRKN蛋白的表达量的高低与患者的生存时间无关(图2A);相反,在接受了化疗的患者中,肿瘤中PRKN蛋白高表达的患者生存时间显著更长(图2B)。
进一步将接受化疗的患者分为两类:接受抗微管类化疗方案治疗的患者、接受DNA损伤类化疗方案治疗的患者。经log-rank检验分析,结果显示在接受抗微管类化疗方案的患者中,肿瘤中PRKN蛋白高表达的患者生存时间显著更长(图2C);相反,对于接受DNA损伤类化疗方案治疗的患者,肿瘤中PRKN蛋白的表达量的高低与患者的生存时间无关(图2D)。
进一步,我们将化疗后达到病理完全缓解(乳腺癌原发灶和腋窝淋巴结手术标本病理检查无浸润性肿瘤细胞残余)的肿瘤定义为敏感肿瘤,将化疗后未达到病理完全缓解的肿瘤定义为耐药肿瘤。根据PRKN染色阳性细胞比例(TPS)判读PRKN表达分级,分为4级:TPS≤10%、10%
经卡方检验分析,结果显示:在对抗微管类化疗药物敏感的肿瘤中,PRKN蛋白高表达,TPS>75%;在对抗微管类化疗药物耐药的肿瘤中,PRKN蛋白低表达,TPS≤10%(图2E);在PRKN蛋白染色阳性细胞比例高的肿瘤中,抗微管类化疗药物敏感的比例高(图2F);PRKN蛋白表达高的肿瘤对抗微管类化疗药物敏感(图2G),即抗微管类化疗药物对高表达PRKN肿瘤的治疗效果好,抗微管类化疗药物对低表达PRKN肿瘤的治疗效果差。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- Massive MIMO的优化方法、装置、设备及介质
- 视频校正方法、装置、电子设备和计算机可读存储介质
- 一种图像畸变校正方法、装置、设备及存储介质
- 成像畸变校正方法、装置、计算机设备及存储介质
- 宽带大规模MIMO通道校正方法、装置、设备和介质
- 一种大规模宽带通道的硬件校正系统
