BglD2突变体、BglD2突变酶及其制备方法和应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及生物技术领域,具体而言,涉及一种BglD2突变体、核酸分子、重组质粒、宿主细胞、BglD2突变酶及其制备方法和应用。
背景技术
白藜芦醇是一种有着重要作用的多酚类化合物,其在医疗医药、化妆品、保健品与食品领域有着广大的应用和开发领域。然而,现阶段白藜芦醇的产量却远不能满足市场的需求。研究表明,利用β-葡萄糖苷酶水解虎杖苷是制备白藜芦醇的重要方法之一,然而β-葡萄糖苷酶存在热稳定性差、乙醇耐受差等问题。来源于海洋细菌Bacillus sp.D1的β-葡萄糖苷酶BglD2对乙醇有着很好的耐受性,且有较高的葡萄糖耐受性和较高的催化水解虎杖苷的能力,其可以在较低温度下高效水解虎杖苷生产白藜芦醇。
存在的问题是:BglD2的热稳定性差,这限制了该酶的大规模应用。
发明内容
本发明解决了BglD2热稳定性差的技术问题,实现了提高BglD2热稳定性的技术效果。
为解决上述问题,本发明提供一种BglD2突变体,BglD2突变体为单一位点的点突变,突变点为D156、D411中的任意一个。
与现有技术相比,采用该技术方案所达到的技术效果:本发明通过分析BglD2的氨基酸组成特征、NetSurfP预测、多重序列比对、分子对接、SIFT预测和Pymol分析突变前后相互作用力的变化,以保护保守性位点和避免有害突变为原则,最终筛选出突变点。
在本发明的一个实例中,BglD2突变体的突变点为D156,BglD2突变体D156E的氨基酸序列如SEQ ID NO:1所示。
在本发明的一个实例中,BglD2突变体的突变点为D411,BglD2突变体D411E的氨基酸序列如SEQ ID NO:2所示。
与现有技术相比,采用该技术方案所达到的技术效果:通过上述突变点,本发明提供的BglD2突变体的热稳定性和酶活性均有所提高。
本发明还提供一种核酸分子,核酸分子编码上述任一实例的BglD2突变体。
与现有技术相比,采用该技术方案所达到的技术效果:本发明提供的核酸分子具有BglD2突变体的所有有益效果,在此不再赘述。
本发明还提供一种重组质粒,重组质粒包含上述实例的核酸分子。
与现有技术相比,采用该技术方案所达到的技术效果:本发明提供的重组质粒具有核酸分子的所有有益效果,在此不再赘述。
本发明还提供一种宿主细胞,宿主细胞包含上述实例的重组质粒。
与现有技术相比,采用该技术方案所达到的技术效果:本发明提供的宿主细胞具有重组质粒的所有有益效果,在此不再赘述。宿主细胞可以是大肠杆菌细胞。
本发明还提供一种BglD2突变酶的制备方法,包括以下步骤:根据BglD2基因序列,设计权利要求1所述的BglD2突变体的突变引物,采用同源重组的方法,以含有BglD2野生型序列的pET-22b(+)质粒为模板,在BglD2引入目的位点进行定点突变,获得重组产物;将重组产物转化至感受态细胞,构建表达菌株;诱导表达表达菌株,并进行纯化,得到BglD2突变酶。
与现有技术相比,采用该技术方案所达到的技术效果:上述制备方法操作简单,且制备得到的BglD2突变酶具有BglD2突变体的所有有益效果,在此不再赘述。根据BglD2基因序列,引物设计方式为:5'-15-21bp反向互补区域+至少15bp的非互补区域-3',进行定点突变,PCR定点突变技术具有突变回收率高、可在任何位点引入突变、材料和试剂容易获得、操作简单等优势。
本发明还提供一种BglD2突变酶,采用上述任一实例的制备方法制备得到。
与现有技术相比,采用该技术方案所达到的技术效果:本发明提供的BglD2突变酶的热稳定性和酶活性较BglD2野生型均有所提高。
本发明还提供一种上述实例的BglD2突变酶的应用,应用于制备白藜芦醇。
与现有技术相比,采用该技术方案所达到的技术效果:本发明提供的BglD2突变酶能够高效水解虎杖苷制备白藜芦醇,且热稳定性高。
采用本发明的技术方案后,能够达到如下技术效果:
(1)本发明通过理性设计方法,寻找影响野生型BglD2热稳定性的氨基酸位点,并对位点进行有选择的替换,经过初筛和复筛分别测定野生酶和突变酶的各项参数,从而得到热稳定性提高且酶活力不受负面影响的突变体。
(2)本发明提供的D156E、D411E突变体的热稳定提高,以虎杖苷为底物,D156E突变体在40℃时的半衰期(T
(3)本发明提供的D156E、D411E突变体的其他酶学性质相比于野生酶几乎不变,且仍有较好的葡萄糖耐受性。
附图说明
本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
图1为本发明实施例提供的BglD2与耐热蛋白的氨基酸组成比较结果图。
图2为本发明实施例提供的BglD2多重序列比对结果图。
图3为本发明实施例提供的ERRAT分析结果图。
图4为本发明实施例提供的拉氏图。
图5为本发明实施例提供的N430E突变前后相互作用变化图。
图6为本发明实施例提供的N391K突变前后相互作用变化图。
图7为本发明实施例提供的N391R突变前后相互作用变化图。
图8为本发明实施例提供的N329R突变前后相互作用变化图。
图9为本发明实施例提供的N232R突变前后相互作用变化图。
图10为本发明实施例提供的D156E突变前后相互作用变化图。
图11为本发明实施例提供的D411E突变前后相互作用变化图。
图12为本发明实施例提供的Y268R突变前后相互作用变化图。
图13为本发明实施例提供的Y367E突变前后相互作用变化图。
图14为本发明实施例提供的W44R突变前后相互作用变化图。
图15为本发明实施例提供的突变体的DNA凝胶电泳图。
图16为本发明实施例提供的野生型及突变酶纯化后的SDS-PAGE分析结果图。
图17为本发明实施例提供的蛋白质浓度标准曲线图。
图18为本发明实施例提供的pNP浓度标准曲线图。
图19为本发明实施例提供的野生型及突变体的比活力图。
图20为本发明实施例提供的突变体N391R、D156E、Y367E、N430E、N391K和D411E的Tm图。
图21为本发明实施例提供的WT及其六个突变体在45℃下的半衰期T
图22为本发明实施例提供的WT及其六个突变体在40℃下的半衰期T
图23为本发明实施例提供的白藜芦醇浓度标准曲线图。
图24为本发明实施例提供的以虎杖苷为底物测得的BglD2的野生型和突变体比活力图。
图25为本发明实施例提供的野生型及突变体D156E和D411E的Tm图。
图26为本发明实施例提供的WT及其两个突变体在40℃下的半衰期T
图27为本发明实施例提供的WT及其突变体的半失活温度T
图28为本发明实施例提供的野生酶及突变酶动力学参数结果图。
图29为本发明实施例提供的pH对野生酶及突变酶活力的影响图。
图30为本发明实施例提供的pH对酶稳定性影响结果图。
图31为本发明实施例提供的野生酶和突变酶的葡萄糖抑制常数Ki图。
具体实施方式
为使本发明的上述目的、特征和优点能够更为明显易懂,下面对本发明的具体实施例做详细的说明。
实施例一:突变体构建
登录NCBI数据库下载BglD2(登录号:MT815914)碱基序列,将序列提交至Bioxm,翻译后分析该序列的各氨基酸组成。将BglD2氨基酸组成与嗜热蛋白各氨基酸组成对比,参见图1,可以清楚知道,BglD2内的氨基酸A、D、F、H、M、N、S、T、W、Y组成较高,其中D、N、W、Y较为明显,氨基酸E、G、I、K、L、P、R、V组成较低,其中E、K、L、R、V较为明显,选择将BglD2表面的氨基酸D、N、W、Y突变为E、K、R,内部氨基酸D、N、W、Y突变为V,最终选择102个氨基酸位点。
将BglD2氨基酸序列提交至在线软件NetSurfP-3.0进行计算,计算反馈的结果会包括蛋白质中每个氨基酸的相对溶剂可及性(RSA)和各个氨基酸残基的分布情况等信息判断氨基酸残基在蛋白质表面的分布,明确102个突变位点的位置分布,结果参见表1。
表1氨基酸位置分布
对于同一家族的蛋白质们来说,其中与其特定功能息息相关的氨基酸残基往往都是相同的,即具有较高的保守性,对这些氨基酸残基的突变往往会导致蛋白质的功能发生较大的变化,有时甚至会导致蛋白质的失活。因此,将BglD2与其他不同来源的BGL进行序列比对,找出BglD2内的保守氨基酸残基,进一步缩减突变文库的大小。序列比对使用NCBI数据库搜索与BglD2一致度较高的BGL,选择威海芽孢杆菌Bacillus weihaiensis(GenBank:WP_072580823)、芽孢杆菌属厚壁菌门Bacillus sp.In firmicutes(GenBank:MK341066)、海栖热袍菌MSB8 Thermotoga maritima MSB8(GenBank:Q08638)、那不勒斯栖热袍菌DSM4359Thermotoga neapolitana DSM 4359(GenBank:B9K7M5),下载序列后提交至ClustalW算法,分析参数选择为默认值,比对结束后会生成clustalw.aln序列比对文件,将该文件提交至ESPript 3进行序列比对结果作图,结果参加图2,可以清楚知道,上述102个位点中,保守的位点有D26、D47、D54、D62、D120、D233、D279、D288、D358、D 368、D402、D420、W33、W80、W119、W131、W158、W165、W324、W398、W406、N45、N133、N441、N91、N162、N220、N293、N296、N352、N403、Y17、Y56、Y74、Y98、Y117、Y143、Y243、Y257、Y294、Y295、Y342、Y348、Y374、Y395、Y410、Y435,共计47个保守位点,这些保守位点不选择突变,剩余55个氨基酸位点。
Swiss-model是一款在线同源建模软件,它可以搜索与用户提交的序列同源的多个已确定空间结构的蛋白,用户可选择其中一个为模板,对所提交序列进行同源建模,一般要求建模对象要与模板的一致度保证在30%以上。建模完成后,对构建的模型进行评价,以评估建模结果是否可以用于后续的分子对接等操作。在Swiss-model中以一致度最高的蛋白(PDB id:6wiu)为模板建模,评分结果参见图3,模型评价中,GMQE得分为0.91,QMEAN的得分为-0.83,EARRT评分得分为94.591,PROCHECK评分中,再参见图4,拉氏图显示落在最合适区域的残基比例为90.1%,综合评价来看,该模型可以用于分子对接和点突变实验设计。
是一款用于分子对接、药物设计等方面的软件。以pNPG为底物,在ChemicBiodraw中画出该物质平面结构图并在ChemBio3D中打开,选择Calculations模块下MM2中的能量最小化选项,分析参数选择为默认参数,点击运行后保存运行结果。将BglD2结构模型的pdb文件在/>
利用SIFT预测突变是否为有害突变并舍弃有害突变体。根据NetSurfP-3.0的预测结果,位于表面的亲水和疏水的氨基酸突变为亲水性且与温度成正相关的氨基酸,因此,位于蛋白表面的氨基酸D、N、W、Y突变成E、K、R,决定将位于蛋白内部的亲水和疏水氨基酸突变为疏水性且与温度正相关的氨基酸,因此,位于蛋白内部的氨基酸D、N、W、Y突变成L、V。结合这一前提,根据SIFT的预测结果,D34、D250、N109、N389、N245这5个位点在突变成相应氨基酸时均为有害突变,因此排除这些位点,拟突变位点剩余49个。
将剩余位点同源建模,将蛋白结构pdb文件在Pymol中打开,Pymol中分析比较突变前后作用力的变化,得出突变体N430E、N391K、N391R、N329R、N232R、W44R、D411E、D156E、Y367E、Y268R,这些突变体相比于BglD2野生型增加了新的相互作用力,对提高蛋白的热稳定性有所帮助,作用力分析结果参见图5至图14。
综上所述,采用理性设计的方法,从氨基酸残基分子间相互作用和氨基酸偏好性的角度出发,通过对BglD2进行氨基酸组成分析、表面氨基酸分布预测、序列比对、同源建模分子对接、预测有害突变和相互作用力分析,获得对提高BglD2热稳定性有益的突变体,最终得到N430E、N391K、N391R、N329R、N232R、W44R、D411E、D156E、Y367E、Y268R十个突变体。
实施例二:测定突变体热稳定性
一、定点突变
针对N430E、N391K、N391R、N329R、N232R、W44R、D411E、D156E、Y367E、Y268R这10个突变体,通过设计相应的突变引物,利用同源重组法对BglD2分别进行单点突变制备相应的突变体。扩大培养后破碎细菌、分离纯化得到BglD2野生型和各个突变体蛋白。
在SnapGene中,根据BglD2基因序列,引物设计方式为:5'-15-21bp反向互补区域+至少15bp的非互补区域-3',引物设计好后交由杭州有康生物合成。引物设计参见表2。
表2定点突变引物及其序列
表2中,小写字母表示突变位点。
采用同源重组的方法,以含有BglD2野生型序列的pET-22b(+)质粒为模板。在BglD2引入目的位点突变,PCR体系参见表3,PCR反应程序参见表4。
表3PCR反应体系
表4 PCR反应程序
PCR反应结束后经0.7%琼脂糖DNA凝胶电泳分析检验,将9μL PCR样品与1μL DNAloading buffer混合均匀,短暂离心后取10μL上样,DNAmarker吸取3μL上样,电泳电压100V,电泳时间1 h,DNA电泳验证结束后,置于凝胶成像系统中紫外灯下成像拍照。突变体的DNA凝胶电泳图参见图15。野生型的质粒碱基对数目为6714,突变体的DNA凝胶电泳图显示突变后的质粒碱基对数目在6000-8000 bp之间,凝胶成像显示结果与质粒实际大小是一致的。DNA电泳验证结束后,采用Dpn I消化原始模板,于冰上配制Dpn I消化体系,Dpn I反应体系参见表5。
表5 Dpn I反应体系
轻轻晃动以混匀反应体系,经过离心机短暂离心后37℃反应1-2 h。消化结束后,采用Exnase II实现线性DNA的体外环化,设置阴性对照,于冰上配制Exnase II反应体系,Exnase II反应体系参见表6。
表6 Exnase II反应体系
将体系充分混匀,置于微型离心机离心5 s,离心结束后置于T100
Thermal Cycler梯度PCR仪中恒温37℃反应30min,结束反应后降温至4℃或立即将反应体系放置于冰盒上0℃保存。
二、突变体菌株构建
重组产物转化:取出超低温保存的DH5α感受态细胞,于冰盒中解冻,于单人净化工作台上使用移液枪吸取10μL重组产物,将其加入100μL解冻后的感受态细胞,轻弹管壁,然后将其于冰盒中静静放置30min,接下来,将其转移到水浴锅中,水温设置在42℃,进行热激处理,时间为45s。热激处理结束后,应立即将样品取出,放置在冰盒中冷却2-3分钟。冷却结束后取900μL不含氨苄霉素的LB液体培养基,于单人净化工作台中将培养基加入感受态细胞中,恒温振荡器中37℃振荡培养1h,振荡器的转速设置为200rpm-250rpm。将相应的含有氨苄霉素(工作浓度:50μg/mL)的LB固体培养基平板置于生化培养箱37℃预热,摇菌结束后立即置于离心机中离心,离心机转速设置为2400×g,离心时间设置为5min,离心结束后,吸取900μL上清液并丢弃。用剩余的100μL培养基在涡旋器上充分涡旋以重悬菌体,于单人净化工作台中,吸取重悬后的菌液滴入已提前预热后的平板,然后使用无菌涂布棒轻轻涂抹,直至菌液被培养基完全吸收。之后,将平板转移至生化培养箱中,设置温度为37℃,平板倒置培养12小时至16小时。
重组产物鉴定:过夜培养后,挑选若干个单克隆接种至含有氨苄霉素(50μg/mL)的10mL LB液体培养基中,设置培养温度为37℃,设定转速为200rpm过夜培养。取1mL菌液送南京擎科生物测序。在SnapGene中比对突变前后的序列变化,确定突变成功后进行下一步操作。
质粒提取与保种:使用质粒提取试剂盒,取5mL菌液用于质粒提取,Nano-100测其A260/A280的值,剩余菌液取0.5mL,加入0.25mL的50%甘油混合均匀后置于-80℃超低温冰箱保存。
表达菌株的构建:取出超低温保存的BL21感受态细胞,于冰盒上解冻,于单人净化工作台上使用移液枪吸取10μL重组产物,将其加入100μL解冻后的感受态细胞,轻弹管壁,于冰盒上静置15min后水浴锅中42℃水浴热激75sec,热激结束后立即置于冰盒上冷却5min。冷却结束后取900μL不含氨苄霉素的LB液体培养基,于单人净化工作台中将培养基加入感受态细胞中,恒温振荡器中37℃振荡培养1h,振荡器的转速设置为200rpm-250rpm。将相应的含有氨苄霉素(工作浓度:50μg/mL)的LB固体培养基平板置于生化培养箱37℃中预热,摇菌结束后立即置于离心机中离心,离心机转速设置为2400×g,离心时间设置为5min,离心结束后,吸取900μL上清液并丢弃。用剩余的100μL培养基在涡旋器上充分涡旋以重悬菌体,于单人净化工作台中,吸取重悬后的菌液滴入已提前预热后的平板,然后使用无菌涂布棒轻轻涂抹,直至菌液被培养基完全吸收。之后,将平板转移至生化培养箱中,设置温度为37℃,平板倒置培养12小时至16小时。
三、蛋白表达与纯化
(1)诱导表达:从上述构建好的BL21表达菌株平板培养基中挑选单菌落,在单人净化工作台中,向10mL LB(L)(含氨苄霉素50μg/mL)接种单菌落,并将培养基置于恒温振荡器中振荡培养,37℃、200rpm过夜培养。然后按1%(V/V)的接种量,向100mL LB(L)(含氨苄霉素50μg/mL)接种菌液,置于恒温振荡器中振荡培养,37℃、200rpm,每隔30min测量一次OD600值,当OD600位于0.6-0.8时,加入IPTG(终浓度0.2mM),16℃、200rpm诱导蛋白表达16h。之后4℃、6000×g离心5min,去掉培养基,收集底部菌体。加入Lysis Buffer轻轻洗涤菌体1-2次以去除残留培养基。
(2)蛋白分离与纯化:按照菌体:Lysis Buffer=1:10(W/V)加入Lysis Buffer,重组菌体后超声破碎(超声20min,工作1.5sec,停3sec)。4℃,12000×g离心30min收集上清液,即粗酶液,使用0.22μm水系针式滤器过滤粗酶液。
过滤后的粗酶液采用镍离子亲和层析法对其进行下一步的纯化操作,镍析柱分离纯化过程(所用试剂与样品均事先用0.22μm水系和有机系滤器处理过):
①将Ni NTA Beads 6FF(1mL规格)重力柱垂直固定在支架上,脱去重力柱的下端塞子和上端塞子,使重力柱里的保护液流出直至流尽为止。
②将5mL裂解平衡液加入柱管中,使填料中充满与目标蛋白相同的缓冲液,从而起到保护蛋白质的作用。
③平衡结束后,将样品加到重力柱中,使得样品在填料中的停留时间不少于2min,重复操作反复上样3次,以保证目的蛋白与填料充分接触,从而使目的蛋白与镍离子充分结合挂柱,提高目的蛋白的回收率,收集流出液。
④用10mL-15mL的洗涤液洗涤重力柱,冲洗与填料非特异性结合的杂蛋白,收集洗涤液。
⑤用5mL-10mL洗脱液对目的蛋白进行洗脱,用离心管分段收集洗脱液,每段收集1mL,使用Nano-100测定每管蛋白质含量,当洗脱液内的蛋白质含量为0时,停止洗脱。
⑥依次使用3mL的裂解平衡液和5mL的去离子水冲洗填料。向重力柱中加入等体积的20%乙醇以保存重力柱,置于4℃保存。
对纯化后的蛋白使用Prepacked Desalting Column蛋白脱盐柱除去里面的高浓度咪唑。脱盐过程如下(所用试剂与样品均事先用0.22μm水系和有机系滤器处理过):
①将Prepacked Desalting Column蛋白脱盐垂直放置于支架上,脱去重力柱的下端塞子和上端塞子,使重力柱里的保护液流出直至流尽为止。
②加入4mL柠檬酸-磷酸氢二钠缓冲液(pH 6.5)对预装柱进行平衡,重复5次。
③向脱盐中加入待脱盐样品,保证待测样品的上样量在1mL-2mL,样品进入填料后,继续往脱盐柱中加入平衡液,对脱盐柱进行持续洗脱,分段收集洗脱液,每段收集1mL,检测每管蛋白浓度和盐浓度,当蛋白洗脱完全时停止洗脱。
④加入4mL平衡液进行再平衡,重复至少5次,将残留的盐冲洗干净,加入10mL20%乙醇保护液,置于4℃保存。
本实施例所用大肠杆菌感受态细胞BL21、DH5α均有实验室自制保存,序列下载自GenBank数据库(登录号:MT815914),连接有该序列的pET-22b(+)载体由南京金斯瑞公司合成。
实施例三:SDS-PAGE验证纯化后的蛋白
对突变体蛋白和野生型蛋白利用使用SDS-PAGE变性蛋白电泳验证分子量大小、表达情况和纯度,其步骤如下:
(1)组合装置:取出洗净烘干的1.0mm玻璃片安装到硅胶框中,将玻璃片固定在制胶工具上,使其下端紧紧抵在硅胶垫上以防止漏液。
(2)制胶:使用诺唯赞快速制胶试剂盒制备10%聚丙烯酰胺凝胶,上层浓缩和下层分离胶的配方参见表7。
表7分离胶和浓缩胶配方
分别向上下层胶中加入不同体积的APS,涡旋器上立即充分涡旋混匀。先向制胶玻璃板中注入5.4mL下层胶(具体注入体积可根据实际情况调整)。无需等待下层胶凝固,立刻将上层胶沿着玻璃板边缘缝隙缓慢注入制胶玻璃板中,直至加入的上层胶液面与制胶玻璃板短板一侧持平,竖直向下向上层胶中轻轻插入梳齿,等待约20min直至上下层胶彻底凝固。
(3)蛋白变性:将16μL蛋白样品与4μL 5×变性蛋白loading buffer混合均匀,短暂离心后置于100℃金属浴10min。
(4)安装:将内部蛋白凝胶已经凝固好的制胶玻璃板装入电泳夹子中,轻轻放入电泳槽中,倒入电泳缓冲液,使制胶玻璃板内侧液面高于其短玻璃板上沿,轻轻拔去梳子。
(5)上样:向加样孔中注入5μL彩虹蛋白Marker作为对照,然后分别将蛋白样品依次注入加样孔中(10μL/孔)。电压设为100V,电泳时间60min。
(6)染色:电泳结束后关闭电源,取出玻璃板轻轻撬开,用刀具小心剥落凝胶,去除上层浓缩胶和残胶后置于玻璃皿内,倒入考马斯亮蓝染色液至液面漫过凝胶1-2cm高度,将玻璃皿放置在轨道式振荡器上振荡染色30min。
(7)脱色:染色完成后,回收染色液,先用去离子水冲洗掉残余的染色液再倒入脱色液,脱色1h后更换脱色液脱色2-3h。
(8)成像:小心将脱色后的凝胶放置在白板上,在凝胶成像系统中,打开白光调节合适的曝光后,进行观察拍照。
参见图16,图16为蛋白纯化前后电泳图,文献报道该酶野生型的分子量约为49.4kDa,纯化后的蛋白电泳结果如下所示,可见在50kDa位置处有非常明显的蛋白条带,两者结果相近,突变体蛋白与作为参照的野生型蛋白位置基本一致。
实施例四:BCA法测定蛋白含量
BCA试剂盒购自南京诺唯赞生物,测定蛋白浓度过程如下:
(1)BCA工作液的配制,根据待测样品得数量计算所需配制得试剂体积(200μL/孔样品),配置比例为V工作液A:V工作液B=50:1,涡旋器上涡旋至两种工作液充分混匀。
(2)绘制BCA标准曲线。取96孔板,设置三组平行实验,按照表8配制标准品:
表8BCA标准蛋白浓度梯度
(3)准备样品:适当稀释待测样品,移液枪吸取20μL稀释后样品置于96孔板,随后每孔加入200μL工作液,重复三组平行实验。
(4)加样结束后,将孔板放置于微孔板恒温振荡器37℃、200rpm反应25min。
(5)孵育结束后测定吸光度,设置测定吸收波长为562nm,酶标仪测定该波长下样品的吸光度,设置上表中0号孔为空白对照。
(6)横坐标选择每孔中待测标准品中的蛋白含量,纵坐标选择酶标仪中所测得的标准品吸光度,以此绘制蛋白含量-吸光度标准曲线。
(7)根据测得的吸光度,带入标准曲线方程计算蛋白含量。
(8)计算蛋白浓度,实际蛋白浓度=蛋白含量/待测样品体积,若有适当稀释,则需考虑实际稀释倍数。
以吸光度为纵坐标,以蛋白含量(μg)为横坐标绘制散点图,通过线性拟合可得标准曲线:y=0.04593x+0.1199,R
实施例五:pNPG初筛
(1)pNP标准曲线的测定
取96孔板,设置三组平行实验,按照表9配制标准品:
表9pNP标准浓度梯度
用酶标仪测定标准品吸光度数值,波长选择405nm,以不含pNP的吸光度为空白对照。横坐标选择标准品中pNP的终浓度(mM)为横坐标,纵坐标选择标准品所测得的吸光度,根据测定结果绘制标准曲线,pNP浓度标准曲线参见图18,标准曲线:y=4.706x+0.08587,R
(2)酶活力测定
酶活力单位定义为:每分钟生产1μmol pNP所需要添加的酶量为1U。
酶促反应体系反应体积为500μL,反应体系包括25μL的pNPG溶液(0.1M)、450μL的柠檬酸-磷酸氢二钠(pH=6.5)缓冲液和25μL的纯酶液(适度稀释)。反应于45℃下进行,反应时间为5min,反应结束后需加入终止剂终止反应,所用的终止剂为Na
(3)pNPG测定酶的最适反应温度和半衰期
在30℃到55℃(每隔5℃)的不同温度条件下,对酶催化反应进行测定,以确定酶的最适反应温度,即确定反应温度对酶活力的影响。以在上述温度区间中所测得的酶活力最大值为100%,计算其他温度反应条件时的酶活力相对于最大酶活力的比值,计为相对酶活(%),以相对酶活力比值(%)为纵坐标,反应温度(℃)为横坐标作图,参见图20。以pNPG底物测得的BglD2的野生型(WT)和突变体比活力参见图19和表10。
表10野生酶与突变酶的比酶活及变化率
突变体N391R、D156E、Y367E的比酶活相比于野生型有所上升,突变体N232R、N329R、Y268R、W44R的比酶活则明显下降,突变体N430E、N391K和D411E则无明显变化。因此初步排除突变体N232R、N329R、Y268R、W44R四个突变体。
酶的半衰期是指酶特定温度下活力衰减为初始酶活力一半的时间,因为BglD2在最适反应温度45℃下不到10min就会失活,而40℃时其相对酶活力可以达到45℃时的80%以上,因此本实施例分别测定酶在45℃下活力丧失一半的时间T(1/2,45℃)和酶在40℃下活力丧失一半的时间T(1/2,40℃)。T(1/2,45℃)的测定过程为:45℃孵育纯化酶液,以10min为间隔,每次从中取出用于测定残余酶活力的部分酶液。具体实验步骤为:取出的酶液后立刻冰浴2min,再采用(2)所述方法测定酶的相对残余活力。设以4℃保存的酶在最适反应体系中所测得的活力为初始酶活,规定为100%,计算在45℃时孵育的酶的活力相比于初始酶活力的残留比值(%),以该值(%)为纵坐标,孵育时间(min)为横坐标作图。T(1/2,40℃)的测定过程为:40℃孵育纯化酶液,每隔10min取出部分酶液用于测定残余活力。具体实验步骤为:取出的酶液后立刻冰浴2min,再采用(2,40摄氏度)所述方法测定酶的相对残余活力。以10min为间隔,每次从中取出用于测定残余酶活力的部分酶液。具体实验步骤为:取出的酶液后立刻冰浴2min,再采用(2)所述方法测定酶的相对残余活力。设以4℃保存的酶在最适反应体系中所测得的活力为初始酶活,规定为100%,计算在40℃时孵育的酶的活力相比于初始酶活力的残留比值(%),以该值(%)为纵坐标,孵育时间(min)为横坐标作图。温度、pH和底物浓度不变时,酶失活的一级动力学方程为:
其中E
参见图20,其为突变体N391R、D156E、Y367E、N430E、N391K和D411E的Tm图,测定各蛋白的Tm均为45℃。
测定突变体N391R、D156E、Y367E、N430E、N391K和D411E的45℃和40℃半衰期,结果参见图21、图22和表11。可以清楚知道,野生型和突变体蛋白在45℃均不足10min,其中野生型蛋白在孵育10min后残余相对酶活力约为36.56±1.04%,而突变体D156E的残余相对酶活力约为41.97±1.90%,突变体D411E的残余相对酶活力约为48.52±1.53%,其余突变体的残余相对酶活力均小于野生型。继续考察各个突变体在40℃时的半衰期,野生型蛋白T(1/2,40℃)约为9.60±0.25min,突变体Y367E的T(1/2,40℃)则为4.58±0.44min,突变体N430E、N391K、N391R、D156E、D411的T(1/2,40℃)均有所上升,结合它们的比酶活和45℃时的稳定性,D156E不仅半衰期有所增加,且其比酶活明显上升,而D411E的T(1/2,40℃)则提高了约4.22倍,是所有突变体中表现最好的,且比酶活基本保持不变。综上考虑,选择突变体D156E和D411E进行下一步复筛实验。
表11野生酶与突变酶的40℃半衰期T
综上所述,初筛以pNPG作为底物,测定野生酶和突变酶的酶活力、T
实施例六:虎杖苷复筛
(1)白藜芦醇标准曲线的测定
白藜芦醇标准曲线绘制,横坐标选择反应结束后生成的白藜芦醇终浓度(mg/mL),纵坐标选择HPLC测定后返回的白藜芦醇峰面积,绘制散点图,GraphPad中拟合可得标准曲线:y=78771x-10.09,R
(2)酶活力测定
参见图24,其为以虎杖苷为底物测得的BglD2的野生型和突变体D156E和D411E的比活力图。可以清楚知道,野生型的比酶活为91.75±2.30U/mg,突变体D156E、D411E的比酶活分别为126.81±2.80U/mg和108.03±2.28U/mg,为野生型的比酶活的1.38±0.07倍和1.18±0.05倍,两个突变体酶活力均有所提升。
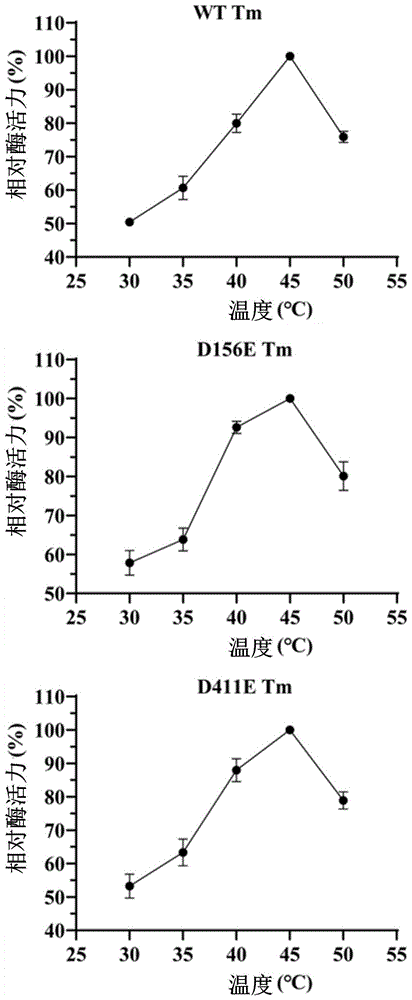
测定三者的Tm,结果参见图25,三个蛋白的Tm均为45℃,再参见表12,在45℃下保温10min后三个蛋白基本都丧失活性,且由Tm测定数据可知,在40℃时的酶活力均可达到最大酶活力的约80%,甚至更高,因此测定的T(1/2,40℃),结果参见图26和表13。
表12野生酶与突变酶45℃下保温10分钟酶活力变化
表13野生酶与突变酶40℃下半衰期
根据表13,可以清楚知道,相比于野生型,两个突变体的T(1/2,40℃)均提高了近1倍,表明突变后的稳定性有着显著提升。
测定三个蛋白的T
表14半失活温度T
可以清楚知道,突变体D156E和D411E的的半失活温度都比野生型酶有所提高,表明突变后的稳定性有着显著提升。
实施例七:动力学参数测定
测定野生型BglD2和突变体D156E、D411E的纯酶在不同虎杖苷底物终浓度(0-1mM)下的反应初速度,建立500μL的酶反应体系,包括25μL适当稀释的酶液,475μL的不同虎杖苷底物终浓度(以柠檬酸-磷酸氢二钠缓冲液(pH=6.5)缓冲液与0.1M虎杖苷溶液按不同比例预先混合配制)。45℃预热1min后加入25μL适当稀释的酶液,反应于45℃下进行,待反应3min后往体系中加入500μL的无水乙醇混合均匀终止反应,吸取200μL经0.22μm有机系针式滤器过滤后转移至液相上样管中进行上样分析。以反应初速度V为横坐标,底物浓度[S]为纵坐标,在Graphd Prism软件中选择Michaelis-Menten方程进行非线性拟合。
V=V
式中:V和Vmax分别代表反应速率和最大反应速率,单位为(mM/s);
[S]--表示反应的底物浓度(mM);
K
催化常数k
其中,[E
野生酶及突变酶动力学参数结果参见图28和表15,野生酶Km为0.15±0.01mM,突变体D156E和D411E的Km分别为0.14±0.01mM和0.14±0.01mM,野生酶的kcat为5.20±0.04s-1,突变体D156E和D411E的kcat分别为6.88±0.16s-1和5.97±0.15s-1,相比野生酶有所提高,表明突变有助于提高酶对底物的催化活力。综合比较而言,野生酶的kcat/Km为34.87s-1˙mM-1,突变体D156E和D411E的kcat/Km分别为49.76s-1˙mM-1和43.84s-1˙mM-1,相比野生型整体催化效率分别提高42.70%和20.46%。
表15野生酶与突变酶的动力学参数
复筛以虎杖苷为底物,测定D156E和D411E的酶比活力、T
综上所述,本发明首先构建出N430E、N391K、N391R、N329R、N232R、W44R、D411E、D156E、Y367E、Y268R这10个突变体,并对突变体和野生型进行扩大培养、诱导表达后获得突变体蛋白和野生型蛋白,最终通过蛋白电泳和镍柱纯化成功制备纯蛋白。然后利用pNPG对各蛋白进行初步筛选,依次测定各蛋白的比酶活、Tm、T(1/2,40℃)和T(1/2,45℃),实验结果表明突变体D156E、D411E的比酶活和T(1/2,40℃)均有明显提升,其T(1/2,45℃)虽然也不足10min,但是在孵育10min后其残余相对酶活力仍然高于野生型酶,因此,综合分析下来选择突变体D156E和D411E进行以虎杖苷为底物的复筛。复筛实验结果最终表明,两个突变体的除比酶活提升外,T(1/2,40℃)和T
进一步的,突变体D156E的氨基酸序列如SEQ ID NO:1所示。突变体D411E的氨基酸序列如SEQ ID NO:2所示。
值得说明的是,突变体N430E的氨基酸序列如SEQ ID NO:3所示;突变体N391K的氨基酸序列如SEQ ID NO:4所示;突变体N391R的氨基酸序列如SEQ ID NO:5所示;突变体N329R的氨基酸序列如SEQ ID NO:6所示;突变体N232R的氨基酸序列如SEQ ID NO:7所示;突变体W44R的氨基酸序列如SEQ ID NO:8所示;突变体Y268R的氨基酸序列如SEQ ID NO:9所示;突变体Y367E的氨基酸序列如SEQ ID NO:10所示。
实施例八:
缓冲液pH、金属离子和反应体系中的葡萄糖浓度都会导致BGL的酶活力发生变化,在一定范围内,上述因素会促进酶促反应的速率,因此验证最佳突变体D156E、D411E以下内容:(1)反应体系pH对酶活和稳定性的影响;(2)不同浓度金属离子对酶活力的影响;(3)葡萄糖抑制常数测定。
(1)pH对酶的影响
以虎杖苷为底物,将野生型酶和突变体D156E、D411E酶分别在不同pH缓冲液中测定酶活,探究反应体系pH对酶活力的影响。以5mM虎杖苷为底物,配制不同pH的缓冲液,pH梯度设置4.5、5、5.5、6、6.5、7这5个梯度,将野生型酶和突变体D156E、D411E酶分别置于上述不同pH的缓冲液中4℃保温,保温时间为12h,以初始酶活力作为100%,计算相对残余酶活力。
参见图29,其为pH对野生酶及突变酶活力的影响图,在pH范围从4.5到7.0内,野生型和D156E、D411E突变体酶的活性随着pH的变化而变化。结果显示,野生型和D411E突变体的最适反应pH均为6.5。在pH 6到7之间,它们的活性保持在约80%以上。而突变体D156E的活性则在低于或高于6.5的pH条件下显著下降。当pH低于5.0时,野生型和突变体的酶活性基本上都丧失了。
参见图30,其为pH对酶稳定性的影响图,野生酶和突变酶在pH 4.5-5的范围内,在4℃下保持12小时后,几乎完全丧失活性。而在pH 6-7的范围内,野生酶和突变酶在4℃下保持12小时后仍保持着80%以上的酶活力,而在pH 5-5.5的范围内,野生酶和突变酶表现出不同的性质,在该pH范围内,野生酶的酶活力仍然可以保持在80%-90%,而突变酶则略低于野生酶,为70%-80%。
(2)金属离子对酶的影响
用柠檬酸-磷酸氢二钠缓冲液(pH=6.5)分别配制0.1M EDTA、Mn
表16金属离子对酶的影响
根据表16,可以清楚知道,EDTA的加入对野生酶和突变酶的活力基本无影响,这表明野生酶和突变酶均不是金属依赖性的蛋白,Cu
(3)葡萄糖的抑制性研究
在45℃、pH=6.5反应条件下,按照标准酶反应体系,以不同浓度的虎杖苷(0.02mmol/L-1.0mmol/L)为底物,向反应体系中添加含有葡萄糖溶液,使得葡萄糖终浓度在反应体系中分别为0.1mM和1mM,然后分别测定野生酶和突变酶的酶活。根据GraphPadPrism 8.0软件的非线性拟合中的竞争性抑制方程Competivitive inhibition拟合计算野生酶和突变酶的葡萄糖抑制常数。
参见图31,其为野生酶和突变酶的葡萄糖抑制常数Ki图,根据软件计算结果,野生酶的Ki为64.33±7.04mM,突变酶D156E的Ki为55.79±4.95mM,突变酶D411E的Ki为85.60±10.01mM。来源不同的BGL对葡萄糖的耐受力也不同,来源是微生物的大多数BGL往往会受到葡萄糖的竞争性抑制作用,据文献报道,在以通用底物pNPG为底物时,抑制常数一般为0.6-14mM,因此,野生酶和突变酶都具有较好的耐高糖的性质。
综上所述,突变体D156E和D411E的性质与野生酶的基本相同,这表明这两个突变体相应位点的氨基酸突变并不会对酶本身的性质产生负面影响。
虽然本发明披露如上,但本发明并非限定于此。任何本领域技术人员,在不脱离本发明的精神和范围内,均可作各种更动与修改,因此本发明的保护范围应当以权利要求所限定的范围为准。
- 高酶活天冬氨酸激酶突变体、工程菌及该突变体的制备方法
- 一种蔗糖水解酶突变体及其制备方法与应用
- 一种苏氨酸脱氨酶突变体及其制备方法和应用
- 一种热稳定性提高的脂肪酶突变体及其制备方法和应用
- 谷氨酸氧化酶突变体、核酸分子及应用和制备酮戊二酸的方法
- 卤醇脱卤酶突变体菌株、卤醇脱卤酶突变体及其制备方法和应用
- 卤醇脱卤酶突变体菌株、卤醇脱卤酶突变体及其制备方法和应用
