一种丝素蛋白-活性成分复合物及其制备方法
文献发布时间:2023-06-19 18:53:06
技术领域
本发明属于复合材料技术领域,尤其涉及一种丝素蛋白-活性成分复合物及其制备方法。
背景技术
近年来,不同水溶性和水不溶性活性成分的协同作用对肿瘤等疾病、组织修复、皮肤保护等的优异作用引起研究者的广泛关注,然而,由于其理化性能差异巨大,如何将其共加载在同一载体,提升其协同作用一直是难以解决的关键问题。目前不同团队根据不同亲疏水活性成分的性质,开发出多种脂质体、乳液、包裹体等不同载体以实现多种药物的加载,其制备工艺复杂,加载率过低等问题极大限制了上述体系的应用,开发新的载体体系,并通过简单可靠的方式实现不同药物的共加载对推动多种药物和活性成分的协同使用,提高应用效果具有重要意义。
丝素蛋白优异的生物相容性,力学性能,可降解性,易于成形以及能够在水溶液中进行处理等优点,引发了研究者的广泛兴趣,并逐渐尝试将其应用于血管、神经、皮肤、骨等多种组织修复以及药物控释领域。特别是在药物控释方面,丝素蛋白载体在提高活性成分稳定性及实现不同成分缓释方面表现出明显性能优势。然而,如何实现不同理化性能活性成分的共加载,尚缺少可行的手段。近年来,基于对丝素蛋白纳米结构和性能本质的深入理解,苏州大学吕强老师团队逐渐开发出不同构象组成、不同纳米尺寸的纳米球、纳米线等丝素蛋白纳米载体,并实现多种药物和活性成分的加载和控释,表现出比传统丝素蛋白载体更好的综合性能。在丝素蛋白载体制备研究中,丝素蛋白特殊的亲水和疏水分区结构以及高负电荷密度可使得丝素蛋白纳米载体具有特殊的水分散性,激发学者们对丝素蛋白纳米载体加载水溶性活性成分和水不溶性活性成分研究的兴趣。丝素蛋白的纳米结构使其具有不同的比表面积,进而影响不同活性成分的吸附行为,结合丝素蛋白纳米载体纳米结构设计和二级结构调控,有可能开发可同时加载水溶性和水不溶性活性成分的丝素蛋白纳米载体,为不同活性成分的协同使用提供新的选择。目前,根据丝素蛋白纳米载体的特征,通过改善载体的比表面积和亲疏水结构分布通过直接加载的方法,实现多种水溶性活性成分的直接加载和缓释。随后,利用特殊构象组成和特殊纳米结构丝素蛋白载体在不同溶剂体系的可分散性,通过将水不溶性活性成分溶解至有机溶剂,再经丝素蛋白纳米载体在有机溶剂-水混合体系中对活性成分的吸附,利用物理方法除去有机溶剂,获得水不溶性活性成分在丝素蛋白纳米载体的加载和水相分散。然而,如何将两种体系融合,并避免亲水和水不溶性活性成分加载在纳米载体的相互不良影响,仍然需要通过精巧设计进行规避。
发明内容
为此,本发明所要解决的技术问题在于克服现有技术中将不同水溶性和水不溶性活性成分共加载在同一载体较难实现、制备工艺复杂、加载率过低、不同水溶性和水不溶性活性成分的比值较难调控限制其协同作用等问题。
为解决上述技术问题,本发明提供了一种丝素蛋白-活性成分复合物及其制备方法。采用具有特殊结构的丝素蛋白纳米载体,以优化其同时加载水溶性活性成分和水不溶性活性成分的能力,同时融合不同的加载方式,通过先加载水不溶性活性成分,再在水相环境加载水溶性活性成分的策略,避免两者加载的不良相互作用,得到高效加载不同活性成分的丝素蛋白-活性成分复合物。
本发明的第一个目的是提供一种丝素蛋白-活性成分复合物,包括丝素蛋白纳米载体,以及负载于所述丝素蛋白纳米载体上的水不溶性活性成分和水溶性活性成分,所述丝素蛋白纳米载体的β-折叠含量高于40%,ZETA电位绝对值大于30mV。
在本发明的一个实施例中,丝素蛋白纳米载体的结构和构象组成等是决定共加载的决定性因素之一,丝素蛋白纳米载体的β-折叠含量高于40%,高的β-折叠含量意味着亲水和疏水区的合理分布,保证足够疏水区域在表面暴露,从而使其在不同类型溶剂中均有优异分散性,提高其吸附水不溶性活性成分的能力。ZETA电位绝对值大于30mV,则赋予丝素蛋白载体良好的电荷斥力,从而抑制纳米载体负载水不溶性活性成分后,在水相聚集,而特殊的纳米结构和亲疏水性则使得丝素蛋白载体对水溶性和水不溶性活性成分均有优异的吸附作用,实现不同类型活性成分的有效加载。
在本发明的一个实施例中,所述丝素蛋白纳米载体为带状或棒状结构,所述丝素蛋白纳米载体的宽度为10-20nm、高度为1-5nm、长度为20-2500nm。赋予载体足够的比表面积,使其高效负载活性成分。
在本发明的一个实施例中,所述水不溶性活性成分为紫杉醇、姜黄素、积雪草苷、视黄醇、维生素E、虾青素、白藜芦醇和尼罗红中的一种或多种。
在本发明的一个实施例中,所述水溶性活性成分为阿霉素、去铁胺、神经酰胺、维生素C、透明质酸、果绿、烟酸和表皮生长因子中的一种或多种。
本发明的第二个目的是提供一种所述的丝素蛋白-活性成分复合物的制备方法,包括以下步骤,
S1、将水不溶性活性成分溶于有机溶剂,加入丝素蛋白纳米载体水溶液,搅拌后进行透析或离心处理,得到丝素蛋白-水不溶性活性成分复合物;
S2、将S1所述丝素蛋白-水不溶性活性成分复合物加水复溶,得到丝素蛋白-水不溶性活性成分复合物水溶液;
S3、向S2所述丝素蛋白-水不溶性活性成分复合物水溶液中加入水溶性活性成分,搅拌后进行透析或离心处理,得到所述丝素蛋白-活性成分复合物。
在本发明的一个实施例中,在S1中,所述有机溶剂为甲醇、乙醇、丙酮、乙腈和二甲基亚砜中的一种或多种。有机溶剂为同水能够混溶的任何有机溶剂或多种有机溶剂的复合,其选择取决于对特定水不溶性活性成分的溶解能力。根据不同水不溶性活性成分在不同有机溶剂的溶解性能,可优化活性成分在有机溶剂-丝素蛋白水溶液复合体系的溶解性能,获得更好的加载量。
在本发明的一个实施例中,在S1中,所述丝素蛋白纳米载体水溶液的浓度为0.1-6wt%。
在本发明的一个实施例中,在S1中,所述丝素蛋白纳米载体水溶液和有机溶剂的体积比为1:9-9:1。
在本发明的一个实施例中,在S2中,所述丝素蛋白-水不溶性活性成分复合物水溶液中丝素蛋白纳米载体的浓度为0.1-6wt%。
在本发明的一个实施例中,在S1和S3中,所述搅拌的速率均为10-1000rpm;搅拌的温度均为4-90℃;搅拌的时间均为0.5-72h。在S1中,合理的温度进行搅拌,避免活性成分失活,在搅拌过程中,活性成分由于同丝素蛋白纳米载体具有良好相互作用,从有机溶剂中附着到纳米载体表面。有机溶剂的可选择性,提高了水不溶性活性成分的选择性,不同抗肿瘤药物、抗氧化剂、染料、抑制剂等均可通过此方式加载至丝素蛋白纳米载体表面。
在本发明的一个实施例中,在S1和S3中,所述透析的时间均为0.5-72h,透析的温度均为4-60℃,透析用溶剂为水或含有合适离子的水溶液。
在本发明的一个实施例中,在S1和S3中,所述离心的速率均为1000-20000rpm,离心的温度均为4-40℃,离心的时间均为0.1-3h。
在本发明的一个实施例中,在S3后,还可以对所述丝素蛋白-活性成分复合物加水复溶或冻干,得到丝素蛋白-活性成分复合物分散液或冻干粉。
在本发明的一个实施例中,所述丝素蛋白-活性成分复合物分散液中的丝素蛋白纳米载体的浓度为0.1-6wt%。
在本发明的一个实施例中,所述冻干的时间为12-72h。
在本发明的一个实施例中,水不溶性活性成分和水溶性活性成分与丝素蛋白纳米载体的比值可以在不高于水不溶性活性成分和水溶性活性成分在丝素蛋白纳米载体上负载的饱和量的前提下,根据活性成分发挥功效的有效浓度进行调控;水不溶性活性成分与水溶性活性成分的比值根据协同作用的比例或需求进行调控。水不溶性活性成分与丝素蛋白纳米载体的比值主要通过水不溶性活性成分溶于有机溶剂的浓度和丝素蛋白纳米载体水溶液和有机溶剂的体积比进行调控。水溶性活性成分与丝素蛋白纳米载体的比值通过水溶性活性成分的加入量进行调控。水不溶性活性成分和水溶性活性成分在丝素蛋白纳米载体上负载的饱和量与活性成分的分子量、表面电荷等性能相关。
在本发明的一个实施例中,考虑到负电荷在维持丝素蛋白纳米载体可分散性的关键作用,为避免水溶性活性成分加载对可分散性的影响,首先通过复合溶剂混合转载的方式加载水不溶性活性成分,这同样是实现高效共加载的关键技术要点。先加载水不溶性活性成分再加载水溶性活性成分主要是保证活性成分的高加载率,加载水不溶性活性成分使用复合溶剂混合转载的方式且需要反复重悬清洗离心或透析的过程去除有机溶剂,若先加载水溶性活性成分,加载上的水溶性活性成分在有机溶剂中可能失去其原本性能,另外在加载、反复重悬清洗离心或透析的过程会部分释放,最终丝素蛋白-活性成分复合物中活性成分的加载率会降低。
本发明的技术方案相比现有技术具有以下优点:
(1)本发明所述的制备方法利用具有特殊结构和性能的丝素蛋白纳米载体,通过载体晶体结构含量、电荷密度、纳米形态的调整,改善亲水区域和疏水区域的分布、表面电荷密度和比表面积,使其同时对水溶性和水不溶性活性成分均具有优异加载能力,并避免其在水相环境的聚集,解决两种类型活性成分共加载对理化环境差异性要求的矛盾。
(2)本发明所述的制备方法通过合理安排水溶性和水不溶性活性成分的加载次序,通过现在混合溶剂加载疏水性成分,随后将有机溶剂去除,将其分散在水相环境,再加载水溶性活性成分的方法,避免一种活性成分负载后抑制另一种活性成分的负载性能,实现水溶性和水不溶性两种类型活性成分的高效加载。
(3)本发明所述的制备方法通过丝素蛋白纳米载体结构的设计,来调控其吸附不同类型活性成分能力,并通过简单物理过程的精巧设计,来完成水溶性和水不溶性活性成分的共加载,其制备过程的简单性和可控性显著优于其它脂质体、包裹体等体系,可有效突破传统方法的诸多弊端,开发设计各种具有新功能的复合物。
附图说明
为了使本发明的内容更容易被清楚地理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明,其中:
图1为本发明丝素蛋白纳米载体的表征;其中,a为超声处理后不同尺寸的丝素蛋白纳米载体的纳米结构图(长度/高度/直径结果);b为红外;c为ZETA电位结果。
图2为本发明丝素蛋白-活性成分复合物的形貌表征;其中,a为未加载活性成分的AFM图以及高度和宽度统计图;b为加载水不溶性活性成分的AFM图以及高度和宽度统计图;c为同时加载水溶性和水不溶性活性成分的复合物AFM图以及高度和宽度统计图。
图3为本发明丝素蛋白-活性成分复合物的细胞同时摄取情况图。
图4为本发明丝素蛋白-活性成分复合物有效抑制肿瘤生长的性能图。
具体实施方式
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
实施例1
一种丝素蛋白-活性成分复合物及其制备方法,具体包括以下步骤:
(1)将紫杉醇溶解到乙醇中,调节紫杉醇浓度为6mg/mL,随后将浓度为2.5wt%的丝素蛋白纳米载体水溶液(纳米载体宽度为10-20nm,厚度为1-5nm,长度为1000-2500nm)加入紫杉醇乙醇溶液,调整乙醇和丝素蛋白纳米载体水溶液的体积比为2:1,将混合溶液在室温条件下以200rpm的转速搅拌20h,使紫杉醇充分加载至丝素蛋白纳米载体;
(2)将上述混合溶液在4℃条件下以10000rpm的转速离心30min,将加载紫杉醇的丝素蛋白纳米载体同混合溶剂分离,去除上层溶液,并使用纯水清洗载紫杉醇的丝素蛋白纳米载体,直至清洗液中无乙醇检出,随后加水重悬,调整至丝素蛋白纳米载体的浓度为2.3wt%;
(3)将阿霉素粉末直接加入上述重悬的丝素蛋白载体水溶液,并调整阿霉素浓度为1mg/mL,将溶液在25℃条件下以100rpm的转速搅拌24h,使阿霉素充分加载至已载紫杉醇的丝素蛋白纳米载体;
(4)将上述充分加载后的混合溶液,在4℃条件下以12000rpm的转速离心20min,将加载紫杉醇和阿霉素的丝素蛋白纳米载体同水分离,去除上层水溶液,清洗4次去除残留的游离阿霉素,加水重悬,获得同时加载紫杉醇和阿霉素的丝素蛋白纳米载体复合物溶液,复溶溶液中丝素蛋白的浓度为2wt%。
实施例2
一种丝素蛋白-活性成分复合物及其制备方法,具体包括以下步骤:
(1)将视黄醇溶解到乙醇中,调节视黄醇浓度为1mM,随后将浓度为6wt%的丝素蛋白纳米载体水溶液(纳米载体宽度为10-20nm,厚度为1-5nm,长度为600-1000nm)加入视黄醇乙醇溶液,调整乙醇和丝素蛋白纳米载体水溶液的体积比为9:1,将混合溶液在室温条件下以500rpm的转速搅拌36h,使视黄醇充分加载至丝素蛋白纳米载体;
(2)将上述混合溶液装入透析袋,外部加纯水在室温条件下进行透析48h,每3h换水一次,直至外部透析水中无乙醇检出,将加载视黄醇的丝素蛋白纳米载体从透析袋取出,加水调整至丝素蛋白纳米载体的浓度为0.3wt%;
(3)将去铁胺粉末直接加入上述载视黄醇的丝素蛋白纳米载体溶液,并调整去铁胺浓度为2mM,将溶液在25℃条件下以200rpm的转速搅拌20h,使去铁胺充分加载至已载视黄醇的丝素蛋白纳米载体;
(4)将上述充分加载后的混合溶液装入透析袋,外部加纯水在室温条件下进行透析24h,每3h换水一次,去除游离去铁胺,将透析袋内溶液取出,冷冻干燥36h,获得同时加载视黄醇和去铁胺的冻干丝素蛋白纳米载体复合物。
实施例3
一种丝素蛋白-活性成分复合物及其制备方法,具体包括以下步骤:
(1)将积雪草苷溶解到甲醇中,调节积雪草苷浓度为3mg/mL,随后将浓度为3wt%的丝素蛋白纳米载体水溶液(纳米载体宽度为10-20nm,厚度为1-5nm,长度为20-60nm)加入积雪草苷甲醇溶液,调整甲醇和丝素蛋白纳米载体水溶液的体积比为1:4,将混合溶液在37℃条件下以300rpm的转速搅拌48h,使积雪草苷充分加载至丝素蛋白纳米载体;
(2)将上述混合溶液装入透析袋,外部加纯水在37℃条件下进行透析12h,每2h换水一次,直至外部透析水中无甲醇检出,将加载积雪草苷的丝素蛋白纳米载体从透析袋取出,加水调整至丝素蛋白纳米载体的浓度为1wt%;
(3)将神经酰胺直接加入上述载积雪草苷的丝素蛋白纳米载体溶液,并调整神经酰胺浓度为2wt%,将溶液在37℃条件下以400rpm的转速搅拌6h,使神经酰胺充分加载至已载积雪草苷的丝素蛋白纳米载体;
(4)将上述充分加载后的混合溶液装入透析袋,外部加纯水在37℃条件下进行透析12h,每3h换水一次,去除游离神经酰胺,将透析袋内溶液取出,冷冻干燥72h,获得同时加载积雪草苷和神经酰胺的冻干丝素蛋白纳米载体复合物。
实施例4
一种丝素蛋白-活性成分复合物及其制备方法,具体包括以下步骤:
(1)将维生素E溶解到甲醇中,调节维生素E浓度为1mg/mL,随后将浓度为4wt%的丝素蛋白纳米载体水溶液(纳米载体宽度为10-20nm,厚度为1-5nm,长度为80-200nm)加入维生素E甲醇溶液,调整甲醇和丝素蛋白纳米载体水溶液的体积比为1:2,将混合溶液在4℃条件下以100rpm的转速搅拌72h,使维生素E充分加载至丝素蛋白纳米载体;
(2)将上述混合溶液装入透析袋,外部加纯水在4℃条件下进行透析72h,每3h换水一次,直至外部透析水中无甲醇检出,将加载维生素E的丝素蛋白纳米载体从透析袋取出,加水调整至丝素蛋白纳米载体的浓度为2wt%;
(3)将维生素C溶解到水中,随后将维生素C水溶液同载维生素E的丝素蛋白纳米载体溶液混合,并调整维生素C浓度为10mg/mL,将溶液在4℃条件下以300rpm的转速搅拌72h,使维生素C充分加载至已载维生素E的丝素蛋白纳米载体;
(4)将上述充分加载后的混合溶液装入透析袋,外部加纯水在60℃条件下进行透析2h,去除游离维生素C,将透析袋内溶液取出,冷冻干燥48h,获得同时加载维生素E和维生素C的冻干丝素蛋白纳米载体复合物。
实施例5
一种丝素蛋白-活性成分复合物及其制备方法,具体包括以下步骤:
(1)将姜黄素溶解到乙腈中,调节姜黄素浓度为2mg/mL,随后将浓度为5wt%的丝素蛋白纳米载体水溶液(纳米载体宽度为10-20nm,厚度为1-5nm,长度为300-500nm)加入姜黄素乙醇溶液,调整乙腈和丝素蛋白纳米载体水溶液的体积比为1:1,将混合溶液在60℃条件下以600rpm的转速搅拌4h,使姜黄素充分加载至丝素蛋白纳米载体;
(2)将上述混合溶液装入透析袋,外部加纯水在60℃条件下进行透析4h,每1h换水一次,直至外部透析水中无乙腈检出,将加载姜黄素的丝素蛋白纳米载体从透析袋取出,加水调整至丝素蛋白纳米载体的浓度为2wt%;
(3)将表皮生长因子直接加入上述重悬的丝素蛋白载体水溶液,并调整表皮生长因子浓度为20μg/ml,将溶液在4℃条件下以600rpm的转速搅拌24h,使表皮生长因子充分加载至已载姜黄素的丝素蛋白纳米载体;
(4)将上述充分加载后的混合溶液装入透析袋,外部加纯水在4℃条件下进行透析72h,每3h换水一次,去除游离表皮生长因子,将透析袋内溶液取出,冷冻干燥72h,获得同时加载姜黄素和表皮生长因子的丝素蛋白纳米载体复合物。
实施例6
一种丝素蛋白-活性成分复合物及其制备方法,具体包括以下步骤:
(1)将虾青素溶解到二甲基亚砜中,调节虾青素浓度为4mg/mL,随后将浓度为2wt%的丝素蛋白纳米载体水溶液(纳米载体宽度为10-20nm,厚度为1-5nm,长度为1000-2500nm)加入虾青素乙醇溶液,调整二甲基亚砜和丝素蛋白纳米载体水溶液的体积比为1:1,将混合溶液在37℃条件下以400rpm的转速搅拌6h,使虾青素充分加载至丝素蛋白纳米载体;
(2)将上述混合溶液在4℃条件下以9000rpm的转速离心20min,将加载虾青素的丝素蛋白纳米载体同混合溶剂分离,去除上层溶液,并使用纯水清洗载虾青素的丝素蛋白纳米载体,直至清洗液中无二甲基亚砜检出,随后加水重悬,调整至丝素蛋白纳米载体的浓度为1.8wt%;
(3)将烟酸加水溶解,随后将烟酸水溶液同载虾青素的丝素蛋白纳米载体溶液混合,并调整烟酸浓度为1mg/mL,将溶液在90℃条件下以700rpm的转速搅拌0.5h,使烟酸充分加载至已载虾青素的丝素蛋白纳米载体;
(4)将上述充分加载后的混合溶液,在4℃条件下以10000rpm的转速离心1h,将加载虾青素和烟酸的丝素蛋白纳米载体同水分离,去除上层水溶液,清洗4次去除残留的游离烟酸,加水重悬,获得同时加载虾青素和烟酸的丝素蛋白纳米载体复合物溶液,复溶溶液中丝素蛋白的浓度为1.5wt%。
实施例7
一种丝素蛋白-活性成分复合物及其制备方法,具体包括以下步骤:
(1)将白藜芦醇溶解到二甲基亚砜中,调节白藜芦醇浓度为5mg/mL,随后将浓度为3wt%的丝素蛋白纳米载体水溶液(纳米载体宽度为10-20nm,厚度为1-5nm,长度为1000-2500nm)加入白藜芦醇二甲基亚砜溶液,调整二甲基亚砜和丝素蛋白纳米载体水溶液的体积比为3:1,将混合溶液在90℃条件下以100rpm的转速搅拌0.5h,使白藜芦醇充分加载至丝素蛋白纳米载体;
(2)将上述混合溶液在4℃条件下以20000rpm的转速离心3h,将加载白藜芦醇的丝素蛋白纳米载体同混合溶剂分离,去除上层溶液,并使用纯水清洗载白藜芦醇的丝素蛋白纳米载体,直至清洗液中无二甲基亚砜检出,随后加水重悬,调整至丝素蛋白纳米载体的浓度为2.8wt%;
(3)将透明质酸直接加入上述重悬的丝素蛋白载体水溶液,并调整透明质酸浓度为2mg/mL,将溶液在25℃条件下以300rpm的转速搅拌4h,使透明质酸充分加载至已载白藜芦醇的丝素蛋白纳米载体;
(4)将上述充分加载后的混合溶液,在40℃条件下以2000rpm的转速离心3h,将加载白藜芦醇和透明质酸的丝素蛋白纳米载体同水分离,去除上层水溶液,清洗4次去除残留的游离透明质酸,加水重悬,获得同时加载白藜芦醇和透明质酸的丝素蛋白纳米载体复合物溶液,复溶溶液中丝素蛋白的浓度为2.5wt%。
实施例8
一种丝素蛋白-活性成分复合物及其制备方法,具体包括以下步骤:
(1)将尼罗红溶解到丙酮中,调节尼罗红浓度为0.5mg/mL,随后将浓度为1wt%的丝素蛋白纳米载体水溶液(纳米载体宽度为10-20nm,厚度为1-5nm,长度为1000-2500nm)加入尼罗红丙酮溶液,调整丙酮和丝素蛋白纳米载体水溶液的体积比为1:9,将混合溶液在50℃条件下以1000rpm的转速搅拌2h,使尼罗红充分加载至丝素蛋白纳米载体;
(2)将上述混合溶液在40℃条件下以1000rpm的转速离心1h,将加载尼罗红的丝素蛋白纳米载体同混合溶剂分离,去除上层溶液,并使用纯水清洗载尼罗红的丝素蛋白纳米载体,直至清洗液中无丙酮检出,随后加水重悬,调整至丝素蛋白纳米载体的浓度为0.8wt%;
(3)将果绿加入上述重悬的丝素蛋白载体水溶液,并调整果绿浓度为0.5mg/mL,将溶液在50℃条件下以500rpm的转速搅拌4h,使果绿充分加载至已载尼罗红的丝素蛋白纳米载体;
(4)将上述充分加载后的混合溶液,在4℃条件下以20000rpm的转速离心10min,将加载尼罗红和果绿的丝素蛋白纳米载体同水分离,去除上层水溶液,清洗4次去除残留的游离果绿,冷冻干燥12h,获得同时加载尼罗红和果绿的冻干丝素蛋白纳米载体复合物。
对比例1
(1)将阿霉素粉末直接加入浓度为2.5wt%的丝素蛋白纳米载体水溶液(纳米载体宽度为10-20nm左右,厚度1-5nm,长度1000-2500nm),并调整阿霉素浓度为1mg/mL,将溶液在25℃条件下以100rpm的转速搅拌24h,使阿霉素充分加载至丝素蛋白纳米载体;
(2)将上述充分加载后的混合溶液,在4℃条件下以12000rpm的转速离心20min,将加载阿霉素的丝素蛋白纳米载体同水分离,去除上层水溶液,清洗4次去除残留的游离阿霉素,加水重悬,获得加载阿霉素的丝素蛋白纳米载体复合物溶液,复溶溶液中丝素蛋白的浓度为2.3wt%。
(3)将紫杉醇溶解到乙醇中,调节紫杉醇浓度为6mg/mL,随后将加载阿霉素的丝素蛋白纳米载体复合物溶液加入紫杉醇乙醇溶液,调整乙醇和水的体积比为2:1,将混合溶液在室温条件下以200rpm的转速搅拌20h,使紫杉醇充分加载至已载阿霉素的丝素蛋白纳米载体;
(4)将上述混合溶液在4℃条件下以10000rpm的转速离心30min,将同时加载紫杉醇和阿霉素的丝素蛋白纳米载体复合物同混合溶剂分离,去除上层溶液,并使用纯水清洗同时加载紫杉醇和阿霉素的丝素蛋白纳米载体复合物,直至清洗液中无乙醇检出,随后加水重悬,获得同时加载紫杉醇和阿霉素的丝素蛋白纳米载体复合物溶液,复溶溶液中丝素蛋白的浓度为2wt%。
与实施例1相比,丝素蛋白-活性成分复合物中水不溶性活性成分和水溶性成分的加载率均显著降低。
对比例2
(1)将尼罗红溶解到丙酮中,调节尼罗红浓度为0.5mg/mL,随后将浓度为1wt%的丝素蛋白纳米载体水溶液(β-折叠含量低于40%,粒径为10-20nm左右颗粒)加入尼罗红丙酮溶液,调整丙酮和水的体积比为1:9,将混合溶液在50℃条件下以1000rpm的转速搅拌2h,使尼罗红充分加载至丝素蛋白纳米载体。
(2)将上述混合溶液在4℃条件下以10000rpm的转速离心1h,将加载尼罗红的丝素蛋白纳米载体同混合溶剂分离,去除上层溶液,沉淀颜色较实施例8明显浅,尼罗红的加载率低;使用纯水清洗载尼罗红的丝素蛋白纳米载体,直至清洗液中无丙酮检出,随后加水重悬,已载尼罗红的丝素蛋白纳米载体在水中分散性差,溶液分层。
测试例1
基于实施例1-8,对不同丝素蛋白纳米载体进行形貌、二级结构和表面电荷的表征,实施例1、6-8用的丝素蛋白纳米载体都是为(1),实施例2为(2),实施例3为(5),实施例4为(4),实施例5为(3),具体结果如图1所示。
图1a,b和c为本发明所用不同长度的丝素蛋白纳米载体AFM图及其红外光谱和ZETA电位结果,从中可以看出不同丝素蛋白纳米载体均在1620-1630cm
测试例2
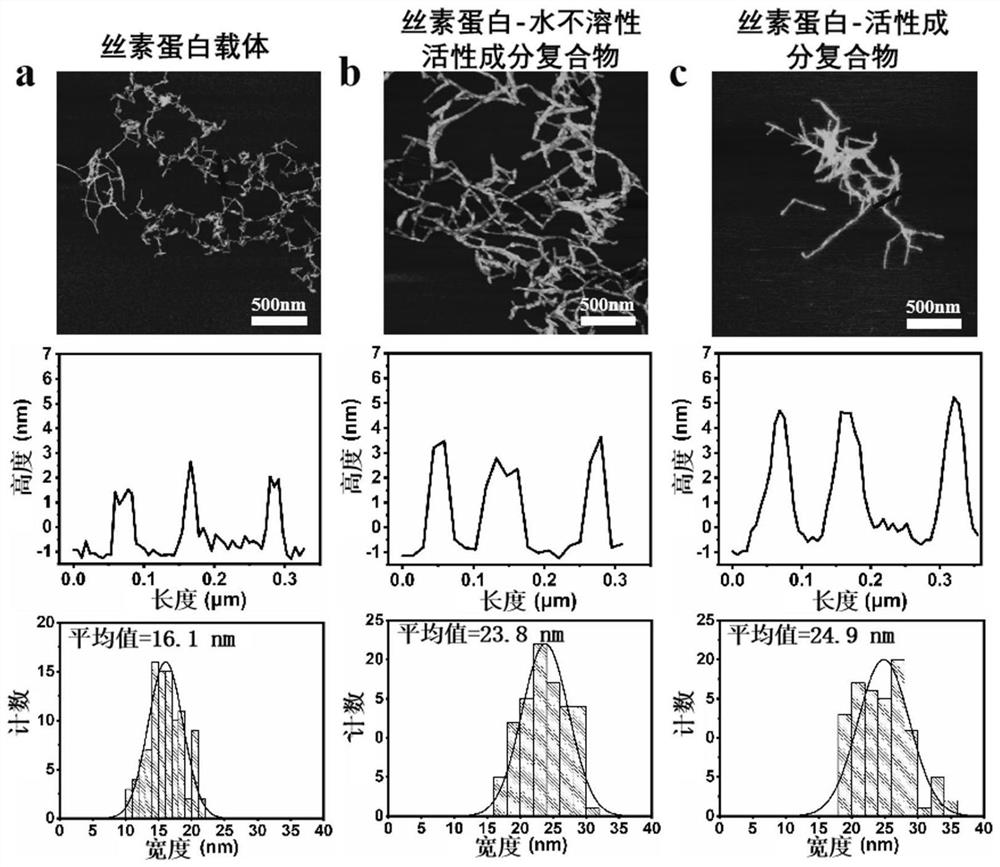
基于实施例1对丝素蛋白纳米载体、丝素蛋白-水不溶性活性成分复合物和丝素蛋白-活性成分复合物进行AFM表征,并利用AFM配套数据处理软件Aanoscope Analysis分析纳米纤维高度,利用ImageJ分析软件统计纳米纤维宽度,结果如图2所示。
图2a为丝素蛋白纳米载体的AFM图以及高度和宽度统计图,从中可以看出纳米载体的宽度为16.1nm,厚度为1-3nm。图2b为丝素蛋白-水不溶性活性成分复合物的AFM图以及高度和宽度统计图,从中可以看出由于水不溶性活性成分的附载,纳米载体的宽度变为23.8nm,厚度增加至2-4nm,证明了活性成分的成功负载。图2c是丝素蛋白-活性成分复合物的AFM图以及高度和宽度统计图,继续负载水溶性活性成分后纳米载体的宽度继续增加至24.9nm,厚度增加至3-5nm。证明两种不同类型活性成分可同时加载至特殊纳米结构的丝素蛋白纳米载体。
测试例3
对实施例8制备的丝素蛋白-活性成分复合物进行细胞摄取实验,使用激光共聚焦显微镜研究MDAMB-231细胞对丝素蛋白-活性成分复合物的细胞摄取情况,结果如图3所示。
图3是丝素蛋白-活性成分复合物细胞摄取的结果,从中可以看出水不溶性活性成分和水溶性活性成分附着在纳米载体,可同时被细胞摄取,获得更好协同效果。
测试例4
对实施例1制备的丝素蛋白-活性成分复合物进行小鼠体内肿瘤局部化疗实验,期间监测肿瘤尺寸量化抗肿瘤效果,结果如图4所示。
图4是丝素蛋白-活性成分复合物抑制肿瘤生长的效果图,同单独负载阿霉素和紫杉醇,或两种游离药物同时作用组相比,同时负载两种药物的丝素蛋白纳米载体表现出更为优异的抑制肿瘤生长的性能,证明同时加载多种活性成分的性能优势。
采用本发明所述方法制备的丝素蛋白-活性成分复合物,可同时解决水不溶性活性成分水相分散及水溶性活性成分缓释的问题,并能够有利于不同类型活性成分作用于同一细胞或相同组织,获得更好协同效果,满足肿瘤治疗、组织再生、皮肤防护、化妆品等多个领域的需求。
复合物通过丝素蛋白纳米载体的结晶度、纳米结构、电荷密度的设计来优化其同时对水溶性活性成分和水不溶性活性成分的优异吸附性能,并在吸附后保持其在水中的可分散性,获得具有更好协同作用的复合材料体系。考虑到物理吸附的机制以及丝素蛋白纳米载体水相分散的本质,本发明除了丝素蛋白纳米载体的特殊设计,采取先加载水不溶性活性成分,随后重悬再加载水溶性活性成分的分步加载方法同样是实现同时加载的关键,可避免先加载水溶性活性成分,导致载体电荷屏蔽或亲水性增加,导在有机溶剂体系无法再分散的问题。因此,基于对加载吸附不同活性成分影响丝素蛋白纳米载体结构和性能的理解,本发明首先利用特殊丝素蛋白纳米载体在不同溶解体系可分散的特性以及对水不溶性成分优异的吸附能力,将丝素蛋白纳米载体水溶液同水不溶性活性成分的有机溶剂溶液混合,在搅拌过程中使得活性成分主动吸附到丝素蛋白纳米纤维,再通过离心或透析的方法去除有机溶剂和游离的活性成分。加载水不溶性活性成分的丝素蛋白纳米载体由于电荷未被屏蔽,保留在水相的分散能力,随后再加入水溶性活性成分,使得其加载至已加载水不溶性活性成分的丝素蛋白纳米载体上,最终获得共加载的复合材料,因此尽管上述的关键条件看似采用的常规技术,但其核心在于对丝素蛋白纳米结构本身状态和同不同活性成分相互作用的深入理解,以及不同参数的优化整合,不同的参数之间具有极高的关联性,不考虑丝素蛋白的本身状态和不同因素影响,而机械套用上述参数并不会制备出结构稳定,同时加载水溶性和水不溶性活性成分的复合物。
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 一种活性丝素蛋白生物组织工程支架的溶喷制备方法
- 一种丝素蛋白光固化水凝胶及其制备方法
- 一种含艾草微胶囊的丝素蛋白中空纤维及其制备方法
- 一种绷带用丝素蛋白整理的抗污抗菌聚丙烯无纺布的制备方法
- 一种活性丝素蛋白多孔材料或活性丝素蛋白膜及其制备方法
- 一种活性丝素蛋白多孔材料或活性丝素蛋白膜及其制备方法
