用于剥脱身体管腔的装置
文献发布时间:2023-06-19 09:30:39
技术领域
本发明涉及一种用于剥脱身体管腔,特别是浅静脉的装置。还构想了用于剥脱身体管腔,特别是浅静脉的方法,以及治疗静脉曲张的方法。
背景技术
静脉曲张是与血管壁结构变化、静脉瓣膜功能不全、血液逆流和汇集相关的静脉扩张、迂曲。其构成慢性静脉疾病(CVD)谱的一部分。患者会出现沉重、酸痛、肿胀,严重时皮肤发炎、肤色异常、溃疡等症状。静脉曲张的病因尚不明确,但是遗传因素导致静脉壁成分不足瓣膜薄弱对此病的发展是重要的。
静脉曲张最常见于下肢浅静脉网中,但在某些疾病状态下也可能发生于骨盆和食管静脉中。浅静脉使血液从皮肤和皮下组织流入深静脉网中,最终回到心脏。主要浅静脉是从脚踝延伸到下肢内侧腹股沟的大隐静脉(GSV)。小隐静脉(SSV)从脚踝延伸到小腿后表面的膝盖处。GSV和SSV分别在腹股沟和膝盖后部的连接处汇入到股深静脉中。
静脉包含瓣膜以通过增加腿部肌肉泵送效率来防止血液逆流。瓣膜具有由结缔组织和平滑肌支撑的内皮褶皱形成的二尖瓣结构。GSV具有10至20个瓣膜,SSV通常具有6至12个瓣膜。瓣膜功能不全导致血液沿与正常流动相反的方向逆流,所述症状可利用多普勒超声观察到。
静脉壁较薄,而动脉壁较厚且弹性较大。静脉顺应性(柔性)更高,从而使得静脉腔在低压状态下可为收缩形式,在静脉压力增加时为扩张形式。隐静脉壁厚通常在200至700微米(μm)范围内。与动脉类似,静脉壁包括三个主要层:内膜、中膜和外膜。然而有别于动脉的是,静脉层的厚度和组成不同,使得血管顺应性更高、肌肉更少。内膜层由被称为内皮的单层鳞状细胞和一些薄弹性纤维、胶原和平滑肌细胞组成。重要的是,存在被称为糖萼的大分子非细胞层,覆盖内皮层保护其免受剪切力。糖萼通常为均匀分布结构,厚度为0.5-3μm,大于内皮细胞的厚度(0.2μm)。中层由胶原、弹性纤维和三层平滑肌细胞组成。外膜是最厚的层,包含致密的胶原、感觉神经和弹性纤维。
血液凝结或血栓形成均可发生于深静脉网和浅静脉网。由于流通量低,浅静脉中的血栓通常是独立的,很少蔓延至深静脉网。其对患者没有危险,不需要治疗,除非有被称为血栓性静脉炎的相关炎症。发生在腿部深静脉的血栓形成,称为深静脉血栓形成(DVT),为临床相关疾病,这是由于其会引起静脉流出阻塞,从而升高静脉压力并导致腿部水肿。血栓还会移动(形成栓塞)到肺,引起称为肺栓塞(PE)的潜在致命疾病。
静脉曲张是最常见的外周血管疾病,成年人群中患病率高达40%[1]。风险因子包括年龄、家族史、肥胖、从事需要长时间站立的职业以及久坐不动的生活方式。
治疗选择范围为从压力袜保守治疗到外科手术治疗。在美国,每年进行约600,000至700,000次手术治疗静脉曲张。静脉曲张的治疗已经从开放手术(包括剥脱整个GSV)转变为基于微创热静脉内导管的技术(包括射频或激光能量)。包括德国和英国在内的一些国家仍以开放静脉剥脱手术为主。
如今通常采用导管引导微创热疗法来治疗浅静脉逆流。采用热能治疗方式的一个重大缺陷是需要多次注射大量与盐水混合的局部麻醉剂(肿胀液),以隔离静脉并保护周围组织免受热损伤。这既耗费医生时间,同时由于需要对腿部进行多次扎针注射,从而又使患者感到疼痛。由于皮肤和静脉之间需要空间注射肿胀液,所以当所治疗静脉靠近重要神经(如治疗位于膝盖以下的静脉的情况)、靠近皮肤或靠近晚期CVD(CEAP分级5和6级)患者的溃疡时,治疗也受限制。
尽管采用了肿胀麻醉,但是仍然可能发生对周围神经和皮肤的热损伤。通过一系列研究发现发生神经损伤导致持续性感觉异常的比率为0%-9%,其中在位置为膝下GSV或SSV的消融治疗中损伤率更高。
血栓栓塞事件是浅静脉逆流治疗的最严重并发症。根据现实研究发现DVT和PE的比率分别为3%-4%和0.2%-0.3%[2]。所有目前使用的治疗技术都有其内在局限性,这会增加形成DVT和/或PE的风险。重要的是,任何静脉曲张的新治疗方式都旨在进一步降低血栓栓塞并发症的风险。
目前的热疗法的内在问题是存在内热诱导血栓形成(EHIT)的风险,其会导致DVT和PE。这被认为是由于热能从热消融装置的尖端向前传导到深静脉系统而导致的。较新的激光尖端纤维径向发射能量从而降低前向传导的风险。然而,这些技术不能阻止蒸汽气泡扩散到邻近的非目标位置,除了组织吸收光之外,蒸汽扩散也被认为是热消融操作可能发生的机制[3]。
最近10年,出现了用于CVD治疗的非热非肿胀(NTNT)新技术。疼痛较小的NTNT技术更适合于诊所环境,在美国现在约90%的手术是在诊所进行。目前的NTNT技术包括化学泡沫硬化疗法、机械化学消融(MOCA)和氰基丙烯酸酯胶(CAG)栓塞。
化学硬化疗法(注射破坏内皮细胞膜的化学去除剂,通过硬化使得静脉阻塞)已经应用了很多年,但是由于稀释作用和血液成分使硬化剂失效,使得其在大静脉中的功效大大降低。将硬化剂和气体混合产生泡沫以形成微泡乳液是一种较新的技术,其驱走血液并使化学剂与内皮保持较长时间接触。尽管有所提升,但功效仍然显著低于热技术,根据先前的组织学研究可知[4],这很可能是由于化学硬化剂不完全覆盖内皮导致。由于泡沫会扩散到深层系统中,损伤内皮并形成DVT,因此DVT潜在风险增加。更高浓度的硬化剂泡沫混合物可能更有效,但DVT和全身并发症的风险也更高。化学硬化剂的全身并发症包括短暂性脑缺血(TIAs)和由于硬化剂化合物通过心脏隔膜中的小孔(卵圆孔未闭)进入动脉循环而引起的中风。化学硬化剂的致畸性也是未知的,从而孕妇禁用。
MOCA涉及化学硬化剂和来自静脉腔内的机械作用的组合,以共同作用改善硬化剂的分布并刺激静脉促进静脉痉挛,从而减小静脉直径。组织学研究表明此方式对内皮细胞完整性上的机械作用有限[5]。中期跟踪研究已表明此方式具有临床功效,但是水平低于目前的热技术。目前的具有机械作用的MOCA装置的远端容易在静脉壁或瓣膜中钩住或卡住。先前研究表明[6],这会导致患者感到不适、受损伤、甚至不慎引起静脉剥脱。
胶栓塞术涉及注射氰基丙烯酸酯或等效化合物,从而发生炎症反应使得静脉阻塞。其缺陷包括外来物质在静脉腔内永久植入,随后的过敏反应风险和栓塞进入深静脉系统导致DVT和/或PE的风险。
在美国,下肢静脉性溃疡治疗费用达每年140亿美元,是主要的医疗费用负担[7],并且目前主要使用压迫绷带来处理。根据2018年4月公布的EVRA研究[8],其新数据提供了I级证据支持对静脉曲张进行早期静脉内治疗,以提高患有CEAP分级VI(C6)疾病的患者溃疡愈合的速度。热疗法不太适合静脉溃疡患者。对老年患者群体来说,多次注射肿胀麻醉使手术时间延长,并且由于邻近溃疡的皮肤完整性差而增加了感染和血肿形成的风险。当治疗膝盖以下的静脉时,治疗目的通常是防止溃疡床附近的静脉逆流,热疗法也增加了神经损伤导致感觉异常的风险[9]。
用于治疗包括曲张静脉血管的装置在以下文献中描述:WO2017194698、US2016030719、US2016030068、US2016030023、WO2016102930、US2011046543、US2016242790、JP2016034485、WO2004112569、US2017056048、GB2519057和US5011489。
US6402745公开了一种具有螺旋构造的弹簧电极,其用于电破坏血管内腔。电极容纳在导管内,电极路线的远端从导管的端部延伸以螺旋方式接触血管内腔。由于电极和血管内腔之间的接触区域,该装置仅部分地剥脱血管内腔。
WO2014140325描述了一种可植入的栓塞刷毛装置,其能够在包括静脉曲张和痔疮的各种适应症的治疗中剥脱血管。该装置包括芯线,该芯线具有从该芯线径向向外延伸的多个刷毛,其中刷毛构造成接合血管内腔以通过刷擦血管内腔来剥脱血管。较大体积的可植入装置在浅静脉中,尤其是在腹股沟和膝盖区域可能导致患者感到不适。使用刷毛剥脱静脉会导致静脉内腔无法完全剥脱。多个尖的和/或细长的部件显著增加了在较薄的顺应性静脉壁中发生钩住和穿孔的风险。
本发明的目的是克服至少一个上述问题。
发明内容
本发明解决了对用于治疗浅静脉逆流的装置的需求,该装置避免了与现有技术中的热治疗、化学治疗和胶植入物治疗技术相关的问题,同时提供了与热治疗方式相当的最佳功效。通过提供一种静脉剥脱装置来实现上述目的,该装置包括线圈,该线圈构造成在手术(非植入)和部署期间经腔输送到待治疗静脉,由此线圈周向地(理想情况下完全周向地)接合静脉的内腔。线圈为偏大线圈(即,部署时其直径大于待治疗静脉的直径)并具有粗糙的腔接合面,使得当线圈部署时,粗糙表面抵靠静脉的内腔,且在部署构造下,线圈沿静脉轴向移动使磨蚀面剪切静脉内腔。这使得静脉沿静脉长度方向被机械剥脱,通常随之发生的是静脉的内皮层和中层破坏,并且理想情况下由于形成血栓,血栓在血管中没有内皮内衬的情况下会发生纤维化转化,最终使得静脉阻塞。理想情况下,内皮完全周向破坏,这是因为若存在小区域保持完整,则可能会不形成血栓,血液将继续流动,从而导致治疗失败、血管再通和/或早期复发。因此,本发明的装置包括螺旋线圈,其相对于待治疗静脉的直径偏大,以确保螺旋线圈的粗糙表面和静脉腔之间的周向接合。此外,线圈(由于其弹性变形构造)可自我调节以允许连续的周向接合,同时沿具有不同直径和迂曲部的静脉或血管节段保持向外径向力(图59)。
根据本发明的第一方面,提供了一种用于剥脱身体管腔的装置,包括身体管腔剥脱头,该身体管腔剥脱头可操作地附接到细长导管构件并构造成用于经腔输送和部署在身体管腔中,身体管腔剥脱头包括线圈,线圈能可实现未盘绕输送构造和盘绕部署构造的调节,该未盘绕输送构造适于在导管构件内经腔输送,该盘绕部署构造的直径等于或大于待剥脱静脉,并且线圈周向接合身体管腔的内腔,线圈具有磨蚀面,磨蚀面构造成当处于盘绕构造下的螺旋线圈沿身体管腔旋转或不旋转地轴向移动时剥脱身体管腔。
根据本发明的第二方面,提供了一种利用装置来剥脱身体管腔的方法,该装置包括身体管腔剥脱头,该身体管腔剥脱头可操作地附接到细长导管构件并构造成用于经腔输送和部署在身体管腔中,该方法包括步骤:将身体管腔剥脱头经腔输送至待治疗的身体管腔;将身体管腔剥脱头部署在待治疗的身体管腔内,其中身体管腔剥脱头具有部署时与身体管腔的内腔周向接触的磨蚀面;沿身体管腔的待治疗节段移动身体管腔剥脱头,其中磨蚀面与身体管腔周向接触,由此磨蚀面剥脱身体管腔;将剥脱头重新收回至导管构件中;将装置从身体管腔移除。
在一个实施方案中,线圈是螺旋线圈。
在一个实施方案中,线圈相对于待治疗身体管腔的直径“偏大”。
在一个实施方案中,线圈的直径(或在直径沿其长度不同的螺旋线圈的情况下的最大直径)通常比待治疗的身体管腔的直径大至少约5%(或在身体管腔具有不同的直径的情况下,比身体管腔最宽点处的直径大至少约5%),例如比待治疗的身体管腔的直径大至少10%、15%、20%、25%或30%,通常大5-30%。重要的是,至少有一匝线圈为偏大尺寸,通常为有1-2匝线圈为偏大尺寸。
在一个实施方案中,该装置构造成剥脱静脉内腔。
在一个实施方案中,线圈包括形状记忆材料并构造成部署时采用盘绕构造。
螺旋线圈通常通常具有足够的弹性变形,从而当其沿身体管腔行进时,可以保持对不同直径的身体管腔壁的圆周径向力进行自我调节。在一个实施方案中,螺旋线圈构造成在沿治疗区轴向移动时响应于不同的静脉直径和不同的轴向力而反射性自我调节其直径,同时保持对静脉的向外径向力。
在其部署状态下的螺旋线圈相对于身体管腔的最宽部分(或身体管腔的待治疗节段)偏大,从而沿着待治疗身体管腔的长度(包括其最宽点)围绕身体管腔的整个圆周施加径向力。
螺旋线圈通常具有足够的弹性变形,以允许线圈绕过身体管腔中的迂曲部,同时保持沿弯曲部抵靠身体管腔的径向力。
螺旋线圈通常具有足够的弹性变形,从而允许线圈穿过身体管腔中的狭窄或阻塞处,例如静脉中的瓣膜。
在一个实施方案中,该装置包括设置在导管构件内用于身体管腔剥脱头的细长控制臂。
通常,控制臂连接到线圈的近端。
控制臂可以是海波管,例如由不锈钢、聚合物或其它材料制成的海波管。
在一个实施方案中,线圈具有单个线圈元件。
在一个实施方案中,在部署构造中,单个线圈元件具有1-5匝、1-4匝、1-3匝,优选地1-2匝,理想地约1.5-1.7匝。
在一个实施方案中,螺旋线圈的直径沿其长度方向变化。
在一个实施方案中,螺旋线圈的直径朝向一端增加(即,圆锥形)。
直径可从近端到远端,或者从远端到近端增加。
如本申请所使用的,在应用于螺旋线圈时术语“近端”是指装置的最靠近引入点的端部,术语“远端”应进行相应的理解。
在一个实施方案中,螺旋线圈的直径沿线圈朝向中点增加,然后减小。
在一个实施方案中,线圈的远端终止于沿着或邻近螺旋线圈的纵向轴线设置的点处。
在一个实施方案中,螺旋线圈具有第一直径的近端部分、相对于近端部分直径减小的中间部分、以及相对于中间部分直径增大的远端部分。
在一个实施方案中,螺旋线圈具有近端和远端螺旋线圈部分,以及中间连接(过渡)部分,该部分通常不是螺旋的,可以是直线或弯曲的。
在一个实施方案中,近端或远端螺旋线圈部分中的一者为右旋螺旋,近端或远端螺旋线圈部分中的另一者为左旋螺旋。
在一个实施方案中,近端螺旋线圈部分为右旋螺旋,远端螺旋线圈部分为左旋螺旋。
在一个实施方案中,远端螺旋线圈部分为右旋螺旋,近端螺旋线圈部分为左旋螺旋。
在一个实施方案中,线圈包括多个线圈元件,例如2、3、4、5或更多个。通常,每个线圈元件为螺旋形。
螺旋线圈可以以两个、三个或四个线圈布置。
通常,线圈元件是同轴的。
通常,每个线圈元件在部署时具有相同的直径。
通常,每个线圈元件在部署时具有相同节距。当处于部署构造时,多个线圈元件一起提供身体管腔的内腔的周向接合。因此,每个线圈元件可构造成在部署构造中,其仅接合内腔圆周的一部分,例如以90°-270°、90°-180°、180°-270°与身体管腔圆周接合。
各线圈元件可连接到相同的控制臂。
在一个实施方案中,线圈具有两个螺旋线圈元件,例如双螺旋。
通常,两个螺旋线圈元件中的每一个在部署时具有至少0.5匝,通常为0.5-1.0匝或0.5-0.7匝。
在一个实施方案中,线圈具有三个螺旋线圈元件,例如三螺旋。
通常,三个螺旋线圈元件中的每一个在部署时具有至少0.3匝,通常部署时为0.3-1.0匝或大约0.3-0.5匝。
在一个实施方案中,线圈具有四个螺旋线圈元件。
通常,四个螺旋线圈元件中的每一个在部署时具有至少0.25匝,通常部署时为0.25-0.75匝。
在一个实施方案中,多个线圈元件在其远端连接在一起。
在一个实施方案中,多个线圈元件在其远端未连接。
在一个实施方案中,线圈或每个线圈元件为螺旋形,并构造成当部署时在盘绕构造下其节距为线圈直径的约0.5-1.5倍。
在一个实施方案中,线圈或每个线圈元件为螺旋形,并构造成当部署时在盘绕构造下其节距大约等于直径。
在一个实施方案中,螺旋线圈元件中的其中一个与另一个线圈元件轴向间隔开。通常,在该实施方案中,将控制臂(通常为控制臂的远端)进行分叉以提供远端控制臂,每个远端控制臂分别连接到螺旋线圈中的其中一个。然而,该装置可以包括单独的控制臂,用于独立控制两个螺旋线圈。
在具有轴向间隔开的螺旋线圈的静脉剥脱头的实施方案中,远端螺旋线圈的控制臂通常轴向穿过近端螺旋线圈(穿过构成近端螺旋线圈的线圈中的一个、多个或全部)。
在一个实施方案中,近端螺旋线圈的最大直径大于远端螺旋线圈的最大直径(例如,是其1.5-4倍大)。
在另一个实施方案中,近端螺旋线圈的最大直径小于远端螺旋线圈的最大直径(例如,是其1/4至2/3)。
在一个实施方案中,近端线圈元件和远端线圈元件的节距不同。
在一个实施方案中,较窄的线圈具有较大的节距。
在一个实施方案中,远端螺旋线圈和/或近端螺旋线圈为圆锥形。
在一个实施方案中,远端螺旋线圈和近端螺旋线圈为圆锥形。
通常,螺旋线圈的直径沿近端方向(即,朝向装置的进入点)增大。
在一个实施方案中,线圈或每个线圈构造成当部署时在盘绕构造下其直径至少等于或大于待治疗的静脉的直径。
在一个实施方案中,螺旋线圈或每个螺旋线圈为圆锥形(即,线圈的直径随着其靠近装置进入点而增大或减小--即,向近端增大或减小)。
通常,螺旋线圈的直径沿近端方向增大。
在一个实施方案中,线圈具有选自圆形、椭圆形、弧形、凸形、凹形、T形、倒T形或任何其它形状的轮廓。
在一个实施方案中,线圈具有平坦的内表面,以及弧形、凹形、凸形或倒T形的外表面。图34至41中示出了具有这些轮廓的螺旋线圈。
在一个实施方案中,通过处理线圈的表面,通常是线圈的面向身体管腔的外表面(和/或线圈的侧面),以使表面粗糙,来形成线圈或每个线圈元件的粗糙表面。
在一个实施方案中,线圈的内表面不是粗糙的,并且理想地是光滑的。这有利于线圈缩回到导管构件中,其中线圈的光滑内表面接触导管的口部。
在一个实施方案中,通过机械磨蚀、电磨蚀、化学磨蚀或通过其它方式的磨蚀来使表面粗糙。
在一个实施方案中,线圈的外表面包括构造成提供粗糙表面的凹口。
在一个实施方案中,凹口构造成在表面上提供齿。在一个实施方案中,凹口为横向凹口。
在一个实施方案中,横向凹口延伸完全跨过线圈的外表面。
在一个实施方案中,横向凹口设置在外表面的每一侧上(即,当线圈的外表面是凹形时)。
在一个实施方案中,凹口是纵向的,并且完全或至少部分地沿螺旋线圈的长度方向延伸。纵向凹槽可以是直的、弯曲的、波状的、之字形的、菱形的或任何构造。
在一个实施方案中,螺旋线圈具有倒T形轮廓,其中齿来自倒T形的腿部。
在一个实施方案中,齿具有选自三角形、多边形、菱形或构造成刮除身体管腔的内皮层的任何其它轮廓。
在一个实施方案中,线圈包括侧齿。
在一个实施方案中,线圈具有平坦的内表面和外表面,以及侧齿。
在一个实施方案中,线圈由具有菱形纹理的粗糙外表面以及光滑内表面的扁平线材形成。
在一个实施方案中,线圈具有凹槽或孔以作为治疗剂的储槽。
在一个实施方案中,线圈或每个线圈元件包括芯线,磨蚀面由螺旋缠绕在芯线上的第二线材形成,以形成第二线圈。
在一个实施方案中,第二线材具有多边形横截面。
在一个实施方案中,第二线圈的节距为1-5mm。
在一个实施方案中,第二线圈近端的节距较大。
在一个实施方案中,第二线圈近端的节距较小。
在一个实施方案中,第二线圈通常在多个位置处与芯线结合。
在一个实施方案中,对第二线材的表面进行处理以使表面粗糙。
在一个实施方案中,螺旋线圈具有与螺旋线圈的纵向轴线大致同轴的近端部分。
在一个实施方案中,螺旋线圈具有与螺旋线圈的纵向轴线大致同轴的远端部分。
在一个实施方案中,用于身体管腔剥脱头的控制臂设置在导管构件内。通常,控制臂连接到线圈的近端。控制臂可以是海波管,例如由不锈钢、聚合物或其它材料制成的海波管。
在一个实施方案中,控制臂构造成进行轴向运动,以将身体管腔剥脱头部署在体内的目标位置处,并在治疗之后将身体管腔剥脱头收回到导管构件中。
在一个实施方案中,控制臂构造成进行旋转运动以使身体管腔剥脱头在身体管腔内旋转。
在一个实施方案中,该装置包括连接到线圈远端的远端控制臂和连接到线圈近端的近端控制臂,由此远端和近端臂的相对轴向运动实现线圈的盘绕和展开。
在一个实施方案中,线圈的远端包括防损伤头,例如柔性材料或球体。
在一个实施方案中,该装置包括手柄,该手柄可操作地连接到导管构件的近端并构造成控制线圈的部署和缩回。在一个实施方案中,手柄包括控制元件,该控制元件构造成旋转或无旋转地轴向调节控制臂。在一个实施方案中,手柄包括构造成旋转调节控制臂的控制元件。
在一个实施方案中,该装置构造成在如下构造间进行调节:
输送构造,其中螺旋线圈在未盘绕构造下收纳在导管构件内,
第一身体管腔剥脱构造,其中在使用中,线圈在第一轴向位置处部署在待治疗的身体管腔中并且抵靠身体管腔的圆周;
第二身体管腔剥脱构造,其中在使用中,线圈靠近第一轴向位置部署在待治疗的身体管腔中并且抵靠身体管腔的圆周;以及
收回构造,其中线圈收纳在导管构件内。
本发明的方法可用于静脉疾病,尤其是浅静脉逆流,优选地为静脉曲张。所治疗的静脉一般为隐静脉,并且通常为大隐静脉(GSV)或小隐静脉(SSV)。在本发明方法的一个实施方案中,身体管腔剥脱头沿着身体管腔的待治疗节段朝向进入点向近端移动。
在一个实施方案中,该方法包括对长度至少为2、4、6、8、10、12、14、16、18或20cm的身体管腔节段进行治疗。
在一个实施方案中,本发明的方法用于完全阻塞身体管腔,例如静脉或动脉。
在一个实施方案中,本发明的方法用于部分阻塞身体管腔,例如静脉或动脉。因此,采用本发明的装置和方法,通过使用本发明的装置部分阻塞血管节段,可治疗特征为脉管系统的一节段所通过的血容量或流速失调或异常的病症或适应症。
在另一种情况下,本发明方法是通过诱导壁显著增厚例如周围内膜增生来增厚静脉壁。这种效果使静脉“动脉化”,使其更能适应较高血压和剪切力的影响。这种增厚效果响应于一次性机械刺激而发生,其应是自限性的,而不是当静脉在动脉系统中用作导管时受到持续较高的剪切力时发生的不受控制的内膜增生。因此,可采用本发明的装置和方法当在动脉循环系统中进行移植之前对静脉进行准备处理。
身体管腔可以是脉管系统,例如动脉或静脉。
在一个实施方案中,本发明的方法是通过剥脱直肠上动脉节段来治疗静脉曲张的方法。
在一个实施方案中,本发明的方法是通过剥脱静脉节段来治疗痔疮的方法。
在一个实施方案中,本发明的方法是通过剥脱被血栓阻塞的静脉或动脉节段完成血栓切除术的方法。
在一个实施方案中,本发明的方法是作为准备步骤,在植入例如瓣膜或支架等医疗装置之前对身体管腔的目标区域(即脉管系统节段)进行准备处理。
在一个实施方案中,本发明的方法是作为准备步骤,在移植之前对动脉的目标区域进行准备处理以降低I型内漏的风险。
在一个实施方案中,被剥脱的身体管腔是供给肿瘤例如实体瘤的动脉。
在一个实施方案中,身体管腔是从肠向肝提供营养物的门静脉。在一个实施方案中,进行治疗的受试者患有肝病,例如癌症,该方法通常在肝切除术之前执行。
在一个实施方案中,接受治疗的身体管腔是形成动静脉畸形部分的血管。
在一个实施方案中,接受治疗的身体管腔是精索静脉。因此,还描述了治疗精索静脉曲张的方法。
在一个实施方案中,接受治疗的身体管腔是供应子宫肌瘤的血管(即子宫动脉)。
在一个实施方案中,接受治疗的身体管腔是胃肠道的一部分,例如十二指肠、空肠或回肠。
在一个实施方案中,接受治疗的身体管腔是前列腺动脉。
在一个实施方案中,接受治疗的身体管腔是骨盆静脉。
在一个实施方案中,本发明的方法通过剥脱卵圆孔未闭(PFO)所涉及的动脉中隔瓣的接触表面来治疗PFO。
在一个实施方案中,本发明的方法通过破坏回盲瓣和回肠的粘膜层来治疗动脉导管未闭。
在一个实施方案中,本发明的方法通过剥脱动脉导管来治疗小肠细菌过度生长。
在一个实施方案中,本发明的方法通过机械消融或剥脱下食管中的细胞(异常细胞)来治疗巴雷特食管。
在本发明方法的一个实施方案中,该方法包括将液体硬化剂输送到导管构件远端的身体管腔中的步骤。
在本发明方法的一个实施方案中,该方法包括通过装置的腔接合表面传导将热能输送到身体管腔的步骤。
在本发明的方法的一个实施方案中,该方法包括使用附接或结合在剥脱头元件中的血管内超声(IVUS)探头来确定血管对治疗的反应的步骤。
在本发明方法的一个实施方案中,治疗剂涂布外表面或嵌入装置上的凹槽或孔中并输送至身体管腔的内表面。
在本发明方法的一个实施方案中,该方法使用本发明的身体管腔剥脱装置。
在另一方面,本发明提供了一种治疗受试者血管(或任何身体管腔)的方法,包括以下步骤:
将装置向远端推进穿过血管中的治疗区,其中装置包括具有管腔和远端的细长导管,以及设置在管腔中并且构造成相对于导管轴向移动的径向膨胀治疗元件;
将径向膨胀的治疗元件部署在导管的远端的外部,以径向膨胀并在治疗区的远端处周向压靠管腔;
在治疗元件周向压靠血管管腔的情况下,沿治疗区向近端收回部署的径向膨胀治疗元件以机械地周向剥脱血管的治疗区;
将径向膨胀治疗元件重新收回至导管的管腔中;以及
将装置从经治疗的血管收回。
在一个实施方案中,血管为曲张静脉,其中方法通常是通过剥脱静脉腔以引起曲张静脉阻塞来治疗静脉曲张。
在一个实施方案中,机械地周向剥脱血管的治疗区的步骤包括沿治疗区周向暴露皮下血管表面。
在一个实施方案中,径向膨胀治疗元件可从适于在导管内经腔输送的未部署输送构造和具有大于治疗区中的血管的直径的部署径向膨胀构造进行自我调节。
在一个实施方案中,径向膨胀治疗元件是弹性可变形的,其中径向膨胀治疗元件在沿治疗区轴向移动期间响应于不同的血管直径和不同的轴向力而反射地自我调节其直径,同时保持对血管的向外径向力。
在一个实施方案中,径向膨胀治疗元件的面向血管腔的外表面具有粗糙表面。
在一个实施方案中,径向膨胀治疗元件的面向血管腔的外表面具有粗糙表面,其中粗糙表面包括粗磨和微磨表面。
在一个实施方案中,血管为浅静脉,例如大隐静脉、小隐静脉、穿静脉或分支静脉。
在一个实施方案中,浅血管为选自大隐静脉和小隐静脉的静脉。
在一个实施方案中,该方法是一种治疗受试者浅静脉逆流的方法,其中血管为浅静脉。
在一个实施方案中,该方法是一种治疗受试者静脉曲张的方法,其中所治疗的静脉为曲张静脉。
在一个实施方案中,该方法导致经治疗的血管的阻塞。
在一个实施方案中,该方法是一种使血管变窄但不阻塞血管的方法。
在一个实施方案中,沿治疗区向近端收回部署的径向膨胀治疗元件的步骤使血管壁机械拉伸,从而激活壁内平滑肌,从而导致沿治疗区血管痉挛,可选地防止一氧化氮从内皮细胞分泌,随后延长血管痉挛。
在一个实施方案中,可径向膨胀治疗元件为线圈。
在一个实施方案中,可径向膨胀治疗元件为螺旋线圈。
在一个实施方案中,使用如超声引导等成像模态来执行该方法。
在一个实施方案中,该方法包括将治疗元件重新收回至导管构件中的步骤,该步骤包括使治疗元件恢复至未部署状态,从而允许重新定位和重新部署。
在一个实施方案中,该方法包括在至少一个步骤中部署临时腔阻塞元件以停止在高流量血管中的血液流动的步骤。
在另一方面,本发明提供一种治疗受试者浅静脉中浅静脉逆流的方法,包括机械地周向剥脱浅静脉的治疗区的步骤。
在一个实施方案中,周向剥脱的浅静脉的治疗区的长度为5-25cm。
在一个实施方案中,机械地周向剥脱浅静脉的治疗区的步骤包括沿治疗区周向暴露皮下血管表面。
在一个实施方案中,机械周向剥脱静脉的治疗区的步骤包括将静脉剥脱装置部署在浅静脉的目标节段的远端部分中以周向压靠静脉腔,以及在装置周向压靠静脉腔的下沿治疗区域向近端将部署的静脉剥脱装置收回。
在一个实施方案中,机械地周向剥脱血管的治疗区的步骤包括沿治疗区周向暴露皮下血管表面。
在一个实施方案中,静脉剥脱装置可从适于在导管内经腔输送的未部署输送构造和具有大于治疗区中的血管的直径的部署径向膨胀构造进行自我调节。
在一个实施方案中,静脉剥脱装置是可弹性变形的,其中径向膨胀治疗元件在沿治疗区轴向移动期间响应于不同的血管直径和不同的轴向力而反射地自我调节其直径,同时保持对血管的向外径向力。
在一个实施方案中,静脉剥脱装置的面向血管腔的外表面具有粗糙表面。
在一个实施方案中,静脉剥脱装置的面向血管腔的外表面具有粗糙表面,其中粗糙表面包括粗磨和微磨表面。
在一个实施方案中,径向膨胀治疗元件为线圈,优选地为可弹性变形线圈。
在一个实施方案中,径向膨胀治疗元件为可弹性变形螺旋线圈。
在一个实施方案中,该方法在超声引导下执行。
在一个实施方案中,径向膨胀治疗元件(或螺旋线圈)的轴向移动是独立于手术者而自动或半自动控制。
在一个实施方案中,该装置构造成收集数据以向手术者反馈,或者由人、统计、大数据或机器学习分析以进一步解释。由此,该装置可以结合构造成检测例如组织或血液温度、压力、电阻抗等体内数据的一个或多个传感器。该装置可构造成通过无线或沿布置在导管构件中的电线传输体内数据。该装置可构造成将数据传输到远程处理器。
本发明的其它方面和优选实施方案在下面陈述的其它说明中限定和描述。
附图说明
图1是在轴平面中人脉管系统的图示,示出了一般静脉壁的组成,包括具有相关内皮和糖萼覆盖物的静脉内衬(内膜)、相邻的中层(中膜)和外层(外膜)。还示出了成人静脉壁的一般厚度(微米)。
图2是在我们的动物研究中进行机械静脉腔内治疗28天后山羊静脉的组织轴向截面。该图像突出了在内皮细胞破坏方面周缘覆盖的重要性。其取自动物研究中部分治疗的静脉。右上角显示凝块附着于静脉壁,在纤维化转化的早期,炎症细胞从外层迁移到血栓中。左下角为保留完整内皮。由于完整内皮的作用,血栓无法附着或使得血栓再通。血液可以在通道中流动,导致该节段的整体治疗失败。
图3示出了在我们的动物研究中机械静脉腔内治疗28天后的山羊静脉的组织轴向截面。由于浅层和深层之间的摩擦力,发生内皮的周向剥脱和剪切。管腔充满了附着的血栓,当其被包括形成胶原的成纤维细胞的炎性细胞侵入时,血栓发生纤维化变化。
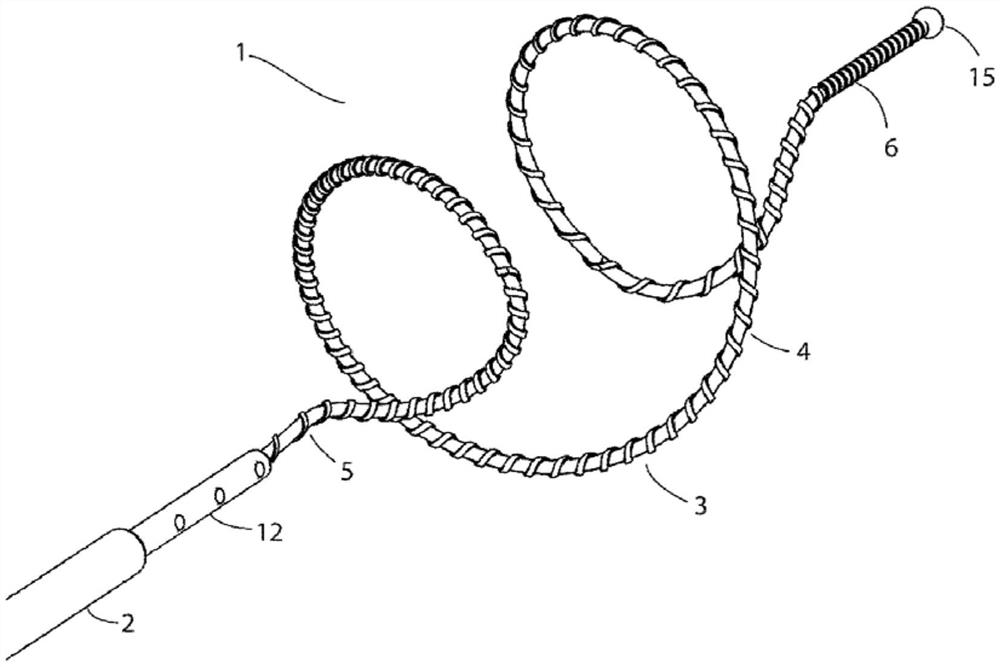
图4示出了根据本发明的第一实施方案的用于剥脱身体管腔的装置。
图5是图1装置的侧视图。
图6是图1装置的透视图。
图7是图1装置的远端正视图。
图8是图4装置的螺旋线圈的一部分的详细视图,示出了由第二线材螺旋缠绕在芯线上形成的锯齿状表面。
图9是图4装置的螺旋线圈的远端的详细视图,示出了第二线材和球形端毂的较长节距。
图10是图4装置的螺旋线圈的近端的详细视图,示出了附接到钢海波管的螺旋线圈,该钢海波管安装在导管构件内。
图11是图4装置的螺旋线圈的近端的详细视图,示出了当第二线材接近线圈的近端以辅助收回时其较短节距。
图12是根据本发明的替代实施方案的装置组成部分螺旋线圈的透视图,其中第二线材的腔接合表面包含一系列螺旋凹口。
图13是图4装置在静脉中的侧视图,其中螺旋线圈处于部署构造。该图示出了如何迫使偏大线圈与身体管腔周向接合,以及示出了由偏大线圈施加的径向力使静脉变形。
图14是与图13类似的图示,示出了如何在直径较小的静脉中使用直径较小的线圈。
图15是静脉外部视角的部署装置的透视图,示出了由部署的线圈施加的径向力如何使静脉变形。
图16是螺旋线圈的磨蚀面接合静脉内腔的详细视图。
图17示出了在浅静脉疾病的治疗中,对下肢静脉进行静脉内机械剥脱以引起阻塞并防止逆流的过程。外导管内的未部署装置在超声引导导航后显示在隐股点附近。
图18示出了治疗期间部署径向膨胀线圈使治疗节段发生血管痉挛。
图19示出了在收回导管之前将径向膨胀元件取回。
图20是根据本发明的另一实施方案的用于剥脱身体管腔的装置的透视图。
图21是图20装置的端视图。
图22是图20装置处于部分部署结构时的侧视图。
图23是图20装置处于完全部署结构时的侧视图。
图24是图20装置处于完全部署结构时的另一侧视图。
图25示出了根据本发明的另一实施方案的用于剥脱身体管腔的装置,其中线圈由两个同轴的螺旋线圈元件构成。
图26是图25装置的端视图。
图27是图25装置的侧视图。
图28示出了根据本发明的另一实施方案的用于剥脱身体管腔的装置,其中线圈由四个同轴的螺旋线圈元件构成。
图29是图28装置的端视图。
图30是图28装置的侧视图。
图31示出了根据本发明的另一实施方案的用于剥脱身体管腔的装置,其中线圈由远端相连的四个同轴螺旋线圈元件构成。
图32是图31装置的端视图。
图33是图31的装置的侧视图。
图34A和图34B是本发明的螺旋线圈的一部分的透视图和侧视图。
图35A和图35B是本发明的另一螺旋线圈的一部分的透视图和侧视图。
图36A和图36B是本发明的另一螺旋线圈的一部分的透视图和侧视图。
图37A和图37B是本发明的另一螺旋线圈的一部分的透视图和侧视图。
图38A和图38B是本发明的另一螺旋线圈的一部分的透视图和侧视图。
图39A和图39B是本发明的另一螺旋线圈的一部分的透视图和侧视图。
图40A和图40B是本发明的另一螺旋线圈的一部分的透视图和侧视图。
图41A和图41B是本发明的另一螺旋线圈的一部分的透视图和端视图。
图42A和图42B是本发明的装置组成部分螺旋线圈的另一实施方案的侧视图和透视图。
图43A和图43B是本发明的装置组成部分螺旋线圈的另一实施方案的侧视图和透视图。
图44A和图44B是本发明的装置组成部分螺旋线圈的另一实施方案的侧视图和透视图。
图45A和图45B是本发明的装置组成部分螺旋线圈的另一实施方案的侧视图和透视图。
图46A和图46B是本发明的装置组成部分螺旋线圈的另一实施方案的透视图和侧视图。
图47A和图47B是本发明的装置组成部分螺旋线圈的另一实施方案的透视图和侧视图。
图48A至48C是本发明的装置组成部分螺旋线圈的另一实施方案的侧视图和透视图。
图49A和49B是本发明的装置组成部分静脉剥脱头的侧视图和透视图,该静脉剥脱头具有两个轴向间隔开的螺旋线圈。
图49A和49B是本发明的装置组成部分静脉剥脱头的侧视图和立体图,该静脉剥脱头具有两个轴向间隔开的螺旋线圈。
图50A和50B是本发明的另一装置组成部分静脉剥脱头的侧视图和透视图,该静脉剥脱头具有两个轴向间隔开的螺旋线圈。
图51A是本发明的另一装置组成部分静脉剥脱头的透视图,该静脉剥脱头具有两个轴向间隔开的螺旋线圈。
图52A示出了供给肿瘤的小动脉,图52B是其中一条动脉的一部分的分解图,示出了使用本发明的装置剥脱一段动脉腔,由于形成血栓而阻塞动脉。
图53A示出门静脉脉管系统,图53B其中一条静脉的一部分的分解图,示出了使用本发明的装置剥脱一段静脉腔,由于形成血栓而阻塞静脉。
图54示出了脉管系统的包含畸形的天生动静脉分流部分,以及使用本发明的装置剥脱一部分分流以通过形成血栓使畸形分流阻塞。
图55示出了左精索静脉和左睾丸周围的精索静脉曲张,以及使用本发明的装置剥脱一段左精索静脉以通过形成血栓使静脉阻塞。
图56示出了本发明装置组成部分螺旋线圈在其被拉动通过血管时如何能够自我适应不同的血管直径以及血管中的收缩部或较窄节段:(A)部署的螺旋线圈与接近血管较窄节段的血管腔周向接触;(B)螺旋线圈穿过较窄节段并且与较窄节段近端处的血管腔周向接触;(C)螺旋线圈向较窄节段的近端移动并且自我调节以保持与血管腔的周向接触。
图57示出了本发明装置组成部分螺旋线圈在其被拉动通过一段静脉时如何能够行进通过静脉中的瓣膜:(A)部署的螺旋线圈与瓣膜远端的静脉腔周向接触;(B)螺旋线圈穿过瓣膜而没有被勾住;(C)螺旋线圈向较窄节段的近端移动并且自我调节以保持与血管腔的周向接触。
图58示出了本发明装置组成部分螺旋线圈如何能够行进通过一段脉管系统,该段脉管系统逐渐变窄并且自我调节线圈直径以保持与血管腔的周向接合:(A)部署的螺旋线圈与血管的宽节段周向接触;(B)部署的螺旋线圈与血管的较窄节段周向接触。
图59示出了本发明装置组成部分螺旋线圈如何能够自我调节不同的血管直径并且在迂曲的血管中行进:(A)部署的螺旋线圈与血管的狭窄节段的血管腔周向接触;(B)螺旋线圈行进通过血管中的急转弯,同时保持与血管腔的周向接触;(C)螺旋线圈行进通过直径更大的血管中的急转弯,同时保持与血管腔的周向接触。
图60示出了当血管由于血管痉挛而主动收缩或者渐缩至较小宽度时,本发明装置组成部分螺旋线圈如何能够自我调节线圈直径以保持与血管腔的周向接合:(A)在血管发生血管痉挛之前,部署的螺旋线圈与长度为I直径为D的血管节段周向接触;截面A-A是在由来自约束力P的压力产生的环向力HF下与血管壁接触的螺旋线材的轴向视图;(B)在血管痉挛期间,部署的螺旋线圈在直径为d的收缩血管内以延伸长度L周向接触。
图61示出了当部署的线圈受到轴向力FA时作用在线圈上的静态力变量;(A)在直径D的血管中开始收回移动之前,其中血管具有向外的线圈接触力FC和血管约束力P;(B)在直径d的较窄血管中线圈被拉长至长度L;(C)在直径e的明显较窄的血管中,线圈被拉长至长度S。在线圈的近端部分上的管壁接触消失,从而减少静摩擦实现线圈无创伤通过。
图62示出了本发明的装置如何能够用于治疗脉管系统血容量异常高或高血流速度,以部分地阻塞血管来使血容量或血流正常:(A)示出了治疗之前的肺动脉,本发明的装置被部署在动脉中并向近端拉动;(B)示出了在用本发明的装置治疗后图62A的肺动脉的慢性变化,内膜增生部分地阻塞(收缩)动脉以减少血容量和通过动脉的流量。
图63示出了在一般血管中具有平滑内表面和带有菱形图案的粗糙外表面的扁平线材的实施方案的斜视图。
图64示出了血管内的装置的斜视图。外部纹理实施方案的近视图示出了(A)在收回方向上垂直于静脉壁的粗磨带槽面;(B)在收回方向上平行于静脉壁的粗磨表面;(C)粗磨表面的菱形构造。
图65示出了改进的静脉套管的尖端,将静脉套管改进以收纳未部署状态下的小型螺旋线圈。
图66示出了使用图65所示的改进的套管,以进入目标静脉并在抽出外护套之后部署螺旋线圈。
图67示出了用图65的套管装置进入腿部浅分支静脉。
图68示出了在分支静脉中部署小型线圈的方法。(A)利用引导线进入静脉内,通过引导线将护套插入;(B)护套进入静脉中并移除引导线;(C)将护套收回以暴露所收纳的螺旋形磨蚀线圈元件;(D)将护套和线圈一起收回以完成治疗静脉节段。
图69示出了图68中使用的护套,其在其内周收纳未部署的螺旋线圈以便于引导线通过。
图70示出了使用剥离式导引器护套将螺旋线圈部署在目标静脉中的方法。
图71示出了使用螺旋消融线圈来治疗左卵巢静脉中的骨盆静脉逆流。
图72示出了在动脉瘘管形成中的静脉重塑(A)正常静脉;(B)内膜层自限性增厚的内膜增生;(C)由于过度内膜增生引起管腔阻塞导致静脉移植物失效。
图73示出了使用具有粗糙内表面和光滑外表面的螺旋线圈来移除血管中的附着血栓。
图74示出了使用具有部分纹理外表面的螺旋线圈,其允许选择性地处理除了轴向收回之外的具有或不具有旋转力的血管壁。
图75示出了在糖尿病治疗中,在内窥镜检查时使用螺旋线圈重建十二指肠黏膜层的应用。
具体实施方式
本申请提及的所有出版物、专利、专利申请和其它参照文献出于所有目的其全部内容通过引用并入本申请,如同特别单独指出将每个单独的出版物、专利或专利申请通过引用并入本申请并且其内容被完全引用。
除非特别指出,否则除了术语在本领域中可能具有任何更广泛(或更窄)的含义之外,在本申请中使用的下列术语具有下列含义:
除非上下文另有要求,否则本申请中使用的单数应被理解为包括复数,反之亦然。关于实体使用的术语“一(a)”或“一(an)”应被理解为指实体,涉及该实体中的一个或多个。因此,术语“一(a)”(或“一(an)”)、“一个或多个”和“至少一个”在本申请中可互换使用。
如本申请所使用的,术语“包括(comprise)”或其变体,例如“包括(comprises)”或“包括(comprising)”,应被理解为指示包括任何所叙述的整体(例如特征、元件、特性、性质、方法/工艺步骤或限制)或整体组(例如特征、元件、特性、性质、方法/工艺步骤或限制),但不排除任何其它整体或整体组。因此,如本申请所使用的,术语“包括(comprising)”是包含性的或开放式的,并且不排除其他未列举的整体或方法/工艺步骤。
如本申请所使用的,术语“疾病”用于定义损害生理功能并与特定症状相关的任何异常病状。该术语广泛用于包括任何紊乱、病痛、异常、病症、不适、病状或综合征,其中无论病因的性质如何(或实际上是否建立了疾病的病因基础),都发生生理功能受损。因此,其包括由感染、创伤、损伤、手术、放射性消融、中毒或营养缺乏引起的病状。
如本申请所使用的,术语“治疗(treatment)”或“治疗(treating)”是指进行干预(例如,向受试者施用药剂)来治愈、改善或减轻疾病综合征或去除其一种或多种病因(或减轻其影响)(例如,降低溶酶体酶病理级别贮积)。在这种情况下,该术语与术语“医治(therapy)”同义使用。
另外,术语“治疗(treatment)”或“治疗(treating)”是指进行干预(例如,向受试者施用药剂)来在经治疗群体内防止或延迟疾病的发作或恶化或降低其发病率(或根除)。在这种情况下,术语治疗与术语"预防"同义使用。
如本申请所使用的,药剂的有效量或治疗有效量定义为在无过度毒性、刺激、过敏反应或其它问题或并发症下可给予受试者的量,其与合理的效果/风险比相称,但足以提供所需效果,例如治疗或预防表现为受试者病症得到永久或暂时改善。量会因不同受试者而有所不同,取决于个体的年龄和一般状况、施用模式和其它因素。因此,尽管不可能指定确切的有效量,但本领域技术人员将能够利用实验和背景常识确定在任意个体情况下的适当"有效"量。在此情况下的治疗结果包括根除或减轻症状、减轻疼痛或不适、延长生存期、改善活动能力和其它临床改善的指标。治疗结果不一定是完全治愈。
在如上定义的治疗和有效量的情况下,术语受试者(在上下文允许的情况下,其被理解为包括“个体”、“动物”、“患者”或“哺乳动物”)定义为需要治疗的任何受试者,特别是哺乳动物受试者。哺乳动物受试者包括但不限于人、家畜、农场动物、动物园动物、竞技动物、宠物动物,如狗、猫、豚鼠、兔、大鼠、小鼠、马、牛、山羊、牛;灵长类,例如猿、猴、猩猩和黑猩猩;犬科动物,如狗和狼;猫科动物,例如猫、狮子和虎;马科动物,例如马、驴和斑马;食用动物,如牛、猪和绵羊;有蹄类动物,例如鹿和长颈鹿;以及啮齿类动物,例如小鼠、大鼠、仓鼠和豚鼠。在优选实施方案中,受试者是人。
如本申请所使用的,术语“剥脱”应理解为是指沿一段身体管腔机械去除身体管腔的内腔表面的表面层或使其不可逆地功能性破坏。当身体管腔为血管或静脉时,内腔的表层通常是单层鳞状细胞,称为血管内皮,其相关结缔组织延伸到中层的表层细胞层,但不深于中层。内皮是身体管腔存活所必需的,这是由于其提供选择性屏障和抗血栓形成表面,去除内皮导致与正常血液成分相互作用的凝血酶原因子暴露,从而引起身体管腔发生凝结和阻塞,并将自身血管收缩剂释放到腔中。当身体管腔为静脉时,该术语是指去除内膜层和浅中膜层。本发明的装置和方法剥脱身体管腔的一纵向节段,例如1-60cm,并且进行周向剥脱;即如果是沿接受治疗的节段剥脱身体管腔,则剥脱整个圆周(或部分圆周或接近整个圆周)。
如本申请所使用的,术语“身体管腔”是指体内的腔,可以是细长腔,例如血管(即动脉、静脉、淋巴管、尿道、输尿管、窦道、耳道、鼻腔、支气管、输卵管、输精管)或心脏中的环形空间,例如左心耳、左心室流出道、主动脉瓣、二尖瓣、二尖瓣结合部、三尖瓣、肺动脉瓣或心瓣、或静脉瓣或瓣口。优选地,身体管腔是脉管系统(即静脉或动脉或动静脉血管)。静脉可以选自隐静脉(SSV、GSV、AASV)、骨盆静脉、精索静脉或门静脉。动脉可以选自主动脉、直肠上动脉、用于置入支架以完全或部分栓塞的一段动脉、子宫动脉或动脉导管。身体管腔可以是一段胃肠道,例如十二指肠、小肠。身体管腔可以是食管。
如本申请所使用的,术语“细长导管构件”应理解为是指细长主体,细长主体具有可操作地连接到身体管腔剥脱主体的远端。在一个实施方案中,导管构件包括控制臂(例如管状构件),该控制臂可操作地连接到剥脱主体以对其进行控制。控制臂可以采用任何形式,例如,杆、线或如海波管等管状构件。在一个实施方案中,控制臂和剥脱主体可相对于导管构件轴向调节。在输送和收回期间,剥脱主体通常是展开的并收纳在导管构件的远端中。控制臂相对于导管主体的轴向调节使剥脱主体以其盘绕构造进行部署。
“经腔输送”是指通过身体管腔将身体管腔剥脱主体输送至目标部位(例如曲张静脉),例如通过动脉、静脉或胃肠道进行输送。
如本申请所使用的,术语“线圈”应理解为是指可从适于收回到导管构件内的未盘绕构造和在使用中能够周向接合身体管腔并将其表面压在身体管腔上(即,沿线圈的至少一整圈接合静脉内腔)的盘绕构造调节的环形元件。处于其盘绕构造的线圈通常是圆形的,但也可以是椭圆形、正方形、三角形或矩形的,只要其能够周向接合身体管腔的内壁即可。由于大多数静脉和动脉具有圆形或接近圆形的轮廓,因此优选为圆形线圈,这是因为由处于其部署构造的线圈施加的径向力可围绕身体管腔的壁均匀分布。需使螺旋线圈的直径沿螺旋圈至少一整圈等于或大于待治疗身体管腔的直径,以实现与静脉内腔的周向接触,从而实现静脉的周向剥脱(见图13中的A)。在优选实施方案中,线圈是具有至少一匝完整圆周的螺旋线圈,优选地为1到3匝,例如约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8或2.9匝。螺旋线圈的线圈优选地是圆形的,但也可以具有其它轮廓,例如椭圆形、正方形、三角形或矩形。螺旋线圈可以为圆锥形。在松弛状态下,线圈的直径通常为2-20mm,更优选地为3-12mm。在松弛状态下,螺旋线圈的节距通常与直径大致相同,但也可以在直径的0.5-1.5倍间变化。应当理解,线圈的尺寸可以根据身体管腔而变化,以确保线圈相对于身体管腔的直径“偏大”。在这点上,线圈的直径(或在其直径沿其长度不同的螺旋线圈的情况下的最大直径)通常比待治疗身体管腔的直径大至少约5%,例如,比待治疗身体管腔的直径的大至少10%、15%、20%、25%或30%,并且通常大5-30%。重要的是,线圈沿线圈的至少一匝是尺寸偏大的,通常沿1-2匝偏大。线圈可以由细长元件形成,通常是单个细长元件,例如线材或细丝。线圈可以由金属(例如不锈钢)或金属合金制成,或者其可由如NITINOL等形状记忆合金制成,或者其可由如壳聚糖、尼龙或人造丝等天然、合成或半合成聚合物制成。身体管腔剥脱头理想地由单个线圈元件组成,尽管在某些实施方案中线圈可以包括多个线圈元件,例如2、3、4、5、6、7、8、9或10个,优选地2-4个线圈元件。
线圈元件的宽度至少为0.1mm。宽度通常为1至3mm,以允许经由适当尺寸的导管和导引器护套进行输送。
通常,螺旋线圈具有足够的弹性可变形,以在其沿身体管腔行进时,保持抵靠直径不同的身体管腔的壁的圆周径向力(即,其构造成“自我调节”或“可自我调节”)。这在图59中示出,该图示出了使用本发明的装置来剥脱具有若干弯曲部和直径逐渐增加的静脉。在该实施方案中,处于其部署状态的螺旋线圈相对于身体管腔的最宽部分偏大,从而在图59C所示的在身体管腔最宽处围绕其整个圆周施加径向力,并且螺旋线圈具有足够的弹性变形以使线圈直径适应静脉的变化直径,同时保持抵靠身体管腔圆周的剥脱径向力。螺旋线圈通常具有足够的弹性变形,以允许线圈穿过静脉中的收缩部或瓣膜,分别如图56和57所示。在治疗长度区域上静脉直径的这些收缩或变化可以是静态的(近端血管的较宽直径逐渐变细成较窄的远端血管)或动态的(在称为静脉痉挛的生理过程中,静脉壁平滑肌收缩使得静脉直径减小)。减小的静脉管直径将增加螺旋线圈上的径向力,这又增加在螺旋线圈材料内产生的环向力,该环向力将转化为纵向力以增加线圈的长度。此概念在图60中示出,其中示出了该装置部署在长度I和直径D的一般血管中。径向力等于垂直于静脉壁作用的压力P。血管施加在偏大线圈上的压力或环向力(HF)用于压缩线圈,并且当血管的直径减小到d时压力或环向力增加。由于开放的螺旋线圈设计,这种增加的环向力将纵向转化以将线圈拉长到长度L。这使得装置外表面与静脉壁的接触点处的径向力减小,以防止过度摩擦,但保持足够的力来维持表面接合并压靠静脉。过度摩擦会导致线圈段卡住或钩住以及壁穿孔和/或对邻近静脉的结缔组织的创伤。
如本申请所使用的,术语“线圈元件”指的是单个独立的线圈元件,各线圈元件一起构成本发明装置的线圈部分。通常,每个线圈元件为螺旋形。通常,线圈元件是同轴的。通常,每个线圈元件在部署时具有相同的直径。通常,每个线圈元件在部署时具有相同的节距。当处于部署构造时,多个线圈元件一起提供身体管腔的内腔的周向接合。因此,每个线圈元件可以构造成在部署构造中,其仅接合内腔圆周的一部分,例如以90°-270°、90°-180°、140°-220°或180°-270°与身体管腔的圆周接合。在一个实施方案中,线圈具有两个螺旋线圈元件,例如双螺旋。通常,两个螺旋线圈元件中的每一个在部署时具有至少0.5匝,并且通常为0.5至1.0匝或0.5至0.7匝。在一个实施方案中,线圈具有三个螺旋线圈元件,例如三螺旋。通常,三个螺旋线圈元件中的每一个在部署时具有至少0.3匝,并且通常在部署时具有0.3到1.0匝或约0.3到0.5匝。在一个实施方案中,线圈具有四个螺旋线圈元件。通常,四个螺旋线圈元件中的每一个在部署时具有至少0.25匝,并且通常在部署时具有0.25到0.75匝。在一个实施方案中,多个线圈元件在其远端连接在一起(闭合构造)。在一个实施方案中,多个线圈元件在其远端未连接(开放构造)。
如本申请所使用的,当应用于身体管腔(或血管或静脉)剥脱头时,术语“不可拆卸地连接到导管构件”应该理解为指该装置构造成不在体内从导管构件拆卸和释放剥脱头;换句话说,该装置构造成不在体内植入的身体管腔剥脱头。
可植入装置不适合用于治疗浅静脉疾病,原因如下:腿部浅静脉相对靠近皮肤表面,容易触摸触诊;较大体积的可植入装置可能会引起疼痛、刺激或局部皮肤畸形;植入物会抑制静脉通过收缩平滑肌减小静脉直径的能力(称为静脉痉挛),而该能力对于减小静脉直径、降低静脉内血栓量和防止再通很重要;植入物可引起免疫介导炎症反应。线圈的至少一部分的身体管腔接合面是粗糙的,用于剪切或不可逆地破坏身体管腔内衬使其离开身体管腔。可以化学、电或物理/机械处理表面,使其粗糙。有几种加工类型可供采用来使表面粗糙,包括机械磨蚀、喷丸、喷砂、滚花、放电加工和脉冲电化学加工。化学蚀刻也可用于部件表面的粗糙化。该表面可以是锯齿状的。该表面还可以包括凸起部,当凸起部接触血管腔时用作磨蚀面,这些凸起部可以是粘结到磨蚀面表面上的碎片,或者是从磨蚀面折叠起来的部分,或是具有格栅效应的有凹坑。提供具有磨蚀面的螺旋线圈的一种方式是如下进行描述的,在附图中所示的将第二线材或多个线材螺旋缠绕在芯线上。第二线材可以具有圆形、扁平、多边形、三角形、正方形、矩形、X形或星形横截面,只要细长元件(芯线)和螺旋缠绕的第二线材的组合生成粗糙的腔接合面即可,该粗糙的腔接合面能够在部署构造下沿腔轴向移动时剥脱腔。线材可能不是包裹中心芯线或中心壳体的唯一材料类型,还可采用例如基于聚合物的模制件、翅片、磨料颗粒或点焊。制作锯齿形表面的另一种方式是在线圈的表面中刻出凹口,或者在表面上制造凸起成形部,例如螺旋凹口或成形部。该表面应具有足够的粗糙度,以随装置单次纵向通过而剥脱管腔,避免需多次通过而受到最初的血管痉挛的限制。优选构造包括形成有粗磨和微磨表面的表面元件。粗磨表面包括从峰到谷的高度至少约0.5mm(例如0.5-1.0mm)的凹槽、凹口或齿。微磨表面包括从峰到谷的高度为约5-100微米的凹槽、凹口或齿。这些凹槽产生粗糙度并防止在治疗长度上细胞碎片阻塞磨蚀面。粗磨凹槽的方向是重要的,其不应平行于而是垂直于收回轴向。这在图64中示出,其示出了在血管中部署的装置。在放大图(A)、(B)和(C)中示出了线圈表面的详细视图。(A)示出了在收回时垂直于血管壁的凹槽图案,其能有效形成机械消融。(B)示出了在收回时平行于静脉壁的方向,其效果较差。由于不同的血管直径和迂曲的静脉解剖结构,需要一种粗磨纹理图案来克服此问题。(C)示出了菱形滚花图案,这是确保装置轴向收回时接合期间粗磨表面的一部分总是垂直于静脉壁的理想选择。微磨表面具有通常在0.8至3.2之间的表面粗糙度或RA值,以实现内皮破坏并防止过度的静摩擦。RA值是在评估长度内记录的轮廓高度偏离中线的绝对值的算术平均值。RA值为0.8对应于平均峰谷高度4μm。通过被称为糖萼的非细胞层来保护大多数血管中的内皮细胞(EC)免于直接暴露于流动的血液。这种凝胶状结构的厚度通常为0.5-3μm,超过EC本身的厚度(0.2-2.0μm)。
如本申请所使用的,术语“形状记忆材料”应当理解为是指记忆其初始形状并且当变形或被迫形成不同构造时在变形力释放后恢复到其变形前的形状的材料,通常为金属合金。一个例子是镍钛诺。在一个实施方案中,线圈或线圈的芯元件由形状记忆材料形成。由形状记忆材料制造线圈的方法通常涉及以下步骤:将形状记忆合金缠绕在模具或热定形夹具上以便在热定形后形成所需的形状,将加载的夹具放入烘箱中以设定温度/时间进行,取出并冷却该部件。也可以将圆柱形管件激光切割成所需尺寸从而形成该形状。也可以通过其它方式,例如通过电活化聚合物,来制造形成这种形状记忆。
如本申请所使用的,术语“治疗区”在应用于身体管腔、血管或浅静脉时是指身体管腔的涉及疾病状态病原的圆柱形部分,通常长度为1cm以上。在浅静脉的上下文中,术语“治疗区”应理解为是指浅静脉腔的不能有效循环血液的圆柱形部分,通常长度为1cm以上。在一个实施方案中,治疗区的长度为1-50cm、1-40cm、1-30cm、1-25cm、1-15cm、1-10cm、5-50cm、5-40cm、5-30cm、5-25cm、5-15cm、5-10cm、10-50cm、10-40cm、10-30cm、10-25cm或10-15cm。
如图1所示,静脉包括三个主要细胞层:由坚韧的纤维组织和无髓鞘神经纤维组成的外膜层,由胶原和平滑肌细胞组成的中层以及由单层鳞状细胞和一些结缔组织组成的内皮层。此外,内皮层被非细胞糖萼覆盖,非细胞糖萼通常是厚度为0.5-3μm的均匀分布结构。
静脉壁比动脉壁更薄,刚性更小且更柔顺。与始终保持其圆柱形的动脉不同,静脉可以因缺少血液而收缩或者显著拉伸以容纳增加的血液量。
静脉痉挛或收缩是由于身体拉伸激活静脉壁外的神经而发生的。当血管内皮细胞因拉伸或破裂而释放内皮素-1等化学物质时,也会发生收缩。
内皮层防止血液在静脉中凝结。如果内皮被破坏或损坏,则暴露凝血酶原因子,血小板将立即粘附并开始凝血级联。随着时间的推移(4-12周,通常情况下平均8周),静脉内的凝块受到周围细胞侵入而变得纤维化,周围细胞在硬化或纤维化转化的过程中沉积纤维蛋白和胶原。这防止了静脉中的血液逆流,从而成功治疗静脉曲张。
该装置的目的是破坏静脉的内皮层和中层,而不破坏外膜层。这需要选择性控制机械破坏到至少5μm的深度,并高达但不超过100μm。这确保实现内皮和浅中层的破坏,而避免可能导致疼痛和/或穿孔的较深中层/外膜破坏。在更深层中可能发生进一步的细胞死亡,这是由于细胞内含物释放导致邻近细胞凋亡,并且随着时间推移以级联方式持续到高达300μm的深度。所产生的血栓形成或凝块以及纤维瘢痕组织阻止血液进入静脉,从而避免了与静脉曲张相关的外观和症状。重要的是,内皮需完全周向破坏,这是因为如果存在小区域保持完整,则凝块可能不会形成,血液将继续流动,从而导致治疗失败和/或早期复发。当在大静脉中使用液体或泡沫化学硬化剂时,可能会发生上述情况,这可能是治疗有效率较低的原因,仅为70%,而热疗的有效率为90%-98%。
当在深静脉连接处的后方两厘米以上开始进行治疗时,由本发明产生的附着血栓被限制在浅静脉,由于没有血液流动,从而血栓无法被携带到会引起并发症的深系统中。
目前尚不清楚成功的长期静脉消融的精确要求。一些治疗浅静脉逆流的专家认为完全内皮破坏是足够的。完全内皮破坏使得血栓形成,血液流动中断,然后身体在硬化或纤维化转变的过程中形成血栓的静脉转化,变成纤维索,从而实现长期消融。其他专家认为,静脉壁组织损伤除了深入到内膜层之外,进入较深的中膜层是长期静脉消融所必需的。其他如热消融支持者等认为需要从内膜层到外膜层的静脉壁完全透壁破坏。
本发明通过其具有磨蚀面的偏大盘绕构造实现了完全周向内皮破坏。其还通过至少三种单独的机制导致中层损坏。首先,磨蚀多边形线圈表面可以穿透超过50μm,从而允许破坏发生在比内膜层更深的位置。这也可以通过使用多于一个线圈来进一步增加,从而允许位于装置上更远端的第二磨蚀线圈更深地穿透到已经被装置上更近端的线圈所剥脱的血管壁部分内。这也可以通过使用相同的装置在相同的治疗长度上重复该过程来实现。其次,在泡沫硬化疗法的研究中已经显示,细胞死亡发生深度达到300μm,进入静脉壁[10]。这可能是由于细胞死亡的级联效应,细胞死亡是由受损细胞释放分子引起的,分子在邻近细胞中发生信号凋亡。在这种情况下,细胞静脉壁损伤可以发生在受机械破坏影响的浅表细胞的更深处。第三,由装置作用于表面层产生的摩擦力与较深中层的阻力结合,在静脉壁层内具有剪切效应,从而导致较深的血管壁破坏。这种效果在先前的研究中已有报道,并且在本发明的临床前试验中也有观察到。
静脉破裂和/或装置被钩住的风险与装置与壁接触分别产生摩擦力或切割力的磨蚀性或锋利度以及磨蚀元件刺入壁的深度成比例。在使用现有的机械化学装置时,对于医生和患者来说,发生钩住是普遍报道的痛点。甚至有文献记载的案例,静脉被钩住并无意中剥离,导致疼痛和血肿形成,称为“无意中自发剥离”[6]。静脉瓣膜小叶也是机械尖端可能变得卡住及导致钩住的障碍。
其中的关键问题是难以完全除去内皮层并部分破坏中层而不引起过度的阻力和/或阻碍。
图2突出了面圆周覆盖在内皮细胞破坏方的重要性。其取自我们动物研究中部分治疗的静脉。右上角显示凝块附着于静脉壁,在手术后28天开始纤维化时发生组织侵入。左下角保留完整内皮。没有凝块形成,血液可以在通道中流动,导致该节段的整体治疗失败。相反,图3示出了在手术后28天完全内皮覆盖和破坏的结果,其中粘附的血栓形成阻塞整个血管腔,阻止血液流动,使得治疗成功。炎症细胞从外膜迁移到血栓中可以通过显微镜检查来确认。这种操作实现了血栓的纤维化转化和长期阻塞。
现在将参照具体实施例描述本发明。这些实施例仅仅是示例性的并且仅用于说明性目的:其不旨在以任何方式限制要求保护的专利权的范围或所描述的发明的范围。这些实施例构成了目前设想的用于实施本发明的最佳模式。
参照附图,首先参照图4至7,示出了根据本发明的用于剥脱身体管腔的装置,其总体上由附图标记1表示。在该实施方案中,该装置1是用于剥脱曲张静脉以使静脉阻塞从而治疗静脉曲张的装置,包括聚酰亚胺导管构件2和剥脱头3,剥脱头3构造成经腔输送到一段待治疗的曲张静脉,并在静脉中的目标位置处部署。剥脱头3包括具有近端5、远端6以及盘绕部分的螺旋线圈4,近端5和远端6通常与螺旋线圈的轴线同轴,盘绕部分为约1.5圈,外径13mm,节距约9mm。
如图4至7所示,螺旋线圈4相对于导管构件从输送构造(未示出)和部署盘绕构造轴向可调节,在输送构造中,线圈展开并收纳在导管构件2的远端中。螺旋线圈包括形状记忆合金,并在其延伸超过导管构件的远端时被偏压以呈现盘绕构造。该装置适用于正常直径4-12mm的曲张静脉(即,其中线圈相对于待治疗静脉尺寸偏大)。
应注意,螺旋线圈的“偏大”直径沿线圈的至少一个完整环路(360度)延伸。此特征加上线圈相对于静脉的偏大直径,确保线圈接合并周向压靠静脉内腔,从而围绕静脉的整个圆周均匀施加径向压力。偏大直径可以沿着小于一个完整环延伸,例如至少300度,然而这导致静脉内腔将不完全剥脱的风险,从而发生静脉部分阻塞和随后再通。在该实施方案中,线圈刚好超过一个整圈,使得即使在拉伸时也可完全覆盖,同时没有太长避免引起与静脉壁的摩擦增加和钩住的情况。较长线圈另外增加线圈匝数可以进一步机械破坏静脉壁。在这种实施方案中,装置与静脉接触的表面积增加也会增加发生钩住和静脉壁损伤的风险。因此,刚好超过一个整圈的线圈为实现血管内表面完全剥脱的最有效方法。
剥脱头的盘绕构造和柔性材料使其能适应在小于线圈直径的尺寸范围内的不同静脉直径,同时仍施加足够的径向力以引起剥脱。这些特性还使得线圈能够适应在同一静脉内在其目标治疗长度上不同的静脉直径。这些变化可能是由于静脉的自然锥形或由于静脉瓣膜。如果刚性结构被瓣膜小叶卡住或截住,则静脉瓣膜可引起严重的钩绊和静脉穿孔。由于线圈的柔性性质和磨蚀部件的最小突起,从而不太可能发生这种情况。在装置被瓣膜小叶卡住的情况下,导致沿纵向轴线的力稍微增加,会自动地减小线圈的直径,同时增加其长度,从而使线圈自身能够自由并且避免钩住或使瓣膜和相关联的瓣膜小叶分离,如图60和61所示。以上将在装置在静脉内正常收回期间自动发生,无需由操作者进行调整、额外操作或补充成像。
参照附图,首先参照图8和9,螺旋线圈4具有磨蚀面,该磨蚀面构造成在部署构造下,当螺旋线圈沿静脉轴向移动时将静脉内衬(主要但不限于内皮细胞层)从静脉剪切掉。在该实施方案中,螺旋线圈包括0.01181"镍钛诺(NITINOL)芯线8和螺旋缠绕在芯线8上的第二线材9,在螺旋线圈4上形成粗糙锯齿状表面。参照图8和9,第二线材9是由不锈钢或镍钛诺形成的扁平线材。在该实施方案中,芯线8直径约1mm,第二线材9宽度约0.7mm,厚度约0.02mm。第二线材的节距约1.5mm。参照图9,芯线8上的第二线材9的节距在螺旋线圈4的远端6处减小,在该实施例中减小到约0.3mm。在远端处设成较小节距/闭合节距的目的是形成装置的柔性远端构件以便使装置行进到目标部位。参照图10,芯线8上的第二线材9的节距在螺旋线圈4的近端5处增大,在该实施例中增大到最大约3mm。设成在近端较大节距的目的是便于在手术之后顺利取回远侧末端。该近端区也可以具有节距较小较紧的闭合部分以便取回。
第二线材9的厚度在0.1和1mm之间。基于使用等同的动物静脉组织的测试,大于1mm的直径将带来产生表面突起的风险,该表面突起可能钩住或卡住静脉壁表面。
参照图10和11,线圈4的近端5附接到不锈钢海波管12,不锈钢海波管12延伸穿过导管构件2到达其近端(未示出)。在使用中,海波管12可相对于导管构件2轴向调节,以实现螺旋线圈4在导管构件的远端部署成盘绕构造,并且在装置经腔输送和收回期间将螺旋线圈4缩回到导管构件中。在该实施方案中,导管构件2是4Fr聚酰亚胺挤出导管,在图11中,其具有向内逐渐变细的口部14,以在螺旋线圈4缩回到导管构件2内时辅助收回螺旋线圈。
参照图9,螺旋线圈4的远端止于防损伤头,在该实施方案中,防损伤头由光滑的金属球15提供,金属球15用于防止螺旋线圈被静脉或瓣膜钩住,并降低当螺旋线圈部署和收回时远端末端引起静脉壁穿孔的风险。另外,参照图9,球15的尺寸设成当装置处于输送构造时嵌套在图11中的导管构件2的锥形口部14中。
参照图9,在磨蚀线圈的端部和远端平滑球之间,存在大约5mm的细长的直节段,以便于装置的行进和放置。在装置的远侧处的球形成防损伤末端,在另一个实施方案中,其直径可以与磨蚀构件的直径相同,从而不形成球而是直的防损伤末端。
参照图12,示出了根据本发明的可选实施方案的装置的一部分,其中参照前述实施方案标记的部件采用相同的附图标记。在该实施方案中,第二线材的表面刻有螺旋凹口20,其用于在螺旋线圈4上提供磨蚀锯齿状表面。
参照图13至19,示出了本发明装置的使用。在以下描述中,近端指的是朝向血管中的进入插入位置,而远端指的是远离血管中的进入位置。该装置可通过单个注射部位输送和移除,并且不需要任何化学试剂的植入或施用。治疗静脉逆流以引起永久性阻塞的方法可以包括以下步骤。
在第一步骤中,将装置调节到输送构造,其中螺旋线圈4缩回到导管构件的端部内(未示出)。在一些实施方案中,导管构件是聚酰亚胺挤压件。然后,在图像引导下,例如超声,经由单独的导引器导管将该装置输送到目标静脉。
然后在超声引导下将装置向远端行进到所需位置。通过图17所示的超声波来验证正确放置,其中导管构件2的远端位于待治疗静脉的开始处。
外导管2轴向收回,将螺旋线圈4和海波管12暴露成图13所示的部署盘绕结构,在一些实施方案中,使用具有拇指轮控制元件的手柄部署螺旋线圈。利用单手直观运动,操作者可以通过用握住手柄的手的拇指转动拇指轮来部署线圈,这样可以用另一只手定位超声波探头来同时实现可视化,从而在必要时医生能够在没有助手的情况下进行手术。
处于其未部署构造和部署构造的线圈必须在超声波下容易看到,以防止意外放置。这通过在导管的尖端上结合回声材料部分来实现。在部署状态下,具有磨蚀面的线圈本身具有回声性。
由于线圈相对于所治疗静脉尺寸偏大,从而其沿静脉的至少一个完整圆周对静脉腔施加向外的径向力。
与目前的治疗选择不同,装置在静脉壁上引起长期阻塞的动作仅随装置在待治疗静脉节段中收回而发生。该动作仅能沿近端方向发生,保护了更远端的结构,该结构包括深系统中的静脉。
如果该装置意外放在目标血管的错误位置,则可被收回到外导管中然后重新定位而不会引起血管损伤。
然后,该装置沿静脉待治疗节段(通常为约10至70cm的静脉段)向前移动,其中线圈的磨蚀面抵靠静脉内腔的径向力和轴向移动使得螺旋线圈去除、毁坏或破坏静脉内腔内侧的表面层。这些层由糖萼、内皮、内皮下结缔组织和中层的表面层组成。静脉壁中的牵张感受器响应于装置向外的径向力,导致血管痉挛。通过释放储存在内皮细胞体内的化学试剂使血管痉挛进一步增强,化学试剂主要是内皮素-1,一种强有力的血管收缩剂。内皮下胶原的暴露导致血小板粘附并触发凝血酶原因子的级联活化,导致血管的血栓性阻塞。如图19所示,显著血管痉挛进一步增强这种血栓性阻塞,其中静脉治疗节段在急性阶段显著收缩,这导致血管中的血流完全终止,其在对山羊侧隐静脉的临床前研究中得到证实,在治疗后45分钟高压人工注射对比剂不进入静脉。
不受理论限制,圆周内皮层破坏使腔内血栓形成直接粘附到血管壁,并引起参与炎症愈合反应的细胞募集,细胞从外膜穿过腔迁移进入血栓。这些细胞包括成纤维细胞,其在血栓性阻塞中产生胶原,从而随着时间的推移将血管转化成纤维索。这导致血管的长期闭合和静脉疾病症状的消退。
与先前认为需要完全的静脉壁透壁细胞损伤相反,本发明人已经证明,仅表面剥脱可以引起足够的炎症反应诱导外膜层上的成纤维细胞向内迁移。这种操作是有利的,因为其提供了一种可以使用装置而不会引起患者疼痛或需要肿胀液扎针准备注射以防止疼痛的作用机制。由于感觉疼痛神经纤维位于血管的外膜层上,其不直接受装置影响,从而避免疼痛。
作者临床前研究的结果也证明了完整圆周内皮破坏在实现长期成功阻塞中的重要性。没有内皮破坏的血栓性阻塞将导致再通,即使内皮被部分破坏,如图2所示。这是因为内皮防止血栓粘附,使得血栓收缩离开血管壁。通过从内皮细胞分泌一氧化氮促进血管舒张而进一步防止粘附,从而抵消静脉痉挛的作用。这可能是涉及基于化学硬化剂技术的低有效率的主要因素。由于硬化剂被血液抑制活性并通过循环快速除去,因而其仅能引起不完全的内皮破坏,特别是在即使处于收缩状态也具有较多血液和较大表面积的较大血管中。
图4至16的实施方案都具有由单个线圈元件形成的身体管腔剥脱头,该线圈元件在部署构造中包括一个完整的螺旋圈并且在使用中周向剥脱身体管腔的内腔。参照图20至24,描述了本发明的装置的可选实施方案,其总体上由附图标记30表示,其中参照前述实施方案描述的部件采用相同的附图标记。在该实施方案中,该装置包括细长控制臂31,其穿过导管构件2并可操作地连接到线圈4的远端6,线圈的近端5连接到不锈钢海波管12。控制臂31相对于海波管12进行轴向运动实现线圈的部署或展开,图22示出线圈为部分盘绕构造,图23示出线圈为完全盘绕构造。该实施方案的使用与前述实施方案基本相同,除了可通过调节控制臂31和海波管12的轴向位置来控制线圈的部署。
参照图25至27,描述了本发明装置的可选实施方案,其总体上由附图标记40表示,其中参照前述实施方案描述的部件采用相同的附图标记。在该实施方案中,线圈4由两个线圈元件41a和41b组成,两个线圈元件协同工作以周向剥脱身体管腔的内腔,每个线圈元件可从适于设置在导管构件内并通过身体管腔进行经腔输送的部署构造和盘绕构造进行调节,如图所示。每一个线圈元件41a、41b均具有与导管构件大致同轴的近端部分,以及在其部署构造中包括小于一整圈的盘绕部分,这样,线圈元件一起呈双螺旋结构,其在使用中沿周向接合待治疗身体管腔。与前述实施方案一样,每个线圈元件包括芯线8,芯线8具有缠绕在芯线上的第二线材9,以提供锯齿状的身体管腔剥脱面。该实施方案的使用与参照前述实施方案描述的一样。
参照图28至30,描述了本发明装置的可选实施方案,其总体上由附图标记50表示,其中参照前述实施方案描述的部件采用相同的附图标记。在该实施方案中,线圈4由四个线圈元件51a-51d组成,四个线圈元件协同工作以周向剥脱身体管腔的内腔,每个线圈元件可从适于设置在导管构件内并通过身体管腔进行经腔输送的部署构造和盘绕构造进行调节,如图所示。部署构造下的线圈元件51a至51d的每一个包括约四分之一整圈,四个线圈元件一起呈四重螺旋结构,使得四个线圈元件一起周向接合待治疗身体管腔。与前述实施方案一样,每个线圈元件包括芯线8,芯线8具有缠绕在芯线上的第二线材9,以提供锯齿状的身体管腔剥脱面。该实施方案的使用与参照前述实施方案描述的一样。
在上述包括多于一个线圈元件的实施方案中,线圈元件在其近端连接并具有自由远端(即开放线圈)。然而,应当理解,线圈可以是闭合线圈,其中线圈元件在近端和远端处连接在一起。图31-图33中描述了这种实施方案,其中参照前述实施方案描述的部件采用相同的附图标记。在该实施方案中,装置60包括由四个螺旋线圈元件61a-61d形成的线圈,四个螺旋线圈元件在其近端5和远端6处连接在一起,每个线圈具有约二分之一整圈。与前述实施方案一样,每个线圈元件包括芯线8,芯线8具有缠绕在芯线上的第二线材9,以提供锯齿状的身体管腔剥脱面。该实施方案的使用与参照前述实施方案描述的一样。
图34至41示出了本发明装置组成部分螺旋线圈,具体地示出了形成线圈的不同类型的线材,以及线圈表面上的形成粗糙表面的不同类型的凹口/成形部。线圈由镍钛诺线材形成,凹口通过滚花工艺切割形成。
参照图34A和34B,示出了螺旋线圈67的一部分,其呈大致平坦的轮廓,具有腔接合外表面61,其中横向凹口形成具有截头三角形轮廓的齿62;平坦内表面63;以及切成锯齿形从而提供多个侧齿65的侧面。
参照图35A和35B,示出了螺旋线圈70的一部分,其呈大致凸形的轮廓,具有腔接合外表面71,其中弯曲的横向凹口形成具有三角形轮廓的齿72;以及光滑的凸形内表面73。
参照图36A和36B,示出了螺旋线圈80的一部分,其呈大致平坦的轮廓,具有腔接合外表面81,其中表面81的每侧84上形成有横向凹口,提供具有截头三角形轮廓的两组齿82;以及平滑的凹内表面83。
参照图37A和37B,示出了螺旋线圈90的一部分,其呈大致凸形轮廓,具有凸形管腔接合外表面91,其中在表面91上形成有凹口,提供菱形齿92,一些菱形齿带有平的尖端,一些菱形齿带有尖的尖端;以及光滑的平坦内表面93。
参照图38A和38B,示出了螺旋线圈100的一部分,其呈大致新月形轮廓,具有凸形腔接合外表面101,其中在表面101上形成有弯曲的凹口,提供具有不等边三角形轮廓的横向齿102;以及平滑的平坦内表面103。
参照图39A和39B,示出了螺旋线圈110的一部分,其呈大致椭圆形轮廓,具有凸形腔接合外表面111,其中在表面111上形成有弯曲的V形轮廓的凹口,提供具有三角形轮廓的横向齿102;以及平滑的平坦内表面113。
参照图40A和40B,示出了螺旋线圈120的一部分,其呈大致平坦的轮廓,具有平坦的腔接合外表面121、平坦的内表面123、以及切成锯齿形从而提供多个侧齿125的侧面。
参照图41A和41B,示出了螺旋线圈130的一部分,其呈大致倒T形轮廓,具有基部131、设置在基部上的齿132、以及光滑平坦的内表面133。
上述表面图案和形状是有利的,这是因为其使得在身体管腔的轴向治疗期间能够以恰当的角度、深度和细胞破坏水平进行输送,其中部署的装置响应于身体管腔直径的变化而自动变形。如前所述,在收回时,粗磨表面应理想地垂直接触血管壁以获得最佳效果。
图42至48示出了本发明装置组成部分多个静脉剥脱头,具体地,静脉剥脱头具有单个螺旋线圈,其中参照前述实施方案描述的部件采用相同的附图标记。
图42A和42B示出了本发明装置组成部分静脉剥脱头,其整体由附图标记140表示,包括控制臂31;具有大约三匝的螺旋线圈141;近端部分142,其中线圈的直径朝向中点143增加;以及远端部分144,其中线圈的直径朝向设置在螺旋线圈的轴线上的远端末端145减小。
图43A和43B示出了本发明装置组成部分静脉剥脱头,其总体上由附图标记150表示,包括控制臂31和具有大约三匝(线圈)152A、152B、152C的螺旋线圈151,每匝具有稍微不同的直径,并相对于前一匝稍微轴向偏移。
图44A和44B示出了本发明装置组成部分静脉剥脱头,其总体上由附图标记160表示,包括控制臂31和螺线圈161。螺旋线圈161具有直径不同的大约七匝(线圈),并且包括近端部分162,其中线圈的直径最初减小,然后朝中点163增大;以及远端部分164,其中线圈的直径朝远端末端165减小。
图45A和45B示出了本发明装置组成部分静脉剥脱头,其总体上由附图标记170表示,包括控制臂31和螺旋螺圈171,螺旋螺圈171具有大约四匝(线圈),并且包括近端线圈元件172、远端线圈元件173、连接线圈元件的过渡构件174、以及远端末端175。
图46A和46B示出了本发明装置组成部分静脉剥脱头,其总体上用附图标记180表示,包括螺旋线圈181,螺旋线圈181具有大约两匝(线圈),并且包括近端线圈元件182、远端线圈元件183,包括连接线圈元件的直部的过渡构件184,以及远端末端185。
图47A和47B示出了本发明装置组成部分静脉剥脱头,其总体上由附图标记190表示,包括控制臂31和螺旋线圈191,螺旋线圈191具有直径在远端朝向远端末端195减小的大约三匝(线圈)。
图48A、48B和48C示出了本发明装置组成部分静脉剥脱头,其总体上由附图标记200表示,包括控制臂31和螺旋线圈201,螺旋线圈201具有大约三匝(线圈),并且包括约两匝的近端右旋线圈元件202、约1.5匝的远端左旋线圈元件203、具有转弯部分206的过渡构件204、以及远端末端205。转弯部分206允许较小直径的右旋近端线圈202过渡到较大直径的左旋远端线圈203。
图49至51示出了本发明装置组成部分多个静脉剥脱头,具体地,静脉剥脱头具有轴向间隔开的两个未连接的螺旋线圈,其中参照前述实施方案描述的部件采用相同的附图标记。
图49A和49B示出了形成根据本发明的装置的一部分的静脉剥脱头,其总体上由附图标记210表示,包括在远端分叉以提供控制元件31A和31B的控制臂31、可操作地附接到控制元件31A的近端螺旋线圈211、以及与近端螺旋线圈轴向间隔开并且可操作地附接到穿过近端螺旋线圈的控制元件31B的远端螺旋线圈212。每个螺旋线圈匝数稍多于两匝(线圈),并且通常为直径向近端增加的圆锥形。
图50A和50B示出了形成根据本发明的装置的一部分的静脉剥脱头,其总体上由附图标记220表示,包括在远端分叉以提供控制元件31A和31B的控制臂31、可操作地附接到控制元件31A的近端螺旋线圈221、以及与近端螺旋线圈轴向间隔开并且可操作地附接到穿过近端螺旋线圈的控制元件31B的远端螺旋线圈222。每个螺旋线圈匝数稍多于两匝(线圈),并且通常为直径向近端增加的圆锥形。此外,近端线圈的最大直径d1约为远端线圈的最大直径d2的三倍,远端螺旋线圈的节距P1约为近端螺旋线圈的节距P2的两倍。
图51A示出了形成根据本发明的装置的一部分的静脉血剥脱头,其总体上由附图标记230表示,包括在远端分叉以提供控制元件31A和31B的控制臂31,可操作地附接到控制元件31A的近端螺旋线圈231,以及与近端螺旋线圈轴向间隔开并且可操作地附接到穿过近端螺旋线圈的一部分的控制元件31B的远端螺旋线圈232。每个螺旋线圈匝数稍多于两匝(线圈),并且通常为直径向近端增加的圆锥形。此外,近端线圈的最大直径大约是远端线圈的最大直径的三分之一,远端螺旋线圈的节距大约是近端螺旋线圈的节距的一半。
参照图61A,当螺旋圈部署并接合血管腔的内表面时,在装置和血管壁之间存在静摩擦。在静止时,在线圈接触点(FC)处存在向外的径向力,该径向力与线圈的刚度和直径以及血管的直径成比例,这通过血管的约束力P来平衡。当使用者收回装置时,轴向力FA增大以克服静摩擦。根据阿蒙顿定律的描述,在固体物体之间的滑动系统中,摩擦力与负载接触力(FC)和表面粗糙度成比例。还已经表明,接触表面积是增加摩擦的因素[11]。
理想地,随着轴向力(FA)增加,在线圈开始伸长之前克服静摩擦。由于已经示出的减少静摩擦的凝胶状糖萼层的存在,静脉和动脉中的静摩擦通常较低[12]。当血管约束力如在静脉痉挛中那样增加时,需要更大的轴向力,这导致线圈变长,同时由于其弹性变形性而仍保持与血管壁接触,如图61B所示。引起线圈拉长所需的轴向力与线材刚度成比例,并且还受到线外形(扁平和圆形)的影响。
在一些情况下,如图61C所示,由于静脉瓣引起的过度静脉痉挛或自然阻塞,在装置上存在显著的约束力。在这种情况下,增加的约束力通常集中在线圈的远端部分上。随着轴向力进一步增加,线圈将其直径减小到足以失去与血管壁的接触,如图61C所示。这显著地减少了静摩擦,并且可以使远端变窄以允许其克服静摩擦和/或阻碍。当这种情况发生时,线圈在回绕期间向近端跳跃或跳过以回到其自然构造。这可能导致静脉壁的小部分错过磨蚀面。在一些情况下,例如穿过非常窄的收缩部或静脉瓣膜,需要一定的导致接触损失的线圈变形,以使线圈在轴向力变得过高而导致血管壁损伤或静脉剥离之前减小静摩擦。当腔内装置的远端末端像锚一样传递轴向力,轴向力足够大以将整个静脉段从周围组织剥离或移除,发生静脉剥离。这种情况已有记载,使用的是先前的用于静脉消融的装置,该装置采用不可变形的较小弹性的设计,并引起患者的显著疼痛和瘀伤以及使手术复杂化[6]。
为了克服过度的线圈拉长和由此导致的跳过,可以通过改变装置元件的厚度、形状、直径和/或刚度来修改与静摩擦和线圈变形性有关的变量。表面粗糙度应该保持恒定以实现足够的机械消融。
使用其它线圈配置也可限制跳过对内皮覆盖的影响。该装置的这种实施方案在图42至51中示出,图45和46包含联接段(174、184),其可用于防止整个线圈的过度伸长。图48示出了具有相反的顺时针和逆时针构造以抵抗过度伸长的线圈之间的联接段。图49至51示出了独立的线圈元件,以在伸长期间如果任一线圈元件暴露于过大的静摩擦并失去接触时提供覆盖。
参照图63,在另一实施方案中,存在单个扁平线材选择。该扁平线材由镍钛诺形成。使用将形状压入线材的滚花工艺使该线材的外表面具有纹理(粗糙化),类似地,该纹理可以通过其它方式施加,例如冲压或微加工。这种操作在线中形成了磨蚀特征。参照图37A,其示出了压入到镍钛诺线中的菱形滚花图案。也可对线材外表面进行喷丸处理,以在线材上形成微磨蚀面。随后将该扁平线保持在热定形夹具中并定形为螺旋轮廓。具有磨蚀性外表面的螺旋线圈构造成当螺旋线圈在部署配置中沿着静脉轴向移动时剪切静脉的内衬(主要但不限于内皮细胞层)。
静脉疾病
本发明的装置和方法可用于治疗或预防静脉疾病。静脉瓣膜失效和静脉壁虚弱的组合导致血液逆流,随后导致下肢中血液淤积的并发症。浅静脉逆流治疗的目的是去除或阻塞逆流静脉,从而使血液转向健康静脉并有效地循环回到心脏。大隐静脉(GSV)是体内最长的静脉,是静脉逆流疾病中最常治疗的静脉。其路径从足部延伸到腹股沟,在腹股沟与深股静脉连接。GSV是静脉逆流最常见的病因。其它静脉包括小隐静脉(SSV)、前副隐静脉(AASV)和许多分支静脉,其也可以是治疗的目标。
下肢的静脉网络分为三个部分:1)位于肌筋膜浅层的浅间室的浅静脉,引流皮肤和皮下组织;2)位于肌筋膜深处的深静脉,引流下肢肌肉;3)穿静脉,穿透肌筋膜并连接浅静脉和深静脉。
理解这些静脉所位于的腿部的具体筋膜层和间室对于理解当前治疗方法中涉及的风险是重要的。GSV通常沿正常体质人的靠近皮肤2到5cm深度的路径,其位于由其下方的肌筋膜和上方的隐筋膜所包围的筋膜空间中从小腿延伸到腹股沟。隐筋膜是皮下组织的膜层的一部分。两个筋膜层,即上面的隐筋膜和下面的肌肉筋膜,在每一端合并形成一个封闭的空间,称为隐间室。隐间室包含隐静脉和伴随的动脉和神经。在膝盖上方时,隐神经通常远离大隐静脉(GSV),且不在隐筋膜中。然而,在膝盖下方时,隐神经靠近GSV,并位于的隐筋膜中。位于隐间室中的唯一的躯干静脉是GSV或其替代。所有的分支静脉和副静脉都位于隐筋膜和隐间室外部的皮下间室中。
浅静脉疾病患者中GSV节段发育不全的发生率为25%[13]。大腿中的这种发育不全的区段通常由靠近皮肤在隐间室外部延伸的副静脉桥接。如果GSV的此区段或任何其它部分非常靠近皮肤延伸,则在为静脉疾病热治疗做准备中,可能难以在静脉周围形成肿胀麻醉平面以保护皮肤。在一些情况下,仅可以执行非热方法或静脉剥离。大腿中的分支静脉在隐间室外部延伸,并且如果发生逆流,则可能在外观上变得曲张。由于其处于更表面的位置,这些不太适合于热治疗。大腿中的主要两条分支静脉是大腿前部和后部回旋静脉。大腿的前部副隐静脉在隐间室中平行于GSV,但不是始终平行,静脉曲张患者中约14%存在此问题。小隐静脉(SSV)从外踝开始,引流到膝盖后面腘空间中的深静脉。小隐静脉靠近腓肠神经,使用热方法容易损伤腓肠神经[14]。SSV的筋膜关系比GSV一致性更高。
穿静脉通过穿透肌筋膜将浅静脉与深静脉连接。下肢有高达150个不同尺寸和分布的穿静脉。腓肠内侧穿孔是临床上最重要的,会导致血液高速流入浅表系统和静脉高血压。由于其长度短并且靠近深静脉系统,从而难以用外科手术、热、胶和/或硬化方法治疗。热、胶或化学硬化剂不慎直接传到深静脉系统中可导致DVT和随后的PE,这是潜在的致命并发症。开放式外科手术结扎在技术上是困难的,并且导致切口的高发病率。GSV和SSV分别与腹股沟和后膝中的深股静脉的连接也是表面和深系统之间的连接点,并且接近这些区域的机能不全的上层静脉的治疗具有血栓栓塞并发症的风险。
鉴于这些解剖学上的考虑,由于对邻近皮肤和神经的内在损伤风险,热能的使用受到限制。此外,热能向前传递到深静脉系统中的非目标组织中是DVT和随后PE的潜在原因。目前的非热方法还受到损伤邻近非靶组织的风险的限制。氰基丙烯酸酯胶可能不慎被置于深静脉系统中,而不能找回或收回。化学硬化剂由于其性质,当从目标部位流出时,便高效地循环到深静脉系统中。泡沫硬化剂制剂可以以硬化剂和空气的结块乳液传播,进入深静脉系统,潜在地损害内皮并导致DVT。化学硬化剂也可能不慎注射到皮下组织、神经或动脉中,引起严重的皮肤坏死。
为了抵消这些限制,有效的非热装置应当能够利用标准超声技术准确且精确地部署。如果在治疗前位置错误,也应该可以找回和收回该装置。目前市场上没有具有这种双重能力的装置。
一种能够在目标位置精确部署而没有不受控制的向前传播或对周围组织造成损伤的机械消融装置,优选用于治疗下肢静脉逆流。收回和重新定位的能力进一步降低了使用者相关错误的风险。
提供不使用永久性植入物或毒性剂的静脉阻塞方法是优选的,因为其避免了感染、免疫介导的炎症反应、神经副作用、植入物机械疲劳继发的碎片迁移和由于占位效应引起的患者不适。
生物可吸收的植入技术以前也未能提供长期静脉阻塞,在吸收后发生再通[15]。
令人惊喜的是,作者发现通过使用纯机械的非可植入溶液,天然血栓性阻塞所起作用像“植入物”一样,并且在被称为血栓的纤维化转化的过程中被身体的自然愈合机制转化为永久性阻塞。
除了阻塞GSV、SSV、AASV或大的浅分支静脉的方法之外,还提供了一种用于治疗通常存在于膝盖以下的长度较小、机能不全的分支静脉的方法。目前,这些通过称为静脉切除术的手术治疗的。包括在局部麻醉下操作形成刺入皮肤切口,并使用静脉钩装置来手动地抽出短静脉段。此手术通常在腿中的多个静脉段上执行。由于需要多次扎针注射局部麻醉剂以及难以对每个静脉段进行充分麻醉,因此对于患者而言会感到疼痛不舒服。通常由于难以接受的患者不适或医生偏好,使用化学硬化剂来代替。增加的化学硬化剂注射次数会增加全身性毒副作用和局部并发症的风险,包括由于将硬化剂不慎注射到皮下组织或动脉系统中而引起的皮肤坏死。
在一个实施方案中,治疗小分支静脉的方法是利用如图66和67所示的小型螺旋线圈来执行,该实施方案提供的作用机制与先前针对如GSV等大静脉的治疗所描述的相同。在插入目标静脉之后,部署具有磨蚀性外表面的小型线圈,从而对静脉壁施加径向力。该表面在收回时剥脱内层。
参照图65,在一个实施方案中,螺旋线圈作为静脉套管的一部分围绕针装载。调整静脉内14G套管的当前布置以减小用于进入静脉的针的尺寸,同时保持护套的外径为2.1mm,这允许容纳如图65所示的螺旋线圈,用聚氨酯外导管形成锥度更大的尖端使能够进入皮肤。使用目前静脉进入、针抽出和套管推进的静脉进入技术,如图67所示,通过部分抽出外部聚氨酯套管,可以部署小型线圈部分(图66)。当到达治疗区的端部时,外套管可用于线圈的收复和无损伤移除。由于既不需要刺扎伤皮肤切口,也不需要如钩静脉切除手术中那样在静脉上牵引以拉出静脉,因此该提出的技术减少了对局部麻醉剂的需要。也不需要化学硬化剂,降低了皮肤坏死的相关风险。
参照图68,在另一实施方案中,用小号针进入静脉,并将引导线穿入静脉。如图69所示,类似于导引器护套的外护套在引导线上通过。该外护套被制造成包含附着于其内衬的线圈,该内衬正好位于尖端处的孔的下方。这允许引导线穿过并经过导引器内的线圈。然后通过部分地抽出外护套68而部署线圈,在另一个实施方案中,通过使用如图70所示的剥离式导引器护套来部署线圈,在一个实施方案中,线圈可以被重新装入护套中并用在单独的静脉上。
下面描述可以用本发明的装置和方法治疗的与身体管腔相关的一些适应症:
已证明骨盆静脉中血液的异常逆流是腿部复发性静脉曲张、外阴/阴道静脉曲张和称为骨盆淤血综合征(PCS)的病症的重要但以前常常被忽略的原因。还认为其与痔疮有关。女性髂内静脉和卵巢静脉的逆流通常是这些病症发展的原因。
PCS的特征是在有超过六个月的慢性骨盆疼痛病史的女性中,静脉造影上骨盆静脉明显充血。最常见的是,左卵巢静脉是逆流和骨盆静脉曲张的原因。与PCS相关的病状可非常严重,导致生活质量的显著降低和患者不适。
PCS表现出不同的骨盆内症状,包括非周期疼痛、尿频和性交困难。目前的治疗通常使用导管经颈静脉或股静脉进入来进行,随后使用金属栓塞线圈、化学致组织硬化剂如3%十四烷基硫酸钠(STS)或两者的组合来阻塞卵巢静脉和/或髂内静脉。线圈栓塞的缺点包括与线圈装置相关的治疗成本高以及包括线圈迁移和静脉破裂的并发症的风险。当线圈不慎移动到非目标位置例如肾静脉或经由下腔静脉移动到肺静脉时,发生线圈迁移,导致肺栓塞。据报道,线圈迁移在病例中的发生率高达4%,并会导致严重症状[16]。据报告,一些患者有持续的骨盆不适或流感样症状,其原因未知,但可能与线圈植入物有关。尚未采用吸热激光或射频静脉消融来治疗骨盆静脉机能不全。这主要是由于存在对邻近血管壁的重要周围骨盆结构的热损伤的风险。虽然采用吸热技术很少出现透壁脉管穿孔和对周围组织的损伤,但若发生在骨盆内治疗其后果远大于下肢。此外,在治疗期间,在下肢静脉周围注射大量肿胀麻醉剂以屏蔽周围组织并防止热损伤和疼痛。这在骨盆内显然是不可能的。因此,仍然需要一种安全且成本有效的装置来通过阻塞治疗骨盆静脉逆流。通过非可植入的、非热的方法提供了最佳解决方案,以降低这些风险。
在一个方面,本发明的方法可以用于骨盆静脉逆流的治疗,其中螺旋线圈装置用于机械剥脱髂内静脉和/或卵巢静脉以引起永久性阻塞。这种阻塞将防止静脉逆流至引起复发性静脉曲张的腿部静脉、供应阴道/外阴的静脉区域和PCS中涉及的静脉区域。在另一个实施方案中,剥脱手术可与临时球囊阻塞结合以减少血流并促进血栓粘附到静脉的治疗节段。这在具有较高逆流量和速度的骨盆静脉中可能尤其有利。在一个实施方案中,该方法可以通过结合使用化学硬化剂和/或栓塞颗粒而增强效果。图71是显示与骨盆静脉逆流相关的静脉解剖结构和使用螺旋线圈剥脱髂内静脉并防止逆流流向所涉及的静脉区域从而治愈症状的示意图。
由下肢股静脉的功能不全的静脉瓣膜引起的深静脉逆流不能通过消融和阻塞来治疗,这是因为血液从肢体循环返回至心脏是非常重要的。DVT已经消除了一些功能不全的静脉瓣膜,但是其它瓣膜保持正常的瓣膜小叶,但是由于壁松弛,其不再恰当地抵御阻止反流。目前的治疗方法涉及侵入性外科手术以产生新瓣膜。因此,需要一种侵入性较小的方法来恢复静脉瓣膜功能。在一个方面,本发明的方法可用于深静脉逆流的治疗,其中螺旋线圈装置被部署并跨过现有瓣膜收回。外表面是轻度磨蚀的,以降低血栓性阻塞的风险,同时保持破坏内皮层的能力。这导致瓣膜小叶和周围组织肥大,具有使瓣膜小叶更靠近在一起并恢复单向瓣膜功能以防止逆流的效果。
如前所述,痔疮可以用骨盆静脉栓塞治疗。较新的技术还针对直肠上动脉的特定阻塞,以防止扩张的静脉丛的填充导致内痔[17]。在大多数情况下,该动脉的直径在3和5mm之间。为了避免放置永久性植入物并为这种常见病症提供更具成本效益的解决方案,需要改进的治疗。在一个方面,本发明的方法用于治疗痔疮,其中使用螺旋线圈装置机械地剥脱直肠上动脉以引起永久性阻塞并防止静脉丛的填充,从而治愈该病症。
精索静脉曲张是男性睾丸周围静脉的异常扩张。临床上成年男性中显著的精索静脉曲张患病率高达15%,其导致疼痛、不适和生育力降低。推荐对睾丸萎缩或生育力降低的年轻男性进行治疗。目前的治疗包括阻塞提供睾丸周围异常扩张静脉的睾丸静脉。目前的阻塞方法包括永久性线圈栓塞、胶水、化学硬化剂或技术的组合。因此,仍然需要一种侵入性较小、性价比较高的方法来阻塞精索静脉曲张中提供扩张静脉的睾丸静脉。在一个方面,本发明的方法可以用于治疗精索静脉曲张,其中使用一次性螺旋线圈机械剥脱睾丸静脉,以引起永久性阻塞。
图55是示出静脉解剖结构和引起永久静脉阻塞的相关过程的示意图。
术前门静脉栓塞(PVE)是在肝大部切除之前终止门静脉血流至肝脏的选定部分的选择性手术。PVE引发肝组织肥大,其在计划的大部切除之后保留,并且可以允许更积极的切除。其在治疗来自结肠直肠癌的原发性和继发性肝转移中作为辅助步骤。当前技术涉及采用直接图像引导的经肝进入来进入到门静脉系统,随后注射栓塞剂,包括胶、聚乙烯醇(PVA)和金属球或线圈。其中许多技术费用高昂,并且患者在进行计划切除之前的病程中可能无法进行手术。因此,需要一种更具成本效益的方法。由于大多数患者在经历门静脉手术时处于的促凝状态作为肿瘤切除的辅助,所以依赖于所选择的门静脉的血栓阻塞的非植入方法可能是有效的。在一个方面,本发明的方法可用于手术前阻塞门静脉,其中使用螺旋线圈装置机械剥脱门静脉以引起阻塞。这种阻塞将促进剩余肝段的肥大并提高患者在计划切除后存活的可能性。图53A是利用非植入物机械剥脱方法的阻塞门静脉的图示。
冠状动脉旁路移植术(CABG)是对左主冠状动脉疾病(CAD)和三管CAD患者的标准护理,外周动脉旁路移植术(PABG)在晚期外周动脉阻塞性疾病患者中进行。内乳动脉通常用于冠状动脉搭桥手术中的血管再造,然而,静脉(几乎只有大隐静脉)仍然是最常用的移植物,尤其是用于PABG手术。插入到动脉系统中的静脉移植物使静脉暴露于更高的拉伸力和剪切应力,这可能导致静脉壁内过度的炎性变化,称为内膜增生,从而导致阻塞和静脉移植物失效。静脉移植手术后10年的通畅率仅为60%[18]。还不能很好地理解为什么一些静脉移植物保持开放而其它的长期阻塞。AH静脉在转移到动脉系统时经历一些重塑或“静脉动脉化”。然而,长期的过度和持续的炎症反应导致移植物衰竭。新的研究表明,移植前静脉的状况可能是移植失败的重要预测因素。在中层中已经肥大、合成倾向的平滑肌细胞的静脉具有较差的预后。因此,提高静脉移植物用于动脉疾病的长期成功率的方法是重要的临床需要,并且可通过在用作动脉系统中的导管之前预处理或调整静脉移植物来实现。在本发明的一个方面中,提出了一种预处理静脉以用于在动脉系统中作为移植物来治疗CAD和PAD的方法。提供了一种具有较少磨蚀面或部分磨蚀面的螺旋线圈,以引起静脉壁增厚而没有完全血栓形成性阻塞和随后的纤维化。静脉壁破坏的深度必须是特定的,以产生不会使静脉易于移植失败的适当炎症反应。理想地,在移植物植入之前4至12周进行该辅助手术,以允许发生和消退涉及静脉重塑的细胞变化。由于炎症变化已经发生并在治疗的一次机械破坏后停止,从而这可以改善静脉适应更大压力和更高剪切力的动脉环境的能力。当置于动脉系统中时,不受控制的过度炎症和肥大变化发生的可能性很小。这可以防止过度的不受控制的中膜肥大和内膜增生的发生,并降低壁动脉粥样化形成的风险,壁动脉粥样化形成是心脏移植物衰竭的主要原因。图72显示了正常静脉、动脉化静脉和失败的静脉移植物之间的组织学差异。
通过外科手术形成的AV瘘在动脉和静脉循环之间吻合,以使得能够利用透析治疗晚期肾脏疾病(ESKD)。与依赖中心静脉导管透析的患者相比,具有工作AVF的患者发病率和死亡率较低,治疗成本也较低。而AVF形成的原发性失效率却高到难以接受,范围在20%到60%。近年来,由于依赖于AVF进行透析的人群出现老龄化和透析中使用较高的泵速度,失败率已经上升[19]。
失败的主要原因是在吻合的静脉段处狭窄。AVF形成中涉及的潜在机制知之甚少,但认为与向外重塑不足和内膜过度增生有关。因此,迫切需要一种形成用于ESKD患者的AVF的改进方法。在本发明的一个方面,在进行形成吻合的手术之前使用磨蚀性降低或部分磨蚀的螺旋线圈,以产生具有健康模式的重塑静脉。理想地,该过程应在AVF产生之前4到12周进行,以允许细胞变化发生并消退。这种静脉的预处理可减少炎症反应和不受控的重塑,而当正常静脉猛烈暴露于动脉压和流速时,炎症反应和不受控的重塑会导致AVF原发性失效。上述操作可以增加AVF手术的成功率。这种技术还可以防止AVF窃血综合症,其为吻合的静脉侧变得过度扩大并导致动脉侧供应的区域中的局部缺血。
血栓性阻塞可发生在动脉或静脉系统中的任何地方,并且通常由红细胞、活化的凝血因子、血小板和炎性细胞组成。随着时间的推移,从数分钟到数天,血栓块变得组织化并粘附到血管壁,尤其是如果存在血管壁损伤。本发明的前述实施方案被设计成主要在浅静脉逆流的情况下,当需要血管阻塞时,促进这种血栓情况。
作者还发现,如果磨蚀面被调整成仅存在于线圈的前缘和内表面上而外表面保持平滑以防止静脉壁创伤,则径向膨胀的螺旋线圈也可用于去除附着于血管壁的血栓。
如果肺部发生栓塞,称为肺栓塞(PE),则急性深静脉血栓形成(DVT)是潜在的威胁生命的病症。保留在外周静脉中的显著大DVT也可导致下肢慢性静脉高血压的高发病率。抗凝是帮助溶解凝块和防止栓塞的治疗的基础。使用机械、化学溶解或超声技术去除凝块,来治疗处于急性情况下的患者的新方法已在过去10年中出现,在某些患者组中显示出觉有改善的结果。去除已经变得粘附到静脉壁的凝块在技术上是困难的,并且失败可能导致更差的结果。一些使用复杂机械系统、抽吸或超声的较新技术由于其高成本而使效果大打折扣。Fogarty球囊是血栓去除的低成本替代方案,但对于粘附的血栓无效。在动脉系统中,存在类似的需要,以去除导致急性肢体缺血的组织性血栓。在神经血管系统中,支架收复系统用于取回血栓并防止中风。在这两种情况下,更组织化的粘附血栓显示出技术挑战。因此,需要开发用于去除血管壁上的粘附凝块或血栓的改进的解决方案。在一个实施方案中,提供了一种方法,用于使用具有磨蚀性的内部和前缘表面的螺旋线圈来从血管壁移走血栓而不引起内皮创伤。图73显示了这种装置如何能够除去血栓,同时保持内皮表面完整并且再形成血栓的可能性很低。该装置在血栓性阻塞的远端部署并朝向进入部位向近端收回。在血栓移出之后,可使用Fogarty球囊、收复篮或抽吸导管将血栓从循环中移除,这将恢复血流并防止血管阻塞后遗症的发生。
通常进行脉管系统的经皮支架术以恢复部分狭窄或阻塞的动脉或静脉循环中的血液流动。支架内血栓形成相对不常见,但是在心脏支架手术之后潜在威胁生命的并发症的发生率为约1%。放置在患病动脉中的支架可以具有覆盖钙化或动脉粥样化斑的支柱。在这些情况下,升高的支架支柱可能导致新内膜覆盖失败,尤其是在药物洗脱支架中[20]。这通常表现为在植入1年后迟发或极度迟发支架血栓形成。需要降低这种手术后支架内血栓形成的概率。在本发明的一个方面,提供了一种具有覆盖线圈圆周的一部分的外磨蚀面的螺旋线圈。这允许选择性治疗动脉表面的一部分,该部分可在之后的状态保持未覆盖。图74示出了在放置支架之前使用部分磨蚀线圈来选择性地预处理动脉部分的方法。这增加了支架支柱被新内膜覆盖的可能性,并降低了后期支架再狭窄的风险。诸如血管内超声(IVUS)等成像技术可以用于对装置进行定向并且使操作者能够选择性地对准血管壁的所期望部分。
动脉的选择性阻塞和通常对特定组织的动脉供应是对各种疾病状态的有效治疗方式。肿瘤栓塞是一种通过经皮方式使用各种方法阻塞供应良性或恶性肿瘤的动脉的技术,经皮方式包括合成的或生物可吸收的珠、金属球、胶或金属线圈。使用这些药剂的常见并发症包括迁移到非靶血管、过度阻塞导致正常组织坏死、疼痛、与异物和坏死组织的组合相关的感染[21]。因此,需要一种侵入性较小、非植入性、并发症发生率较低的治疗方法,用于对良性或恶性肿瘤供应的动脉进行栓塞治疗。
参照图52A和52B,示出了肿瘤240和包括小动脉241的向肿瘤供应血液的动脉,本发明的装置可用于阻塞其中一个小动脉并使肿瘤缺乏血液供应。图52B示出本发明装置的静脉剥脱头242,其部署在小动脉中,其中螺旋线圈周向接合动脉腔。
参照图52A,该装置沿着供给肿瘤的动脉行进,并在点243部署,然后向近端缩回。螺旋线圈沿动脉的缩回,加上螺旋线圈的粗糙表面和动脉腔之间的周向接触,导致动脉腔的一部分被剥脱,去除上皮细胞层,随后在点243处形成血栓,导致动脉阻塞。
子宫肌瘤是良性病变,其可以引起显著的骨盆疼痛和痛经。子宫肌瘤可以通过子宫切除术或通过供给纤维瘤的子宫动脉的微创栓塞术来治疗。用于子宫动脉栓塞(UAE)的最常用的栓塞剂是聚乙烯醇(PVA)、三丙烯基明胶微球和Polyzene-F水凝胶微球。并发症包括栓塞材料迁移到非靶组织、过度坏死引起疼痛和感染。因此,需要一种侵入性较小、非植入性且并发症发生率较低的治疗方法来治疗子宫肌瘤。在一个实施方案中,提供了一种使用具有磨蚀外表面的螺旋线圈的方法,以便部分或完全阻塞供应子宫肌瘤的子宫动脉或远端分支。减少或消除血流会减小尺寸并缓解由纤维瘤引起的症状。使用该方法通过诱导内膜增生引起血管的充分狭窄可以降低坏死并发症的风险,同时保持对纤维瘤的尺寸减小效果。该方法也可用于治疗以下病症,包括但不限于;肺、脑或肝循环中的动静脉畸形(AVM)、恶性肿瘤、良性前列腺肥大(由前列腺动脉阻塞引起)。
卵圆孔未闭(PFO)是常见心壁异常,成年人群中患病率约30%。而通常在某些PFO中的良性发现可以打开,使反常的栓塞从静脉循环移动到动脉循环,潜在地造成大脑突然丧失功能和系统性栓塞。患有隐发性中风史的个体的治疗是使用中隔封堵器经皮闭合。这些装置是穿过缺损部署的永久性植入物。PFO的解剖学上涉及到第一房间隔和第二房间隔的重叠,其形成瓣阀,当右心房压力超过左心房压力时,例如在咳嗽或打喷嚏时,该瓣阀可打开。这些装置费用高并且可能引起并发症,包括血栓形成和中风。需要一种具有较低并发症风险的较小侵入性的治疗。在一个实施方案中,提供了一种方法,使用线圈或环箍形状的磨蚀装置来剥脱所涉及的房间隔瓣的接触表面,这导致炎症反应,使得在瓣表面之间形成粘结,致使PFO永久关闭从而消除大脑突然丧失功能的危险。类似的方法可用于心脏内以产生疤痕组织和增厚以在引起心律失常的异常传导点处阻断神经传导。
动脉导管(DA)是主肺动脉和主动脉之间的胎儿血管连接,其将血液从肺动脉床转移。在出生后,DA经历主动收缩和最终消失。当DA未能在产后完全关闭时,发生动脉导管未闭(PDA)。在组织学上,导管组织与相邻的主动脉和肺动脉的导管组织不同。导管的内膜较厚,并且中膜包含更多以特有螺旋方式排列的平滑肌纤维。DA可以采用各种形状和形式。小型PDA直径通常小于3mm。对于具有PDA必须闭合的婴儿的最佳治疗方法仍然是争辩的主题。目前经皮治疗的选择包括线圈和阻塞装置。这些治疗的局限性包括高成本和线圈迁移引起栓塞并发症的风险。如果不能恰当调整尺寸,阻塞装置可能导致严重的并发症,例如当儿童生长时主动脉缩窄[22]。因此,需要一种侵入性较小的有效的PDA经皮治疗方法。在一个实施方案中,使用具有外磨蚀面的螺旋线圈来剥脱DA,随着时间的推移导致血栓形成和纤维化阻塞。这将通过关闭DA来缓解与分流相关的症状并降低心内膜炎的风险。该技术也可用于以类似方式治疗小直径房间隔缺损。
腹主动脉瘤(AAA)是主动脉异常扩张,其可因破裂而复杂化,从而导致高发病率和死亡率。对大动脉瘤的治疗旨在降低破裂的风险。治疗选择是放置移植物的开放手术或使用大覆膜支架移植物的血管内动脉瘤修复(EVAR)。EVAR是侵入性更小、恢复时间更快和肾损伤风险更低的手术。然而,EVAR的长期效果受限,患者内漏的发生率高达20%,需要进行放射监测、翻修手术或辅助手术[23]。内漏可分为I型至V型,I型内漏发生在近端或远端移植物附接部位。血液通过血管壁和移植物之间的间隙进入并填充囊,导致发生破裂的风险。当发生从腰部或肠系膜血管经由侧支进入动脉瘤囊的逆行流动时,发生II型内漏,并且还导致破裂的风险。I型和II型内漏占与EVAR术后病程相关的发病率的大部分。目前用于I型内漏的治疗方法包括小型螺钉和额外的支架移植物放置。II型内漏可以将栓塞线圈放置在供给囊的腰椎或肠系膜血管中来治疗。所有这些方法都是侵入性的、费用高并且带有主动脉壁破裂和感染的并发症。因此,需要降低I型和II型内漏风险的技术。在一个实施方案中,提供了一种用于制备主动脉靠近移植物附接位点的部分以降低I型内漏风险的方法。这通过使用螺旋线圈剥脱这些特定位置的内皮内衬来执行,这些位置可以基于术前成像规划而容易地确定。通过执行这一手术,动脉壁被引发以在移植物附接位点形成新内膜增殖并降低血液渗漏和I型内漏的风险。这种益处将降低可能使术后病程复杂化的辅助手术的风险。类似的方法可以用于治疗I型内漏,因为其通过将可膨胀的弹性磨蚀装置插入间隙中而发生,在该间隙中,内漏随着时间的推移发生,导致具有纤维化转变的血栓性阻塞。提供了另一种治疗II型内漏的方法,该方法使用膨胀的弹性磨蚀元件剥脱供应腰部或肠系膜的动脉,从而引起阻塞并防止囊破裂的危险。由于这些动脉中的流动是从吻合连接逆行的,所以其更可能表现得像静脉,并且由于线圈的永久植入而易于血栓形成阻塞。类似的方法可用于治疗与经皮心脏瓣膜置换相关的瓣膜周围渗漏。经皮二尖瓣和主动脉瓣置换手术后的瓣周渗漏导致术后发病率和在一些情况下导致翻修手术。
十二指肠粘膜表面重修术(DMR)是一种新技术,其在早期临床研究中已经显示出改善糖尿病患者的血糖控制[24]。十二指肠是葡萄糖吸收和向内分泌器官发信号的重要导管。十二指肠粘膜响应于产生胰岛素抗性信号的慢性高糖饮食而变得增生,从而使葡萄糖控制恶化。通过消融这种增生的粘膜,新的粘膜表面可以再生而没有有害信号传导。十二指肠的解剖结构与静脉系统共有一些重要的特征。其具有弯曲的路径,高度顺应性,可扩张,并且肌肉壁收缩可以引起收缩。治疗的目的是安全地仅消融表面粘膜层而不影响下面的较深的肌层,这在大约10厘米的十二指肠长度上进行。
目前开发的方法包括放置能够将热液能量从球囊内流体传递至十二指肠壁的可扩张球囊,从而引起消融或损伤粘膜内衬上的细胞[22]。该方法需要熟练的内窥镜专家通过将粘膜从粘膜下层提升起来而产生热障。这目前通过在将针在粘膜下插入以注射盐水时围绕球囊的圆周抽吸通道以保持表面粘膜层来实现。如果没有恰当地执行,则存在十二指肠壁穿孔和对较深肌层的损伤的风险。因此,需要一种侵入性较小、易于实施、成本较低且治疗速度较快的治疗方法,其可选择性地将十二指肠的表层消融至深度不大于0.6mm。在本发明的一个实施方案中,径向膨胀的弹性变形磨蚀装置通过标准内窥镜中的通道输送,如图75所示,部署磨蚀元件以接触远端靠近空肠连接处的十二指肠壁。磨蚀元件具有最大峰谷距离为0.6mm的表面粗糙度。该装置朝向胃近端收回。在收回过程中,其引起圆周剥脱或对粘膜层的破坏。这使得葡萄糖控制恢复和改善。类似的方法可以用于胃肠道的其它部分以治疗吸收脂质、铁、维生素和包括锰的矿物质产生影响的病变。
当通常存在于结肠中的过量微生物定殖小肠时,会发生小肠细菌过度生长(SIBO)。侵袭性细菌菌株通过产生肠毒素和通过直接的壁粘附而损伤肠表面。未吸收的碳水化合物的发酵导致腹胀、膨胀和肠胃气胀。也可能发生回肠炎症,引起腹泻和营养吸收不良。小肠(空肠和十二指肠)通常具有比结肠显著更低浓度的细菌和其它微生物。胃肠道的这些部分之间的边界由回盲瓣控制。当该阀关闭不全时,其可以允许大肠内容物逆流到小肠中。这促进了细菌的过度生长,细菌摄取小肠的富营养成分[25]。目前在初次治疗中使用抗生素治疗以阻止小肠中细菌的过度生长。然而,大约40%的小肠细菌过度生长(SIBO)患者在最初的抗生素治疗后具有持续的症状。已经证明通过回盲瓣的异常逆流是SIBO的病因[25]。因此,需要更有效的SIBO治疗。在一个实施方案中,使用可径向膨胀的磨蚀装置来破坏回盲瓣和回肠的粘膜层,引起炎症反应,然后增生,这可以减小回盲瓣的直径,大大降低来自结肠的流体逆流的可能性。第二个作用可以是消融被附着细菌定殖的回肠区域,以允许正常或非定殖粘膜再生。该方法可与抗生素疗法联合使用,以增强效果并降低高复发率。可以使用类似的方法来收紧在括约肌松弛时会带来胃反流的胃-食管连接。
巴雷特食管(BE)是食道癌的恶变前病症,由于慢性损伤和胃食管反流病(GORD)引起的炎症,发生下部食道的细胞变化。据估计,GORD患者中的发病率为10%。早期干预可防止发展为癌症。目前早期的介入方法包括对受影响的浅层进行热和射频消融,以使正常组织再生[26]。射频消融是当前使用的涉及射频探针的内窥镜插入的技术。这种方法的主要缺点是射频装置的成本高。因此,需要更简单、性价比高的治疗这种常见病症的方法。在一个实施方案中,提供了一种用于内窥镜部署径向膨胀磨蚀元件以机械消融下食道中的异常细胞从而降低癌症发展风险的方法。考虑到巴雷特食管的组织学分级和最终确诊对病理学家具有高挑战性,该方法的另一个优点是其允许收集剥脱头上的细胞,其可以在手术后进行分析。这与完全破坏细胞的热方法相反。这种细胞收集功能也可用于诊断和处理胃肠道其它部分的恶化前或恶性病变,例如结肠、肺支气管和细支气管、子宫、子宫颈、泌尿道和膀胱。
肛周瘘是直肠和肛管周围皮肤之间的异常连接,存在于患有炎症性肠病的患者中,并且由于感染、疼痛和出血而导致高发病率。肛周瘘难以用目前的方法治疗,包括侵入性手术切除或应用缝合以在长期治疗过程中逐渐去除通道。这些治疗选择具有高复发率[27]。因此,需要开发一种用于肛周瘘的侵入性更小的更有效的治疗。在一个实施方案中,提供了一种用于在胃肠道中部署和收回的径向膨胀的磨蚀装置,使得衬有内皮细胞的管道剥脱。随后发生炎症反应导致结疤,并且防止粪便内容物进入管道阻止愈合。之后通过纤维化炎性反应闭合管道预防病症。类似的方法可用于封闭或关闭在慢性阻塞性肺病中发生肺疾病的部分。当吸入的空气进入肺疾病的这些部分时,不会发生肺的氧交换,导致血氧水平的降低。在这些情况下需要阻塞或密封细支气管或肺泡以将空气转移到健康的肺组织。
当患者需要永久避孕时,女性绝育通常通过输卵管结扎进行。目前的方法包括开放性手术结扎、输卵管切除术和微创夹子放置。这些手术的并发症包括疼痛、出血和感染。需要一种避免手术切除或永久性植入的侵入性较小的可靠方法。在一个实施方案中,在输卵管中插入、部署和收回径向扩张的螺旋装置。这破坏了内皮层和内皮下层,引发炎症反应,引起输卵管随时间的纤维化阻塞。该技术也可以应用于输精管管腔上的男性绝育手术。
图52至55示出了使用本发明的装置在疾病治疗中阻塞受试者不同血管。
参照图53A和53B,示出了使用本发明的装置来阻塞门静脉系统。这种治疗可用于通过阻塞门静脉系统的将营养物从肠254带到肝脏的部分来治疗肝癌。在图中,示出了处于部署构造的门静脉251中的血管剥脱头252。螺旋线圈沿静脉缩回,加上螺旋线圈的粗糙表面与静脉腔周向接触,使得一节段门静脉腔随着上皮细胞层的去除而剥脱,并因此形成血栓,导致静脉阻塞。
参照图54,示出了使用本发明的装置治疗动静脉畸形,该动静脉畸形是连接静脉262和动脉263血管的异常血管缠结261。在所示的实施方案中,本发明的装置沿动脉行进进入畸形,螺旋线圈264部署成与血管261周向接触并缩回以剥脱血管内腔,从而导致血栓形成和血管261阻塞,由此关闭动脉和静脉血液系统之间的分支。
参照图55,图中示出了使用本发明的装置治疗精索静脉机能不全(或精索静脉曲张),精索静脉机能不全是类似于发生在阴囊272的静脉中的静脉曲张的情况,其能引起病人的不育症、疼痛和不适。在所示的实施方案中,本发明的装置沿着左内部精索静脉270行进,螺旋线圈271部署成与静脉270周向接触并缩回以剥脱血管腔,从而导致血栓形成和血管270阻塞,由此阻塞静脉并治疗该病症。
参照图56A至56C,示出了使用本发明的装置的情况,特别是该装置能够自我调节其直径以适应直径不同的血管。线圈由镍钛诺形成,在松弛状态下形成具有大于待治疗血管的直径的螺旋线圈。当线圈在血管中部署时(通常从输送导管部署),导管膨胀以适应血管的圆周,通过线圈的至少一匝对血管的圆周施加向外的径向力。图56A示出了在血管281中部署的螺旋线圈280,其与接近血管的较窄节段282的血管腔周向接触,其中线圈的近端部分的直径自我调节到血管的较小直径。图56B示出了螺旋线圈280已经穿过较窄节段282,并且保持与靠近较窄节段的血管腔周向接触。图53C显示了螺旋线圈向较窄节段的近端移动,并且当血管变宽时自我调节以保持与血管内腔的周向接触。
参照图57A至57C,示出了使用本发明的装置的情况,特别是本发明装置组成部分螺旋线圈如何能够在其被拉动通过一段静脉时在静脉中通过瓣膜:(A)部署的螺旋线圈290附接到控制臂31且与瓣膜292远侧的静脉腔291周向接触;(B)螺旋线圈290通过瓣膜292缩回近端,线圈的直径自我调节以防止线圈被瓣膜小叶钩住;(C)螺旋线圈向较窄节段的近侧移动并且自我调节以维持与瓣膜近侧的血管腔的周向接触。
参照图58A至58B,示出了使用本发明装置的情况,特别是形成本发明的装置的一部分的螺旋线圈如何能够自我调节以行进通过脉管系统300的一节段,该节段逐渐变窄,螺旋线圈301的直径自我调节以保持与脉管内腔的周向接合:(A)部署的螺旋线圈301与血管的宽节段302周向接触;(B)部署的螺旋线圈301与血管的较窄节段303周向接触。
参照图59A至59C,示出了使用本发明的装置的情况,特别是形成本发明的装置的一部分的螺旋线圈如何能够自我调节不同的血管直径并通过迂曲的血管:(A)部署的螺旋线圈310在血管的较窄节段311处与血管内腔周向接触;(B)螺旋线圈310行进通过脉管中的急转弯312,同时保持与脉管腔的周向接触;(C)螺旋线圈310行进通过更大直径的血管中的第二急转弯313,同时保持与血管腔的周向接触。从图中可以看出螺旋线圈如何适应血管的不同的直径,并且即使当其穿过迂曲转弯时,也保持与血管腔的周向接触。
参照图60A和60B,示出了使用本发明的装置的情况,特别是当血管由于血管痉挛而收缩时,形成本发明的装置的一部分的螺旋线圈如何能够自我调节线圈的直径以保持与血管腔的周向结合:(A)在血管痉挛之前,部署的螺旋线圈在直径D的宽血管内在长度I上周向接触;截面A-A示出了在约束压力P下血管内的线圈的轴向视图,约束压力P在线圈内转化为环向力(HF)。通过其开放端设计,该HF使线圈伸长。(B)在血管痉挛期间,部署的螺旋线圈在直径d的收缩血管内在拉伸长度L上周向接触。
参照图62A和62B,使用本发明的装置的以部分地阻塞身体管腔,在所示的实施方案中,专门治疗血容量异常高或血流速高的脉管系统,部分地阻塞血管,从而使血容量或血流正常化。(A)示出了治疗之前的肺动脉330,本发明的装置包括螺旋线圈331、控制臂31和导管构件2,将上述部件部署在动脉中并沿箭头X所指的方向被拉动;(B)示出了在用本发明的装置治疗之后的肺动脉330,内膜增生333部分地阻塞动脉以提供减少的血容量和通过动脉的流量。
理解动脉和静脉系统中血管壁的生物物理特性对于预测疾病进展和评估治疗反应都是重要的。
现在血管内皮中的异常被认为是血管疾病的早期前兆[28]。一种这样的标志是血管响应于机械或化学刺激进行收缩或痉挛的效果。慢性高血压和/或慢性不受控制的血糖水平对内皮层造成损伤,从而比起动脉粥样硬化、动脉狭窄或阻塞,上述症状可以在较早阶段检测到。乙酰胆碱离子电渗是一种结合测量通过血管截面的血流量来测试内皮反应的方法。这些方法已通过实验显示,内皮功能通过饮用加糖饮料和处于慢性高血压状态而被抑制[29]。在血管介入手术期间,目前没有方法来评估动脉粥样硬化性损伤中或附近的内皮细胞功能。因此,需要收集更多关于内皮功能的信息以告知治疗决策和告知预后。例如,在血管内支架放置期间,目前没有方法使医生知道血管成形术期间血管壁响应于扩张的情况。这会导致包括血管破裂、出血和血栓性阻塞的并发症[30]。目前是基于经验和充气后的血管造影外观来测量充气气囊中的气压以及将其充气至标准水平。然而,由于血管壁特征的差异和患者间的差异,诸如血管壁破裂等并发症的发生仍然难以预测。在一个实施方案中,在离散的远点接触血管壁的径向可扩张元件用于测量内皮对化学或机械刺激的反应。机械刺激可以由装置本身的径向力提供,该径向力可以是静态的或者是可经由控制臂调整的。化学刺激可以通过在装置表面上涂覆药物来提供。在一个实施方案中,压电传感器结合到径向膨胀元件中,以测量腔内手术期间线圈上的压力和流动效应。在静脉腔内产生向外径向力的膨胀元件将在血管壁内产生环向力(HF)。这种拉伸HF将在腔内装置内产生相反的压缩环向力。因此,测量装置内的固有压力将作为替代标记,以表征血管壁对伸展的响应。该数据可以被记录和存储在中央控制单元中。该数据可用于进一步的性能增强,包括血管系统中的手术的自动化。该数据也可以被人工分析或通过利用机器学习方法分析以确定血管疾病的预后和验证血管疾病的诊断标记。
以上描述详细示出了本发明的当前优选实施方案。在考虑这些描述后,可预期本领域技术人员会想到在其实践时的许多修改和变型。这些修改和变型都旨包含在所附的权利要求书中。
参考文献
1.Evans CJ,et al.Prevalence of varicose veins and chronic venousinsufficiency in men and women in the general population:Edinburgh VeinStudy.J Epidemiol Community Health 1999
2.O′Donnell TF,et al.Assessment of thrombotic adverse events andtreatment patterns associated with varicose vein treatment J Vasc Surg:Venousand Lym Dis 2015
3.Proebstle T.M,et al.Endovenous treatment of the greater saphenousvein with a 940-nm diode Iaser.Thrombotic occlusion after endoluminal thermaldamage by Iaser-generated steam bubbles.J Vasc Surg 2005
4.Ikponmwosa A,et al.The Impact of Different Concentrations of SodiumTetradecyl Sulphate and Initial Balloon Denudation on Endothelial Cell Lossand Tunica Media Injury in a Model of Foam Sclerotherapy Eur J Vasc EndovascSurg 2010
5.Boersma D,et al,Macroscopic and Histologic Analysis of Vessel WallReaction After Mechanochemical Endovenouis Ablation Using the ClariVein OCDevice in an Animal Model.Eur J Vasc Endovasc Surg 2016
6.Lane TR,et al.Retrograde inversion stripping as a complication ofthe
7.Rice JB,et al.Burden of venouis leg ulcers in the UnitedStates.Joumal of Medical Economics2014
8.Gohel MS,et al.A Randomized Trial of Early Endovenous Ablation inVenous Ulceration.New Eng J Med 2018
9.Kerver AL,et al.The surgical anatomy of the small saphenous veinand adjacent nerves in relation to endovenous thermal ablation.J Vasc Surg2012
10.Whiteley M,et al.Media Damage Following Detergent SclerotherapyAppears to be Secondary to the Induction of Inflammation and Apoptosis:AnImmunohistochemical Study Elucidating Previous HistologicalObservations.Eur J Vasc Endovasc Surg 2016
11.Chen YM,et al.Study on the Sliding Friction of Endothelial CellsCultured on Hydrogel and the Role of Glycocalyx on FrictionReduction.Advanced Engineering Materials 2010
12.Dimitrievska S,et al.New functional tools for antithrombogenicactivity assessment of live surface glycocalyx.Arterioscler Thromb VascBiol.2016
13.Caggiati A,et al.Segmental hypoplasia of the great saphenous veinand varicose disease.Eur J Vasc Endovasc Surg 2004
14.Sanioglu S.et al.Mid-calf level as a puncture site is not safeenough for thermal ablation of the small saphenous vein.SAGE OpenMedicine2017
15.Proebstle T.M.et al.A two-cohort feasibility study on polyglycolicacid yarn implantation for abolition of saphenous vein reflux.J Vasc Surg:Venous and Lym Dis 2018
16.Kwon SH,et al.Transcatheter ovarian vein embolization using coilsfor the treatment of pelvic congestion syndrome.Cardiovasc Intervent Radiol2007
17.Zakharchenko A,et al.Safety and efficacy of superlor rectal arteryembolizationwith partides and metallic coils for the treatment of hemorrhoids(Emborrhoid technique)Diagnostic and Interventional Imaging 2016
18.Owens,C.D.Adaptive changes in autogenous vein grafts forarterialreconstruction:clinicai implications.J.Vasc.Surg.2010
19.Beathard GA,et al.Aggressive treatment of early fistulafailure.Kidney International 2003
20.Oyabu J,et al.Angioscopic evaluation of neointima coverage:sirolimus drug-eluting stent versus bare metal stent.Am Heart J.2006
21.Leyon JJ,et al.Endovascular Embolization:Review of CurrentlyAvailable Embolization Agents.Curr Probl Diagn Radiol,January/February 2014
22.Delaney JW,et al.Patent ductus arteriosus closure using the
23.Avgerinos ED,Chaer RA,Makaroun MS.TYpe ll endoleaks.J Vasc Surg2014
24.Haidry RJ,et al.Duodenal mucosal resurfacing:proof-of-concept,procedural development,and initial implementation in the clinicalsetting.Gastrointestinal Endoscopy 2019
25.Roland BC,et al.Lowileocecal valve pressure is significantlyassociated with small intestinal bacterial overgrowth(SIBO).Dig Dis Sci.2014
26.Akiyama J,et al.Managing Barrett’s esophagus with radiofrequencyablation.Gastroenterology Report 12013
27.Keogh KM,et al.The proposed use of radiofrequency ablation for thetreatment of fistula-in-ano.Med Hypotheses 2016.
28.Boulanger CM,.et al,Highlight on Endothelial Activation andBeyond.Arterioscler Thromb Vasc Biol 2018
29.Loader J,et al.Effects of Sugar-Sweetened Beverage Consumption onMicrovascular and Macrovascular Function in a Healthy Population.ArteriosclerThromb Vasc Biol2017
30.Gruberg L,et al.Incidence,management,and outcome of coronaryartery perforation during percutaneous coronary intervention.Am J Cardiol2000
- 用于剥脱身体管腔的装置
- 用于促进血凝块形成的栓塞装置和从身体管腔取回该装置的方法
