皂苷衍生物在制备用于治疗和预防溃疡性结肠炎药物中的用途、制备方法及应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及生物医学领域,尤其涉及皂苷衍生物在制备用于治疗和预防溃疡性结肠炎药物中的用途、制备方法及应用,是通过植物化学的手段从白头翁[Pulsatillachinensis(Bunge)Regel]干燥根中分离得到的28个齐墩果烷型皂苷衍生物,此类化合物在抑制MLCK通路激活,预防与治疗溃疡性结肠炎的应用。
背景技术
溃疡性结肠炎(Ulcerative colitis,UC)是一种以腹痛、腹泻、直肠出血为主要症状的慢性复发性炎症性肠道疾,严重影响患者的工作能力和生活质量。虽然溃疡性结肠炎的治疗取得了很大的进展,但其发病机制尚不清楚,包括遗传、环境或免疫因素的积累。目前治疗UC的药物疗法包括氨基水杨酸酯类药物(如美沙拉嗪,MLZ)、糖皮质激素和免疫抑制试剂,但上述治疗均不能帮助患者摆脱长期用药所带来的痛苦和严重的副作用。此外,UC的高复发率和严重并发症与结直肠癌的高风险相关。
UC发病起因于结肠粘膜上皮屏障受到损伤,上皮细胞层渗透性增加,免疫原性物质进入肠壁引发一系列过度免疫应答反应。DSS诱导的小鼠UC模型是用于UC发病机制和药物研究的经典模型。在UC动物模型中典型的病理学变化为体重降低、结肠组织缩短、DAI评分升高、长组织上皮屏障损伤以及结肠组织TNF-α异常高表达。肠上皮屏障包括上皮单层细胞和细胞间起调节屏障渗漏的紧密连接结构,在肠道稳态环境中起到了关键作用。研究表明上皮细胞肌球蛋白轻链激酶(myosin light chain kinase,MLCK)与调节上皮屏障通透性密切相关。MLCK被激活后一方面使肌球蛋白轻链(myosin light chain,MLC)磷酸化,引发肌细胞收缩,增加上皮屏障通透性;另一方面MLCK也参与调控claudin-2,occludin,ZO-1等紧密连接结构。研究发现,在UC肠组织中长链MLCK上调,启动下游长链MLCK的转录,上调claudin-2表达破坏细胞间紧密连接结构和肠上皮屏障,加重UC的进程。因此,抑制MLCK信号通路是发现新型UC治疗药物的关键靶点。
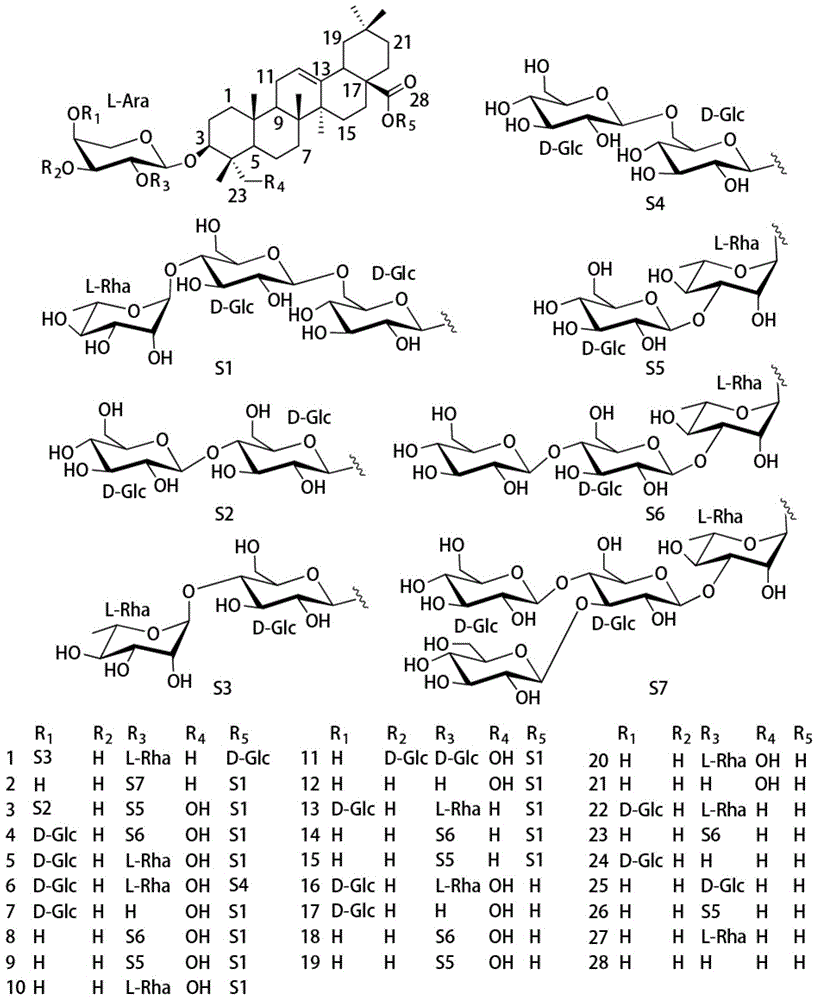
中药白头翁是毛茛科植物白头翁属植物白头翁(Pulsatilla chinensis(Bunge)Regel)的干燥根。白头翁中的齐墩果烷型皂苷根据苷元可以分为齐墩果酸(Oleanolicacid)和常春藤皂苷元(hederagenin)两种类型;根据C-3和C-28上是否具有寡糖基侧链分为3-寡糖基皂苷、28-寡糖基皂苷和3,28-双寡糖基皂苷三种类型。此外,寡糖基侧链上单糖单元的种类、连接位置、和糖链的长度的多样性进一步丰富了白头翁皂苷的结构多样性。苷元和糖基侧链的差异使得不同类型的白头翁皂苷具有不同的活性,如白头翁皂苷A显示了较好的抗癌活性(CN102133220A),但未显示抗UC活性。
本发明所涉及的化合物1-9,11-16其治疗UC的活性为首次发现,其中化合物1,2和3为新化合物。
本发明首次发现3,28-双寡糖基齐墩果酸皂苷是白头翁治疗UC的主要药效组分,能够缓解UC小鼠结肠炎症状,下调MLCK信号通路,修复肠上皮屏障。
发明内容
本发明是从白头翁[Pulsatilla chinensis(Bunge)Regel]干燥根中提取分离得到的齐墩果烷型皂苷衍生物,经药理实验研究表明,这类化合物对UC具有显著的治疗作用。本发明的目的之一是提供具有抗UC活性的齐墩果烷型皂苷衍生物及其制备方法。本发明的另一个目的在于基于抗UC活性成分提供活性成分含量为50.0~99.9%(重量百分比)的白头翁提取物及其制备方法。本发明的再一个目的在于提供所述齐墩果烷型皂苷衍生物和/或白头翁提取物的用途,包括所述齐墩果烷型衍生物和/或白头翁提取物在制备预防和治疗UC药物中的应用。
目前关于白头翁抗UC的药效成分研究,仅白头翁皂苷B4(CN112107586A)和白头翁皂苷B5(CN108451964A)被公开报道。白头翁皂苷B4与本专利涉及的化合物母核骨架不同,白头翁皂苷B4为羽扇豆烷型三萜骨架,本专利涉及的化合物为齐墩果烷型三萜骨架。白头翁皂苷B5是以常春藤皂苷元为苷元的化合物,与本专利涉及的以齐墩果酸为苷元的化合物1,2,13-15的苷元结构和糖基取代基均不相同。另外,本专利涉及1种以常春藤皂苷元为苷元的新化合物3与白头翁皂苷B5的糖基取代基完全不同。白头翁皂苷苷元和糖基取代基的不同显著影响化合物的活性,如同样以常春藤皂苷元和齐墩果酸为苷元的白头翁皂苷化合物16-28在本研究中未显示抗UC活性。
本发明的技术方案如下:一种皂苷衍生物在制备用于治疗和预防溃疡性结肠炎药物中的用途,所述皂苷衍生物为齐墩果烷型三萜皂苷类化合物,其结构通式为式I所示化合物;
其中:R1为糖基或氢,R2为糖基或氢,R3为糖基或氢,R5为糖基或氢,R1,R2,R3和R5相同或不同;糖基为单糖基或2-4个单糖基形成的寡糖基;R4为羟基或氢。
上述的齐墩果烷型三萜皂苷类化合物,主要是从白头翁[Pulsatilla chinensis(Bunge)Regel]干燥根中分离得到的28个齐墩果烷型三萜皂苷类化合物,其化学结构式可以具体如下:
所述齐墩果烷型三萜皂苷类化合物选自化合物1-9,11-15或选自:化合物1-3,5,13-15,其化学结构式如下:
所述化合物1,2,13,14,15包含于白头翁中药提取物,以白头翁中药提取物总重量为100%计,所述白头翁中药提取物含有化合物1,2,13,14,15中任意一种或2种以上,且重量占比白头翁中药提取物总重量的50%至99.9%。
一种白头翁中药提取物的制备方法,包括以下步骤:
1)取白头翁干燥根,用体积浓度为20-95%的乙醇水溶液提取,提取液浓缩后得到粗提物,将粗提物经过大孔树脂柱层析,洗脱液为体积浓度0、20%、50%、70%、100%的乙醇水溶液,分别进行洗脱;弃去纯水洗脱液,收集其余各部位洗脱液,浓缩得20%乙醇水溶液洗脱部分P20、50%乙醇水溶液洗脱部分P50、70%乙醇水溶液洗脱部分P70S和乙醇水溶液洗脱部分P100;
2)P70S组分载入MCI小孔树脂色谱柱,用纯净水冲洗至洗脱液无色,用50%甲醇冲洗2个柱体积后,用70%甲醇冲洗5个柱体积,收集70%甲醇洗脱液,减压干燥后得到白头翁中药提取物P70。
3)基于步骤1)和步骤2)所得组分,进一步进行分离纯化
将上述组分P50经正相硅胶柱色谱梯度洗脱,得到组分P50-I、P50-II和P50-III。组分P50-I经葡聚糖凝胶柱色谱,反相色谱柱和半制备液相色谱纯化得到化合物11和12。P50-II组分经葡聚糖凝胶柱色谱和反相色谱柱分离得到组分P50-IIA和P50-IIB。组分P50-IIA通过半制备液相色谱纯化得到化合物9和10。组分P50-IIB经半制备液相色谱纯化得到化合物6,7和8。组分P50-III经葡聚糖凝胶柱色谱、反相柱色谱和半制备液相色纯化得到化合物3,4和5。组分P70S经正相硅胶柱色谱梯度洗脱得到P70S-I和P70S-II两个组分,组分P70S-I经半制备液相色谱纯化得到化合物1和15;组分P70S-II经半制备液相色谱纯化得到化合物2,14和13。组分P100经正相硅胶柱色谱梯度洗脱得到馏分P100-I~V;组分P100-I经正相和反相柱色谱分离得到化合物28,26和27;P100-II通过正相硅胶柱色谱和半制备液相色谱纯化得到化合物23和一组混合物24/25;组分P100-III经过反相柱色谱纯化得到化合物21和22。组分P100-IV通过葡聚糖凝胶柱色谱和半制备液相色谱分离纯化得到化合物20,19,18和化合物17。组分P100-V经过反相柱层析后,经半制备液相色谱反复纯化得到化合物16。
上述的大孔树脂可以为本领域常规的大孔树脂,譬如D101,XAD16,XAD1600等树脂。
上述制备方法中,在分离纯化步骤中,所用正相硅胶型号为100-200目和(或)300-400目,并用二氯甲烷-甲醇-水-甲酸系统梯度洗脱(体积比4:1:0.1:0.1~1:1:0.2:0.1)。
上述制备方法中,在分离纯化步骤中,反相色谱所用填料为ODS-18,半制备高效液相色谱柱填料为ODS-18,洗脱液为甲醇-水体系(体积比3:7~7:3)。
本发明的有益效果:本发明对所得的三萜皂苷及由活性皂苷组成的不同药效组分进行了体内抗溃疡性结肠炎活性研究,经药理实验研究表明,所述3,28-双寡糖基常春藤皂苷化合物3~12显示了较弱的抗UC活性;3,28-双寡糖基齐墩果酸三萜皂苷化合物1,2,13~15及由其组成的药效组分P70(抗UC活性白头翁提取物)对DSS诱导的溃疡性结肠炎小鼠具有显著的治疗效果,其活性明显优于3,28-双寡糖基常春藤皂苷类化合物。因此可用治疗溃疡性结肠炎,用于制备治疗和预防溃疡性结肠炎的药物。
附图说明
图1(A)为药效组分P50的HPLC指纹图谱;图1(B)P70的HPLC指纹图谱;图1(C)P100的HPLC指纹图谱。
图2:化合物1-28的结构图。
图3:化合物1的
图4:化合物1的
图5:化合物1的HSQC谱。
图6:化合物1的HMBC谱。
图7:化合物1的COSY谱。
图8:化合物1的TCOSY谱。
图9:化合物2的
图10:化合物2的
图11:化合物2的HSQC谱。
图12:化合物2的HMBC谱。
图13:化合物2的COSY谱。
图14:化合物2的TCOSY谱图。
图15:化合物3的
图16:化合物3的
图17:化合物3的HSQC谱。
图18:化合物3的HMBC谱。
图19:化合物3的COSY谱。
图20:化合物3的TCOSY谱
图21(A)-图21(F):各提取物组分对UC小鼠生理变化的影响。图21(A)各组小鼠每天的体重变化率;图21(B)各组小鼠第9天的体重变化率,(体重变化率=当日体重/第0天的体重*100%);图21(C)各组小鼠DAI评分;图21(D)各组小鼠第8天的DAI评分;图21(E)各组小鼠的结肠照片;图21(F)各组小鼠的结肠长度。***P<0.001,**P<0.01,*P<0.05,n=8。
图22(A)和图22(B)Western blotting评价各提取物组分对UC小鼠结肠组织中TNF-α表达水平的影响;图22(C)H&E染色评价P70对UC小鼠结肠上皮损伤的保护作用,图例表示100μm。***P<0.001,**P<0.01,*P<0.05,n=8。
图23(A)-图23(F):化合物1-3,5,13-15对UC小鼠生理变化的影响。图23(A)化合物1对UC小鼠体重变化率的影响;图23(B)化合物1对UC小鼠DAI评分的影响;图23(C)化合物1对UC小鼠结肠长度的影响,与空白组比较
图24(A)-图24(F):图24(A)H&E染色评价化合物1对UC小鼠结肠上皮损伤的修复作用,n=8图例表示100μm;图24(B)-图24(F)Western blotting评价化合物1对MLCK通路的调控作用,与空白组比较
具体实施方式
下面结合实施方式对本发明的实施方案进行详细说明,但下列实施方式和实例仅用于说明本发明,而不应视为限制本发明的范围。
实施例1制备白头翁药效组分P20、P50、P70和P100;
1.制备白头翁提取物
白头翁干燥根(5kg)粉碎,用原料重量10-30的体积浓度为70%的乙醇水溶液冷浸24小时,60℃回流提取6小时,此步骤重复2次。合并提取液,减压浓缩至干燥,既得白头翁总提取物PE(3kg)。
2.制备白头翁药效组分P50、P70和P100
将上述提取物于6L纯净水混悬,过滤后经大孔树脂色谱柱吸附,并用0、20%、50%、70%、100%乙醇梯度洗脱,每个梯度冲洗大约3个柱体积。弃去纯水洗脱部分,收集其余各部位洗脱液,浓缩,干燥得药效组分P20(260g)、P50(800g)、P70S(500g)和P100(220g)。
将上述组分P70S混悬于纯净水,载入MIC色谱柱(每100mL MIC填料的上样量为0.25g/mL P70S水溶液15mL),用纯净水冲洗至洗脱液无色,用体积浓度为50%的甲醇水溶液冲洗2个柱体积后,用体积浓度为70%的甲醇水溶液冲洗5个柱体积,收集70%甲醇洗脱液,减压浓缩,干燥后得到淡黄色粉末,即为抗UC活性白头翁提取物P70用于下述指纹图谱和体内活性研究。
药效组分P50、P70和P100的HPLC指纹图谱如图1所示。图中编号为峰号,阴影所示为该部位的特征化合物。如图1(A)所示指纹图谱表明,组分P50主要由3,28-双寡糖基常春藤皂苷类成分化合物3-12组成,面积归一化法测得其在该组分中含量为77.72%(表1);如图1(B)所示P70由3,28-双寡糖基齐墩果酸皂苷类成分1,2,13-15组成,面积归一化法测得其在该组分中含量为95.93%(表2);如图1(C)所示P100组分主要含有3-单寡糖基常春藤皂苷和3-单寡糖基齐墩果酸皂苷类成分16-28组成,面积归一化法测得其在该组分中含量为88.82%(表3)。
表1.药效部位P50各成分归属和含量(面积归一化)
表2.药效部位P70各成分归属和含量(面积归一化)
表3.药效部位P100各成分归属和含量(面积归一化)
实施例2.制备白头翁皂苷衍生物1-28
1、单体化合物分离纯化
(1)上述组分P50(20g)经正相硅胶(100-200目)柱色谱,二氯甲烷-甲醇-水-甲酸系统梯度洗脱(4:1:0.1:0.1-1:1:0.2:0.1),得到亚组分P50-I(1.0g)、P50-II(8.0g)和P50-III(9.0g)。
(2)组分P50-I(1.0g)经葡聚糖凝胶柱色谱(Sephadex LH-20,40%甲醇)和反相色谱柱(ODS-18,53%MeOH)洗脱后,通过半制备液相色谱(ODS-18,25×300mm,10um)以60%甲醇为流动相,纯化得到化合物11(13mg)、12(19mg)。
(3)组分P50-II(4.0g)经葡聚糖凝胶柱色谱(Sephadex LH-20,40%甲醇)、反相色谱柱(ODS-18,60%MeOH)纯化得到化合物9(93mg)、10(20mg);经半制备液相色谱(ODS-18,25×300mm,10um),以55%甲醇为流动相,纯化得到化合物6(18mg)、7(100mg)、8(96mg)。
(4)组分P50-IV(5.0g)经葡聚糖凝胶柱色谱(Sephadex LH-20,40%甲醇)洗脱后,经反相柱色谱(ODS-18,30%MeOH)纯化得到化合物3(34mg),4(25mg)和5(1.6g)。
(5)上述药效组分P70S(10g)经正相硅胶柱色谱(100-200目),通过二氯甲烷-甲醇-水-甲酸系统梯度洗脱(4:1:0.1:0.1-4:1:0.2:0.1,v/v),得到P70S-I(5.0g)和P70S-II(4.0g)两个亚组分。
(6)组分P70S-I经半制备液相色谱(ODS-18,25×300mm,10um,60% MeOH)纯化得到化合物1(1.1g)和15(800mg)
(7)组分P70S-II经半制备液相色谱(ODS-18,25×300mm,10um,60% MeOH)纯化得到化合物2(50mg),13(1.2g)和14(1.3g)。
(8)上述组分P100(500g)经正相硅胶柱色谱(100-200目),C:M:W:A系统梯度洗脱(4:1:0.1:0.1-4:1:0.2:0.1,v/v)得到亚组分P100-I~V。
(9)组分P100-I经正向硅胶柱色谱(5×80cm,300-400目,C:M:W 6:1:0.1)分离得到化合物28(54mg),经反相ODS-18柱色谱(5×50cm,65% MeOH)纯化得到化合物26(53mg)和27(30mg)。
(10)组分P100-II(3.1g)通过正相硅胶柱色谱(300-400目,C:M:W 6:1:0.1)、反相ODS-18柱色谱(70%甲醇)以及半制备液相色谱(ODS-18,25×300mm,10um,68% MeOH)纯化得到化合物23(82mg)和一组混合物24/25(33mg)。
(11)组分P100-III(800mg)经过ODS-18柱色谱(70% MeOH)纯化得到化合物21(30mg)和22(106mg)。
(12)组分P100-IV通过葡聚糖凝胶柱色谱(Sephadex LH-20)分离后,通过半制备液相色谱(ODS-18,65% MeOH)纯化得到化合物20(80g),19(61mg),18(88mg)和17(54mg)。
(13)组分P100-V(5.0g)经过ODS-18反相柱层析,60%甲醇洗脱后,经半制备液相色谱反复纯化得到化合物16(1.3g)。
2.单体化合物结构鉴定
通过1D NMR、2D NMR、MS、IR、旋光等坚定了新化合物1-3的结构(图2),命名为pulsatilloside P(1),pulsatilloside Q(2),pulsatilloside R(3)。通过1D NMR和MS数据,结合理化性质与文献报道一致,鉴定了已知化合物的结构(图2),已知化合物为pulsatilloside F(4),pulsatilla saponin H(5),pastuchoside C(6),leonloside D(7),yemuoside YM
化合物1:白色粉末;
化合物2:白色粉末;
化合物3:白色粉末;
化合物4:
化合物5:
化合物6:
化合物7:
化合物8:
化合物9:
化合物10:
化合物11:
化合物12:
化合物13:
化合物14:
化合物15:
化合物16:
化合物17:
化合18:
化合物19:
化合物20:
化合物21:
化合物22:
化合物23:
化合物24:
化合物25:
化合物26:
化合物27:
化合物28:
测试例1总提取物(PE)活性组分P20、P50、P70抗UC活性实验
1实验方法
将健康C57BL/6J雄性小鼠(22±2g)随机分组,每组8只。采用硫酸葡聚糖(3%DSS)诱导小鼠产生溃疡性结肠炎,通过疾病活动指数(DAI)、体重变化、结肠长度变化、结肠组织病理变化、结肠组织中炎症因子TNF-α的表达水平等指标来评价不同给药处理对溃疡性结肠炎的治疗作用。
1.1造模和给药
1)空白对照(CON):在全部实验周期自由饮纯净水,不做任何药物处理。
2)模型组(DSS):自由饮纯净水3天后,将纯净水更换为3%的DSS溶液(每隔一天重新配制),自由饮用DSS溶液开始为第0天,自由饮用DSS溶液7天后(天0–天7),重新更换为纯净水至实验结束(天9)。
3)白头翁活性组分治疗组:每组小鼠通过灌胃给药的方式给予200mg/kg/day剂量的P20,P50,P70,P100和PE,给药至实验结束;给药3天后开始造模,造模方法和周期同模型组。
4)阳性药组:选用美沙拉嗪(MLZ)作为阳性药(购买自Sigma Chemical Co.),通过灌胃给药的方式给予250mg/kg/day剂量的美沙拉嗪,给药至实验结束;给药3天后开始造模,造模方法和周期同模型组。
1.2评价指标:
1)体重变化率:造模开始后,每天的同一时间称量并记录各组小鼠的体重;造模开始时的体重(天0)作为初始体重,以体重变化率=(当日体重/初始体重)×100%作为比重变化的评价指标
2)疾病活动指数(DAI):从造模开始后第二天(天2)开始记录各组小鼠的体重、血便情况以及粪便性状。其中小鼠便隐血评分按照贝索生物匹拉米洞半定量检测法试剂盒步骤进行,没两天测试一次,因此每两天计算一次DAI评分。疾病活动指数(DAI)计算方式为:小鼠体重下降率(每日体重/造模开始的体重)、便隐血及粪便性状各自打分并计算平均值,具体评分细则如表4所示:
表4.DAI评分标准
3)结肠长度:造模结束两天后(天9),将各组小鼠处死,迅速取出结肠,拍照并测量其长度。
1.3结肠组织H&E染色:取后端结肠组织0.5cm,经4%多聚甲醛固定、脱水后,将结肠组织包埋在石蜡中,使用石蜡切片机进行制片。将石蜡切片经脱蜡、水化后,根据制造商的说明,将石蜡切片用苏木精和伊红染色(H&E)。封片后,使用显微成像系统观察和记录结肠组织的病理变化。
1.4Western blotting分析:造模结束两天后(天9),将各组小鼠处死,迅速取出结肠。测量长度后,在结肠末端1厘米左右的位置取下适量结肠组织(约30mg),并用生理盐水清洗干净。加入一定量(700μL)的蛋白裂解液,使用高速匀浆机和超声破碎仪在4℃下匀浆90s;匀浆在4℃下静止裂解30min。将匀浆通过12000rpm离心30min,吸取上清液即为蛋白;经BCA法测蛋白浓度,加入适量5×SDS Loding buffer,沸水煮10min,待冷却至室温后进行Western blotting分析。将蛋白转移到PVDF膜上之后,用anti-TNF-α作为一抗进行孵育;与相应的二抗孵育后,加入ELC发光液,使用凝胶成像进行图像采集,最后利用Image Lab软件对蛋白条带进行定量分析。
2实验结果
采用DSS诱导的UC模型小鼠对总提取物PE以及P20、P50、P70和P100组分的抗UC活性进行评价。如图21所示,与对照组相比,DSS组小鼠的体重显著降低(图21(A)、图21(B)),疾病活性指数(DAI)显著升高(图21(C)、图21(D)),结肠明显缩短(图21(E)、图21(F))。与DSS组相比,PE、P50和P70组分的小鼠体重和结肠长度显著增加,DAI评分也均有不同程度的降低;P20和P100组并没有显著改善上述指标(图21(A)-图21(F));P70处理组治疗溃疡性结肠炎活性明显优于PE处理组或P50处理组(p<0.05),PE和P50处理组只显示了较弱的抗UC活性。
TNF-α高表达是溃疡性结肠炎的病理学指标之一。采用Western blotting测定了结肠组织中TNF-α的表达水平。如图22所示,与对照组相比,DSS诱导的UC小鼠结肠组织中TNF-α的表达水平明显升高。与此同时,P50或P70处理对DSS诱导的UC小鼠结肠组织中TNF-α的表达有明显的抑制作用。值得注意的是,在UC小鼠中,P70对TNF-α表达的抑制作用显著优于P50处理组(p<0.05);PE、P20和P100对TNF-α表达的影响无统计学意义(p>0.05,图22(A)、图22(B))。这些结果表明P70组分是白头翁提取物治疗UC的关键活性物质。
为了进一步验证P70的抗UC能力,我们用H&E染色检测了结肠组织的病理变化。对照组结肠黏膜完好,腺体分布规律,隐窝结构完整,杯状细胞丰富(图22(C))。DSS的诱导使结肠黏膜严重受损,出现肌水肿和炎症浸润(图22(C)),而P70的治疗明显改善了上述病理变化。
3实验结论
本测试例研究结果表明总提取物PE和各个提取物组分之间抗UC活性存在明显差异。在相同给药剂量下P100未显示抗UC活性,PE、P50和P70显示了抗UC活性,P70活性明显优于P50和PE,P50和PE活性接近。表明不同化合物组分具有不同的活性。由实施例1可知,组分P50主要由3,28-双寡糖基常春藤皂苷类成分化合物3-12组成,P70由3,28-双寡糖基齐墩果酸皂苷类成分1,2,13-15组成,P100组分主要含有3-单寡糖基常春藤皂苷和3-单寡糖基齐墩果酸皂苷类成分16-28组成。本测试例研究结果表明3,28-双寡糖基齐墩果酸皂苷类成分抗UC活性明显优于3,28-双寡糖基常春藤皂苷类成分;28位以游离羧基形式存在的皂苷未显示抗UC活性。上述活性结果表明,苷元种类和寡糖取代基的差异显著影响该类化合物抗UC活性。因此本发明的白头翁提取物P70组分可用于抗UC的用途,可以用于制备预防和治疗UC的药物中。
测试例2单体化合物抗UC实验
1实验方法
实验方案和评价指标参见测试例1,空白对照(CON)、模型组(DSS)和阳性药组给药方法参见测试例1;白头翁活性单体治疗组:每组小鼠通过灌胃给药的方式给予150mg/kg/day剂量的活性单体化合物1,2,3,5,13,14和15给药至实验结束;给药3天后开始造模,造模方法和周期同模型组。
2实验结果
采用DSS诱导的UC模型小鼠对单体化合物1,2,3,5,13,14和15的抗UC活性进行评价。如图23所示,与对照组相比,DSS组小鼠的体重显著降低(图23(A)、图23(D)),疾病活性指数(DAI)显著升高(图23(B)、图23(E)),结肠明显缩短(图23(C)、图23(F))(P<0.01)。与DSS组相比,化合物1,2,13,14和15处理组的小鼠体重和结肠长度显著增加,DAI评分均明显降低(P<0.01);化合物3和5只显示了较弱的抗UC活性;化合物1,2,13,14和15抗UC活性明显优于化合物3和5(P<0.01)。
3实验结论
化合物1,2,13,14和15均能够明显改善UC小鼠病理学指标,能够作为预防和治疗UC的用途,能过用于制备UC治疗药物。结合P70的活性作用,和其中所含化合物的种类,可以明确其活性主要源于化合物1,2,13,14和15。
测试例3化合物1对UC对小鼠肠组织病理学和TNFα/NF-κB/MLCK信号同路作用
1实验方法
1.1实验方案和结肠组织H&E染色参见测试例1。空白对照(CON)、模型组(DSS)和阳性药组给药方法参见测试例1;单体化合物1治疗组:每组小鼠通过灌胃给药的方式给予75mg/kg/day和150mg/kg/day剂量的活性单体化合物1给药至实验结束;给药3天后开始造模,造模方法和周期同模型组。
1.2Western blotting分析:方法见测试例1。电泳结束后将蛋白转移到PVDF膜上,用anti-claudin-2,anti-TNF-α,anti-GAPDH(Cell Signaling Technology,Beverly,MA),anti-long MLCK和anti-p-MLC(Abcam,Cambridge,MA)作为一抗进行孵育;与相应的二抗孵育后,加入ELC发光液,使用凝胶成像进行图像采集,最后利用Image Lab软件对蛋白条带进行定量分析。
2实验结果
我们用H&E染色检测了结肠组织的病理变化。对照组结肠黏膜完好,腺体分布规律,隐窝结构完整,杯状细胞丰富(图24(A))。DSS的诱导使结肠黏膜严重受损,出现肌水肿和炎症浸润(图24(A)),而化合物1处理后明显改善了上述病理变化(图24(A))。随后,通过Western blotting检测结肠组织中claudin-2蛋白的表达,评价了化合物1对结肠上皮紧密连接结构的影响。如图24(B)和图24(C)所示,与DSS组相比,化合物1明显下调了claudin-2的表达。鉴于TNF-α在溃疡性结肠炎中的病理学特征,以及长链肌球蛋白轻链激酶(MLCK)信号通路在UC肠上皮屏障障碍中的重要作用,我们检测了MLCK通路中关键蛋白的表达水平。Western blotting实验表明,化合物1处理显著下调UC小鼠结肠组织中TNF-α和MLCK的表达水平,抑制了MLC的磷酸化(图24(B)、图24(D)-图24(F))。
3实验结论
这些体内实验结果表明,化合物1可以明显抑制UC小鼠结肠组织病理学损伤,抑制TNF-α的表达;通过抑制MLCK信号通路的激活,下调claudin-2的表达,恢复杯状细胞丰度,改善UC小鼠肠道上皮屏障功能。
- 一类环状内酯类化合物在制备用于预防和/或治疗亨廷顿病的药物中的用途
- 用于制备治疗肝癌药物的芳基钌配合物及其制备方法和用途
- 一种吡唑并嘧啶衍生物及其制备方法和在药物制备中的用途
- 一种用于治疗过敏性鼻炎的药物组合物及其制备方法和用途
- 一种6-取代平板霉素衍生物、制备方法、药物制剂及用途
- 新的嘧啶衍生物和它们在治疗中的用途及嘧啶衍生物在制备用于预防和/或治疗阿尔茨海默病的药物中的用途
- 延龄草甾体总皂苷及其中甾体皂苷类化合物在制备治疗溃疡性结肠炎药物中的应用
