用于解析复杂、多步骤抗体相互作用的方法
文献发布时间:2024-04-18 19:44:28
本发明属于抗体表征领域。更详细地,本文提供了一种用于使用表面等离子体共振并考虑涂层密度和相互作用类型来表征抗体-FcRn相互作用的新方法。利用这种新方法,提供了Fc区以及抗体对FcRn亲和力的改进确定。
背景技术
IgG半衰期由细胞再循环机制介导,该机制依赖于与FcRn的pH依赖性结合。虽然已明确FcRn的核心相互作用位点位于CH2-CH3肘区,但有趣的新数据强烈表明Fab臂也有助于受体结合。理论上,IgG分子具有多个FcRn结合位点。实验数据还支持IgG抗体可变结构域内的氨基酸变化可以极大地调节细胞转运、FcRn结合和半衰期。因此,需要充分理解IgG-FcRn相互作用的复杂多步骤化学计量。
SPR(表面等离子体共振)是一种基于生物传感器的技术,以测量实时蛋白质-蛋白质相互作用。SPR技术已成为生物制药研发领域的标准工具(参见,例如,M.A.Cooper,Nat.Rev.Drug Dis.1(2002)515-528;D.G.Myszka,J.Mol.Recognit.12(1999)390-408;R.L.Rich and D.G.Myszka,J.Mol.Recognit.13(2000)388-407;D.G.Myszka andR.L.Rich,Pharm.Sci.Technol.Today 3(2000)310-317;R.Karlsson and A.Faelt,J.Immunol.Meth.200(1997)121-133),并且通常用于确定大分子相互作用的速率常数。确定分子相互作用的缔合和解离动力学的能力提供了关于复合物形成机制的详细见解(参见,例如,T.A.Morton,D.G.Myszka,Meth.Enzymol.295(1998)268-294)。该信息正在成为单克隆抗体和其他生物制药产品的选择和优化过程的重要组成部分(参见,例如,K.Nagataand H.Handa,in Real-time analysis of biomolecular interactions,Springer,2000;R.L.Rich and D.G.Myszka,Curr.Opin.Biotechnol.11(2000)54-61;A.C.Malmborg andC.A.Borrebaeck,J.Immunol.Meth.183(1995)7-13;W.Huber and F.Mueller,Curr.Pharm.Des.12(2006)3999-4021)。此外,SPR技术允许确定例如抗体结合靶标的结合活性(结合能力)。
十多年来,表面等离子体共振(SPR)已被用于研究抗体-抗原或抗体-受体相互作用,例如以确定抗体与人新生儿Fc受体(FcRn)的pH依赖性结合亲和力,从而理解其对抗体再循环效率的贡献。鉴于两个结合配偶体的复杂性,根据定义,不可能建立可以应用单一1:1Langmuir动力学拟合进行评估的SPR相互作用测定。
已使用多种策略通过利用FcRn补救途径(包括FcRn增强/废除突变、Fc融合蛋白和FcRn结合的竞争性抑制)来调节治疗性蛋白质和内源性抗体的血清持久性。然而,治疗性IgG可能具有非常不同的半衰期,该半衰期似乎与huFcRn亲和力无关(Giragossian等人Curr.Drug Metab.14(2013)764-790)。
WO 2013/181087报道了具有改善的体内稳定性、药代动力学和功效的多聚体复合物。
US2017/0037121报道了包含第一多肽和第二多肽的多肽,该第一多肽和第二多肽各自在N末端到C末端方向上包含免疫球蛋白铰链区的至少一部分,该免疫球蛋白铰链区包含一个或多个半胱氨酸残基、免疫球蛋白CH2结构域和免疫球蛋白CH3结构域,其中i)该第一和第二多肽包含突变H310A、H433A和Y436A,或ii)该第一和第二多肽包含突变L251D、L314D和L432D,或iii)该第一和第二多肽包含突变L251S、L314S和L432S。
US2020/0353078报道了分离的IL-33蛋白、其活性片段,以及针对IL-33蛋白的抗体、其抗原结合片段。还提供了调节细胞因子活性的方法,例如用于治疗免疫和炎性疾病的目的。
Vaughn,D.E.等人报道了新生儿Fc受体的pH依赖性抗体结合的结构基础(Structure 6(1998)63-73)。
因此,需要分析抗体-FcRn相互作用,尤其是以技术更先进的方式来解决潜在的复杂性。
发明内容
虽然表面等离子体共振(SPR)通常用于测量IgG与重组新生儿Fc受体(FcRn)的结合,但解释数据以获得可靠的结合动力学并不简单明了。本文报道了一种新的用于适当的FcRn结合评估的基于SPR的FcRn结合测定。该测定可以与合适的可视化相结合,以获得抗体的Fc区和Fab臂对FcRn结合动力学的贡献的深入理解。
也就是说,本文报道了一种新的基于SPR的抗体-FcRn结合测定,该测定解释了用于抗体-FcRn结合评估的单独的Fab-FcRn和Fc区-FcRn相互作用。本发明的这个方面至少部分基于以下发现:pH依赖性FcRn涂层对固相诸如例如SPR芯片的影响。
本文报道了一种用于确定抗体-FcRn相互作用的方法,其中
-FcRn固定表面是SPR芯片,其中捕获基团直接附着于固体表面(层),并且其中该(固体)表面不包含右旋糖酐基质/基团(不是由右旋糖酐衍生),
-该捕获试剂以分离的、即非二聚化或多聚化的形式提供,即该捕获试剂仅具有针对分析物(靶分子)的单一结合位点,因此该捕获试剂为单体的,并且
-固定中使用的运行缓冲液控制固定期间该捕获试剂的聚集状态,即该捕获试剂保持单体形式还是作为二聚体/多聚体。
本发明的一个方面是一种用于确定抗体-FcRn相互作用的方法,该方法包括以下步骤:
a)将FcRn固定在适合于表面等离子体共振测量的固体表面上,
b)将包含不同浓度的抗体的溶液单独应用于步骤a)中获得的固体表面,并针对每种浓度来确定抗体-FcRn相互作用的缔合速率常数和解离速率常数,
c)用在步骤b)中获得的速率来确定抗体-FcRn相互作用的K
其中经固定的FcRn为单体FcRn,
其中(使用直接(附着)在所述固体表面上的官能(捕获)基团)固定该单体FcRn,
其中固体表面不含支链葡聚糖,并且
其中FcRn的固定在pH 7至pH 8的pH值下实现/完成。
在上述以及下述实施方案和方面的一个实施方案中,FcRn的固定在约pH 7.4的pH值下实现/完成。
在上述以及下述实施方案和方面的一个实施方案中,FcRn以50至150响应单位(RU)的密度固定。在一个优选的实施方案中,FcRn以80至120RU的密度固定。
在上述以及下述实施方案和方面的一个实施方案中,FcRn为单链FcRn(scFcRn)。在一个实施方案中,scFcRn为通过(GGGGS)
在上述以及下述实施方案和方面的一个实施方案中,使用胺偶联以约1pg或更高、在某些实施方案中约10pg或更高、在某些实施方案中约50至150pg(sc)FcRn/mm
在上述以及下述实施方案和方面的一个实施方案中,使用生物素/链霉亲和素偶联以约1pg或更高、在某些实施方案中约10pg或更高、在某些实施方案中约50至150pg(sc)FcRn/mm
在上述以及下述实施方案和方面的一个实施方案中,使用在pH值为约pH 7.4的10mM HEPES缓冲液中包含浓度为约250μg/ml的FcRn的溶液完成固定。
在上述以及下述实施方案和方面的一个实施方案中,步骤b)中应用于固定的FcRn的抗体溶液包含i)150mM NaCl,或ii)400mM NaCl,或iii)400mM NaCl和20%(w/w)乙二醇。
在上述以及下述实施方案和方面的一个实施方案中,i)使用包含150mM NaCl的抗体溶液,和ii)使用包含400mM NaCl的抗体溶液或者/以及使用包含400mM NaCl和20%(w/w)乙二醇的抗体溶液执行步骤b)。在一个实施方案中,包含400mM NaCl的溶液或/和包含400mM NaCl和20%(w/w)乙二醇的溶液减少或消除Fab-FcRn相互作用。在一个实施方案中,包含400mM NaCl的溶液或/和包含400mM NaCl和20%(w/w)乙二醇的溶液用于减少或消除分子间相互作用和Fab-FcRn相互作用。从而实现分离的Fc区-FcRn相互作用的确定。
在上述以及下述实施方案和方面的一个实施方案中,步骤b)中应用于固定的FcRn的抗体溶液包含10mM MES、150mM或400mM NaCl、0.05%(w/v)聚山梨醇酯20(P-20)和任选的20%(w/w)乙二醇,pH值为5.8,或包含10mM HEPES、150mM或400mM NaCl、0.05%(w/v)P-20和任选的20%(w/w)乙二醇,pH值为pH 7.4。
在上述以及下述实施方案和方面的一个实施方案中,支链葡聚糖是复合支链葡聚糖。葡聚糖是由葡萄糖缩合得到的多糖。在一个实施方案中,复合支链葡聚糖是右旋糖酐。在一个实施方案中,复合支链葡聚糖是微生物来源的支链聚-α-d-葡糖苷,其具有主要从C-1至C-6"的糖苷键。在一个实施方案中,右旋糖酐具有3kDa至2,000kDa的分子量。
在上述以及下述实施方案和方面的一个实施方案中,使用2-/3-维图来划分和可视化Fab-FcRn相互作用以及Fc区-FcRn相互作用,其中稳定性(log kd,解离率)显示于/对应于x轴,并且识别(log ka,缔合率)显示于/对应于y轴。
在上述以及下述实施方案和方面的一个实施方案中,要分析FcRn与抗体的Fc区之间的相互作用,
-传感器表面是具有羧甲基化表面的SPR芯片,其中羧基直接附着于(固体)表面(层),并且其中SPR芯片不含右旋糖酐基质,
-使用胺偶联在中性pH(pH 7.4的10mM HEPES中约250μg/ml)下将包含C末端His(10)-Avi-标签的β-2-微球蛋白-人FcRn融合多肽(基团通过(GGGGS)
-运行缓冲液为10mM MES,150mM NaCl,pH 5.8,0.05%(w/v)P-20或10mM HEPES,pH 7.4,150mM NaCl,0.05%(w/v)P-20。
在上述以及下述实施方案和方面的一个实施方案中,传感器表面是具有羧甲基化表面的SPR芯片,其中羧基直接附着于(固体)表面(层)并且不含右旋糖酐。在该实施方案中,使用胺偶联在中性pH(pH 7.4的10mM HEPES中约250μg/ml)下将包含C末端His(10)-Avi-标签的β-2-微球蛋白-人FcRn融合多肽(基团通过(GGGGS)
在上述以及下述实施方案和方面的一个实施方案中,该方法用于选择具有pH依赖性FcRn介导的抗体再循环或/和长体内半衰期的抗体,并且所选择的抗体在pH 5.5-6.0下的pH依赖性总抗体-FcRn相互作用强度在100nM至400nM范围内。总抗体-FcRn相互作用强度包括Fc-FcRn相互作用和Fab-FcRn相互作用。
在上述以及下述实施方案和方面的一个实施方案中,该方法用于选择具有pH依赖性FcRn介导的抗体再循环或/和长体内半衰期的抗体,并且所选择的抗体在pH 5.5至pH6.5范围内的pH值下的一侧Fc区-FcRn结合强度为25nM或更高。在一个实施方案中,结合强度为100nM或更高、或200nM或更高、或300nM或更高。在一个实施方案中,如果不存在另外的Fab-FcRn结合亲和力,尤其是在pH 7.4下,则对于一侧Fc区-FcRn结合亲和力使用低于100(200)nM的结合强度。这应该与在pH 7.4和更高pH下的低或不可检测的结合强度有关。在一个实施方案中,结合强度为25nM或更高并且抗体在pH 7.4下与FcRn解离。这可以用于选择具有改善的药代动力学特性的抗体变体。
在上述以及下述实施方案和方面的一个实施方案中,该方法用于选择具有修饰的Fc区的变体抗体,其中该方法包括用亲本抗体和至少两种在其Fc区氨基酸序列上有所不同的变体抗体进行/执行步骤b),步骤c)确定相互作用检测点图案,并且选择具有与亲本抗体的相互作用检测点图案相似/匹配的相互作用检测点图案的变体抗体,其中检测点图案是2-/3-维图,其中稳定性(log kd,解离率)显示于/对应于x轴,并且识别(log ka,缔合率)显示于/对应于y轴。
在上述以及下述实施方案和方面的一个实施方案中,该方法用于确定Fab-FcRn相互作用的类型,即用于确定是否存在基于电荷或疏水性的相互作用,其中该方法包括首先用包含10mM MES或HEPES、150mM 0.05%(w/v)P-20的pH值为pH 7.4的抗体溶液进行/执行步骤b)以获得第一相互作用检测点图案,其次用包含10mM MES或HEPES、400mM 0.05%(w/v)P-20的pH值为pH 7.4的抗体溶液进行/执行步骤b)以获得第二相互作用检测点图案,并且用包含10mM MES或HEPES、400mM 0.05%(w/v)P-20和20%(w/w)乙二醇的pH值为pH 7.4的抗体溶液进行/执行步骤b)以获得第三相互作用检测点图案,其中如果第一相互作用检测点图案和第二相互作用检测点图案不同,则Fab-FcRn相互作用的类型是基于电荷的,并且如果第一和第二相互作用检测点图案相似且第三相互作用检测点图案是不同的,则Fab-FcRn相互作用的类型是基于疏水性的,其中相互作用检测点图案是2-/3-维图,其中稳定性(log kd,解离率)显示于/对应于x轴,并且识别(log ka,缔合率)显示于/对应于y轴。
在上述以及下述实施方案和方面的一个实施方案中,抗体是双特异性抗体。
在上述以及下述实施方案和方面的一个实施方案中,双特异性抗体是结构域交换抗体。
在上述以及下述实施方案和方面的一个实施方案中,双特异性抗体是单臂单链抗体。
在上述以及下述实施方案和方面的一个实施方案中,双特异性抗体是双臂单链抗体。
在上述以及下述实施方案和方面的一个实施方案中,双特异性抗体是共同轻链双特异性抗体。
本发明的一个方面是用于选择抗体/抗体选择的根据本发明的方法。在一个实施方案中,用至少两种在其FcRn相互作用方面有所不同的抗体执行根据本发明的方法,由此选择具有最高的(分离的)Fc区-FcRn相互作用亲和力/强度的抗体/选择具有更高的(分离的)Fc区-FcRn相互作用亲和力/强度的抗体。
本发明的一个方面是用于抗体工程化的根据本发明的方法。在一个实施方案中,用至少两种在其Fc区-和/或Fab-氨基酸序列方面有所不同的抗体执行根据本发明的方法,由此选择Fc-FcRn相互作用与Fab-FcRn相互作用之间的比率最高/最大的抗体/选择Fc-FcRn相互作用与Fab-FcRn相互作用之间的比率最高/更大的抗体。
本发明的一个方面是根据本发明的方法用于确定Fab-FcRn和Fc区-FcRn相互作用的用途。
本发明的一个方面是根据本发明的方法用于确定抗体Fc区突变对抗体体内半衰期的影响的用途。
本发明的一个方面是根据本发明的方法用于选择体内半衰期改变/改善(更长或更短)的抗体的用途。
本发明的一个方面是根据本发明的方法用于确定抗体的Fab-FcRn相互作用和Fc区-FcRn相互作用的用途。
本发明的一个方面是根据本发明的方法用于描绘抗体的Fab-FcRn相互作用和Fc区-FcRn相互作用的用途。
本发明的一个方面是根据本发明的方法用于单独分析抗体的Fab-FcRn相互作用和Fc区-FcRn相互作用的用途。
在此明确指出,即使没有逐字呈现,也公开了任何方面与任何单独实施方案的组合或实施方案的组合。本文报道的方面涉及执行本发明的单独的、独立的方式,而实施方案涉及执行本发明的一个或多个方面的特定的、依赖性方式。
具体实施方式
本文报道了一种新的基于SPR的抗体-FcRn结合测定,该测定解释了抗体-FcRn结合评估中的单独的Fab-FcRn和Fc区-FcRn相互作用。本发明的这个方面至少部分基于固相诸如例如SPR芯片上的pH依赖性FcRn涂层。
根据本发明这个方面的方法已经通过将抗体的复杂性降低至仅具有一个活性FcRn结合位点的单独的Fc区并且此后依次添加回分子的附加结构域而得到证实。
本发明至少部分基于以下发现:用于确定Fc区-FcRn相互作用的SPR设置包括许多可变性。
本发明还至少部分基于以下发现:通过在SPR传感器表面上使用FcRn的有意固定(即通过使用FcRn捕获)与有意的缓冲液设置的组合可以获得关于所有抗体-FcRn相互作用的信息,即Fab-FcRn和Fc区-FcRn相互作用的信息。
本发明至少部分基于以下发现:必须协同解释/观察多种IgG-FcRn相互作用。只有在剖析单独的结合步骤和结合相互作用之后,才有可能理解有助于总结合的单独的分子相互作用。只有基于这种相互作用剖析,才能成功地工程化抗体,即通过分别工程化Fc-FcRn和Fab-FcRn相互作用来工程化抗体。
本发明至少部分基于以下发现:由于抗体重链的对称性,会发生不同结合事件的混合,并且将受控(即限定)量的FcRn固定在SPR传感器表面上是重要的。这在根据本发明的方法中通过在固定步骤期间控制FcRn二聚化(例如,形成异二聚体)来实现。已发现FcRn以pH依赖性方式二聚化。通过使用单链FcRn,可以在SPR传感器表面上提供非常均匀的FcRn表面。
本发明至少部分基于以下发现:i)通过控制SPR芯片,尤其是使用单链FcRn并在中性/生理pH(即在pH 7至pH 8的范围内)下固定,和ii)调整缓冲液条件,可以剖析抗体与FcRn之间的多阶段结合机制,并且该机制可以用于根据药代动力学特性选择和筛选工程化抗体。在某些实施方案中,简化抗体,和/或使用具有在x轴上的稳定性(log kd)和在y轴上的识别(log ka)的充分可视化来分离不同的抗体-FcRn相互作用,和/或药代动力学特性是pH依赖性FcRn结合。
本发明至少部分基于以下发现:pH依赖性抗体-FcRn相互作用强度在pH 5.5至pH6.0下必须在100nM至400nM的范围内,以选择具有合适的pH依赖性FcRn介导的抗体再循环并且因而具有长体内半衰期的抗体。在某些实施方案中,抗体-FcRn相互作用强度是总抗体-FcRn相互作用强度。总抗体-FcRn相互作用强度包括Fc-FcRn相互作用和Fab-FcRn相互作用。在某些实施方案中,抗体-FcRn相互作用强度是Fc-FcRn相互作用强度。
本发明至少部分基于以下发现:具有较高亲和力的群体的分数,即更靠近原点(2-/3-维图的左下角)的检测点随着SPR固体表面(即芯片)上固定的scFcRn(单链FcRn)的密度的增加而增加。
定义
关于人免疫球蛋白轻链和重链的核苷酸序列的一般信息给出于:Kabat,E.A.等人,Sequences of Proteins of Immunological Interest,第5版,Public HealthService,National Institutes of Health,Bethesda,MD(1991)中。重链和轻链的所有恒定区和结构域的氨基酸位置可根据Kabat,等人,Sequences of Proteins ofImmunological Interest,第5版,Public Health Service,National Institutes ofHealth,Bethesda,MD(1991)中描述的Kabat编号系统编号,并且在本文中被称为“根据Kabat编号”。具体地,将Kabat编号系统(参见Kabat等人,Sequences of Proteins ofImmunological Interest,第5版,Public Health Service,National Institutes ofHealth,Bethesda,MD(1991)的第647-660页)用于κ和λ同种型的轻链恒定结构域CL,并且将Kabat的EU索引编号系统(参见第661-723页)用于恒定重链结构域(CH1、铰链、CH2和CH3,这在本文中通过在此情况下称为“根据Kabat的EU索引编号”而进一步分类)。
必须注意的是,如本文和所附权利要求书中所用,单数形式“一个”、“一种”和“该/所述”包括复数指代,除非上下文另外明确规定。因此,例如,提及“一个细胞”包括多个此类细胞和本领域技术人员已知的其等同物,诸如此类。同样,术语“一个/一种”、“一个或多个/一种或多种”和“至少一个/至少一种”在本文中可以互换使用。
还应当注意的是,术语“包含”、“包括”和“具有”可以互换使用。
对于本领域的技术人员而言,将例如肽接头或融合多肽的氨基酸序列转化为相应的编码核酸序列的程序和方法是众所周知的。因此,核酸的特征在于其核酸序列由单独的核苷酸组成,并且特征同样在于由其编码的肽接头或融合多肽的氨基酸序列。
使用重组DNA技术能够生成核酸衍生物。此类衍生物可例如在一个或几个核苷酸位置处通过取代、改变、交换、缺失或插入来修饰。修饰或衍生化可以例如借助定点诱变来进行。此类修饰可以由本领域技术人员容易地进行(参见例如,Sambrook,J.等人,Molecular Cloning:A laboratory manual(1999)Cold Spring Harbor LaboratoryPress,New York,USA;Hames,B.D.和Higgins,S.G.,Nucleic acid hybridization–apractical approach(1985)IRL Press,Oxford,England)。
可用于实施本发明的方法和技术描述于:例如Ausubel,F.M.(编辑),CurrentProtocols in Molecular Biology,第I卷至第III卷(1997);Glover,N.D.和Hames,B.D.编辑,DNA Cloning:A Practical Approach,第I卷和第II卷(1985),Oxford UniversityPress;Freshney,R.I.(编辑),Animal Cell Culture–a practical approach,IRL PressLimited(1986);Watson,J.D.等人,Recombinant DNA,第二版,CHSL Press(1992);Winnacker,E.L.,From Genes to Clones;N.Y.,VCH Publishers(1987);Celis,J.编辑,Cell Biology,第二版,Academic Press(1998);Freshney,R.I.,Culture of AnimalCells:A Manual of Basic Technique,第二版,Alan R.Liss,Inc.,N.Y.(1987)。
术语“约”表示其后所跟随的数值的+/-20%范围。在一个实施例中,术语“约”表示其后所跟随的数值的+/-10%范围。在一个实施例中,术语“约”表示其后所跟随的数值的+/-5%范围。
“亲和力”或“结合亲和力”是指分子(例如抗体)的单个结合位点与其结合配偶体(例如抗原)之间的非共价相互作用的总和的强度。分子X对其配偶体Y的亲和力通常可以用解离常数(K
本文的术语“抗体”以最广泛的含义使用,并且包括各种抗体结构,包括但不限于单克隆抗体、多特异性抗体(例如双特异性抗体、三特异性抗体)和抗体片段,只要它们至少包括Fc区即可。
抗体通常包含两个所谓的轻链多肽(轻链)和两个所谓的重链多肽(重链)。重链多肽和轻链多肽中的每一者都含有可变结构域(可变区)(通常是多肽链的氨基末端部分),该可变结构域包含能够与抗原相互作用的结合区。重链多肽和轻链多肽中的每一者都包含恒定区(通常是羧基末端部分)。重链的恒定区介导抗体i)与携带Fcγ受体(FcγR)的细胞(诸如吞噬细胞)或ii)与携带新生儿Fc受体(FcRn)(也称为Brambell受体)的细胞的结合。它还介导与一些因子的结合,这些因子包括经典补体系统的因子,诸如组分(C1q)。抗体重链的恒定结构域包含CH1结构域、CH2结构域和CH3结构域,而轻链仅包含一个恒定结构域CL,它可以是κ同种型或λ同种型。
免疫球蛋白轻链或重链的可变结构域又包含不同的区段,即四个框架区(FR)和三个高变区(HVR)。
抗体的“类别”是指抗体的重链所具有的恒定结构域或恒定区的类型。存在五大类抗体:IgA、IgD、IgE、IgG和IgM,并且这些抗体中的一些可以进一步分为亚类(同种型),例如IgG
术语“结合(至FcRn)”表示在体外测定中抗体或至少抗体Fc区或包含融合多肽的抗体Fc区与(人)FcRn的结合。在一个实施方案中,在结合测定中确定结合,其中(人)FcRn与固体表面(例如传感器芯片)结合,并且通过表面等离子体共振(SPR)测量抗体(或分离的Fc区或包含融合多肽的Fc区)的结合。
如本文所用的术语“单克隆抗体”是指从基本上同质的抗体群体获得的抗体,即,除了可能的变异抗体(例如,含有天然存在的突变或在单克隆抗体制剂的生产过程中产生,此类变体通常以少量形式呈递)之外,包含该群体的各个抗体是相同的和/或结合相同的表位。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂相反,单克隆抗体制剂中的每种单克隆抗体针对抗原上的单一决定簇。因此,修饰语“单克隆”表示抗体的特征是从基本上同质的抗体群体获得的,并且不应解释为需要通过任何特定方法产生抗体。例如,按照根据本发明使用的单克隆抗体可通过多种技术制备,包括但不限于杂交瘤方法、重组DNA方法、噬菌体展示方法,以及利用含有全部或部分人免疫球蛋白基因座的转基因动物的方法,在本文中描述了用于制备单克隆抗体的此类方法和其他示例性方法。
如本文所用的术语“高变区”或“HVR”是指在序列中高变(“互补决定区”或“CDR”)和/或形成结构上限定的环(“高变环”)和/或含有抗原接触残基(“抗原接触点”)的抗体可变结构域的区域每一种。通常,抗体包含六个HVR:三个在VH中(H1、H2、H3),并且三个在VL中(L1、L2、L3)。本文中的示例性HVR包括:
(a)存在于氨基酸残基26-32(L1)、50-52(L2)、91-96(L3)、26-32
(H1)、53-55(H2)和96-101(H3)处的高变环(Chothia和Lesk,J.Mol.
Biol.196:901-917(1987));
(b)存在于氨基酸残基24-34(L1)、50-56(L2)、89-97(L3)、31-35b(H1)、50-65(H2)和95-102(H3)处的CDR(Kabat等人,Sequences ofProteins of Immunological Interest,第5版,Public Health Service,National Institutes of Health,Bethesda,MD(1991));
(c)存在于氨基酸残基27c-36(L1)、46-55(L2)、89-96(L3)、30-35b(H1)、47-58(H2)和93-101(H3)处的抗原接触点(MacCallum等人,J.
Mol.Biol.262:732-745(1996));以及
(d)(a)、(b)和/或(c)的组合,包括HVR氨基酸残基46-56(L2)、47-56
(L2)、48-56(L2)、49-56(L2)、26-35(H1)、26-35b(H1)、49-65(H2)、
93-102(H3)和94-102(H3)。
除非另有说明,否则可变结构域中的HVR残基和其他残基(例如FR残基)在本文中根据Kabat等人编号。
如在本申请中所用的术语“价”表示(抗体)分子中存在指定数目的结合位点。因此,术语“二价”“四价”和“六价”分别表示(抗体)分子中存在两个结合位点、四个结合位点和六个结合位点。如本文所报道的双特异性抗体是“二价”的一个优选实施例。
术语“结合亲和力”表示单个结合位点与其相应靶标的相互作用的强度。实验上,可以例如通过测量平衡状态下抗体与FcRn的缔合(kA)和解离(kd)动力学常数/速率确定亲和力。
术语“结合亲合力”表示一个分子(抗体)的多个结合位点与同一靶标的相互作用的组合强度。因此,亲合力是键亲和力的组合协同强度,而不是键的总和。亲合力的必要条件是:分子(诸如抗体,或一个靶标(FcRn)的功能性多聚体)的多价性。
亲和结合和亲合结合之间的复合物(单价或二价)Fc缔合没有区别。然而,亲合结合的复合物解离取决于所涉及的所有结合位点的同时解离。因此,由于亲合结合(与亲和结合相比)引起的结合强度的增加取决于解离动力学/复合物稳定性:复合物稳定性越大(越高),所有相关结合位点同时解离的可能性就越小;对于非常稳定的复合物,亲和结合与亲合结合的差异基本上为零;-复合物稳定性越小(越低),所有相关结合位点同时解离的可能性就越大;亲和结合与亲合结合的差异增加。
多特异性抗体
在某些实施方案中,根据本发明的方法中使用的抗体是多特异性抗体,例如双特异性抗体。“多特异性抗体”是对在一个抗原上的至少两个不同位点或至少两个不同抗原具有结合特异性的单克隆抗体。在某些实施例中,结合特异性中的一个针对第一抗原,而另一个针对不同的第二抗原。在某些实施例中,多特异性抗体可以与同一抗原的两个不同的表位结合。
用于制备多特异性抗体的技术包括但不限于具有不同特异性的两个免疫球蛋白重链-轻链对的重组共表达(参见Milstein,C.和Cuello,A.C.,Nature 305(1983)537-540,WO 93/08829,以及Traunecker,A.等人,EMBO J.10(1991)3655-3659)和“杵臼结构”工程化(参见例如US 5,731,168)。多特异性抗体也可通过用于制备抗体Fc-异二聚分子的工程化静电转向效应来制备(WO 2009/089004)。
抗体也可以是多特异性抗体,如WO 2009/080251、WO 2009/080252、WO 2009/080253、WO 2009/080254、WO 2010/112193、WO 2010/115589、WO 2010/136172、WO 2010/145792或WO 2010/145793中所述。
其抗体也可以是如WO 2012/163520中公开的多特异性抗体(也称为“DutaFab”)。
双特异性抗体通常是与同一抗原上的两个不同的、不重叠的表位或与不同抗原上的两个表位特异性结合的抗体分子。
不同的双特异性抗体形式是已知的。
可用于本文报道的方法中的示例性双特异性抗体形式是
-结构域交换抗体(CrossMab形式):包含第一Fab片段和第二Fab片段的多特异性IgG抗体,其中在第一Fab片段中
a)仅CH1和CL结构域相互替换(即第一Fab片段的轻链包含VL和CH1结构域,并且第一Fab片段的重链包含VH和CL结构域);
b)仅VH和VL结构域相互替换(即第一Fab片段的轻链包含VH和CL结构域,并且第一Fab片段的重链包含VL和CH1结构域);或
c)CH1和CL结构域相互替换并且VH和VL结构域相互替换(即第一Fab片段的轻链包含VH和CH1结构域,并且第一Fab片段的重链包含VL和CL结构域);并且
其中第二Fab片段包含轻链和重链,该轻链包含VL和CL结构域,该重链包含VH和CH1结构域;
结构域交换的抗体可以包含第一重链和第二重链,该第一重链包含CH3结构域,该第二重链包含CH3结构域,其中两个CH3结构域通过各自的氨基酸取代以互补方式工程化,从而支持第一重链和修饰的第二重链的异二聚化,例如如在WO 96/27011、WO 98/050431、EP 1870459、WO 2007/110205、WO 2007/147901、WO 2009/089004、WO 2010/129304、WO2011/90754、WO 2011/143545、WO 2012/058768、WO 2013/157954、或WO 2013/096291中公开的(以引用方式并入本文);
单臂单链抗体(单臂单链形式):包含第一结合位点和第二结合位点的抗体,所述第一结合位点与第一表位或抗原特异性结合,所述第二结合位点与第二表位或抗原特异性结合,由此单独的链如下:
-轻链(可变轻链结构域+轻链κ恒定结构域)
-组合轻链/重链(可变轻链结构域+轻链恒定结构域+肽接头+可变重链结构域+CH1+铰链+CH2+具有杵突变的CH3)
-重链(可变重链结构域+CH1+铰链+CH2+具有臼突变的CH3);
-双臂单链抗体(双臂单链形式):包含第一结合位点和第二结合位点的抗体,所述第一结合位点与第一表位或抗原特异性结合,所述第二结合位点与第二表位或抗原特异性结合,由此单独的链如下:
-组合轻链/重链1(可变轻链结构域+轻链恒定结构域+肽接头+可变重链结构域+CH1+铰链+CH2+具有臼突变的CH3)
-组合轻链/重链2(可变轻链结构域+轻链恒定结构域+肽接头+可变重链结构域+CH1+铰链+CH2+具有杵突变的CH3);
-共同轻链双特异性抗体(共同轻链双特异性形式):包含第一结合位点和第二结合位点的抗体,所述第一结合位点与第一表位或抗原特异性结合,所述第二结合位点与第二表位或抗原特异性结合,由此单独的链如下:
-轻链(可变轻链结构域+轻链恒定结构域)
-重链1(可变重链结构域+CH1+铰链+CH2+具有臼突变的CH3)
-重链2(可变重链结构域+CH1+铰链+CH2+具有杵突变的CH3)。
在一个实施例中,双特异性抗体是结构域交换抗体。
在一个实施例中,双特异性抗体是单臂单链抗体。
在一个实施例中,双特异性抗体是双臂单链抗体。
在一个实施例中,双特异性抗体是共有轻链双特异性抗体。
表面等离子体共振方法
可以例如通过使用BIAcore仪器(GE Healthcare Biosciences AB,Uppsala,Sweden)进行表面等离子体共振来研究抗体对FcRn的动力学结合参数。
通常,对于抗体与其靶抗原的亲和力测量,抗IgG抗体(例如抗人IgG或抗小鼠IgG抗体)通过胺偶联固定在传感器芯片(诸如CM5芯片)上,用于待分析的相应抗体的捕获和呈递。
例如,大约2,000-12,000响应单位(RU)的10-30μg/ml抗IgG抗体在BIAcore B4000或T200仪器中以pH 5.0和流速10-30μl/min偶联到CM5传感器芯片的流动池的一些检测点上(例如检测点1和5是活性检测点,检测点2和4是参照检测点,或检测点1和2是反应检测点,检测点3和4是参照检测点等):使用GE Healthcare提供的胺偶联试剂盒。
可以在HBS缓冲液(HBS-P(10mM HEPES,150mM NaCl,0.005%Tween 20,pH 7.4)、或HBS-EP+缓冲液(0.01M HEPES,0.15M NaCl,3mM EDTA,0.05%v/v表面活性剂PS20,pH7.4)、或HBS-ET缓冲液(10mM HEPES pH 7.4,150mM NaCl,3mM EDTA,0.005%w/vTween20))中,在25℃(或可替代地在12℃至37℃范围内的不同温度下)确定抗体与其同源抗原的结合。
因此,抗体在相应缓冲液中以10nM至1μM范围内的浓度注入30秒,并与每个流动池的反应检测点结合。
此后,根据抗体的亲和力,将相应的抗原以在溶液中的各种浓度注入,诸如例如144nM、48nM、16nM、5.33nM、1.78nM、0.59nM、0.20nM和0nM,并通过在10-30μl/min流速下20秒至10分钟的注入时间来确定缔合。
通过用相应的缓冲液清洗芯片表面3-10分钟来确定解离。
利用制造商的软件和说明,通过1:1Langmuir结合模型来估计K
本发明的具体实施例
由于抗体结构,分子水平上的FcRn结合非常复杂。
因此,具有相同IgG1 Fc区但不同Fab的抗体在其FcRn相互作用中表现出不同的行为(参见图1;包含抗体(探索性和批准的)的不同人源化/嵌合人IgG1 Fc区的SPR传感图;在相同的SPR条件下利用相同的浓度和相同的单体浓度记录传感图;唯一的区别是抗原结合位点)。
本发明至少部分基于以下发现:FcRn设置包括许多可变性,以及通过FcRn在SPR传感器表面上的固定(即通过使用FcRn捕获)可以获得关于所有抗体-FcRn相互作用的信息,即Fab和Fc区的信息。
本发明至少部分基于以下发现:不通过经典的KD解释协同解释多种IgG-FcRn相互作用是不利的。只有在剖析单独的结合步骤之后,才有可能理解有助于结合的分子相互作用。只有基于这种理解,所需的工程化才能在Fc工程化的适应性Fab意义上应用。
本发明至少部分基于以下发现:由于抗体重链的对称性,存在不同结合事件的混合,并且因此将受控(即限定)量的FcRn固定在SPR传感器表面上是重要的。这通过控制FcRn二聚化(例如形成异二聚体)来实现。已发现FcRn以pH依赖性方式二聚化。通过使用单链FcRn,可以在SPR传感器表面上提供非常均匀的FcRn表面。
可以使用2-/3-维图来划分和可视化抗体-FcRn相互作用(即Fab-FcRn相互作用以及Fc区-FcRn相互作用),其中稳定性(log kd,解离率)对应于x轴,并且识别(log ka,缔合率)对应于y轴(参见例如图5)。为了生成此类2-/3-维图,可以使用任何合适的软件,诸如例如Ridgeview Diagnostics AB(瑞典乌普萨拉)的Interaction Map(IM)软件。
因此,从理论上讲,如果分析恰好具有一个结合位点的Fc区与/针对FcRn之间的相互作用,则应该只存在一个检测点。
在图2中,显示了分离的、无Fab的Fc区-FcRn相互作用(即分离的抗体Fc区与通过在一个Fc区多肽中引入突变I253A/H310A/H435A(本文使用根据Kabat的编号)获得的单一FcRn结合位点的理论1:1相互作用)的3-维图(稳定性(log kd)在x轴上,识别(log ka)在y轴上,并且强度在z轴上)。可以看出,尽管有基本理论,但是存在两个检测点,然而一个Fc区多肽对于FcRn相互作用而言是惰性的,即它不能与FcRn结合。已经发现,具有较高亲和力的群体部分(即更靠近原点(图的左下角)的检测点)随着SPR固体表面(即芯片)上固定的scFcRn(单链FcRn)的密度的增加而增加。
在图3中,显示了全长、单特异性抗洋地黄毒苷抗体与SPR固体表面上的FcRn的相互作用的2-维图。可以看出,在这种情况下甚至可以看到三个检测点。
前面两个实例中所示的相互作用的差异至少部分归因于相互作用模式,即,抗体与FcRn分别是“复杂”相互作用还是“简单”相互作用。
因此,为了正确解析所有这些相互作用,必须采用改进的SPR方法。
本发明提供了此类改进的方法。
更详细地,本发明提供了一种用于检测抗体-FcRn相互作用的方法,其中
-固定表面是具有表面的SPR芯片,其中捕获基团直接附着于表面层并且没有右旋糖酐基质,
-捕获试剂以分离的、即非二聚化或多聚化的形式提供,即捕获试剂仅具有针对分析物(靶分子)的单一结合位点,
-固定中使用的运行缓冲液控制固定期间捕获试剂的聚集状态,即该捕获试剂保持单体形式还是作为二聚体/多聚体。
通过这种方法,少量的捕获试剂(即50至150RU范围内)可以与固体表面共价缀合
因此,在本发明的一个方面,其中要分析FcRn与Fc区/抗体之间的相互作用,
-传感器表面是具有羧甲基化表面的SPR芯片,其中羧基直接附着于表面层并且没有右旋糖酐基质,
-使用胺偶联在中性pH(pH 7.4的10mM HEPES中约250μg/ml)下将包含C末端His(10)-Avi-标签的β-2-微球蛋白-人FcRn融合多肽(基团通过(GGGGS)4肽接头连接)固定在传感器表面上,并且
-运行缓冲液为10mM MES,150mM NaCl,pH 5.8,0.05%P-20或HBS-P缓冲液(10mMHEPES缓冲液,pH 7.4,150mM NaCl,0.05%P-20)。
利用根据本发明的方法,少量的scFcRn(即约80至120RU或50至100RU)可以与固体表面共价缀合。由于固定在pH 7.4下进行,因此确保scFcRn以单体形式固定并且不形成聚集体。其效果在图4和图5中显示,前者中显示了传感图,后者中显示了简单的Fc区-FcRn相互作用(即分离的、无Fab的抗体Fc区与通过在一个Fc区多肽中引入突变I253A/H310A/H435A并且利用胺偶联在低FcRn固定水平下保持相应的野生型Fc区多肽作为相应的另一Fc区多肽获得的单一FcRn结合位点的1:1相互作用)的相应2-维图(稳定性(log kd)在x轴上并且识别(log ka)在y轴上)。可以看出,仅存在一个检测点。
与此相反,如果在pH 5.5下执行scFcRn的固定,则由于在该pH值下发生异二聚化,二聚的scFcRn将被固定。信号强度是与单体的scFcRn的相互作用的两倍,表明二聚的scFcRn可以结合两个Fc区。
在图6中显示了复杂的IgG1全长抗体-FcRn相互作用的传感图。在图7和图8中,分别显示了使用胺偶联在低FcRn固定水平下以及使用生物素/抗生物素蛋白偶联在高FcRn固定水平下的复杂的IgG1全长抗体-FcRn相互作用的2-维图。可以看出,除了Fc区-FcRn相互作用之外,还存在额外的检测点以及由此产生的相互作用。
因此,可以通过将Fab添加至Fc区(在一个Fc区多肽中的突变I253A/H310A/H435A和在相应的另一Fc区多肽中的野生型)来确定分离的Fab-FcRn相互作用的效果。
在第一个实例中,在图9至图11中,这显示了添加至具有单一FcRn结合位点的Fc区(在一个Fc区多肽中的突变I253A/H310A/H435A和在相应的另一Fc区多肽中的野生型;抗体的草图参见图42-a)的抗洋地黄毒苷-Fab。根据所使用的缓冲液条件,相互作用可以增强或减弱(低密度FcRn,约80RU):
-150mM氯化钠(图9):分子内相互作用(1250nM;草图参见图16,检测点1)和分子间相互作用(20.5nM;草图参见图16,检测点
2);
-400mM氯化钠(图10):分子内相互作用(1060nM;与150mM氯化钠相比增强)和分子间相互作用(60nM);
-400mM氯化钠和20%(w/w)乙二醇(MW=62.07g/mol)(图11):
仅分子内相互作用(3230mM;与其他条件相比减弱)且无分子间相互作用。
因此,通过应用根据本发明的方法与高离子缓冲强度的组合,可以减少或甚至消除Fab-FcRn。不受该理论的束缚,假设所有分子间相互作用以及Fab-FcRn相互作用都被消除,并且在这些条件下确定的相互作用是Fc区-FcRn相互作用。
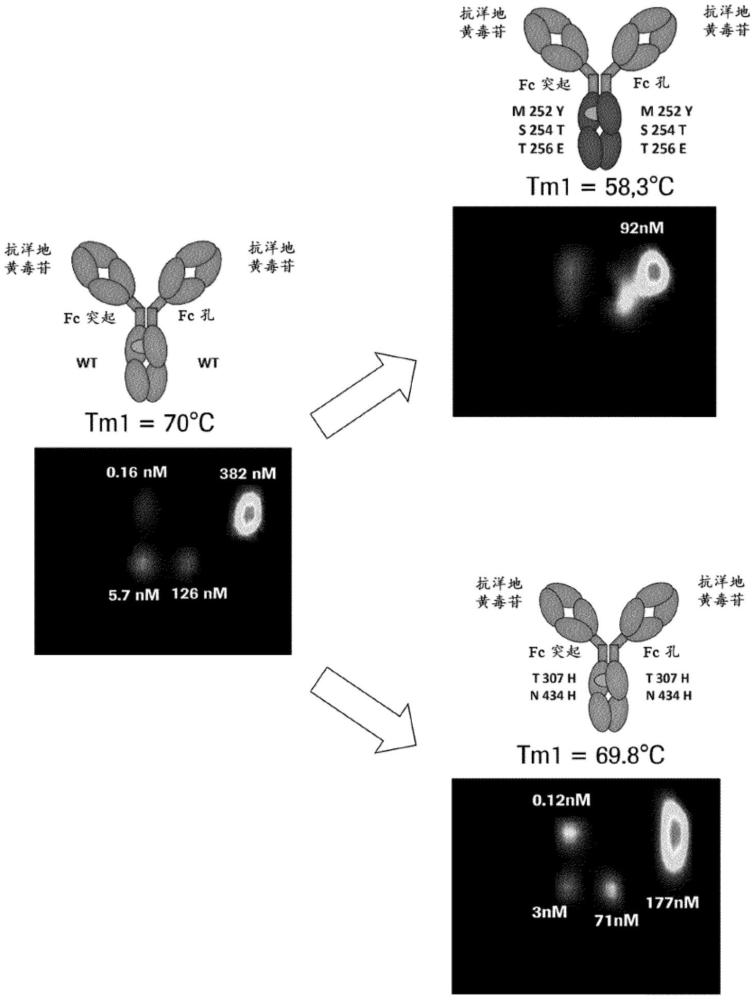
在第二个实例中,对于在一个Fc区多肽中具有突变I253A/H310A/H435A(消除Fc-FcRn相互作用)和在相应的另一Fc区多肽中具有突变M252Y/S254T/T256E(增加Fc-FcRn相互作用强度)的不对称抗体(抗体草图参见图42-b),也已经显示了相互作用强度的相同变化:
-150mM氯化钠:分子内相互作用(184nM;草图参见图16,检测点1)和分子间相互作用(4.7nM;草图参见图16,检测点2);
-400mM氯化钠:分子内相互作用(166nM;与150mM氯化钠相比增强)和分子间相互作用(6.2nM)。
对于在一个Fc区多肽中具有突变I253A/H310A/H435A和在相应的另一Fc区多肽中具有突变T307H/N434H的不对称抗体(抗体草图参见图42-c),也已经确定了相互作用强度的相同变化:
-150mM氯化钠:分子内相互作用(391nM;草图参见图16,检测点1)和分子间相互作用(10.4nM;草图参见图16,检测点2);
-400mM氯化钠:分子内相互作用(325nM;与150mM氯化钠相比增强)和分子间相互作用(4.3nM和39nM)。
因此,所用缓冲液中盐浓度的增加会增强Fc区不对称抗体中的分子内相互作用。因此,在一个实施方案中,当确定不对称抗体(即全长、Y型、二价、双特异性抗体)的分子内相互作用时,缓冲液包含约400mM盐,优选氯化钠。
当使用连接到野生型IgG1 Fc区的相同抗洋地黄毒苷Fab时,可以看到不同的效果(低密度FcRn,约80RU;图12至图14):
-150mM氯化钠(图12):382nM的分子内结合1+2(草图参见图15),0.16nM的分子内结合1+2+1+2(草图参见图15);5.7nM的分子间结合1+2'(草图参见图15),126nM的分子间结合1+1'(草
图参见图15);
-400mM氯化钠(图13):840nM的分子内结合1+2(草图参见图15),0.33nM的分子内结合1+2+1+2(草图参见图15);4.8nM的分子间结合1+2'(草图参见图15),100nM的分子间结合1+1'(草图参见图15);与150mM氯化钠相比,分子内相互作用减弱并且分
子间相互作用增强;
-400mM氯化钠和20%(w/w)乙二醇(MW=62.07g/mol)(图14):1140nM的分子内结合1+2(草图参见图15)和75nM的分子间结合1+1'(草图参见图15);与150mM氯化钠相比,分子内相互作用减弱并且分子间相互作用增强(即与其他检测点相比更占主导地位)。
当使用连接到在两个Fc区多肽中均具有突变M252Y/S254T/T256E的IgG1 Fc区的相同抗洋地黄毒苷Fab时,可以看到相同的效果(低密度FcRn,约80RU)(抗体草图参见图42-d):
-150mM氯化钠:92nM的分子内结合1+2(草图参见图15),分子
内结合1+2+1+2(草图参见图15);
-400mM氯化钠:92nM的分子内结合1+2(草图参见图15),1.6
nM的分子内结合1+2+1+2(草图参见图15)。
如在增加的Fc结合强度中所见的,如果Fc区被工程化以用于非常强的FcRn结合,则Fc-FcRn相互作用驱动的检测点与Fab-Fc介导的亲合力检测点之间的平衡转变为仅Fc-FcRn相互作用。
当使用连接到在两个Fc区多肽中均具有突变T307H/N434H的IgG1 Fc区的相同抗洋地黄毒苷Fab时,可以看到相同的效果(低密度FcRn,约80RU)(抗体草图参见图42-e):
-150mM氯化钠:177nM的分子内结合1+2(草图参见图15),0.12nM的分子内结合1+2+1+2(草图参见图15);3nM的分子间结合1+2'(草图参见图15),71nM的分子间结合1+1'(草图参见图15);
-400mM氯化钠:156nM的分子内结合1+2(草图参见图15),0.13nM的分子内结合1+2+1+2(草图参见图15);25nM的分子间结合1+1'(草图参见图15)。
已发现,通过工程化抗体以增强pH依赖性FcRn相互作用而显著增加抗体-FcRn相互作用并不必然导致同样改善的药代动力学特性。
另外,已经发现,对于抗体的药代动力学工程化,例如,在引入YTE突变时,与亲本抗体相匹配的相互作用检测点模式优于转变的模式,因为抗体可能具有改进的热稳定性(参见图36)。
复杂的多步骤抗体-FcRn结合机制是多变量机制,其涉及
-pH依赖性亲和力:FcRn结合不能通过简单的1:1相互作用来描述;
-pH依赖性亲合力:两条Fc区重链均涉及Fc-FcRn相互作用;
-Fab贡献:由于额外且同时发生的Fab-FcRn相互作用,若干相互作用总计为异质结合模式。
因此,IgG与新生儿Fc受体的双交叉结合机制控制了复合物的稳定性和IgG血清半衰期。在图15和图16中显现了复杂性。
本发明至少部分基于以下发现:i)通过控制SPR芯片,尤其是使用单链FcRn并在中性/生理pH(即在pH 7至pH 8的范围内)下固定,和ii)调整缓冲液条件,抗体与FcRn之间的多阶段结合机制可以用于根据药代动力学特性选择和筛选工程化抗体。在某些实施方案中,简化抗体,和/或使用具有在x轴上的稳定性(log kd)和在y轴上的识别(log ka)的充分可视化来分离不同的抗体-FcRn相互作用,和/或药代动力学特性是pH依赖性FcRn结合。
因此,用根据本发明的方法进行的测量是用单体固定的FcRn完成的。从而可以解析
-结合/相互作用价的影响
-Fab电荷的影响
-FcRn密度对芯片表面的影响
-缓冲液组成的影响。
首先,通过使用胺偶联或生物素/抗生物素蛋白偶联将(sc)FcRn固定到SPR芯片的表面来将涂层密度控制到低水平(参见图19至图26),即与其他方法相比减少芯片表面上的FcRn密度。从而提高了该方法的灵敏度,并且可以以单独的形式可视化不同的相互作用。通过使用2-或3-维图(其中稳定性(log kd)在x轴上并且识别(log ka)在y轴上,即通过充分的可视化),一方面,可以可视化Fc工程化对总抗体-FcRn相互作用的影响,并且另一方面,可以可视化Fab-FcRn相互作用对总抗体-FcRn相互作用的影响。尤其是可以分离Fc-FcRn和Fab-FcRn结合强度的相互关系(参见图17和图18)。
为了生成此类2-或3-维图,可以使用任何合适的软件,诸如例如RidgeviewDiagnostics AB(Uppsala,Sweden)的Interaction Map(IM)软件。
在图21和图22中显示了在约1700RU的涂层密度下通过生物素/抗生物素蛋白偶联获得的分辨率。在图23和图24中显示了在约80RU的涂层密度下通过生物素/抗生物素蛋白偶联获得的分辨率。在图25和图26中显示了在约80RU的涂层密度下通过胺偶联获得的分辨率。
在一个优选的实施方案中,在根据本发明的方法中使用胺偶联的涂层密度为约80至115pg(sc)FcRn/mm
在一个优选的实施方案中,在根据本发明的方法中使用生物素/抗生物素蛋白偶联的涂层密度为约1700pg(sc)FcRn/mm
其次,通过以pH依赖性方式执行SPR芯片涂层,实现了受控的scFcRn单体固定。因此,固定在pH 7.4下进行以确保scFcRn以单体形式固定,并且在固定过程期间不会形成二聚体或多聚体。由此,少量的scFcRn(即约80至120RU)可以与固体表面共价缀合。与此相反,如果在pH 5.5下执行scFcRn的固定,则由于在该pH值下发生异二聚化,二聚的scFcRn将被固定。
在一个具体实施方案中,传感器表面是具有羧甲基化表面的SPR芯片,其中羧基直接附着于表面层并且没有右旋糖酐基质。在此实施方案中,使用胺偶联在中性pH(pH 7.4的10mM HEPES中约250μg/ml)下将包含C末端His(10)-Avi-标签的β-2-微球蛋白-人FcRn融合多肽(基团通过(GGGGS)4肽接头连接)固定到固体表面。由此约80RU的FcRn与固体表面共价缀合。使用的运行缓冲液是10mM MES,150mM NaCl,pH 5.8,0.05%P-20或HBS-P缓冲液(10mM HEPES,pH 7.4,150mM NaCl,0.05%P-20)。
使用根据本发明的方法,可以分析Fab-FcRn相互作用以及Fc区-FcRn相互作用的效果。在图27中,显示了相同亲本抗CD44抗体的五个Fab电荷变体的2-维图。可以看出,Fab-FcRn相互作用根据修饰的种类变化。在图28中,显示了相同亲本抗CD44抗体的四个Fc区变体的2-维图(左上图)。可以看出,Fc区-FcRn相互作用根据修饰的类型变化。
因此,本发明中描绘的效果可以使用2-或3-维图来显示,其中解离常数(稳定性;log kd)显示在x轴上,并且缔合常数(识别;(log ka)显示在y轴上。通过使用此类2-或3-维图,一方面,可以可视化Fc工程化对总抗体-FcRn相互作用的影响,并且另一方面,可以可视化Fab-FcRn相互作用对总抗体-FcRn相互作用的影响。尤其是可以分离Fc-FcRn和Fab-FcRn结合强度的相互关系(参见图17和图18)。
为了生成此类2-或3-维图,可以使用任何合适的软件,诸如例如RidgeviewDiagnostics AB(Uppsala,Sweden)的Interaction Map(IM)软件。
通过简化抗体,可以监测抗体中的单一修饰对总抗体-FcRn相互作用的影响(参见图29至图31)。
本发明至少部分基于以下发现:pH依赖性总抗体-FcRn相互作用强度在pH 5.5至pH 6.0下必须在100nM至400nM的范围内,以选择具有合适的pH依赖性FcRn介导的抗体再循环并且因而具有长体内半衰期的抗体。总抗体-FcRn相互作用强度包括Fc-FcRn相互作用和Fab-FcRn相互作用。
在pH 5.5与pH 6.5之间的范围内的高一侧Fc结合强度(例如200nM或更高)应与pH7.4和更高pH下的低或不可检测的结合强度相关。这可以用于选择具有改善的药代动力学特性的抗体变体。
由Fab-FcRn相互作用产生的总相互作用的分数可以从2-或3-维图中可见的额外检测点获得和/或通过单独分析Fc区的相互作用(例如,在裂解下Fab片段之后)获得。额外检测点的数量/受影响检测点的数量越多,存在的Fab-FcRn相互作用越多。
可以例如通过使Fab中的残基突变来减少所述Fab-FcRn相互作用,或者可以例如通过Fc工程化来增加pH依赖性Fc区-FcRn相互作用。最好的情况是,将两种工程化技术结合起来。
例如,图31和图32中的抗体mAb-1、mAb-2和mAb-3通过引入突变I253A/H310A/H435A而在一个Fc区多肽中使FcRn结合沉默,并且通过分别引入突变M252Y/S254T/T256E和M252Y/S254T/T256E/T307Q/N434Y而在相应的另一Fc区多肽中具有增加的FcRn亲和力。可以看出Fab-FcRn相互作用减少并且Fc区-FcRn亲和力增加。由此,抗体-FcRn相互作用变得仅依赖于Fc区-FcRn相互作用,并且Fab-FcRn相互作用的贡献/导致的变形几乎被消除。
改善/增加Fc-FcRn相互作用的上限是完全消除pH依赖性结合。这种消除例如通过在人IgG1 wt-Fc区中引入突变MST-HN(Met252至Tyr、Ser254至Thr、Thr256至Glu、His433至Lys和Asn434至Phe)来实现(参见例如Patel等人,J.Immunol.187(2011)1015-1022)。
Fab与FcRn之间存在哪种类型的相互作用(即基于电荷或疏水性的相互作用)可以在SPR分析中使用不同的缓冲液组合物来确定。例如,如果向SPR缓冲液中添加乙二醇导致Fc-FcRn/Fab-FcRn相互作用比率增加,则可以看到疏水性Fab-FcRn相互作用的存在。同样,如果向SPR缓冲液中添加盐导致Fc-FcRn/Fab-FcRn相互作用比率增加,则可以看到离子/电荷驱动的Fab-FcRn相互作用的存在(参见图9至图14,和图29至图32)。
这概述于图33。
利用根据本发明的方法,可以单独分析不同的抗体-FcRn相互作用(参见图34)。
基于不同相互作用的分离,根据本发明的方法可以用于抗体开发和选择/筛选期间的多种应用。
一个方面是用于抗体筛选的根据本发明的方法。在抗体筛选中,Fc-FcRn相互作用的亲和力/强度是选择标准。分子内亲合力可以通过盐的增加/添加来确定/减弱。溶液密度可以减弱分子间亲合力。这图示显示于图35。
一个方面是用于抗体工程化的根据本发明的方法。在抗体工程化中,Fc-FcRn相互作用与Fab-FcRn相互作用之间的比率的增加是目标标准。例如,不同的Fc区工程化(即引入不同的FcRn结合影响突变)会导致不同的模式(参见图36)。
为了显示Fc区工程化对抗体-FcRn相互作用的影响,使用抗体布雷奴单抗(Ozespa
然而,氨基酸差异位于(同源)FcRn结合区之外,并且因此可以认为在FcRn依赖性药代动力学中没有作用(参见例如,Ropeenian,D.C.和Akilesh,S.,Nat.Rev.Immunol.7(2007)715-725)。有趣的是,乌司奴单抗的(报道的)中位终末半衰期为22天(参见Zhu,Y.等人,J.Clin.Pharmacol.49(2009)162-175),而布雷奴单抗的终末半衰期仅为8-9天(参见Gandhi,M.等人,Semin.Cutan.Med.Surg.29(2010)48-52;Lima,X.T.等人Expert.Opin.Biol.Ther.9(2009)1107-1113;Weger,W.,Br.J.Pharmacol.160(2010)810-820)。
抗体布雷奴单抗的氨基酸序列报道于WO 2013/087911(SEQ ID NO:01和SEQ IDNO:02),抗体乌司奴单抗的氨基酸序列报道于WO 2013/087911(SEQ ID NO:03和SEQ IDNO:04),以及抗体贝伐珠单抗的氨基酸序列报道于药物银行条目DB00112。
图37中显示了具有延长体内半衰期的YTE突变的乌司奴单抗与FcRn相互作用的pH依赖性2-维图。可以看出,相互作用在低pH值下强,并且在生理pH值下较弱。这导致有效的pH依赖性FcRn介导的再循环,并且从而导致长体内半衰期。
布雷奴单抗与具有延长体内半衰期的YTE突变的布雷奴单抗的相互作用的pH依赖性2-维图分别如图38和39所示。可以看出,相互作用在低pH值和生理pH值下强。这导致损伤的pH依赖性FcRn介导的再循环,并且从而导致短体内半衰期。还可以看出,就布雷奴单抗而言,Fc区工程化导致Fab-FcRn相互作用增加。
此外,2-或3-维图中检测点的转变指示Fc区因wt-Fc区工程化而变形。
因此,可以通过使用抗体-FcRn相互作用的2-或3-维可视化来分析额外的体内效应,例如,与FcRn柱色谱法相比的体内效应。
发明内容
抗体半衰期由FcRn介导。潜在的再循环机制基于抗体与FcRn的pH依赖性结合。先前已描述抗体FcRn相互作用是双交叉结合机制(Jensen等人,Mol.Cell Proteom.16(2017)451-456)。通过氢-氘交换(HDX)阐明了这一机制。
抗体Fc区包含两条重链。所有利用表面结合FcRn的测定设置都受到动力学行为是2:1和1:1相互作用混合的问题的阻碍。根据所应用的FcRn涂层密度,Fc区能够与两个或仅一个结合位点相互作用。
经典的偶联化学通常只允许随机占用SPR芯片。只可以通过芯片上较低的FcRn浓度来指导局部高FcRn密度的概率。
利用根据本发明的方法,可以证明FcRn还表现出pH依赖性自相互作用。对于允许获得有关机械细节的更详细信息的测定设置,必须考虑这种相互作用。
因此,本发明的这个方面是一种新的基于SPR的Fc-FcRn结合测定,其解释了Fc-FcRn结合评估中的单独的相互作用。
本发明的这个方面至少部分基于固相诸如例如SPR芯片上的pH依赖性FcRn涂层。
根据本发明这个方面的方法已经通过将抗体的复杂性降低至仅具有一个活性FcRn结合位点的单独的Fc区并且此后依次添加回分子的附加结构域而得到证实。
复杂的动力学可以使用Interaction Map软件来解析。这允许抗体-FcRn相互作用的表征和分离同时发生。
通过将根据本发明方法获得的数据与相应的野生型抗体结合概况相比,显示了人上皮再循环测定(HERA)和在人FcRn转基因小鼠中根据本发明的体外测定对于抗体运输和再循环(诸如体内药代动力学)(的较高复杂性)的预测。
已经证明,在抗洋地黄毒苷抗体的情况下,Fab-FcRn结合的贡献非常强,以至于在人转基因小鼠模型中,在体内无法观察到对称YTE工程化抗体的明显差异。
***
提供以下实例和附图以帮助理解本发明,本发明的真正范围在所附权利要求中阐明。应当理解,在不脱离本发明的精神的情况下,可对所阐述的程序进行修改。
序列表
<110> 豪夫迈·罗氏有限公司(F. Hoffmann-La Roche AG)
<120> 用于解析复杂、多步骤抗体相互作用的方法
<130> P36712-WO
<150> EP21157850.5
<151> 2021-02-18
<160> 7
<170> PatentIn 版本 3.5
<210> 1
<211> 115
<212> PRT
<213> 人工序列
<220>
<223> 布雷奴单抗重链可变区的氨基酸序列(CJ-695、ABT-874)。
<400> 1
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 2
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 布雷奴单抗轻链可变区的氨基酸序列(J-695、ABT-874)。
<400> 2
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Tyr Thr
85 90 95
His Pro Ala Leu Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 3
<211> 119
<212> PRT
<213> 人工序列
<220>
<223> 乌司奴单抗重链可变区的氨基酸序列 (CTNO-1275)。
<400> 3
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Thr Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Asp Trp Ile
35 40 45
Gly Ile Met Ser Pro Val Asp Ser Asp Ile Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Met Ser Val Asp Lys Ser Ile Thr Thr Ala Tyr
65 70 75 80
Leu Gln Trp Asn Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Arg Arg Pro Gly Gln Gly Tyr Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 4
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 乌司奴单抗轻链可变区的氨基酸序列 (CTNO-1275)。
<400> 4
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Glu Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ile Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 5
<211> 20
<212> PRT
<213> 人工序列
<220>
<223> G4S-接头
<400> 5
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<210> 6
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> AVI-标签
<400> 6
Gly Leu Asn Asp Ile Phe Glu Ala Gln Lys Ile Glu Trp His Glu
1 5 10 15
<210> 7
<211> 25
<212> PRT
<213> 人工序列
<220>
<223> His(10)-AVI-标签
<400> 7
His His His His His His His His His His Gly Leu Asn Asp Ile Phe
1 5 10 15
Glu Ala Gln Lys Ile Glu Trp His Glu
20 25
附图说明
图1包含抗体(探索性和批准的)的不同的人源化/嵌合人IgG1 Fc区的SPR传感图;在相同的SPR条件下利用相同的浓度和相同的单体浓度记录传感图;唯一的区别是抗原结合位点。
图2分离的、无Fab的Fc区-FcRn相互作用(即分离的抗体Fc区与通过在一个Fc区多肽中引入突变I253A/H310A/H435A(本文使用根据Kabat的编号)获得的单一FcRn结合位点的理论1:1相互作用)的三维图(稳定性(log kd)在x轴上,识别(log ka)在y轴上,并且强度在z轴上)。
图3全长、单特异性抗洋地黄毒苷抗体与SPR固体表面上的FcRn的相互作用的二维图。
图4简单的Fc区-FcRn相互作用(即分离的、无Fab的抗体Fc区与通过在一个Fc区多肽中引入突变I253A/H310A/H435A并且利用胺偶联在低FcRn固定水平下保持相应的野生型Fc区多肽作为相应的另一Fc区多肽获得的单一FcRn结合位点的1:1相互作用)的传感图。
图5简单的Fc区-FcRn相互作用(即分离的、无Fab的抗体Fc区与通过在一个Fc区多肽中引入突变I253A/H310A/H435A并且利用胺偶联在低FcRn固定水平下保持相应的野生型Fc区多肽作为相应的另一Fc区多肽获得的单一FcRn结合位点的1:1相互作用)的二维图(稳定性(log kd)在x轴上并且识别(log ka)在y轴上)。
图6复杂的IgG1全长抗体-FcRn相互作用的传感图。
图7使用胺偶联在低FcRn固定水平下的复杂的IgG1全长抗体-FcRn相互作用的二维图。
图8使用生物素/抗生物素蛋白偶联在高FcRn固定水平下的复杂的IgG1全长抗体-FcRn相互作用的二维图。
图9在150mM氯化钠下确定的添加至具有单一FcRn结合位点的Fc区(在一个Fc区多肽中的突变I253A/H310A/H435A和在相应的另一Fc区多肽中的野生型)的抗洋地黄毒苷-Fab的分离的Fab-FcRn相互作用的效果。
图10在400mM氯化钠下确定的添加至具有单一FcRn结合位点的Fc区(在一个Fc区多肽中的突变I253A/H310A/H435A和在相应的另一Fc区多肽中的野生型)的抗洋地黄毒苷-Fab的分离的Fab-FcRn相互作用的效果。
图11在400mM氯化钠和20%(w/w)乙二醇(MW=62.07g/mol)下确定的添加至具有单一FcRn结合位点的Fc区(在一个Fc区多肽中的突变I253A/H310A/H435A和在相应的另一Fc区多肽中的野生型)的抗洋地黄毒苷-Fab的分离的Fab-FcRn相互作用的效果。
图12在150mM氯化钠下确定的添加到野生型IgG1 Fc区的抗洋地黄毒苷Fab的分离的Fab-FcRn相互作用的影响。
图13在400mM氯化钠下确定的添加到野生型IgG1 Fc区的抗洋地黄毒苷Fab的分离的Fab-FcRn相互作用的影响。
图14在400mM氯化钠和20%(w/w)乙二醇(MW=62.07g/mol)下确定的添加到野生型IgG1 Fc区的抗洋地黄毒苷Fab的分离的Fab-FcRn相互作用的影响。
图15描绘不同分子内Fab-FcRn和Fc区-FcRn相互作用的草图。
图16描绘分子内和分子间抗体FcRn相互作用的草图。
图17可以分离具有Fc-FcRn和Fab-FcRn结合强度的独立相互关系的传感图。
图18具有Fc-FcRn和Fab-FcRn结合强度的独立相互关系的二维图。
图19用于将(sc)FcRn固定到SPR芯片表面的生物素/抗生物素蛋白偶联密度。
图20用于将(sc)FcRn固定到SPR芯片表面从而将涂层密度控制到低水平的胺偶联。
图21显示使用具有约1700RU的通过生物素/抗生物素蛋白偶联捕获的(sc)FcRn的芯片的抗洋地黄毒苷抗体与野生型IgG1 Fc区的Fc-FcRn和Fab-FcRn结合强度的二维图。
图22显示使用约1700RU的通过生物素/抗生物素蛋白偶联捕获的(sc)FcRn的抗洋地黄毒苷抗体与具有对称M252Y/S254T/T256E突变的IgG1 Fc区的Fc-FcRn和Fab-FcRn结合强度的二维图。
图23显示使用具有约80RU的通过生物素/抗生物素蛋白偶联捕获的(sc)FcRn的芯片的抗洋地黄毒苷抗体与野生型IgG1 Fc区的Fc-FcRn和Fab-FcRn结合强度的二维图。
图24显示使用约80RU的通过生物素/抗生物素蛋白偶联捕获的(sc)FcRn的抗洋地黄毒苷抗体与具有对称M252Y/S254T/T256E突变的IgG1 Fc区的Fc-FcRn和Fab-FcRn结合强度的二维图。
图25显示使用具有约80RU的通过胺偶联捕获的(sc)FcRn的芯片的抗洋地黄毒苷抗体与野生型IgG1 Fc区的Fc-FcRn和Fab-FcRn结合强度的二维图。
图26显示使用约80RU的通过胺偶联捕获的(sc)FcRn的抗洋地黄毒苷抗体与具有对称M252Y/S254T/T256E突变的IgG1 Fc区的Fc-FcRn和Fab-FcRn结合强度的二维图。
图27亲本与相同亲本抗CD44抗体的五个Fab电荷变体的Fab-FcRn和Fc区-FcRn相互作用的二维图。
图28显示了相同亲本抗CD44抗体的四个Fc区变体的Fab-FcRn和Fc区-FcRn相互作用的二维图(左上图)。
图29使用单臂Fab-Fc区融合监测抗体中引入M252Y/S254T/T256E突变(即单一修饰)对总抗体-FcRn相互作用的影响。
图30使用单臂Fab-Fc区融合监测在抗体中引入V308P/Y436H突变(即单一修饰)对总抗体-FcRn相互作用的影响。
图31使用单臂Fab-Fc区融合监测在抗体中引入I253A/H310A/H435A突变(即单一修饰)和去除Fab(与图29中的mAb-2相比)对总抗体-FcRn相互作用的影响。
图32使用单臂Fab-Fc区融合监测在抗体中引入T307Q/N434A和进一步的V308P/Y436H突变(即两个单一修饰)对总抗体-FcRn相互作用的影响。
图33疏水性和电荷驱动的抗体-FcRn相互作用的去线性化。
图34不同抗体-FcRn相互作用的分析。
图35显示通过增加/添加盐来确定/减弱分子内亲合力以及通过溶液密度来确定/减弱分子间亲合力的二维方案。
图36相互作用检测点图案,其显示对于抗体的药代动力学工程化,例如在引入YTE突变时,匹配亲本抗体相互作用的检测点图案优于转变的检测点图案,因为抗体可能具有改进的热稳定性
图37具有YTE突变的乌司奴单抗与FcRn相互作用的pH依赖性2-维图。
图38布雷奴单抗与FcRn相互作用的pH依赖性2-维图。
图39具有YTE突变的布雷奴单抗与FcRn相互作用的pH依赖性2-维图
图40乌司奴单抗和布雷奴单抗的轻链氨基酸序列比对;CDR标有星号(*)。
图41乌司奴单抗和布雷奴单抗的重链氨基酸序列比对;CDR标有星号(*)。
图42实例中使用的抗体的草图。
根据制造商的信息:
传感器芯片C1具有平坦的羧甲基化表面。提供与传感器芯片CM5相同的官能团,但没有右旋糖酐基质(羧基直接附着于表面层)。不存在表面基质使传感器芯片C1的亲水性低于传感器芯片CM5。传感器芯片C1和传感器芯片CM5的实验方案遵循相同的原则。不存在表面基质将导致固定产率是传感器芯片CM5在可比条件下获得的固定产率的大约10%。
胺偶联利用配体赖氨酸残基的N末端和ε-氨基。
一般来说,固定程序由三个不同的部分组成:
活化:传感器芯片的启动使其可以与另一个分子形成共价键
偶联:注入配体使其与传感器表面形成共价键
失活:注入低分子反应基团以淬灭剩余的活性表面基团
活化:
就基于右旋糖酐的传感器芯片上的共价胺结合化学而言,用NHS(N-羟基琥珀酰亚胺)和EDC(1-乙基-3-(3-二甲基氨基丙基)碳二亚胺)的混合物活化羧基以产生N-羟基-琥珀酰亚胺酯。通过改变活化时间,活化更多或更少的羧基。此外,可以改变NHS/EDC混合物的浓度来控制活化羧基的数量。活化基团的数量决定了有多少配体可以与传感器表面结合。在0.05M NHS/0.2M EDC下,在5μl/min流速下,BIACORE的CM5传感器芯片的标准活化时段为7分钟。
偶联:
配体在所选pH下的反应性决定了配体与活化表面结合的速度。预浓缩速率与固定溶液的配体浓度和pH直接相关。太高的配体浓度将产生高配体预浓缩响应,但也将使得难以固定适量的配体。当传感器芯片达到饱和时,配体与活化表面接触的时间量和结合的配体量之间的关系不是线性的。
固定多少配体:
待固定的配体量取决于应用。
对于特异性测量,几乎任何配体密度都可以,只要它能提供良好的信号。
浓度测量需要最高的配体密度以促进传质阻力。在总传质控制实验中,结合将取决于分析物浓度,而不取决于配体和分析物之间的结合动力学。
可以使用低到中等密度的传感器芯片来完成亲和力排名。重要的是分析物在适当的时间范围内使配体饱和。
动力学应以最低的配体密度完成,该密度仍能提供良好的响应,而不会受到诸如传质或空间位阻的次要因素的干扰。
应使用高密度传感器芯片完成低分子量结合,以结合尽可能多的分析物从而获得正确的信号。
一般来说,对于动力学测量,当注入分析物(1)、(2)时,需要最多100RU的总分析物响应(参见质量传输)。考虑到该值(Rmax),可以通过下式计算待固定的配体量(以响应单位计):Rmax响应/配体响应。
失活:
失活溶液将用过量的试剂封闭所有剩余的活化位点,并且由于其高离子强度和高pH,该溶液将洗掉大部分静电结合的配体。胺偶联程序通常用乙醇胺封闭,但也可以使用BSA或酪蛋白。如果高盐浓度对配体有害,则实验者可以慢慢等待,直到所有活性位点都衰变回羧基。封闭的目的是去除活化基团并使表面尽可能惰性。
如果分析带正电的分析物,则可以用乙二胺封闭表面,以减少传感器表面的负电荷,并且从而降低非特异性结合的可能性。
参考文献:
(1)Karlsson,R.等人,使用基于新型生物传感器的分析系统对单克隆抗体-抗原相互作用进行动力学分析。Journal of Immunological Methods 229-240;(1991)。
(2)Myszka,D.G.1998年光学生物传感器文献调查。J.Mol.Recognit.12:390-408;(1999)。
胺偶联
胺偶联利用配体赖氨酸残基的N末端和ε-氨基。编号点是指固定程序中的不同阶段。
1)连续流动(5μl/min)下未修饰的传感器芯片表面的基线。
2)注入35μl NHS/EDC,从而通过将羧甲基修饰为N-羟基琥珀酰亚胺酯来活化表面。
3)活化后的基线。表面活化对SPR信号(100至200RU)仅具有非常轻微的影响。
4)注入配体(10μg/ml至200μg/ml)导致静电吸引并耦合到表面基质。此时,配体溶液仍然与传感器表面接触,并且响应包括固定的和非共价结合的配体。N-羟基琥珀酰亚胺酯与配体上的胺自发反应形成共价连接(1)。
5)失活前固定的配体。配体已通过传感器表面,并且大部分未共价结合的蛋白质被洗脱。
6)使用用NaOH调节至pH 8.5的35μl 1M盐酸乙醇胺使未反应的NHS-酯失活。SPR信号的增加是由于本体折射率的变化所致。失活过程还去除任何剩余的静电结合配体。
7)点7减去点3得出失活后固定配体的量。
胺偶联是新分子偶联的首选。然而酸性配体(pI<3.5)难以固定。此外,当游离胺基团位于生物活性位点时,必须研究其他化学之一。
参考文献
(1)Johnsson,B.等人,将蛋白质固定到羧甲基右旋糖酐修饰的金表面以用于表面等离子体共振传感器中的生物特异性相互作用分析。Analytical Biochemistry 198:268-277;(1991)。
用于确定Fc-FcRn相互作用的通用SPR方法
所有测量均使用BIAcore T200仪器(GE Healthcare)在25℃下进行。生物素化单链人FcRn用于所有相互作用研究。
FcRn以两种不同的方式固定,即低密度固定和高密度固定。
对于低密度固定,使用标准胺偶联将FcRn固定在C1芯片上。因此,用缓冲液(10mMHEPES;pH 7.4)将蛋白质稀释至浓度为0.245mg/ml,并在芯片表面上注入60秒。固定产生大约80RU的固定水平。
对于高密度固定,通过生物素捕获固定FcRn。首先,使用标准胺偶联将Neutravidin(ThermoScientific)固定在C1芯片上。将Neutravidin在pH为4.5的10mM乙酸钠缓冲液中稀释至0.1mg/ml的浓度,并在芯片表面上注入6分钟。固定产生大约1000RU的固定。固定Neutravidin后,通过在芯片上注入浓度为0.24mg/ml的生物素化蛋白5分钟捕获FcRn。捕获产生大约1700RU的固定水平。
对于与不同抗体的相互作用测量,使用由10mM MES(pH 5.8)、150mM NaCl和0.05%P-20组成的缓冲液。使用单循环或多循环动力学和2倍或3倍稀释系列来分析测试抗体-FcRn相互作用。使用参考流通池和空白进样对记录的传感图进行双参考减去。使用TraceDrawer软件(Ridgeview Instruments AB)评价所得传感图。
- 一种用于解析复杂多聚体蛋白受体的脉冲电子顺磁共振数据的系统及方法与应用
- 用于纯化抗体的连续多步骤方法
- 用于对复杂异质群落中的完整微生物株系进行分析、确定其功能关系及相互作用以及基于此来识别和合成生物活性改性剂的方法、设备和系统
