携带并表达IL-27的肿瘤特异性T淋巴细胞的制备方法
文献发布时间:2024-04-18 19:48:15
技术领域
本发明涉及肿瘤免疫治疗技术领域,具体地说,是关于一种携带并表达IL-27的肿瘤特异性T淋巴细胞的制备方法。
背景技术
肿瘤对人类的生命健康造成十分严重的危害,近二十年来,国内外肿瘤免疫治疗研究取得了重大进展,其中以T淋巴细胞为基础的过继转输治疗已经成为目前临床效果显著的一类新型抗肿瘤免疫治疗方法。它的基本原理是指将自体肿瘤浸润T淋巴细胞(tumorinfiltrating lymphocyte,TIL)在体外刺激扩增,或把自体外周血淋巴细胞经基因工程改造后,使其具有肿瘤抗原特异性,再进一步经体外扩增后制成的细胞制剂回输机体,来达到治疗肿瘤的目的。
然而,T细胞过继免疫治疗实体肿瘤仍有一系列问题有待克服。首先,从肿瘤浸润淋巴细胞中扩增特异性T淋巴细胞的过程冗长,需要的数量巨大。经过长时间体外培养的T淋巴细胞难以在肿瘤微环境中存活并发挥作用。其次,肿瘤诱导扩增的抑制性细胞,如调节性T细胞(Treg)常常限制过继转输的效应T细胞的功能。去除Treg细胞的免疫治疗(如抗CTLA-4抗体治疗)也常常引起严重自身免疫性疾病,导致治疗无法继续或失败。因此,提升过继转输的肿瘤特异性T淋巴细胞的存活能力,抑制Treg细胞亚群是提升T细胞过继免疫治疗的关键。
T细胞过继治疗实体肿瘤取得了很大的成功,但目前对晚期肿瘤的治疗还远未达到满意的效果,其原因在于:肿瘤内部是一个缺氧的微环境,T细胞难以在肿瘤微环境中长期存活并保持杀伤活性;肿瘤微环境呈现免疫抑制的特点,肿瘤诱导的抑制性细胞(如Treg)的扩增可限制肿瘤特异性T细胞发挥抗肿瘤作用;此外,在长期与肿瘤细胞的搏斗过程中,肿瘤特异性T细胞往往呈现功能衰竭(Zhou P,et al:B7 blockade alters thebalance between regulatory T cells and tumor-reactive T cells forimmunotherapy of cancer.Clinical cancer research:an official journal of theAmerican Association for Cancer Research 2009,15(3):960-970)。
IL-27是IL-12细胞因子家族的一员,由一个EBV诱导基因3(EBI3)和P28两个亚单位构成,一般由活化的抗原提呈细胞(APCs)如树突状细胞和巨噬细胞等分泌。IL-27信号通过细胞上异源二聚体受体IL-27R传导至胞内。IL-27R由WSX-1和gp130亚基构成。WSX-1和gp130可以在包括T细胞、NK细胞、B细胞、髓系细胞等多种细胞上表达。IL-27、IL-27R的信号通过增强多种Jak家族信号和激活传导因子STAT1和STAT3从而发挥生物学活性。IL-27不仅能够直接抑制肿瘤的生长、增殖、转移,而且能够通过免疫调控增强其抗肿瘤作用。
发明内容
本发明的目的就在于提供一种新的T细胞治疗肿瘤的方案,以解决目前T细胞过继治疗实体肿瘤中所遇到的肿瘤特异性T细胞在肿瘤微环境中的存活能力较差,以及肿瘤诱导的抑制性细胞(如Treg)的扩增可限制肿瘤特异性T细胞发挥抗肿瘤作用的问题。
为实现上述目的,本发明采用以下解决方案:
本发明的第一个方面,提供了一种携带并表达IL-27的肿瘤特异性T淋巴细胞的制备方法,包括以下步骤:
S1:PCR扩增表达IL-27的基因,插入载体质粒中,获得表达IL-27的重组表达质粒;
S2:将S1获得的重组表达质粒与包装质粒混合后转染包装病毒,得到携带并表达IL-27的逆转录病毒;
S3:将S2得到的逆转录病毒感染分离获得的T淋巴细胞,得到携带并表达IL-27的肿瘤特异性T淋巴细胞。
根据本发明的优选实施例,步骤S1中所述的载体质粒为pMigR1。
根据本发明的优选实施例,步骤S2中所述的包装质粒为pCL-Eco。
根据本发明的优选实施例,步骤S2中所述的转染包装病毒是将转染试剂与重组表达质粒和包装质粒的混合质粒按1∶3的比例混合,然后转染入人胚胎肾细胞HEK-293T中。
本发明的第二个方面,提供了按照上述方法制备得到的携带并表达IL-27的肿瘤特异性T淋巴细胞。
本发明的第三个方面,提供了一种携带并表达IL-27的逆转录病毒的构建方法,包括以下步骤:
S1:PCR扩增表达IL-27的基因,插入载体质粒中,获得表达IL-27的重组表达质粒;
S2:将S1获得的重组表达质粒与包装质粒混合后转染包装病毒,得到携带并表达IL-27的逆转录病毒。
根据本发明的优选实施例,步骤S1中所述的载体质粒为pMigR1。
根据本发明的优选实施例,步骤S2中所述的包装质粒为pCL-Eco。
根据本发明的优选实施例,步骤S2中所述的转染包装病毒是将转染试剂与重组表达质粒和包装质粒的混合质粒按1∶3的比例混合,然后转染入人胚胎肾细胞HEK-293T中。
本发明的第四个方面,提供了按照上述方法构建得到的携带并表达IL-27的逆转录病毒。
本发明具有以下有益效果:
1、本发明通过构建携带并表达IL-27的逆转录病毒,并进一步感染分离获得的T淋巴细胞,得到携带并表达IL-27的肿瘤特异性T淋巴细胞,证实了靶向肿瘤的转基因T淋巴细胞递送IL-27到肿瘤并促进肿瘤免疫治疗的可行性。
2、本发明的方法制备得到的携带并表达IL-27的肿瘤特异性T淋巴细胞用于治疗肿瘤,与单独的肿瘤特异性T淋巴细胞相比,能够显著抑制小鼠的肿瘤生长,延长荷瘤小鼠的生存期,增强T淋巴细胞的治疗效果,并且还能够改善过继肿瘤特异性T淋巴细胞的存活率并抑制Treg细胞亚群。
3、避免了使用现有的提高体内IL-27表达水平来治疗肿瘤的AAV-IL-27系统给药所可能带来的不可预料的副作用,为临床肿瘤免疫治疗开发了一条新途径。
附图说明
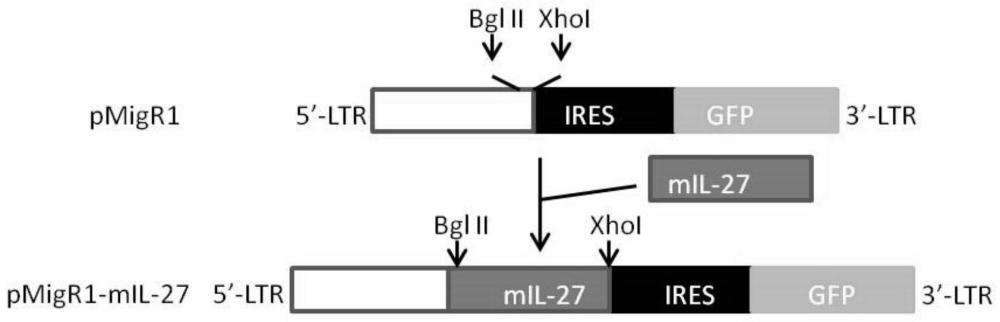
图1为质粒pMigR1-mIL-27的构建示意图。
图2A和2B分别显示了T细胞的早期活化标志蛋白CD69和CD25在IL-27处理后第2、6和9小时后的表达情况。
图3A和3B显示了经IL-27处理后,CD8
图4显示了经IL-27处理后,CD8
图5A和5C显示了经IL-27处理过的体外培养的CD8
图6A、6B和6C显示了OT-1-IL-27能表达IL-27并显示更优化的肿瘤特异杀伤能力。
图7A显示了OT-1-IL-27治疗的小鼠的肿瘤生长明显受到抑制,图7B显示了荷瘤小鼠的生存期得到了延长。
图8A、8B、和8C分别显示了在T细胞过继治疗后的10天、15天和27天,OT-1-IL-27改善了过继T淋巴细胞的存活率;图8D和8E显示了在OT-1-IL-27治疗过的小鼠的脾脏和肿瘤浸润淋巴细胞中检测到更高比例和数目的CD45.1 T细胞。
图9显示了OT-1-IL-27治疗过的小鼠的外周血和脾脏中Treg细胞亚群被明显抑制。
图10A和10B分别显示了使用本发明的OT-1-mIL-27和现有的AAV-IL-27治疗后小鼠体内IL-27的表达水平。
具体实施方式
下面通过具体实施例对本发明的技术方案进一步的详细描述。应理解,所描述的实施例仅是本发明的一部分实施例,而不是全部的实施例。基于本发明的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明的范围。
以下实施例中所使用的实验材料,除特别说明的外,均可通过常规市售途径获得;所涉及的实验操作,如没有特别说明的,均为本领域领域的常规操作,或者按照产品说明书操作。
实施例1、表达IL-27的逆转录病毒的构建
1.1、鼠源IL-27表达质粒pMigR1-mIL-27的构建
1、对pMigR1质粒(Addgene)进行Bgl II、Xho I双酶切,回收大片段;
2、设计mIL-27的引物对,以mIL-27 carrier AAV vectors(Zhu J,Liu JQ,Shi M,Cheng X,Ding M,Zhang JC,et al.IL-27 gene therapy induces depletion of Tregsand enhances the efficacy of cancer immunotherapy.JCI insight.2018;3(7))为模板进行PCR大规模扩增,获得mIL-27基因,其中:
mIL-27的引物对序列如下:
F:5’-GGAAGATCT ATGTCCAAGCTGCTCTTCCT-3’;
R:5’-CCG CTCGAG GGAATCCCAGGCTGAGCCTG-3’;
PCR反应体系如下:
使用PrimeSTAR HS PCR酶(Takara Bio),运用两步法PCR,98℃,10s,68℃,1min30s,30个循环。
3、对步骤2的PCR扩增得到的mIL-27基因进行Bgl II、Xho I双酶切,回收片段后与步骤1得到的大片段用DNA Ligation Kit(Takara Bio)进行连接,转化DH5α感受态细胞(生工生物),以氨苄霉素筛选鉴定从而获得得到表达mIL-27的质粒pMigR1-mIL-27。
鼠源IL-27质粒的构建如图1所示。本领域的技术人员容易理解,虽然本实施例采用pMigR1质粒作为载体,但是根据现有可用载体质粒的情况,以及不同的IL-27的来源等因素,选择其它合适的质粒载体也是容易想到的,本发明并不局限于pMigR1这一种特定的质粒载体。
1.2、逆转录病毒RV-mIL-27-GFP的构建
取上述步骤得到的质粒pMigR1-mIL-27与包装质粒pCL-Eco(Addgene)按照1∶1的比例混合,使用Fugene6转染试剂(Roche)转染包装病毒。转染时,按照转染试剂∶质粒=1∶3将混合质粒转染入人胚胎肾细胞HEK-293T(购自美国ATCC)中,产生表达IL-27的逆转录病毒RV-mIL-27-GFP。转染后48小时和72小时,收集上清病毒液,即为逆转录病毒RV-mIL-27-GFP,浓缩分装后-80℃冰箱保存。
本领域的技术人员容易理解,虽然本实施例采用pCL-Eco作为包装质粒,但是对于本领域的技术人员来说,可以根据实际需要选择其它适合的包装质粒,这是显而易见的,本发明并不局限于pCL-Eco这一特定的包装质粒。
实施例2、携带并表达IL-27的T淋巴细胞OT-1的制备
将实施例1得到的携带并表达IL-27的逆转录病毒RV-mIL-27-GFP感染从OT-1小鼠脾脏分离获得的CD8
逆转录病毒感染细胞时,加病毒RV-mIL-27-GFP和polybrene(HANBIO)到待感染的细胞培养液中,polybrene的终浓度为8ug/ml。30℃、2000rpm 2小时离心细胞,离心后继续培养;48小时后,换成正常细胞培养液,得到携带并表达IL-27-GFP的T淋巴细胞OT-1-mIL-27。
实施例3、IL-27的体外抗肿瘤效果
3.1、IL-27促进体外培养的T淋巴细胞的激活
将从小鼠脾脏分离获得的CD8
由图2A和2B可见,T细胞的早期活化标志蛋白CD69和CD25在IL-27处理后第2、6、和9小时后,表达量均显著高于对照组,可见IL-27能促进体外培养的CD8
3.2、IL-27促进体外培养的T淋巴细胞的增殖
将从小鼠脾脏分离获得的CD8
将体外培养的CD8
由图3A和3B可知,经IL-27处理后,CD8
将从小鼠脾脏分离获得的CD8
由图4可知,经IL-27处理后,CD8
3.3、IL-27促进体外培养的T淋巴细胞的肿瘤特异性杀伤能力
为了研究T淋巴细胞的肿瘤特异性杀伤,我们引进了OT-1小鼠(上海南方模式生物),OT-1小鼠的CD8
取一定数量的IL-27处理5天的体外培养的OT-1 CD8
图5A显示了流式细胞术检测T细胞分泌肿瘤杀伤因子TNF-α的情况,可见经IL-27处理过的体外培养的CD8
图5B是吸掉悬浮的T细胞,加入1%CCK-8(Beytime)的完全培养液,孵育2小时后用酶标仪在450nm测定吸光度(OD)的结果,颜色的深浅和细胞数目呈线性关系,T细胞的杀伤效率=(空白对照孔OD
由图5B的结果可知,经IL-27处理过的体外培养的CD8
图5C显示了实时定量PCR检测T细胞分泌杀伤相关细胞因子的mRNA表达情况,可见经IL-27处理过的体外培养的CD8
实施例4、携带并表达IL-27的T淋巴细胞OT-1-mIL-27的抗肿瘤效果
我们前期的研究结果提示IL-27能显著提高肿瘤特异性T淋巴细胞过继治疗的效果,但因为常用的提高体内IL-27表达的AAV-IL-27系统给药可能有不可预料的副作用。因此,本实施例通过实施例2得到的携带并表达IL-27的肿瘤特异性T淋巴细胞T淋巴细胞OT-1-mIL-27,探索用肿瘤特异性的T淋巴细胞OT-1递送IL-27的肿瘤治疗效果。
4.1、T淋巴细胞OT-1-mIL-27增强肿瘤免疫治疗效果
图6A显示了流式细胞仪检测GFP(IL-27)阳性的肿瘤特异性OT-1 T细胞的比例。图6B显示了细胞培养液上清或小鼠血清用ELISA试剂盒(eBiosciences)检测IL-27的浓度。图6C显示了固定肿瘤细胞B16.OVA的数目,取相应数量的OT-1-mIL-27和OT-1-对照,分别按照比例T细胞/肿瘤细胞=0,1,2,5加入肿瘤细胞中混匀共培养;24小时后吸掉悬浮的T细胞,加入1%CCK-8(Beytime)的完全培养液,孵育2小时后用酶标仪在450nm测定吸光度(OD)的结果,颜色深浅和细胞数目呈线性关系,T细胞的杀伤效率=(空白对照孔OD
酶联免疫吸附测定(enzymelinkedimmunosorbentassay,ELISA)步骤:用coatingbuffer把coating antibody稀释250倍,用于包被反应板(每孔100ul),贴膜置于4℃冰箱过夜;第二天用PBST溶液洗涤3次后,加入100ul diluent buffer室温放置1小时;弃尽diluentbuffer,加入标准品和待测样本,标准品和每个样品做复孔,室温孵育2小时,用PBST洗涤3次;加入含detection antibody的diluent buffer(每孔100ul),室温孵育1小时,用PBST洗涤3次;加入含辣根过氧化物酶HRP的diluent buffer(每孔100ul),室温孵育30分钟,用PBST彻底洗净5次;加入底物液(过氧化氢尿素溶液TMB,每孔50ul),室温避光放置,观察,至浓度最低的标准品逐渐变成蓝色,每孔加入磷酸溶液终止反应,上机检测读板。
图6A、6B和6C的结果显示,实施例2得到的携带并表达IL-27的T淋巴细胞OT-1-mIL-27能表达IL-27并显示更优化的体外肿瘤特异杀伤能力。
取6周龄C57BL6小鼠,皮下注射B16.OVA细胞(5×10
图7A的结果显示,OT-1-mIL-27治疗的小鼠的肿瘤生长明显受到抑制,图7B的结果显示,荷瘤小鼠的生存期得到了延长。
以上结果表明,肿瘤特异性的T淋巴细胞OT-1携带IL-27能显著提高肿瘤浸润淋巴细胞的治疗效果。
4.2、T淋巴细胞OT-1-mIL-27改善过继T淋巴细胞的存活率并抑制Treg细胞亚群
为了得到CD45.1标记的OT-1 CD8
6周龄C57BL6小鼠皮下注射B16.OVA细胞(5×10
取治疗荷瘤小鼠的脾脏和肿瘤制成单细胞悬液,检测脾脏和肿瘤浸润淋巴细胞中CD8
如图8A、8B和8C所示,在T细胞过继治疗后的10天、15天和27天,OT-1-IL-27治疗过的小鼠外周血中与OT-1-对照相比,我们能检测到更高比例和数目的CD45.1 T细胞,说明OT-1-IL-27能改善过继T淋巴细胞的存活率。
如图8D和8E所示,在OT-1-IL-27治疗过的小鼠的脾脏和肿瘤浸润淋巴细胞中也能检测到更高比例和数目的CD45.1 T细胞。
此外,我们还分析了荷瘤小鼠中对肿瘤免疫有抑制作用的Treg细胞的比例,即将外周血或脾脏样本裂红后的单细胞悬液取1×10
4.3、治疗后小鼠体内IL-27表达水平的比较
我们分别检测了OT-1-mIL-27治疗和现有的AAV-IL-27治疗的小鼠体内的IL-27表达水平,结果如图10A和10B所示。
图10B的结果显示现有的AAV-IL-27治疗持续的提高体内IL-27表达水平可能带来的不可预料的副作用,图10A的结果显示采用本发明的OT-1-mIL-27治疗与AAV-IL-27治疗相比小鼠体内IL-27的表达水平明显降低,提示可以有效降低小鼠肿瘤的治疗风险。
虽然以上仅以动物实验验证了携带并表达IL-27的肿瘤特异性T淋巴细胞对于肿瘤治疗的效果,但是本领域的技术人员在本发明所公开的实施例的基础上,容易想到可以将本发明进一步用于开发临床肿瘤治疗。考虑到使用现有的提高体内IL-27表达水平来治疗肿瘤的AAV-IL-27系统给药所可能带来的不可预料的副作用,例如AAV-IL-27和T细胞联合治疗后,高浓度持续的IL-27会带来不安全因素等,本发明无疑为临床肿瘤免疫治疗提供了一条更为安全的新途径。
- 一种抗原特异性的T淋巴细胞杂交瘤及其制备方法和应用
- 肿瘤特异性基因表达盒、重组表达载体及构建方法和应用
- 肿瘤特异性基因表达盒、重组表达载体及构建方法和应用
- 携带并表达IL-27的肿瘤特异性T淋巴细胞的制备方法
- 来源于肿瘤组织的具有肿瘤特异性杀伤效果的T淋巴细胞及其制备方法和细胞制剂
