痘病毒重组嵌合抗原、其亚单位疫苗及其应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明属于生物医药领域,具体涉及一种痘病毒重组嵌合抗原、其亚单位疫苗及其应用。
背景技术
以猴痘病毒为代表的痘病毒是一类核质大DNA病毒,其病毒基因组约为130-375kbp,能够编码多达200种病毒蛋白。除编码病毒蛋白繁复外,痘病毒的病毒颗粒也较为复杂,其具有两种形态不同的感染性病毒颗粒,称为细胞内成熟病毒(IMV)和细胞外包膜病毒(EEV)。其中IMV具有一层囊膜,其相较于EEV具有更高的稳定性,主要参与病毒在宿主间传播。而EEV则具有一层特殊的外膜结构,主要参与病毒在宿主体内的扩散。由于IMV和EEV具有不同的膜结构、膜组份和细胞感染机制,其表面中和抗原也截然不同。
猴痘是一种病毒性人畜共患病,由猴痘病毒(Mpoxvirus,MPXV)感染导致。猴痘病毒与天花病毒同属痘病毒科正痘病毒属,该属共包括四种人致病性病毒,分别是天花病毒(Variola virus,VARV)、猴痘病毒、牛痘病毒(Cowpox virus,CPXV)和痘苗病毒(Vacciniavirus,VACV)。猴痘病毒于1958年由丹麦科学家首次从实验室的猴子身上分离发现,并于1970年在刚果(金)发现首例人感染病例。在此之后,猴痘病毒长期在非洲中西部局部传播,并演化出西非和刚果盆地(中非)2个分支。中非支系传播能力和致病力较强,病死率约为10.6%,主要在加蓬、喀麦隆、刚果(金)、刚果(布)及苏丹等非洲国家流行;西非支系传播能力和致病力较弱,病死率约为3.6%,主要出现在尼日利亚、利比里亚、加纳和塞拉利昂等非洲西部和欧洲等非洲以外国家。自2022年5月份英国确诊了猴痘疫情的第一个病例以来,美国、意大利、瑞典、西班牙、葡萄牙、比利时、德国、澳大利亚等多个国家均陆续出现猴痘确诊病例,猴痘病毒呈全球流行趋势。当地时间2022年7月23日,世界卫生组织(WHO)正式宣布猴痘疫情构成“国际关注的突发公共卫生事件”(PHEIC),这是WHO继2020年新冠疫情后发出的又一最高级别警报。截止2022年10月7日,此次疫情全球累计报告猴痘病例共计71237例,其中死亡病例26例,共涉及107个国家和地区。此外,天花病毒虽然已于上世纪80年代被消灭,但其病原体仍然存在,目前仍有再次威胁人类健康的可能。
目前,全球暂无特异性针对猴痘病毒研发的疫苗,只有2款疫苗可用于预防猴痘病毒感染,分别是安卡拉-巴伐利亚北欧公司(Bavarian Nordic)公司生产的JYNNEOS
简言之,现有获批疫苗均为针对天花病毒研发的弱毒活疫苗,其对猴痘病毒传播的扼制能力仍有待验证;此外,弱毒活病毒存在明显的接种副作用,并可能面临突变导致病毒毒力回强的风险和不确定性。上述问题导致疫苗的接种人群受限,因而其不适宜幼儿、孕妇和免疫功能低下或受损人群的接种。
除接种人群受限和明确的接种副作用外,弱毒活疫苗还存在不确定性和安全隐患,一是潜在的疫苗株突变导致毒力回强带来的安全风险;二是痘病毒作为一种核质大DNA病毒,病毒基因组可以编码多达200种病毒蛋白,因此,活病毒疫苗携带的抗原成分极其复杂,有效免疫原和作用机制不明确,其中包括多种具有免疫抑制功能的病毒蛋白,会给疫苗的免疫和宿主的免疫系统带来负面影响。这些安全隐患和不确定性在免疫力低下的人群如老人、HIV携带者等中表现的尤其明显,这进一步限制了此类免疫弱势人群的疫苗接种。
不仅如此,弱毒活疫苗的活病毒本质导致其产能低、成本高,无法满足人群大范围接种和应急疫苗生产的需求。因此,鉴于现有疫苗的种种弊端,针对近期猴痘病毒的全球流行趋势以及天花等痘病毒未来可能的威胁,亟需借助新技术,开发免疫原成分清晰、作用机制明确、安全有效并可快速获得的新一代疫苗,助力疾病防控。
公开于该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域一般技术人员所公知的现有技术。
发明内容
发明目的
鉴于现有技术疫苗的种种弊端,本发明的目的在于提供一种能够高效地激发针对猴痘病毒的特异性免疫反应(例如,产生保护性抗体)的猴痘病毒重组嵌合抗原,其相关疫苗产品,其制备方法及应用;此外,基于该重组嵌合抗原的疫苗类产品还具有安全、有效、免疫原成分和保护机制清晰、高产能、低成本等优势,从而可满足应急疫苗人群大范围接种的安全性和产能需求。
解决方案
为实现本发明目的,本发明提供了以下技术方案:
第一方面,本发明提供了一种痘病毒重组嵌合抗原,所述重组嵌合抗原包含按照下式(I)排布的氨基酸序列:
A1-C
(I)
式(I)中:
A1表示猴痘病毒A35蛋白(由猴痘病毒A35R基因编码)或其抗原性片段I,或与其具有至少90%,92%,95%,96%,97%,98%或99%同一性且与其具有相同或基本相同的免疫原性的氨基酸序列,
A2表示猴痘病毒A35蛋白(由猴痘病毒A35R基因编码)或其抗原性片段II,或与其具有至少90%,92%,95%,96%,97%,98%或99%同一性且与其具有相同或基本相同的免疫原性的氨基酸序列,
M1表示猴痘病毒M1(由猴痘病毒M1R基因编码)蛋白或其抗原性片段I,或与其具有至少90%,92%,95%,96%,97%,98%或99%同一性且与其具有相同或基本相同的免疫原性的氨基酸序列,
M2表示猴痘病毒M1(由猴痘病毒M1R基因编码)蛋白或其抗原性片段II,或与其具有至少90%,92%,95%,96%,97%,98%或99%同一性且与其具有相同或基本相同的免疫原性的氨基酸序列;
C
其中,
A1与A2相同或不同,
M1与M2相同或不同。
在可行的实现方式中,所述A35蛋白的抗原性片段I或II为该蛋白的胞外段或其一部分;和/或,所述M1蛋白的抗原性片段I或II为该蛋白的胞外段或其一部分。
在一些实施方案中:
所述A1表示如SEQ ID NO:1所示的氨基酸序列,或者如SEQ ID NO:1所示的氨基酸序列经取代、缺失或添加一个或几个氨基酸获得的、与其具有相同或基本相同的免疫原性的氨基酸序列;
和/或,所述A2表示如SEQ ID NO:1所示的氨基酸序列,或者如SEQ ID NO:1所示的氨基酸序列加上由其向A35蛋白的N端延伸1-30个氨基酸的片段的氨基酸序列,或者由上述氨基酸序列经取代、缺失或添加一个或几个氨基酸获得的、与其具有相同或基本相同的免疫原性的氨基酸序列;优选地,所述A2表示如SEQ ID NO:2所示的氨基酸序列,或者如SEQID NO:2所示的氨基酸序列经取代、缺失或添加一个或几个氨基酸获得的、与其具有相同或基本相同的免疫原性的氨基酸序列;
和/或,所述M1与M2相同,表示如SEQ ID NO:3所示的氨基酸序列,或者如SEQ IDNO:3所示的氨基酸序列经取代、缺失或添加一个或几个氨基酸获得的、与其具有相同或基本相同的免疫原性的氨基酸序列。
在优选的实施方案中:
所述A1表示如SEQ ID NO:1所示的氨基酸序列;
所述A2表示如SEQ ID NO:1或SEQ ID NO:2所示的氨基酸序列;
所述M1与M2相同,表示如SEQ ID NO:3所示的氨基酸序列。
进一步优选地,所述A1表示如SEQ ID NO:1所示的氨基酸序列;
所述A2表示如SEQ ID NO:2所示的氨基酸序列;
所述M1与M2相同,表示如SEQ ID NO:3所示的氨基酸序列。
可选地,所述C
更进一步优选地,所述重组嵌合抗原包含如SEQ ID NO:4所示的氨基酸序列;
在具体实施方式中,所述重组嵌合抗原中的2个所述A35R蛋白或其抗原性片段可在适当条件下二聚化,形成稳定的单链二聚体结构。因此,在具体实施方式中,所述重组嵌合抗原可为单链二聚体结构。
此外,作为优选,所述重组嵌合抗原的N端还包含信号肽序列;可选地,所述信号肽序列如SEQ ID NO:5所示;
作为优选,所述重组嵌合抗原的C端还包含标签序列;可选地,所述标签选自Flag标签、His标签、MBP标签、HA标签、myc标签、GST标签、SUMO标签中的至少一种;优选地,所述标签为His标签。
本发明中,为了兼顾针对EEV和IMV两种病毒粒子的免疫保护效应,设计了同时包含EEV的中和抗原A35和IMV的中和抗原M1的重组嵌合抗原,两种中和抗原分别由猴痘病毒的A35R基因和M1R基因编码,与痘苗病毒A33R和L1R为同源基因。
第二方面,本发明提供了一种如上述第一方面所述重组嵌合抗原的制备方法,其包括以下步骤:
在编码如上述第一方面所述重组嵌合抗原的核苷酸序列的5’端加上Kozak序列以及信号肽的编码序列,3’端加上组氨酸标签的编码序列和终止密码子,进行克隆表达,筛选正确的重组子,然后将其转染表达系统细胞进行表达,收集细胞培养上清,从中分离获得所述重组嵌合抗原。
在上述制备方法的一种可行的实现方式中,所述表达系统的细胞为哺乳动物细胞、昆虫细胞、酵母细胞或细菌细胞;
可选地,所述哺乳动物细胞为HEK293T细胞、293F系列细胞或CHO细胞;进一步可选地,所述293F系列细胞为HEK293F细胞、Freestyle293F细胞或Expi293F细胞;
可选地,所述昆虫细胞为sf9细胞、Hi5细胞、sf21细胞或S2细胞;
可选地,所述酵母细胞为毕赤酵母细胞或者由其改造的酵母细胞;
可选地,所述细菌细胞为大肠杆菌细胞。
第三方面,本发明提供了如上述第一方面所述的重组嵌合抗原在制备用于预防和/或治疗痘病毒感染的药物中的应用。
可选地,所述痘病毒选自:猴痘病毒、牛痘病毒、天花病毒和痘苗病毒;
可选地,所述药物为疫苗,优选为重组蛋白疫苗;进一步优选地,所述重组蛋白疫苗采用选自以下的佐剂:铝佐剂、MF59佐剂和类MF59佐剂;
可选地,所述疫苗为鼻喷剂、口服制剂、栓剂或胃肠外制剂的形式;
优选地,所述鼻喷剂选自气雾剂、喷雾剂和粉雾剂;
优选地,所述口服制剂选自片剂、粉末剂、丸剂、颗粒剂、软/硬胶囊剂、薄膜包衣剂和膏剂;进一步优选地,所述片剂为舌下片;进一步优选地,所述颗粒剂为细粒剂;进一步优选地,所述粉末剂为散剂;进一步优选地,所述丸剂为小丸剂;
优选地,所述胃肠外制剂为经皮剂、软膏剂、硬膏剂、外用液剂、可注射制剂;进一步优选地,所述可注射制剂为可推注制剂。
第四方面,本发明提供了一种疫苗或免疫原性组合物,其包含如上述第一方面所述的重组嵌合抗原,以及生理学可接受的媒介物、佐剂、赋形剂、载体和/或稀释剂。
在一些优选的具体实施方案中,所述疫苗或免疫原性组合物为痘病毒重组蛋白疫苗,其包括如上述第一方面所述的重组嵌合抗原和佐剂;
优选地,所述佐剂为选自以下佐剂中的一种或多种:铝佐剂、MF59佐剂和类MF59佐剂。
在可行的实现方式中,所述疫苗或免疫原性组合物为鼻喷剂、口服制剂、栓剂或胃肠外制剂的形式;
优选地,所述鼻喷剂选自气雾剂、喷雾剂和粉雾剂;
优选地,所述口服制剂选自片剂、粉末剂、丸剂、颗粒剂、软/硬胶囊剂、薄膜包衣剂和膏剂;
进一步优选地,所述片剂为舌下片;
进一步优选地,所述颗粒剂为细粒剂;
进一步优选地,所述粉末剂为散剂;
进一步优选地,所述丸剂为小丸剂;
优选地,所述胃肠外制剂为经皮剂、软膏剂、硬膏剂、外用液剂、可注射制剂;进一步优选地,所述可注射制剂为可推注制剂。
第五方面,本发明提供了一种预防和/或治疗痘病毒感染的方法,所述方法包括:向有需要的受试者施用预防和/或治疗有效量的以下物质:如上述第一方面所述的重组嵌合抗原,和/或如上述第四方面所述的疫苗或免疫原性组合物。
所述“预防和/或治疗有效量”可根据给药对象、对象脏器、症状、给药方法等不同而存在差异,可以考虑剂型的种类、给药方法、患者的年龄和体重、患者的症状等,根据医生的判断来确定。
有益效果
本发明的发明人设计了一种针对痘病毒(特别是猴痘病毒)的重组嵌合抗原,其包含按照特定方式排布的两种免疫原:猴痘病毒A35蛋白或其抗原性片段(或它们的衍生肽段),和猴痘病毒M1蛋白或其抗原性片段(或它们的衍生肽段);其中,前者为细胞内成熟病毒颗粒(IMV)上特有的中和抗原,后者为细胞外包膜病毒颗粒(EEV)上特有的中和抗原;包含二者的疫苗能够激发针对两种感染性病毒颗粒的免疫反应。
在具体实施方式中,本发明通过将两个所述猴痘病毒A35蛋白或其抗原性片段与两个所述猴痘病毒M1蛋白或其抗原性片段直接串联或者通过适当的连接序列串联,从而形成单链形式的串联融合多价抗原。在该串联融合多价抗原中,A35形成稳定的二聚体形态,逆转了单独免疫时A35蛋白免疫原性缺失的问题;同时M1抗原的二价化极大地提高了其特异性抗体激发水平;与两个蛋白单独免疫相比,串联融合多价抗原不但保留了两种抗原各自的抗原性,还能更高效地激活针对猴痘病毒的特异性保护性抗体。
与现有技术中的痘病毒疫苗相比,基于本发明的重组嵌合抗原的疫苗类产品具有以下优势:
1)亚单位疫苗具有更好的安全性,因而克服了现有的弱毒活病毒疫苗的安全性问题;同时,相比弱毒活病毒疫苗,亚单位疫苗具有生产成本低、能够快速响应和产能支撑优势;经实验验证,本发明的痘病毒疫苗具有良好的有效性;
2)运用猴痘病毒自身的抗原序列,对于猴痘病毒具有较高的特异性;现有的活病毒疫苗均是以痘苗病毒为基础开发而成的,痘苗病毒虽与猴痘病毒同属痘病毒科,但二者的中和抗原序列和抗原表位仍存在一定差异,因此,其对猴痘病毒的保护效果尚待明确,而本发明的痘病毒疫苗是基于猴痘病毒的抗原表位开发的,因此,其对猴痘病毒的防治具有较高的特异性;
3)猴痘病毒中的蛋白种类繁多,其中绝大多数蛋白不能激发有效的抗病毒免疫反应,即为无效成分,此外,还有一些病毒蛋白具有免疫抑制作用;现有的活病毒疫苗无法去除上述无效和有害成分,因此存在接种风险和不确定性,而本发明的痘病毒疫苗只保留2种病毒中和抗原,实验数据表明,仅这2种抗原既可在小鼠模型中展现完全的保护效应。
附图说明
一个或多个实施例通过与之对应的附图中的图片进行示例性说明,这些示例性说明并不构成对实施例的限定。在这里专用的词“示例性”意为“用作例子、实施例或说明性”。这里作为“示例性”所说明的任何实施例不必解释为优于或好于其它实施例。
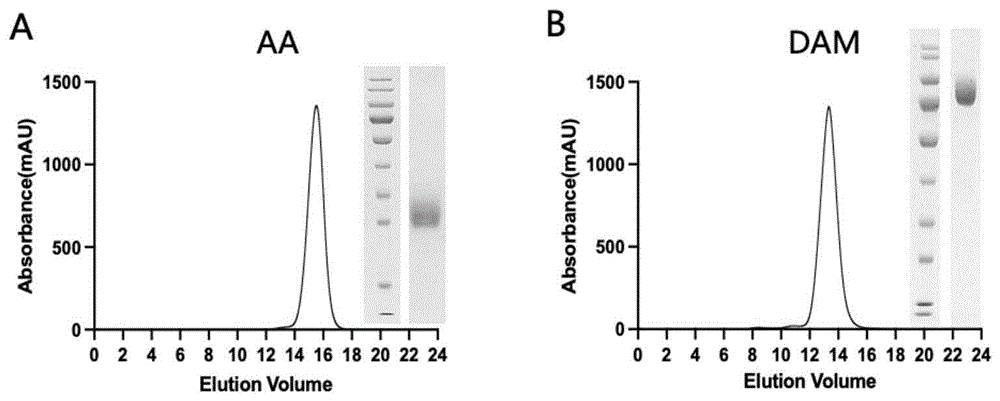
图1显示了本发明实施例2中所表达的免疫原蛋白AA和DAM的凝胶过滤层析洗脱曲线和SDS-PAGE鉴定结果。
图2显示了本发明实施例2中所表达的单一免疫原蛋白A35和M1的凝胶过滤层析洗脱曲线和SDS-PAGE鉴定结果。
图3显示了本发明实施例3中所检测的免疫原蛋白M1(A)、DAM(B)结合中和抗体7D11的亲和力分析结果。
图4显示了本发明实施例3中所检测的免疫原蛋白A35(A)、AA(B)和DAM(C)结合中和抗体A27D7的亲和力分析结果。
图5是本发明实施例4、实施例7中所采用的小鼠免疫和攻毒策略示意图。
图6显示了本发明实施例5中所检测的免疫小鼠血清中的特异性结合抗体滴度,其中,图6A为针对各免疫原的特异性抗体水平,图6B为针对M1和A35表位的特异性抗体水平。
图7显示了本发明实施例6中所检测的免疫小鼠血清对VACV活病毒的中和抗体滴度。
图8显示了本发明实施例7中记载的采用不同剂量VACV-WR病毒滴鼻感染BALB/c小鼠的预实验结果,其中,横坐标显示的是攻毒后天数,纵坐标显示的是小鼠的存活百分率。
图9显示了本发明实施例7中记载的各免疫原蛋白对于VACV-WR病毒滴鼻攻击BALB/c小鼠的保护效应,其中,横坐标显示的是攻毒后天数,纵坐标显示的是小鼠的体重变化百分比(A)和存活百分率(B)。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
另外,为了更好的说明本发明,在下文的具体实施方式中给出了众多的具体细节。本领域技术人员应当理解,没有某些具体细节,本发明同样可以实施。在一些实施例中,对于本领域技术人员熟知的原料、元件、方法、手段等未作详细描述,以便于凸显本发明的主旨。
除非另有其它明确表示,否则在整个说明书和权利要求书中,术语“包括”或其变换如“包含”或“包括有”等等将被理解为包括所陈述的元件或组成部分,而并未排除其它元件或其它组成部分。
实施例1:免疫原设计
本实施例中,作为本发明的代表性实例,将两个EEV中和抗原A35与两个IMV中和抗原M1按照从N端到C端依次为A35-M1-A35-M1的排布方式进行串联,所形成的单链融合肽可形成A35-A35二聚化的单链四亚基结构,以下简称DAM,其代表本发明的重组嵌合抗原。
以下序列均采用猴痘病毒分离株MPXV_USA_2022_MA001的序列,该病毒完整基因组的GenBank号为ON563414.3。
所述DAM中,两个A35中和抗原采用不同的A35蛋白片段,一个是A35蛋白的S90-T181肽段(其氨基酸序列如SEQ ID NO:1所示),另一个是A35R蛋白的S64-T181肽段(其氨基酸序列如SEQ ID NO:2所示),两个M1中和抗原的氨基酸序列相同,均为如SEQ ID NO:3所示的氨基酸序列;由此,所述DAM的氨基酸序列如SEQ ID NO:4所示。
在构建所述DAM的过程中,为了蛋白表达与纯化的需要,发明人还在如SEQ IDNO:4所示的DAM氨基酸序列的N端加上信号肽序列(如SEQ ID NO:5所示),在其C端加上6个组氨酸标签,从而形成如下SEQ ID NO:6所示的完整构建体:
DAM完整构建体(SEQ ID NO:6)
其中,最前面的下划线部分为信号肽序列,黑体部分为两个A35肽段的氨基酸序列,斜体部分为两个M1肽段的氨基酸序列,最后面的下划线部分为组氨酸标签序列。
此外,作为对比,本实施例中还设计了仅由两个EEV中和抗原A35串联形成的A35-A35单链二聚体结构,以下简称AA;所述AA构建中,除了不包含两个M1肽段外,其余序列与上述DAM构建的相同;同样地,为了蛋白表达与纯化的需要,发明人还在其N端加上信号肽序列(如SEQ ID NO:5所示),在其C端加上6个组氨酸标签,从而形成如下SEQ ID NO:7所示的完整构建体:
AA完整构建体(SEQ ID NO:7)
其中,最前面的下划线部分为信号肽序列,黑体部分为第一个A35肽段的氨基酸序列,斜体部分为第二个A35肽段的氨基酸序列,最后面的下划线部分为组氨酸标签序列。
此外,作为对比,本实施例还设计了单一抗原M1和A35肽段的表达构建体,M1和A35肽段的氨基酸序列分别如下:
M1肽段的氨基酸序列(SEQ ID NO:8):
MGAAASIQTTVNTLSERISSKLEQEANASAQTKCDIEIGNFYIRQNHGCNITVKN
MCSADADAQLDAVLSAATETYSGLTPEQKAYVPAMFTAALNIQTSVNTVVRDFENYV
KQTCNSSAVVDNKLKIQNVIIDECYGAPGSPTNLEFINTGSSKGNCAIKALMQLTTKATTQIAPRQVAG;
A35肽段的氨基酸序列(SEQ ID NO:9):
MSTTQYDHKESCNGLYYQGSCYILHSDYKSFEDAKANCAAESSTLPNKSDVLTTWLIDYVEDTWGSDGNPITKTTSDYQDSDVSQEVRKYFCT。
实施例2:免疫原蛋白的表达与纯化
构建体DAM和AA的表达与纯化
对实施例1中所设计的构建体DAM和AA的氨基酸序列进行人源密码子优化,获得编码DAM、AA抗原的核苷酸序列,分别如SEQ ID NO:10、SEQ ID NO:11所示;在这些核苷酸序列的5’端加入Kozak序列(GCCACC)、3’端加入翻译终止密码子,然后,人工合成这些DNA片段,将其克隆到pCAGGS载体的EcoRI和XhoI酶切位点之间,得到构建体DAM和AA的表达质粒。
将上述DAM和AA的表达质粒分别转染293F细胞,以进行体外重组表达;转染后5-7天,收集细胞上清,其中含有所表达的免疫原蛋白;然后,进行蛋白纯化;具体地,将含有免疫原蛋白的细胞上清经镍离子亲和层析(HisTrap
凝胶过滤层析的洗脱曲线及SDS-PAGE鉴定结果如图1所示,图1表明,经过两步纯化后,可获得高纯度AA和DAM蛋白,分子量分别为~25kDa和~75kDa,符合预期。
单一免疫原M1和A35的表达与纯化
将实施例1中设计的单一抗原M1和A35肽段的氨基酸序列进行人源密码子优化,获得编码M1、A35肽段的核苷酸序列,分别如SEQ ID NO:12、SEQ ID NO:13所示;在这些核苷酸序列的3’端加入翻译终止密码子,然后,人工合成这些DNA片段,将其克隆到pET-28a表达载体中,得到M1和A35的表达质粒。
将上M1和A35的表达质粒通过大肠杆菌(E.coli)系统表达,所形成的包涵体经精氨酸稀释复性的方法,体外复性为活性蛋白M1和A35;然后,将复性所得M1或A35蛋白用凝胶过滤层析柱Superdex200 100/300GL进行纯化,最后,通过SDS-PAGE鉴定蛋白纯度和分子量。
凝胶过滤层析的洗脱曲线及SDS-PAGE鉴定结果如图2所示,由图2可知,经过上述凝胶过滤层析纯化后,可获得高纯度M1和A35蛋白;其中,M1蛋白的出峰位置和SDS-PAGE均显示为~20kDa,符合预期;A35蛋白的出峰位置对应分子量为25kDa,而SDS-PAGE显示为~12kDa,由此可知,A35蛋白为分子间互作力形成的二聚体,符合既往文献报道。
实施例3:免疫原的抗原性检测
为了检测本发明的重组嵌合抗原的各抗原表位的暴露情况及其抗原性,本实施例中,通过表面等离子共振(SPR)实验方法,分别检测了实施例2所表达和纯化的免疫原蛋白(包括单链融合免疫原蛋白DAM和AA以及单个抗原蛋白M1和A35)结合中和抗体7D11和A27D7的能力;7D11和A27D7抗体分别为痘苗病毒抗原L1和A33的中和抗体,有数据表明,它们可以交叉识别猴痘病毒的M1和A35抗原,其中,抗体A27D7能够识别A35的二聚体表位。
结果如图3和图4所示。
由图3A和3B可知,单个抗原M1与中和抗体7D11的亲和力为3.3nM,呈现慢结合慢解离的结合模式;而本发明的重组嵌合抗原DAM与7D11的亲和力相对于M1提高了3倍,表现为结合速率(kon)增加,同时解离速率(koff)降低,表明DAM上二价的M1表位均暴露在外,可以被特异性抗体识别,同时,M1的二价化提高了DAM上M1的表位数,从而提高了抗体对其的结合能力和抗原性;
由图4A-C可知,单个抗原A35与抗体A27D7的亲和力为2.2μM,呈现快结合快解离的结合模式;单链融合免疫原AA与抗体A27D7的亲和力与单个抗原A35的相似;本发明的重组嵌合抗原DAM与抗体A27D7的亲和力与上面二者相似,表明:DAM上的A35表位暴露,并呈稳定的二聚体形态。
以上数据均表明:本发明的重组嵌合抗原DAM上的A35和M1抗原表位均能较好地暴露,具有较高的抗原性;特别是,其中的M1表位的二价化使得其抗原性较单一抗原蛋白M1有了极大的提高。
实施例4:小鼠免疫实验
为验证本发明的重组嵌合抗原的免疫保护效力,发明人将实施例2中获得的各免疫原蛋白分别与AddaVax
免疫实验中,小鼠全部采用雌性BALB/c小鼠,周龄为6-8周,平均体重为15-20g。每个实验组采用6只小鼠。如图4所示,小鼠分别在第0天,第21天和第42天接受免疫,共计3次,每次剂量为10μg/只;接种方式为肌肉注射,注射位置位于小鼠大腿处,左右腿各注射50μL。
VACV-VTT则采用尾根部划痕方式免疫小鼠,具体地,在第0天进行免疫,共免疫一次,免疫剂量为10
在二免、三免和攻毒前两天(即,第19、第40和第54天),对所有组别小鼠分别进行眼眶采血。通过静置凝血后1500rpm离心10分钟,获得小鼠血清,立刻将小鼠血清分装并置于-80℃冰箱保存,用于后续特异性抗体滴度的ELISA检测和活病毒中和能力测定。
实施例5:ELISA实验检测疫苗诱导的特异性抗体效价
将用于小鼠免疫的各免疫原蛋白(即,单一抗原蛋白A35和M1,单链融合免疫原AA和DAM,由实施例2制备)用ELISA包被液(索莱宝,C1050)稀释到2μg/mL,向96孔ELISA板(Corning,3590)每孔加入100μL上述稀释好的免疫原蛋白或痘苗天坛株感染后的细胞裂解物(用于弱毒活疫苗免疫组的抗体效价检测),4℃静置过夜;弃掉包被液,加入PBS洗去残留包被液,加入100μL ELISA封闭液(PBST配制的10%脱脂奶粉),室温静置1小时以进行封闭。封闭期间,将免疫小鼠血清用ELISA封闭液进行稀释,从200倍起进行3倍倍比稀释,每个样品做11个稀释度;待封闭完成后,去除封闭液,将用封闭液10倍稀释的免疫小鼠血清加入到ELISA板中,每个稀释度100μL,室温孵育1小时,之后用PBST洗3遍;然后,加入用封闭液1:4000稀释的HRP标记的山羊抗鼠二抗(Abcam,ab6789),室温孵育1小时,之后用PBST洗5-6遍,加入TMB显色液显色,反应适当时间后加入2M盐酸终止反应。在酶标仪上检测OD
各免疫原蛋白所免疫小鼠的血清特异性抗体效价检测结果如图6所示,其中,图6A为针对各免疫原的特异性抗体水平,图6B为针对M1和A35表位的特异性抗体水平;由图6A可知:本发明的单链融合抗原DAM在第一次免疫后即能很好地激发出特异性抗体,并且,在每次免疫后的特异性抗体滴度均优于包括弱毒活疫苗免疫在内的所有对照组;值得一提的是,就A35表位而言,A35蛋白单独免疫无法激发特异性抗体,免疫原性缺失,而单链融合改造后的AA和DAM则能够有效地激发针对A35表位的特异性抗体反应,具有较好的免疫原性(图6B);并且,DAM能够同时高水平地激发针对A35和M1表位的特异性抗体反应,且均高于单独免疫组(AA和M1,图6B);
实施例6:免疫血清的VACV活病毒中和能力测定
痘苗病毒(Vacciniavirus,VACV)是痘病毒属的模式病毒,由于痘病毒属的主要免疫原间具有较高的同源性,国际上通常将生物安全等级较低、易于操作的痘苗病毒用于其他痘病毒疫苗的细胞水平中和能力评价和小鼠模型中的保护效力评价。因此,本实施例中,采用国际上经常使用的痘苗病毒小鼠适应株Western Reserve(VACV-WR),进行各免疫原蛋白的细胞水平的活病毒中和能力测定。
将实施例4获得的免疫小鼠血清用含2%灭活血清的培养基(DMEM)稀释,从20倍起进行2倍倍比稀释,每个样品做10个稀释度。VACV-WR病毒也用相同的稀释液稀释到500PFU/mL。取200μL稀释好的免疫小鼠血清(不含免疫小鼠血清的稀释液用作对照孔)与200μL稀释好的病毒液混合,37℃孵育1小时。Vero细胞提前一天种于12孔板中,第二天密度约为95%时为最佳密度。将12孔板中的培养基弃去,用PBS洗去残留的培养基后,将孵育好的血清-病毒混合液加入到12孔板中,37℃感染2小时。感染后,去除病毒-血清混合液,用PBS洗去残留病毒,加入配置好的羧甲基纤维素-DMEM混合液(2%的羧甲基纤维素和2×DMEM按照1:1混合),37℃培养48-60小时。显微镜下观察到明显的CPE后,加入4%多聚甲醛固定液,室温固定2小时后,结晶紫染色,计数。
PRNT
结果见图7。
由于活病毒中和实验采用的毒株VACV-WR株,其几乎不产生EEV,因此我们的中和实验均使用IMV。
如图7所示,由于A35不存在于IMV病毒粒子上,因此A35和AA免疫组在活病毒的中和水平上不能体现出中和能力;而M1、DAM和VACV-VTT免疫组均能产生针对IMV病毒粒子的中和抗体,其中,DAM的中和抗体激发能力明显高于M1以及弱毒活疫苗VACV-VTT免疫组。
实施例7:攻毒保护实验
VACV-WR病毒株滴鼻感染BALB/c小鼠时,可导致小鼠死亡。为确定合适的攻毒剂量,我们首先对17-19周龄(与三次免疫后攻毒时周龄一致)的BALB/c小鼠进行不同剂量VACV-WR病毒的滴鼻感染预实验,以测定我们实验体系下VACV-WR感染BALB/c小鼠的LD50。预实验结果如图8所示,在攻毒量为2×10
如图5所示,实施例4中三次免疫的小鼠在三免后两周,即,第56天进行7LD50的VACV-WR病毒滴鼻攻毒实验,以评价疫苗在动物模型中的保护效果,各攻毒实验组小鼠的体重变化百分比和存活百分率结果分别见图9A和图9B。
图9A和9B的结果表明,单一抗原A35免疫组对VACV-WR病毒感染的小鼠无保护效果,全部小鼠在攻毒后6天全部死亡,这与其不能有效的激发出特异性抗体结果一致;单一抗原M1和单链融合免疫原AA尽管在实施例4中可见较高水平的特异性抗体水平,且在实施例5中可见较高水平中和抗体激发能力,但是其只能保护60%的小鼠免于VACV-WR感染致死,存活小鼠也表现出很大程度的体重下降;相比以上各组,本发明的单链融合免疫原DAM能对VACV-WR感染小鼠起到100%的保护效果,且未出现明显的体重变化。
上述结果表明:本发明的单链融合免疫原DAM在小鼠模型中呈现出极佳的保护效果。
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明技术方案的精神和范围。
本申请所涉及的序列:
SEQ ID NO:1(DAM中的第一个A35肽段的氨基酸序列)
SEQ ID NO:2(DAM中的第二个A35肽段的氨基酸序列)
SEQ ID NO:3(DAM中的M1肽段的氨基酸序列)
SEQ ID NO:4(DAM的氨基酸序列)
SEQ ID NO:5(信号肽的氨基酸序列)
SEQ ID NO:6(实施例1中的DAM完整构建体的氨基酸序列)
SEQ ID NO:7(实施例1中的AA完整构建体的氨基酸序列)
SEQ ID NO:8(实施例1中的单一抗原M1肽段的氨基酸序列)
MGAAASIQTTVNTLSERISSKLEQEANASAQTKCDIEIGNFYIRQNHGCNITVKNMCS
ADADAQLDAVLSAATETYSGLTPEQKAYVPAMFTAALNIQTSVNTVVRDFENYVKQT
CNSSAVVDNKLKIQNVIIDECYGAPGSPTNLEFINTGSSKGNCAIKALMQLTTKATTQI
APRQVAG
SEQ ID NO:9(实施例1中的单一抗原A35肽段的氨基酸序列)
MSTTQYDHKESCNGLYYQGSCYILHSDYKSFEDAKANCAAESSTLPNKSDVLTTWLI
DYVEDTWGSDGNPITKTTSDYQDSDVSQEVRKYFCT
SEQ ID NO:10(编码如SEQ ID NO:6所示的DAM完整构建体的核苷酸序列)
/>
SEQ ID NO:11(编码如SEQ ID NO:7所示的AA完整构建体的核苷酸序列)
SEQ ID NO:12(编码单一抗原M1肽段(即,SEQ ID NO:8)的核苷酸序列)
atgggagcagctgcgtcaatacaaacaactgtaaacaccctgagcgaacgtattagctccaaacttgagcaagaggcaaacgcgagc
gcgcaaacgaaatgcgatattgagatcggcaacttctatatccgccaaaatcacggttgtaatattaccgtcaagaacatgtgcagcgcg
gacgcggacgcgcagctggacgccgttttgtctgcagcgaccgaaacctattccggtctgaccccggagcagaaagcgtacgttccg
gctatgttcaccgcagcactcaatatccaaaccagcgtcaataccgttgttcgtgattttgaaaattacgtgaagcagacgtgcaactcct
cggcggtggtggataacaaactgaagatccaaaacgtgattatcgacgaatgttacggcgctccgggttctccgaccaacttggagttt
atcaacactggcagcagcaaaggcaactgcgctattaaggcgctgatgcagctgactacaaaggcgaccacgcagatcgccccacg
tcaggtggccggt
SEQ ID NO:13(编码单一抗原A35肽段(即,SEQ ID NO:9)的核苷酸序列)
atgtcaactacacaatatgatcacaaagaaagttgcaacggcttatattatcagggttcttgttatatcctgcacagcgactacaagtctttt
gaggatgcgaaagctaactgcgcggcagaaagcagcaccctgccgaataagtccgacgtgttgaccacgtggctgatcgattacgtg
gaagatacctggggttccgacggcaacccgattaccaaaactacgagcgactaccaggatagcgacgtttcgcaagaggttcgtaaat
acttctgcacc
- 一组山羊痘病毒重组蛋白抗原制备方法及其应用
- 嵌合抗原受体及其基因和重组表达载体、CD19-CD20双靶向性的T细胞及其应用
- 单一位点嵌合巴氏杆菌PlpE抗原表位的兔出血症病毒VP60重组抗原及其制备和应用
- 双位点嵌合巴氏杆菌PlpE抗原表位的兔出血症病毒VP60重组抗原及其制备和应用
