一种CD3、CD20双克隆抗体蛋白含量测定的检测方法
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及CD3、CD20双克隆抗体蛋白含量检测技术领域,具体为一种CD3、CD20双克隆抗体蛋白含量测定的检测方法。
背景技术
目前常见的蛋白含量检测方式有酶联免疫吸附(Elisa)法、福林酚(Lowry)法、凯氏定氮(Kjedahl)法、双缩脲(Biuret)法、紫外吸收法、考马斯亮蓝(Bradford)法、BCA法,但对于双克隆抗体,由于其蛋白含量较低,所以以上方法均无法满足需求。
Elisa法、福林酚(Lowry)法和考马斯亮蓝(Bradford)法虽然检测灵敏度较高,但Elisa法检测过程中重复性较差,检测步骤繁琐,检测时间通常在20h以上;福林酚(Lowry)法和考马斯亮蓝(Bradford)法影响检测的干扰物质较多,对检测结果影响较大;凯氏定氮(Kjedahl)法检测灵敏度低适用于0.2~1.0mg氮,且检测时间为8~10小时;双缩脲(Biuret)法检测灵敏度低,适用于1~10mg/ml,且不同蛋白质显色相似;紫外吸收法较为灵敏,适用于0.2~2mg/ml,但所检样品低于0.2mg/ml时无法满足需求;BCA法检测灵敏度为20~200μg/ml,但检测结果受到蛋白质内半胱氨酸,酪氨酸,色氨酸含量的影响。
因此,对于上述现有检测方法均存在着不同程度的技术缺陷问题,本发明提出一种CD3、CD20双克隆抗体蛋白含量测定的检测方法。
发明内容
本发明目的是提供一种CD3、CD20双克隆抗体蛋白含量测定的检测方法,以解决上述背景技术中的问题。
为实现上述目的,本发明提供如下技术方案:一种CD3、CD20双克隆抗体蛋白含量测定的检测方法,包括以下步骤:
S1,CD3、CD20双克隆抗体样品检测:
从CD3、CD20双克隆抗体样品溶液中取样,并将溶液通过色谱柱中,采用高效液相色谱进行检测;
其中,高效液相色谱条件包括:采用C4反相色谱柱;荧光检测器的激发波长:280nm;发射波长:345nm;流动相为流动相A与流动相B的混合溶液,所述流动相A为三氟乙酸水溶液,所述流动相B为三氟乙酸乙腈溶液;梯度洗脱;
S2,标准曲线绘制:
利用高效液相色谱绘制色谱图曲线:绘制目标物的标准曲线,通过HPLC保留时间和目标峰值,对样品进行定量分析。
优选的,所述流动相A为体积分数0.05%~0.1%的三氟乙酸水溶液;流动相B为体积分数0.05%~0.1%三氟乙酸乙腈溶液。
优选的,所述流动相A为体积分数0.05%的三氟乙酸水溶液;流动相B为体积分数0.05%三氟乙酸乙腈溶液。
优选的,所述流动相A与流动相B的优选初始体积配比为(65~75):(25~35)。
优选的,所述流动相A与流动相B的优选初始体积配比为70:30。
优选的,所述流动相的流速为0.8ml/min~1.2ml/min。
优选的,所述流动相的流速为1.0ml/min。
优选的,所述色谱柱温度为35℃~40℃。
优选的,所述色谱柱温度为40℃。
本发明至少具备以下有益效果:
(1)本发明提供的一种CD3、CD20双克隆抗体蛋白含量测定的检测方法,通过不断优化检测条件,对CD3、CD20双克隆抗体进行检测,确定最佳液相色谱条件,绘制标准曲线,实现对CD3、CD20双克隆抗体定量分析,本发明标准曲线回归系数R
(2)本发明提供的一种CD3、CD20双克隆抗体蛋白含量测定的检测方法,专属性强,样品保留时间为4.7min;操作简单,对于蛋白量在标准曲线检测范围内的样品,无需进行处理,直接进行检测;检测时间短,每个样品检测时间为13min。
附图说明
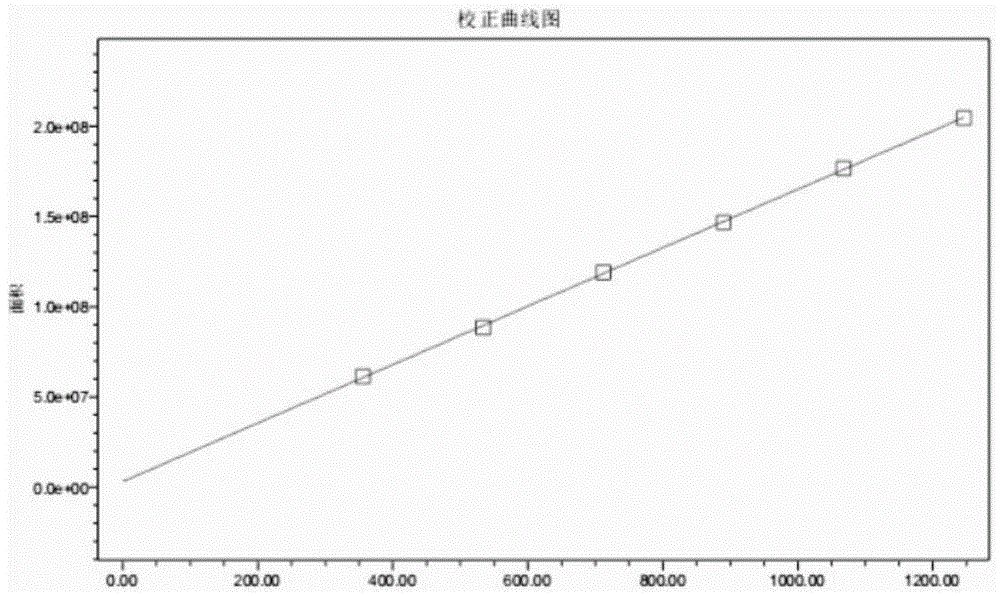
图1为CD3、CD20双克隆抗体的色谱的标准曲线图;
图2为其它条件不变,流动相A与动相B的初始体积配比为75:25条件下CD3、CD20双克隆抗体的色谱曲线图;
图3为其它条件不变,流速0.8ml/min下CD3、CD20双克隆抗体的色谱曲线图;
图4为其它条件不变,色谱柱温度35℃下CD3、CD20双克隆抗体的色谱曲线图。
具体实施方式
下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
实施例1
一种CD3、CD20双克隆抗体蛋白含量测定的检测方法,包括以下步骤:
S1,CD3、CD20双克隆抗体样品检测:
从CD3、CD20双克隆抗体样品溶液中取样,并将溶液通过色谱柱中,采用高效液相色谱进行检测;
其中,高效液相色谱条件包括:采用C4反相色谱柱;荧光检测器的激发波长:280nm;发射波长:345nm;流动相为流动相A与流动相B的混合溶液,所述流动相A为三氟乙酸(TFA)水溶液,所述流动相B为三氟乙酸(TFA)乙腈溶液;梯度洗脱;
S2,标准曲线绘制:
利用高效液相色谱绘制色谱图曲线:绘制目标物的标准曲线,通过HPLC保留时间和目标峰值,对样品进行定量分析。
其中,流动相A为体积分数0.08%的三氟乙酸(TFA)水溶液;流动相B为体积分数0.08%三氟乙酸(TFA)乙腈溶液。
其中,流动相A与流动相B的优选初始体积配比为65:25。
其中,流动相的流速为0.8ml/min。
其中,色谱柱温度为35℃。
实施例2
一种CD3、CD20双克隆抗体蛋白含量测定的检测方法,包括以下步骤:
S1,CD3、CD20双克隆抗体样品检测:
从CD3、CD20双克隆抗体样品溶液中取样,并将溶液通过色谱柱中,采用高效液相色谱进行检测;
其中,高效液相色谱条件包括:采用C4反相色谱柱;荧光检测器的激发波长:280nm;发射波长:345nm;流动相为流动相A与流动相B的混合溶液,所述流动相A为三氟乙酸(TFA)水溶液,所述流动相B为三氟乙酸(TFA)乙腈溶液;梯度洗脱;
S2,标准曲线绘制:
利用高效液相色谱绘制色谱图曲线:绘制目标物的标准曲线,通过HPLC保留时间和目标峰值,对样品进行定量分析。
其中,流动相A为体积分数0.1%的三氟乙酸(TFA)水溶液;流动相B为体积分数0.1%三氟乙酸(TFA)乙腈溶液。
其中,流动相A与流动相B的优选初始体积配比为75:35。
其中,流动相的流速为1.2ml/min。
其中,色谱柱温度为37℃。
实施例3
一种CD3、CD20双克隆抗体蛋白含量测定的检测方法,包括以下步骤:
S1,CD3、CD20双克隆抗体样品检测:
从CD3、CD20双克隆抗体样品溶液中取样,并将溶液通过色谱柱中,采用高效液相色谱进行检测;
其中,高效液相色谱条件包括:采用C4反相色谱柱;荧光检测器的激发波长:280nm;发射波长:345nm;流动相为流动相A与流动相B的混合溶液,所述流动相A为三氟乙酸(TFA)水溶液,所述流动相B为三氟乙酸(TFA)乙腈溶液;梯度洗脱;
S2,标准曲线绘制:
利用高效液相色谱绘制色谱图曲线:绘制目标物的标准曲线,通过HPLC保留时间和目标峰值,对样品进行定量分析。
其中,流动相A为体积分数0.05%的三氟乙酸(TFA)水溶液;流动相B为体积分数0.05%三氟乙酸(TFA)乙腈溶液。
其中,流动相A与流动相B的优选初始体积配比为70:30。
其中,流动相的流速为1.0ml/min。
其中,色谱柱温度为40℃。
实施例3的具体检测方式如下:
实验材料:CD3、CD20双克隆抗体样品
1、仪器:
高效液相色谱仪(Waters e2695)、C4(Symmtey 300TM C4,4.6*250mm,5μm)色谱柱(Waters)、分析天平、台式离心机、离心管等。
2、试剂:
三氟乙酸TFA(色谱级)、乙腈(色谱级)、超纯水(屈臣氏)。
3、试剂配制:
流动相A(0.05%三氟乙酸(TFA)水溶液)的配制:量取1000ml超纯水加入500μlTFA,超声脱气20min;
流动相B(0.05%三氟乙酸(TFA)乙腈溶液)的配制:量取1000ml乙腈加入500μlTFA,超声脱气20min。
4、检测过程
4.1、CD3、CD20双克隆抗体样品溶液前处理:
将样品8000rcf离心5min后,进行检测。
4.2、CD3、CD20双克隆抗体样品检测:
4.2.1、液相条件:
流动相包括流动相A和流动相B的组合,流动相A为体积分数0.05%三氟乙酸(TFA)水溶液,流动相B为体积分数0.05%三氟乙酸(TFA)乙腈溶液;流动相A与动相B的初始体积配比为70:30;
洗脱梯度为30%流动相B溶液,0.2min;30~65%流动相B溶液,0.7min;65~100%流动相B溶液,2.5min;100%流动相B溶液,4.6min;100~30%流动相B溶液,0.1min;30%流动相B溶液,4.7min;选流为1.0ml/min。
4.2.2、实验步骤:
开机,待仪器自检通过后,连接仪器和电脑,依次进行Seal wash、Needle wash、Purge injector、用流动相进行Wet prime,完成后,用流动相A、B充满管路,连接色谱柱。
参数设置为:柱温40℃,荧光检测器的激发波长:280nm;发射波长:345nm;最大压力4000psi,流速1.0ml/min。
样品分析梯度如表1所示,系统平衡至基线水平,进行检测。
表1洗脱梯度
4.2.3、标准曲线绘制:
利用高效液相色谱绘制目标物的标准曲线,通过HPLC保留时间和目标峰值,以蛋白量为横坐标,峰面积为纵坐标,绘制标准曲线,对样品进行定量分析,见图1。
实施例4
根据实施例3的实施条件,其他不变,流动相A与动相B的初始体积配比调整为75:25,如表2,利用高效液相色谱对CD3、CD20双克隆抗体样品进行检测并绘制色谱图,见图2,结果显示峰拖尾现象明显,峰高、峰面积不变。
表2洗脱梯度
实施例5
根据实施例3的实施条件,其他不变,流速调整为0.8ml/min,利用高效液相色谱对CD3、CD20双克隆抗体样品进行检测并绘制色谱图,见图3,结果显示峰拖尾现象明显,峰高降低、峰面积变大。
实施例6
根据实施例5的实施条件,其他不变,柱温调整为35℃,利用高效液相色谱对CD3、CD20双克隆抗体样品进行检测并绘制色谱图,见图4,结果显示峰拖尾现象明显,峰高、峰面积不变。
以上显示和描述了本发明的基本原理和主要特征和本发明的优点,对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
- 抗人血红蛋白单克隆抗体或抗体试剂盒、抗人血红蛋白单克隆抗体固定化不溶性载体粒子和使用它们的测定试剂或测定方法
- 测定SARS病毒核衣壳蛋白的测定方法、测定用试剂盒、试验器具、SARS病毒核衣壳蛋白单克隆抗体及其产生上述单克隆抗体的杂交瘤
