羊草内源再生因子组合在遗传转化中的应用及羊草的高效遗传转化方法
文献发布时间:2024-04-18 19:58:30
技术领域
本发明属于植物组培技术和植物转基因技术领域,涉及一种羊草内源再生因子组合在遗传转化中的应用及羊草的高效遗传转化方法,具体涉及一种诱导羊草幼穗产生愈伤组织,并以这些愈伤组织作为根癌农杆菌侵染对象,利用外源载体靶向激活羊草内源再生因子组合的表达,以建立高效、快速的羊草遗传转化和再生体系。
背景技术
羊草(Leymus chinensis(Trin.)Tzvel.)又名碱草,为禾本科赖草属多年生牧草和生态草,广泛分布于欧亚大陆,是天然草场上的重要牧草之一。因其具有品质优良、适口性好、耐寒、耐旱、耐盐碱等优点,也被誉为“禾草之王”。除作为优质牧草外,羊草根茎穿透和扩展能力极强,能形成发达的地下根茎网络,盘结固持土壤作用强大,是很好的草原修复和水土保持植物。在改善我国北方草原生态环境、修复退化草原及发展草原畜牧业等方面具有重要作用。
羊草本身存在诸如“三低”(即结实率低、出苗率低、产草量低),自交不亲和等问题,极大限制了先进、高效育种技术的应用,导致目前羊草育种工作进展缓慢,优良品种极其短缺。解析羊草“三低”、自交不亲和等现象的分子调控机理,是利用分子设计等现代育种技术快速高效培育高产优质羊草品种的基础。
羊草高效遗传转化体系的建立,将会极大地促进羊草“三低”、自交不亲和等性状相关功能基因的鉴定及分子机制解析,促进现代育种技术在羊草中应用,精准快速地对羊草进行驯化及改良。
根癌农杆菌介导转化法是目前主要采用的遗传转化方法,根癌农杆菌是一种革兰氏阴性菌,当植物受到伤害时,伤口处的细胞会分泌大量的酚类化合物,这些物质会吸引根癌农杆菌转移到这些细胞表面,同时根癌农杆菌所携带的T-DNA就会转移到受伤的植物体中,并且最终整合到受体植物的基因组中,然后通过组培快繁再生出植株。例如专利文献CN114836464A(以下称文献1)公开一种根癌农杆菌介导的羊草遗传转化方法,其创造性地通过添加生长素2,4-D和ZT并筛选得到了适合侵染的羊草愈伤组织基因型LcF-01,使羊草分化率达到95%以上,得到了羊草愈伤组织(以羊草的种子为外植体)分化而来的再生植株。然而,该文献1公开的羊草遗传转化方法的遗传转化率和再生率均较低,仅为2-3%,而且转化周期较长,为4-5个月。
目前提高遗传转化率和再生率的有效手段是利用生长调节因子促进离体培养和组培苗再生。例如小麦中的研究表明,利用GRF-GIF融合蛋白可以提高小麦的遗传转化率和基因编辑效率(Debernardi等人,A GRF–GIF chimeric protein improves theregeneration efficiency of transgenic plants.Nat Biotechnol 38,1274–1279(2020);Qiu等人,Transient expression of aTaGRF4-TaGIF1 complex stimulateswheat regeneration and improves genome editing.Sci China Life Sci 65,731-738(2021))。最近的一项研究表明,TaWOX5具有显著提高小麦再生率和遗传转化率的作用(Wang等人,The gene TaWOX5 overcomes genotype dependency in wheat genetictransformation.Nat Plants 8,110–117(2022),以下称文献2)。但是目前在羊草中利用哪种生长调节因子可以促进羊草的遗传转化率和再生率还没有相关的报道。
发明内容
针对现有技术中存在的问题的一个或多个,本发明一个方面提供一种羊草内源再生因子组合在羊草遗传转化中的应用,其中所述羊草内源再生因子组合选自以下组合(1)-(3)中任一种:
(1)LEC1和LEC2;
(2)LEC2和AGL15;和
(3)BBM和LEC2。
本发明另一方面提供一种重组载体,其包括PDV载体和靶向激活以上组合(1)-(3)述及的羊草内源再生因子组合的sgRNA;其中所述PDV载体包括SunTag系统和XVE系统,所述XVE系统利用基于CaMV 35S改造的组成型启动子G10-90驱动XVE融合蛋白表达,所述靶向激活以上组合(1)-(3)述及的羊草内源再生因子组合的sgRNA位于所述SunTag系统中,且由水稻OsU3启动子驱动表达。
在一些实施方式中,靶向激活羊草内源再生因子组合(1)中的LEC1和LEC2的sgRNA的核苷酸序列分别如SEQ ID NO:1和SEQ ID NO:2所示。
在一些实施方式中,靶向激活羊草内源再生因子组合(2)中的LEC2和AGL15的sgRNA的核苷酸序列分别如SEQ ID NO:3和SEQ ID NO:4所示。
在一些实施方式中,靶向激活羊草内源再生因子组合(3)中的BBM和LEC2的sgRNA的核苷酸序列分别如SEQ ID NO:5和SEQ ID NO:2所示。
本发明另一方面还提供一种宿主细胞,其转化有上述的重组载体。
在一些实施方式中,所述宿主细胞为根癌农杆菌。
本发明再一方面提供一种羊草的高效遗传转化方法,其包括:利用上述的宿主细胞侵染羊草愈伤组织以靶向激活羊草内源再生因子组合的表达。
在一些实施方式中,所述遗传转化方法包括以下步骤:
1)羊草幼穗愈伤组织诱导:以羊草幼穗为外植体在诱导培养基上诱导愈伤组织,待外植体长出愈伤组织后,在无菌的环境中将愈伤组织转移到继代培养基上进行继代培养,得到状态良好的胚性愈伤组织;
2)侵染与共培养:向步骤1)所得胚性愈伤组织中加入乙酰丁香酮侵染液重悬的宿主细胞进行侵染,侵染结束后对所述胚性愈伤组织进行暗培养,得到共培养愈伤组织;
3)恢复培养:将步骤2)所得培养愈伤组织转移至恢复培养基上进行恢复培养;
4)筛选培养:将步骤3)恢复培养后的愈伤组织转移到筛选培养基上进行筛选培养,得到抗性愈伤组织;
5)分化培养:将步骤4)所得抗性愈伤组织转移到分化培养基上进行分化培养,并在继代分化培养基上继代培养,直至得到长至1-2cm高的羊草分化幼苗;和
6)生根培养:将步骤5)所得羊草分化幼苗转移至生根培养基上培养至羊草生根,得到羊草转基因植株。
在一些实施方式中,步骤1)中所述诱导培养基的配方为:4.0-5.0g/L MS基础培养基,4.8-5.2mg/L 2,4-D,1.4-1.6mg/L 6-BA,25-35g/L蔗糖,3.5-4.5g/L植物凝胶,pH=5.7-5.9;所述继代培养基的配方为:4.0-5.0g/L MS基础培养基,250-350mg/L水解酪蛋白,450-550mg/L脯氨酸,80-120mg/L肌醇,0.8-1.2mg/L 2,4-D,35-45g/L蔗糖,3.5-4.5g/L植物凝胶,pH=5.7-5.9。
在一些实施方式中,步骤2)中所述乙酰丁香酮侵染液的配方为:0.4-0.5g/L LS基础培养基,0.4-0.5g/L MS基础培养基,0.4-0.6g/L MES,8-12g/L葡萄糖,90-110μM/L乙酰丁香酮,pH=5.7-5.9;所述暗培养的温度为25±1℃。
在一些实施方式中,步骤3)中所述恢复培养基的配方为:4.0-5.0g/L LS基础培养基,4.0-5.0g/L MS基础培养基,1.90-2.00g/L MES,0.70-0.80g/L MgCl
在一些实施方式中,步骤4)中所述筛选培养基的配方为在所述恢复培养基的配方的基础上加入筛选剂,其可选为浓度为45-55mg/L的潮霉素。
在一些实施方式中,步骤6)中所述生根培养基的配方为:2.0-3.0g/L MS基础培养基,25-35g/L蔗糖,3.5-4.5g/L植物凝胶,0.04-0.06mg/L萘乙酸,pH=5.7-5.9。
在一些实施方式中,步骤5)中所述分化培养基的配方为:4.0-5.0g/L LS基础培养基,0.4-0.6g/L MES,2.0-3.0mg/L CuSO
在一些实施方式中,所述遗传转化方法包括:利用转化有包括靶向激活羊草内源再生因子组合(3)中的BBM和LEC2的sgRNA的重组载体的宿主细胞和转化有第二重组载体的宿主细胞共侵染所述羊草愈伤组织以靶向激活羊草内源再生因子组合的表达;
其中所述第二重组载体包括PDV载体和靶向激活以下羊草内源再生因子组合的sgRNA:WUS和STM;可选地,靶向激活羊草内源再生因子WUS和STM的sgRNA的核苷酸序列分别如SEQ ID NO:7和SEQ ID NO:8所示。
在一些实施方式中,所述遗传转化方法包括:利用转化有包括靶向激活羊草内源再生因子组合(1)中的LEC1和LEC2的sgRNA的重组载体的宿主细胞、转化有包括靶向激活羊草内源再生因子组合(2)中的LEC2和AGL15的sgRNA的重组载体的宿主细胞、和转化有第三重组载体的宿主细胞共侵染所述羊草愈伤组织以靶向激活羊草内源再生因子组合的表达;
其中所述第三重组载体包括PDV载体和靶向激活以下羊草内源再生因子组合的sgRNA:BBM和LEC1;可选地,所述第三重组载体中包括的靶向激活羊草内源再生因子BBM和LEC1的sgRNA的核苷酸序列分别如SEQ ID NO:5和SEQ ID NO:6所示。
本发明再一方面还提供一种适用于以羊草幼穗为外植体产生的愈伤组织分化出芽的培养基,其配方为:4.0-5.0g/L LS基础培养基,0.4-0.6g/L MES,2.0-3.0mg/LCuSO
基于以上技术方案,通过靶向激活以下任一种羊草内源再生因子组合:LEC1和LEC2;LEC2和AGL15;和BBM和LEC2,尤其是靶向激活羊草内源再生因子BBM和LEC2的组合,可以明显提高羊草遗传转化的再生率和转化率。基于此,本发明提供一种羊草的高效遗传转化方法,其利用根癌农杆菌介导转化法将携带有可靶向激活以上羊草内源再生因子组合的sgRNA侵染入羊草愈伤组织中,可以以高的再生率(约为3.7%以上,优选为8%以上)和转化率得到转基因阳性株系,进而可以快速高效建立稳定的根癌农杆菌介导的羊草遗传转化体系和再生体系。并且本发明提供的羊草的高效遗传转化方法还可以通过利用多种分别转化有靶向不同的羊草内源再生因子组合的sgRNA的根癌农杆菌共侵染羊草愈伤组织,也可以以高的再生率(3.8%以上,优选为12%以上)和转化率(3.5%以上,优选为11%以上)得到转基因阳性株系。并且,本发明提供的遗传转化方法还可以明显缩短遗传转化的周期,由上述文献1公开的4-5个月缩短至3个月左右。
另外,本发明还筛选获得一种更加适于以羊草幼穗为外植体产生的愈伤组织分化出芽的培养基,其可有助于羊草转化后愈伤组织分化出芽。
附图说明
图1为羊草幼穗愈伤组织在不同分化培养基中分化培养出芽照片。
图2为SunTag-PDV载体结构示意图。
图3为转化对照载体和SunTag-PDV载体(PDV4+PDV5)后羊草愈伤组织在分化培养基上再生培养1周后的照片。
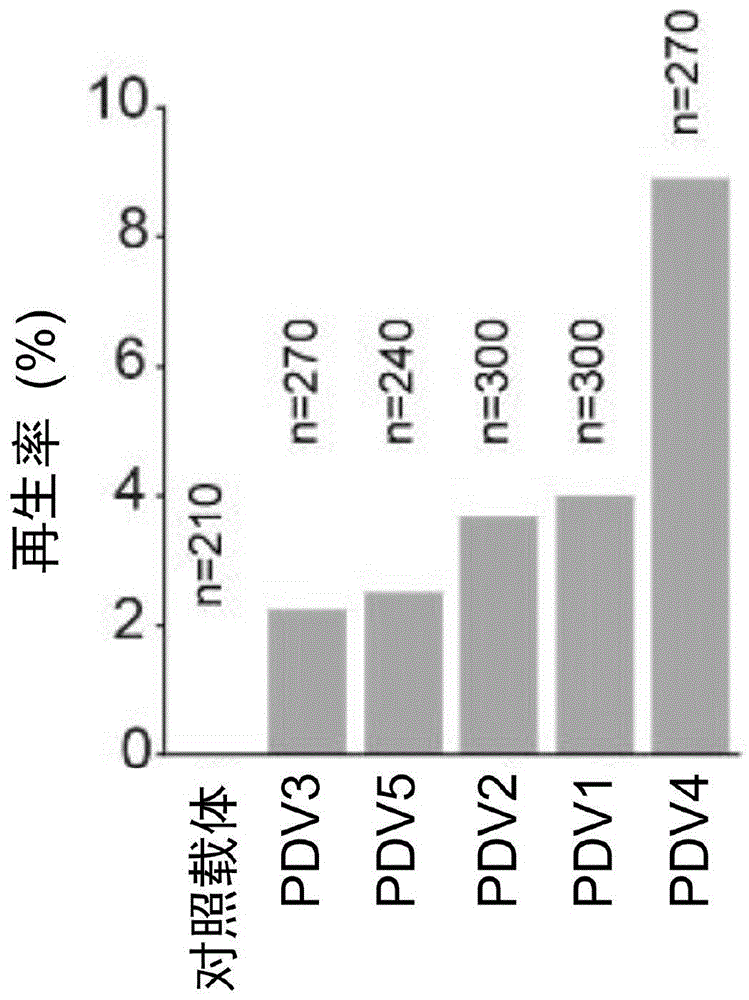
图4为转化对照载体和不同的SunTag-PDV载体(PDV1、PDV2、PDV3、PDV4、PDV5)的羊草愈伤组织的再生率统计柱状图。
图5为PCR分析羊草转基因再生植株的凝胶电泳图。
图6为转化TaWOX5和SunTag-PDV载体的再生羊草表型照片。
具体实施方式
以下结合具体实施例,对本发明进一步阐述。应当理解的是,具体实施例仅用于进一步说明本发明,而不是用于限制本发明的内容。
实施例中描述到的各种生物材料的取得途径仅是提供一种实验获取的途径以达到具体公开的目的,不应成为对本发明生物材料来源的限制。事实上,所用到的生物材料的来源是广泛的,任何不违反法律和道德伦理能够获取的生物材料都可以按照实施例中的提示替换使用。下述实施例中所用的试验材料,如无特殊说明,均自常规生化试剂商店购买得到。
在以下实施例中,MS基础培养基为Murashige&Skoog基础培养基(PhytoTechLABS,M519),LS基础培养基为Linsmaier&Skoog基础培养基(PhytoTech LABS,L689)。
实施例1:筛选适合羊草幼穗愈伤组织分化的培养基
1.1、羊草幼穗愈伤组织诱导:以羊草的幼穗为外植体诱导愈伤组织,在温度28℃黑暗或弱光下培养1个月左右,待外植体长出愈伤组织后,选取生长状态一致,有颗粒感且状态发白的羊草愈伤组织;其中使用的诱导培养基的配方为:4.43g/L MS基础培养基(可为4.0-5.0g/L MS基础培养基),5mg/L 2,4-D(可为4-6mg/L 2,4-D),1.5mg/L 6-BA(可为1.4-1.6mg/L6-BA),30g/L蔗糖(可为25-35g/L蔗糖),4g/L植物凝胶(可为3.5-4.5g/L植物凝胶),pH调至5.8左右(可为5.7-5.9)。
1.2、愈伤组织分化培养:在无菌的环境中将步骤1.1选取的羊草愈伤组织转移到新鲜分化培养基上进行分化培养,其中该步骤中使用了多种不同的分化培养基,分别为:MDZ(其配方为:4.43g/L MS基础培养基,2mg/L 2,4-D,1mg/L ZT(6-(4-羟基-3-甲基-2-丁烯基)氨基嘌呤,又称玉米素),30g/L蔗糖)、P1(其配方为:4.43g/L MS基础培养基,1mg/L6-BA,1mg/L KT(6-糠基氨基嘌呤),1mg/L TDZ(N-苯基-N’-1,2,3-噻二唑-5-基脲),0.15mg/L NAA,30g/L蔗糖)、FH1(其配方为:4.43g/L MS基础培养基,1mg/L GA,1mg/L IBA,1mg/LNAA,30g/L蔗糖)、LW(其配方为:4.43g/L MS基础培养基,0.1g肌醇,0.5mg/L 6-BA,1mg/L 2,4-D,1mg/L NAA,30g/L蔗糖)、LSZ(其配方为:4.43g/L LS基础培养基,0.5g/LMES(2-(N-吗啡啉)乙磺酸),2.5mg/L CuSO
1.3、拍照记录步骤1.2中在不同分化培养基中分化培养的愈伤组织的分化生长状态。在整个培养过程持续观察发现,在培养1周后,在不同分化培养基上分化培养的愈伤组织表面均开始出现绿色芽点。
结果如图1所示,示出了愈伤组织分别在分化培养基MDZ、LW、P1、LSZ和FH1中的分化培养分化情况,其中LSZ’为在分化培养基LSZ上分化培养的部分愈伤组织分化后的放大图。可见将羊草愈伤组织接种到LSZ分化培养基上能够最有效地诱导愈伤组织的分化出芽,而单独使用其他4种分化培养基时虽能使愈伤组织变绿,但很难分化出芽,且实验证明只有将这些变绿的愈伤组织再次更换到LSZ分化培养基上才能诱导其出芽。因此,本发明确定使用LSZ分化培养基作为羊草幼穗愈伤组织的分化用培养基,可以有效诱导羊草幼穗愈伤组织分化出芽。
该实施例中,还利用以下两种分化培养基对步骤1.1选取的羊草幼穗愈伤组织进行分化培养:LSZ1(4.0g/L LS基础培养基,0.4g/L MES,2.0mg/L CuSO
实施例2:使用外源重组载体提高羊草遗传转化率和再生率
2.1、重组载体的构建
该实施例中提及的重组载体的空载体,命名为PDV,获自北京大学刘启昆教授,其包括SunTag系统和XVE系统两部分,其中XVE系统部分利用基于CaMV 35S改造的组成型启动子G10-90驱动XVE(LexA-VP16-ER)融合蛋白表达(Zuo,J.等人,An estrogen receptor-based transactivator XVE mediates highly inducible gene expression intransgenic plants,The Plant Journal 24.2(2000):265-273),LexA为DNA结合蛋白可以结合到特定的启动子序列,VP16为转录激活因子,ER为人类雌激素受体,在雌激素的诱导下可以进入细胞核内发挥功能;SunTag系统发挥作用依赖三个主要的功能元件,分别是guideRNA、ScFV-VP64、以及dCas9-GCN4。其中dCas9-GCN4融合蛋白由LexA启动子驱动表达。ScFV-VP64由玉米Ubiquitin启动子驱动表达。guide RNA是一段单链的核糖核苷酸序列,提供靶向基因的特异性,由水稻OsU3启动子驱动表达。转基因植物在雌激素诱导的条件下,XVE融合蛋白可以进入细胞核特异性地结合LexA启动子,由转录激活因子VP16激活dCas9-GCN4的表达。dCas9-GCN4元件在guide RNA的引导下,将结合位于目标基因的转录起始位点上游序列(启动子区)。与dCa9融合的GCN4抗原多肽将与其抗体ScFV特异结合,并将与ScFV融合表达的VP64转录激活因子捕获至目标基因的启动子序列。在此情况下,VP64转录激活因子将发挥其转录激活功能,特异地激活目标基因的表达。
在该实施例中,针对羊草内源再生因子编码基因,共设计了8个基于CRISPR/Cas9体系的重组载体(1
表1.重组载体SunTag-PDV靶向激活的羊草内源再生因子编码基因及其相应sgRNA
2.2、根癌农杆菌转化
电激法转化根癌农杆菌感受态:冰上融化根癌农杆菌Agl-0感受态细胞,冰上融化后,加入100ng的上述步骤2.1构建的重组载体质粒DNA,冰上静置20分钟。将加入质粒的农杆菌感受态细胞吸入0.4cm间距电击杯中电激转化,使用200μL无抗LB培养基将菌液混匀涂于添加50mg/L卡那霉素和50mg/L的利福平固体培养基上,28℃暗培养。待长出单克隆后,挑取单个克隆至含有50mg/L卡那霉素和50mg/L的利福平液体LB培养基中,28℃,200rpm培养至少12小时,得到分别转化1
2.3、羊草的遗传转化
(1)羊草幼穗愈伤组织诱导:以羊草幼穗为外植体诱导愈伤组织,具体为在温度28℃黑暗或弱光下培养1个月左右,待外植体长出愈伤组织后,在无菌的环境中将愈伤转移到含相应植物激素的新鲜继代培养基上,继代3-5次,得到生长状态良好的胚性愈伤组织;其中用于诱导愈伤组织的诱导培养基的配方可为:4.0-5.0g/L MS基础培养基,4.8-5.2mg/L2,4-D,1.4-1.6mg/L 6-BA,25-35g/L蔗糖,3.5-4.5g/L植物凝胶,pH=5.7-5.9(具体为4.43g/L MS基础培养基,5mg/L 2,4-D,1.5mg/L 6-BA,30g/L蔗糖,4g/L植物凝胶(pH=5.8));所述继代培养基的配方可为:4.0-5.0g/L MS基础培养基,250-350mg/L水解酪蛋白,450-550mg/L脯氨酸,80-120mg/L肌醇,0.8-1.2mg/L 2,4-D,35-45g/L蔗糖,3.5-4.5g/L植物凝胶,pH=5.7-5.9(具体为4.43g/L MS基础培养基,300mg/L水解酪蛋白,500mg/L脯氨酸,100mg/L肌醇,1mg/L 2,4-D,40g/L蔗糖,4g/L植物凝胶(pH调至5.8));
(2)侵染与共培养:将步骤(1)挑选出的生长状态良好的胚性愈伤组织转移至50ml无菌离心管中,7500rpm离心10min,然后分别加入含有乙酰丁香酮侵染液重悬的已经转化有SunTag-PDV载体的根癌农杆菌(分别为:PDV1+PDV2+PDV3(混转,下同)、PDV4+PDV5、PDV7+PDV8)和对照载体(转化有空载体PDV的根癌农杆菌),150rpm温和震荡培养15-20min。侵染结束后吸干愈伤组织上的水分,放入添加灭菌滤纸的培养皿中暗培养3天,得到共培养愈伤组织。所述侵染液可含有:0.4-0.5g/L LS基础培养基,0.4-0.5g/L MS基础培养基,0.4-0.6g/L MES,8-12g/L葡萄糖,90-110μM/L乙酰丁香酮,pH=5.7-5.9(具体为0.443g/L LS基础培养基,0.443g/L MS基础培养基,0.5g/L MES,10g/L葡萄糖,100uM/L乙酰丁香酮(pH调至5.8)),暗培养的温度为25±1℃;
(3)恢复培养:将步骤(2)所得共培养愈伤组织转移到恢复培养基上,于28℃黑暗下培养7天。所述的恢复培养基配方可为:4.0-5.0g/L LS基础培养基,4.0-5.0g/L MS基础培养基,1.90-2.00g/L MES,0.70-0.80g/L MgCl
(4)筛选培养:将步骤(3)恢复后的愈伤组织转移到筛选培养基上,于28℃黑暗下培养1个月左右,筛选培养后得到抗性愈伤组织。所述的筛选培养基的配方可为在所述恢复培养基的配方的基础上加入相应筛选剂,可为浓度为45-55mg/L(具体为50mg/L)的潮霉素;
(5)分化培养:将步骤(4)所得抗性愈伤组织转移到分化培养基上,于28℃光下培养分化,4周左右于继代分化培养基上继代一次,直到得到长至1-2cm高的羊草分化幼苗。所述的分化培养基为实施例1中筛选得到的分化培养基,该步骤中具体为:4.43g/LLS基础培养基,0.5g/L MES,2.5mg/L CuSO
(6)生根培养:将步骤(5)所得羊草分化幼苗转移至生根培养基,28℃光照14小时,黑暗8小时培养至羊草生根,约3周左右,株高约10cm,得到羊草转基因植株(转基因阳性植株的鉴定在以下2.4中详述),转化周期约为3个月。所述生根培养基的配方可为:2.0-3.0g/L MS基础培养基,25-35g/L蔗糖,3.5-4.5g/L植物凝胶,0.04-0.06mg/L萘乙酸,pH=5.7-5.9(具体为1/2MS基础培养基,30g/L蔗糖,4g/L植物凝胶,0.05mg/L萘乙酸(pH调至5.8))。
下表2列出了使用PDV1+PDV2+PDV3、PDV4+PDV5、PDV7+PDV8和对照载体侵染的羊草的再生率和转化率,可见相对于对照载体侵染,使用PDV1+PDV2+PDV3和PDV4+PDV5共侵染(即混转)的羊草愈伤组织均能明显提高羊草遗传转化的再生率和转化率,使得再生率可达3.8%以上,甚至可达12%以上,使得转化率可达3.5%以上,甚至可达11%,使用PDV7+PDV8侵染羊草愈伤组织虽然也能够提高羊草遗传转化的再生率和转化率,但提高程度不及PDV1+PDV2+PDV3和PDV4+PDV5。
表2:不同SunTag-PDV载体转化羊草的再生率和转化率
在该实施例的另一实验中,还按照上述步骤2.3中(1)-(6)的方法对羊草幼穗愈伤组织分别侵染PDV1-PDV6和对照载体PDV,并统计各组的羊草遗传转化的再生率。结果如图4所示(其中n表示愈伤组织数量),其示例性示出了使用PDV1-PDV5和对照载体侵染的羊草的再生率的统计柱状图,可见相对于对照载体,使用PDV1、PDV2和PDV4单独侵染羊草愈伤组织,均能明显提高羊草遗传转化的再生率,可达到约3.7%(PDV2),优选可达约4%(PDV1),甚至可达约8.8%(PDV4),使用PDV3和PDV5单独侵染羊草愈伤组织虽也能够提高羊草遗传转化的再生率,但提高程度不及PDV1、PDV2和PDV4。
综上结果,本发明确定使用PDV1、PDV2和PDV4单独侵染羊草愈伤组织,或者使用PDV1+PDV2+PDV3和PDV4+PDV5共侵染羊草愈伤组织,均可以明显提高羊草遗传转化的再生率和转化率,而且可以将转化周期缩短至3个月左右,尤其是当使用PDV4单独侵染羊草愈伤组织,或者使用PDV4+PDV5共侵染羊草愈伤组织时,可以获得更高的再生率和转化率。
2.4、转基因阳性植株的鉴定
(1)羊草转基因再生植株DNA提取:取上述步骤2.3中(6)获得的新鲜的羊草转基因再生植株的叶片剪碎并置于1.5mL离心管中,使用研磨机震碎后充分混匀,加入2×CTAB提取液1mL,65℃水浴30分钟,在水浴期间轻轻颠倒离心管4-6次。水浴结束后,待液体冷却至室温,加入等体积氯仿剧烈震荡15秒,12000rpm室温离心10分钟,取上清液转移至新的1.5mL离心管中,然后加入等体积异丙醇震荡混匀,于-20℃冰箱中沉淀过夜。12000rpm室温离心10分钟,然后用1mL 75%乙醇洗涤沉淀(即为DNA沉淀)两遍,最后室温干燥DNA,去除残余乙醇溶液。加入100μL去离子水溶解DNA。
(2)PCR检测:合成转基因载体的PCR鉴定上下游引物,HYG-F:5’-AAAGACCGAGGTGCAGACAG-3’(SEQ ID NO:11),HYG-R:5’-TCCAGCTCGAACAGGGAGTA-3’(SEQ IDNO:12)。PCR反应总体系为20μL,分别加入PCR鉴定上下游引物各0.4μL(终浓度20pmol/L),模板DNA 1μL(约100ng),2×Taq PCR StarMix(Genestar,A012-01)10μL,去离子水补齐20μL反应总体系。PCR反应条件:95℃预变性5分钟;95℃变性30秒,60℃退火30秒,72℃延伸30秒,32个循环;72℃延伸5分钟,然后取出PCR反应产物4℃恒温保存。各取10μL的PCR扩增产物,进行琼脂糖凝胶电泳(1.0%),点样时5μL Trans2K Plus IIDNA Marker作为分子量标准,电泳图拍照。鉴定结果如图5所示,示例性示出了12个羊草转基因再生植株的鉴定结果,可见其中有11个羊草转基因再生植株为阳性植株,即转入了外源重组载体,另1个羊草转基因再生植株为阴性植株,即未转入外源重组载体。
观察已转入PDV4的羊草再生植株的表型,并观察按照上述文献2公开的方法得到的Ubi:WOX5转基因羊草再生植株(即表达TaWOX5基因的转基因羊草植株)的表型,结果如图6所示,可见相比于表达TaWOX5基因的转基因羊草植株,本发明转入PDV4的羊草再生植株不仅可以促进羊草愈伤组织的再生,还没有表现出生长发育异常表型。转入PDV1、PDV2、PDV3或PDV5的羊草再生植株也可以促进羊草愈伤组织的再生,且也没有表现出生长发育异常表型。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种根癌农杆菌介导的羊草遗传转化方法
- 一种根癌农杆菌介导的羊草遗传转化方法
