一种增强γδT细胞抗肿瘤能力的方法
文献发布时间:2024-01-17 01:14:25
技术领域
本申请涉及生物技术领域,尤其是涉及一种增强γδT细胞抗肿瘤能力的方法。
背景技术
γδT细胞根据它的表面结构不同,又可分为Vδ1+、Vδ2+、Vδ3+和Vδ5+等若干个亚群,这群特殊的细胞在人体免疫保护和免疫监视中发挥重要功能。外周血中半数以上的γδT细胞共表达Vδ2链和Vγ9链,这个细胞亚群被称为γδT细胞,仅存在于人类和非人灵长类动物中。人的外周血和淋巴器官中γδT细胞主要是γδT细胞,它们承担了很多抗感染和肿瘤的第一道防御屏障,尤其是来源于健康人群的γδT细胞被认为是肿瘤细胞免疫治疗中一个前景广阔的细胞亚群,更具临床应用价值。γδT细胞被激活后可以表达CD86、MHC-II和CD80等细胞粘附分子,并具有抗原呈递细胞的功能。γδT细胞还表达NK细胞的重要受体NKG2D,所以它具备了T细胞和NK细胞两种免疫细胞的功能。目前培养γδT细胞抗肿瘤活性不高,因此,为了使γδT细胞治疗取得理想的临床治疗效果,需要获得大量具有高抗肿瘤活性的γδT细胞,以满足临床治疗的需要。
目前,培养γδT细胞抗肿瘤活性不高,因此,为了使γδT细胞治疗取得理想的临床治疗效果,需要获得大量具有高抗肿瘤活性的γδT细胞,以满足临床治疗的需要。
发明内容
为了解决上述技术问题,本申请提供了一种增强γδT细胞抗肿瘤能力的方法,CD137及肠道菌刺激后明显提高了γδT细胞的抗肿瘤活性,在培养10-15天即可获得纯度在90%以上的γδT细胞;且本申请操作步骤简单,可操作性强,具有很好的推广价值。
本申请提供的一种增强γδT细胞抗肿瘤能力的方法,是通过以下技术方案得以实现的:
一种增强γδT细胞抗肿瘤能力的方法,包括以下步骤:
步骤一,制备PBMCs,取外周血采用淋巴细胞分离液分离得PBMCs,并用PBS缓冲液重悬,红细胞裂解液裂解残余红细胞,并在离心下洗涤细胞2次,得PBMCs;
步骤二,γδT细胞的刺激培养:在1000 mL的KBM581细胞基础培养基中,加入1.8-2.2mM的双抗,使用γδT细胞刺激培养基重悬PBMCs,并调整密度至3.0-4.0×10
步骤三,扩增培养:
培养至第3 天时,离心后去除培养基,γδT细胞基础培养基将细胞密度调整到1.95-2.05×10
培养至第6 天后,换液同第3天换液,并调整细胞密度为1.0-1.05×10
本申请无需对PBMCs进行纯化,在培养10-15天即可获得纯度在90%以上的γδT细胞,所得γδT细胞共表达Vδ2链和Vγ9链。且在CD137和肠道菌刺激后明显提高了γδT细胞的抗肿瘤活性。本申请操作步骤简单,可操作性强,具有很好推广价值。
优选的,所述肠道菌是由双歧杆菌、乳酸菌复合组成;所述双歧杆菌:乳酸菌的质量比为(0.6-1.2):(0.6-1.2)。
优选的,所述双歧杆菌为长双歧杆菌、动物双歧杆菌、青春双歧杆菌、两歧双歧杆菌中的至少一种;所述乳酸菌为鼠李糖乳杆菌、罗伊氏乳杆菌、嗜酸乳杆菌、干酪乳杆菌中的至少一种;双歧杆菌:乳酸菌的质量比为1(0.9-1.0)。
优选的,所述双歧杆菌为长双歧杆菌、动物双歧杆菌、青春双歧杆菌,长双歧杆菌、动物双歧杆菌、青春双歧杆菌的质量比为1:0.8:(1.6-2);所述乳酸菌为鼠李糖乳杆菌、罗伊氏乳杆菌、干酪乳杆菌,鼠李糖乳杆菌、罗伊氏乳杆菌、干酪乳杆菌的质量比为1:1:1;所述双歧杆菌:乳酸菌的质量比为1:1。
优选的,所述步骤一中的制备PBMCs,具体包括以下步骤:
S1.1,采用肝素抗凝的真空采血管抽取一名健康志愿者的100mL外周静脉血,收集新的50mL离心管里;
S1.2,取60mL淋巴细胞分离液,平均加到淋巴细胞分离管中,每管15mL,将离心管倾斜,沿管壁缓慢25 mL外周静脉血,在500-1000 g和 25℃下离心25-30 min;
S1.3,离心结束后,可以发现离心管中液体可以分为4层,从上到下依次为:血浆层、PBMC絮状层、外周血淋巴细胞分离液层、红细胞层,用巴士吸管先缓慢小心吸掉部分上层血清后,用巴士吸管吸取中层絮状层至新的50 mL离心管中,约20 mL;
S1.4,向离心管中加入等倍体积的PBS,约45 mL,在300-600 g 和25℃ 离心10-12min;离心结束后弃去上清,轻弹管底,各加入5 mL红细胞裂解液,轻柔吹打,常温下裂解5-6min;
S1.5,加入5.0倍体积的PBS终止裂解,在400-800g和25℃下离心10-12 min;离心结束后弃去上清,加入2 mL培养基重悬,收集至新的15 mL离心管中,再加入培养基混匀使终体积为10 mL,并进行计数,获得24-26×10
优选的,所述步骤一中的制备PBMCs,具体包括以下步骤:
S1.1,采用肝素抗凝的真空采血管抽取一名健康志愿者的100mL外周静脉血,收集新的50mL离心管里;
S1.2,取60mL淋巴细胞分离液,平均加到淋巴细胞分离管中,每管15mL,将离心管倾斜,沿管壁缓慢25 mL外周静脉血,在700-850 g和 25℃下离心25-30 min;
S1.3,离心结束后,可以发现离心管中液体可以分为4层,从上到下依次为:血浆层、PBMC絮状层、外周血淋巴细胞分离液层、红细胞层,用巴士吸管先缓慢小心吸掉部分上层血清后,用巴士吸管吸取中层絮状层至新的50 mL离心管中,约20 mL;
S1.4,向离心管中加入等倍体积的PBS,约45 mL,在400-480 g 和25℃ 离心10-12min;离心结束后弃去上清,轻弹管底,各加入5 mL红细胞裂解液,轻柔吹打,常温下裂解5-6min;
S1.5,加入5.0倍体积的PBS终止裂解,在500-600g和25℃下离心10-12 min;离心结束后弃去上清,加入2 mL培养基重悬,收集至新的15 mL离心管中,再加入培养基混匀使终体积为10 mL,并进行计数,获得24-26×10
优选的,所述步骤二中唑来膦酸的浓度为每10毫升培养基加9.5-10.5mM的唑来膦酸;所述IL-2的浓度为每10毫升培养基加360-420IU IL-2;所述IL-15的浓度为每10毫升培养基加85-120IU IL-15进行刺激培养。
通过采用上述技术方案有利于纯化得到共表达Vδ2链和Vγ9链的γδT细胞。
优选的,所述步骤二,γδT细胞的刺激培养:在1000 mL的KBM581细胞基础培养基中,加入2.0mM的双抗,使用γδT细胞刺激培养基重悬PBMCs,并调整密度至3.0-4.0×10
通过采用上述技术方案,进一步地有利于纯化得到共表达Vδ2链和Vγ9链的γδT细胞,进而提升对肿瘤细胞的杀伤效果。
优选的,所述步骤二中的无血清T细胞培养基为Optimizer的无血清T细胞培养基,无血清培养基中可加入AB血清有利于细胞的扩增、生长。
优选的,所述步骤三,扩增培养:培养至第3 天时,离心后去除培养基,γδT细胞基础培养基将细胞密度调整到2.0×10
通过采用上述技术方案,进一步地有利于纯化得到共表达Vδ2链和Vγ9链的γδT细胞,进而提升对肿瘤细胞的杀伤效果。
综上所述,本申请具有以下优点:
1、本申请CD137和肠道菌共同刺激后明显提高了γδT细胞的抗肿瘤活性,在培养10-15天即可获得纯度在90%以上的γδT细胞;
2、本申请操作步骤简单,可操作性强,具有很好的推广价值。
附图说明
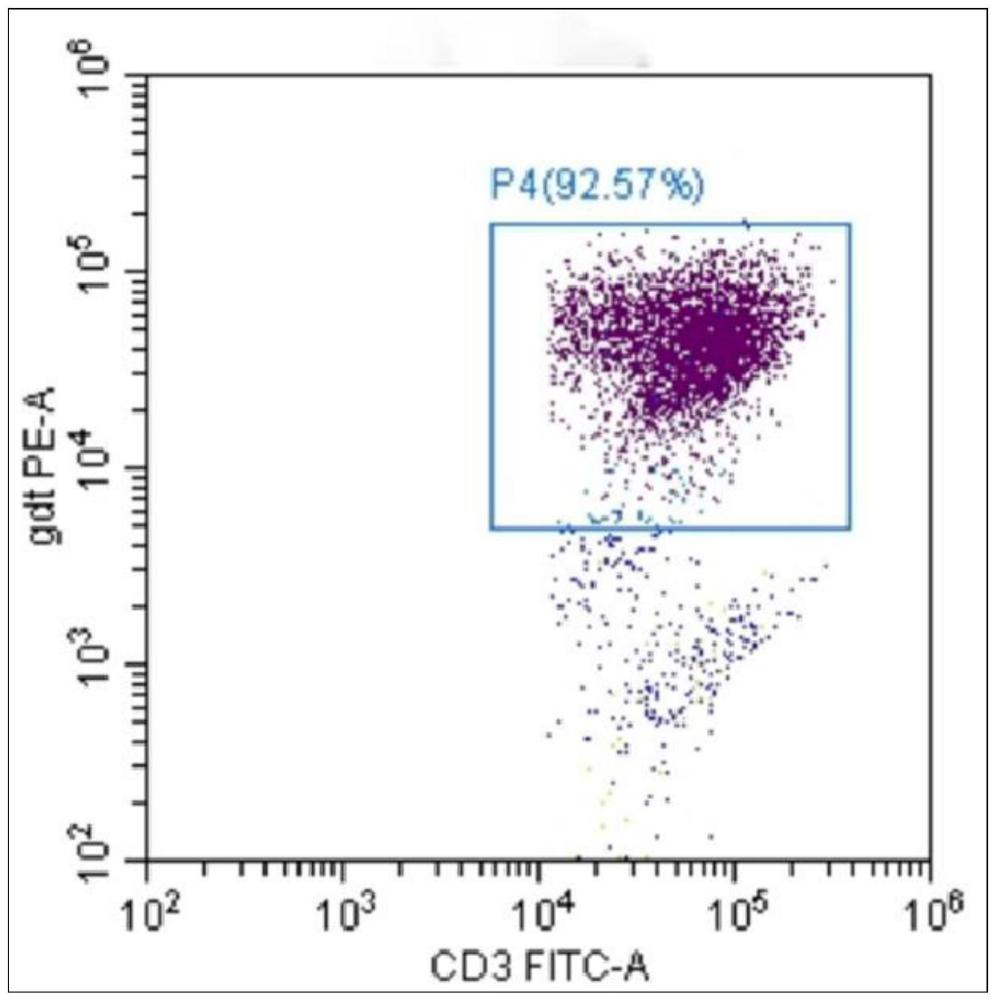
图1是采用实施例一方法诱导扩增后外周血中γδT细胞比例的流式结果;
图2是采用对比例1方法诱导扩增后外周血中γδT细胞比例的流式结果;
图3-1、3-2是采用实施例一方法获得的γδT细胞的细胞因子的检测结果;
图4是采用实施例一和对比例1方法获得的γδT细胞的抗肿瘤活性的体外试验检测结果;
图5-1和图5-2是采用实施例一和对比例1方法获得的γδT细胞的体内抗肿瘤活性的动物试验检测结果。
实施方式
以下结合附图、对比例和实施例对本申请作进一步详细说明。
实施例
实施例一
本申请公开的一种增强γδT细胞抗肿瘤能力的方法,包括以下步骤:
步骤一,制备PBMCs:
S1.1,采用肝素抗凝的真空采血管抽取一名健康志愿者的100mL外周静脉血,收集新的50mL离心管里;
S1.2,取60mL淋巴细胞分离液,平均加到淋巴细胞分离管中,每管15mL,将离心管倾斜,沿管壁缓慢25 mL外周静脉血,在800 g和 25℃下离心25 min;
S1.3,离心结束后,可以发现离心管中液体可以分为4层,从上到下依次为:血浆层、PBMC絮状层、外周血淋巴细胞分离液层、红细胞层,用巴士吸管先缓慢小心吸掉部分上层血清后,用巴士吸管吸取中层絮状层至新的50 mL离心管中,约20 mL;
S1.4,向离心管中加入等倍体积的PBS,约45 mL,在450g 和25℃ 离心10min;离心结束后弃去上清,轻弹管底,各加入5 mL红细胞裂解液,轻柔吹打,常温下裂解5min;
S1.5,加入5.0倍体积的PBS终止裂解,在500g和25℃下离心10-min;离心结束后弃去上清,加入2 mL培养基重悬,收集至新的15 mL离心管中,再加入培养基混匀使终体积为10 mL,并进行计数,获得25×10
步骤二,γδT细胞的刺激培养:
培养第一天:在1000 mL的KBM581细胞基础培养基中,加入2.0mM的双抗,使用γδT细胞刺激培养基重悬PBMCs,并调整密度至3.0-4.0×10
步骤三,扩增培养:
培养至第3 天时,离心后去除培养基,γδT细胞基础培养基将细胞密度调整到2.0×10
其中,肠道菌是双歧杆菌:乳酸菌的质量比为1:1组成,双歧杆菌为长双歧杆菌、动物双歧杆菌、青春双歧杆菌,长双歧杆菌、动物双歧杆菌、青春双歧杆菌的质量比为1:0.8:2;乳酸菌为鼠李糖乳杆菌、罗伊氏乳杆菌、干酪乳杆菌,鼠李糖乳杆菌、罗伊氏乳杆菌、干酪乳杆菌的质量比为1:1:1;;
培养至第6 天后,换液同第3天换液,并调整细胞密度为1.0×10
实施例二
实施例二与实施例一的区别在于:培养液中加入10ng/mL的CD137和60亿/mL的肠道菌。
实施例三
实施例三与实施例一的区别在于:培养液中加入20ng/mL的CD137和70亿/mL的肠道菌。
实施例四
实施例四与实施例一的区别在于:培养液中加入30ng/mL的CD137和80亿/mL的肠道菌。
实施例五
实施例五与实施例一的区别在于:培养液中加入40ng/mL的CD137和90亿/mL的肠道菌。
实施例六
实施例六与实施例一的区别在于:培养液中加入80ng/mL的CD137和120亿/mL的肠道菌。
实施例七
实施例七与实施例一的区别在于:培养液中加入80ng/mL的CD137和180亿/mL的肠道菌。
实施例八
实施例八与实施例一的区别在于:培养液中加入80ng/mL的CD137和300亿/mL的肠道菌。
对比例
对比例1
本申请公开的一种增强γδT细胞抗肿瘤能力的方法,包括以下步骤:
步骤一,制备PBMCs:
S1.1,采用肝素抗凝的真空采血管抽取一名健康志愿者的100mL外周静脉血,收集新的50mL离心管里;
S1.2,取60mL淋巴细胞分离液,平均加到淋巴细胞分离管中,每管15mL,将离心管倾斜,沿管壁缓慢25 mL外周静脉血,在800 g和 25℃下离心25 min;
S1.3,离心结束后,可以发现离心管中液体可以分为4层,从上到下依次为:血浆层、PBMC絮状层、外周血淋巴细胞分离液层、红细胞层,用巴士吸管先缓慢小心吸掉部分上层血清后,用巴士吸管吸取中层絮状层至新的50 mL离心管中,约20 mL;
S1.4,向离心管中加入等倍体积的PBS,约45 mL,在450g 和25℃ 离心10min;离心结束后弃去上清,轻弹管底,各加入5 mL红细胞裂解液,轻柔吹打,常温下裂解5min;
S1.5,加入5.0倍体积的PBS终止裂解,在500g和25℃下离心10-min;离心结束后弃去上清,加入2 mL培养基重悬,收集至新的15 mL离心管中,再加入培养基混匀使终体积为10 mL,并进行计数,获得25×10
步骤二,γδT细胞的刺激培养:
培养第一天:在1000 mL的KBM581细胞基础培养基中,加入2.0mM的双抗,使用γδT细胞刺激培养基重悬PBMCs,并调整密度至3.0-4.0×10
步骤三,扩增培养:
培养至第3 天时,离心后去除培养基,γδT细胞基础培养基将细胞密度调整到2.0×10
培养至第6 天后,换液同第3天换液,并调整细胞密度为1.0×10
对比例2与实施例一的区别在于:
培养液中加入100ng/mL的CD137和100亿/mL的肠道菌。
培养至第3 天时,离心后去除培养基,γδT细胞基础培养基将细胞密度调整到2.0×10
其中,肠道菌是双歧杆菌:乳酸菌的质量比为1:1组成,双歧杆菌为长双歧杆菌、动物双歧杆菌、青春双歧杆菌,长双歧杆菌、动物双歧杆菌、青春双歧杆菌的质量比为1:0.8:2;乳酸菌为鼠李糖乳杆菌、罗伊氏乳杆菌、干酪乳杆菌,鼠李糖乳杆菌、罗伊氏乳杆菌、干酪乳杆菌的质量比为1:1:1;;
培养至第6 天后,换液同第3天换液,并调整细胞密度为1.0×10
对比例3与实施例一的区别在于:
培养液中加入500ng/mL的CD137和100亿/mL的肠道菌
培养至第3 天时,离心后去除培养基,γδT细胞基础培养基将细胞密度调整到2.0×10
其中,肠道菌是双歧杆菌:乳酸菌的质量比为1:1组成,双歧杆菌为长双歧杆菌、动物双歧杆菌、青春双歧杆菌,长双歧杆菌、动物双歧杆菌、青春双歧杆菌的质量比为1:0.8:2;乳酸菌为鼠李糖乳杆菌、罗伊氏乳杆菌、干酪乳杆菌,鼠李糖乳杆菌、罗伊氏乳杆菌、干酪乳杆菌的质量比为1:1:1;
培养至第6 天后,换液同第3天换液,并调整细胞密度为1.0×10
性能检测试验
检测方法/试验方法
1 .细胞计数
取实施例一和对比例1的细胞,PBS稀释10倍,取10μL加入到血细胞计数板中,在显微镜下计数,并以“细胞总数÷4×10
2.流式细胞术检测γδT细胞
收集扩增第10天的γδT细胞约5×10
3、γδT细胞对肿瘤的杀伤活性
(1)靶细胞的处理
1)分别收集培养的肿瘤细胞作为靶细胞,1000rpm离心5min,PBS洗1次;
2)用PBS重悬靶细胞,调整浓度为1×10
(2)效应细胞的处理
取实施例一-八、对比例1-3诱导后的γδT细胞,200g离心5min,收集细胞,将细胞密度调整至1×10
(3)铺96板(各设三个复孔,取平均值) 自发释放孔:50μL靶细胞+50μL培养基+10μLPBS; 最大释放孔:50μL靶细胞+50μL培养基+10μLPBS;
实验孔:50μL靶细胞+50μL效应细胞+10μLPBS
(4)检测
1)体外杀瘤实验:37℃,5%CO
2) 选用SPF级雌性5-6周龄C57BL/6在小鼠分三组:实验组2组(无刺激治疗组、CD137和肠道菌刺激治疗组)和对照组(PBS治疗组),每组8只,对实验组小鼠腹壁皮下种植肿瘤细胞1×10
表1是实施例一-八和对比例1-3中培育的γδT细胞的体外试验和动物试验的检测参数表
结合实施例一-八和对比例1-3并且结合表1,可以看出,10-100ng/mL的CD137和50-150亿/mL的肠道菌加入培养液作为刺激因子,所得的γδT细胞具有较好的抗肿瘤效果,且其中以50ng/mL的CD137和100亿/mL的方案较优。
参考图1和图2,结果显示:本申请中在培养12-14天即可获得纯度在92%以上的γδT细胞,且所纯化得到的γδT细胞具有高杀伤活性。
参考图3-1和图3-2,结果显示:实施例一方法获得的γδT细胞的细胞因子较高,得到的γδT细胞具有高杀伤活性。且实施例一与对比例1-3对比可知,采用50ng/mL的CD137和100亿/mL的肠道菌刺激培养所得的γδT细胞具有高杀伤活性。
参考图4,体外试验结果可知:实施例一的肿瘤细胞死亡率大于对比例1-3,采用50ng/mL的CD137和100亿/mL的肠道菌刺激培养所得的γδT细胞具有高杀伤活性。
参见图5-1,结果显示:PBS治疗组小鼠瘤体体积增长速度较γδT细胞治疗组、CD137和肠道菌刺激后γδT细胞治疗组明显较快,CD137和肠道菌刺激γδT细胞治疗组小鼠瘤体增长速度最慢。
参见图5-2,结果显示:小鼠治疗结束处死后,PBS治疗组小鼠肿瘤体积较γδT细胞治疗组、CD137和肠道菌刺激γδT细胞治疗组明显较大。
综上所述:本申请加入的CD137和肠道菌,能够明显提高γδT细胞对肿瘤细胞肿瘤细胞的杀伤作用,说明本申请诱导扩增的γδT细胞具有更强的抗肿瘤活性。本申请无需对PBMCs进行纯化,在培养10-15天即可获得纯度在90%以上的γδT细胞,所得γδT细胞共表达Vδ2链和Vγ9链;CD137和肠道菌刺激后明显提高了γδT细胞的抗肿瘤活性,且本申请操作步骤简单,可操作性强,具有很好推广价值。
本具体实施例仅仅是对本申请的解释,其并不是对本申请的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本申请的权利要求范围内都受到专利法的保护。
- 一种抗肿瘤效果增强的聚乙二醇纳米递药系统及制备方法
- 利用微流控细胞培养检测人免疫细胞抗肿瘤能力的方法
- 一种具有增强CAR-T细胞抗肿瘤能力的嵌合抗原受体、D-CAR-T细胞及其应用
- 一种制备用于阻止肿瘤细胞诱导T细胞老化并逆转其免疫抑制能力的药物的方法及其在抗肿瘤免疫治疗中的用途
