用于肿瘤或纤维化诊断和治疗的纤连蛋白结合肽
文献发布时间:2024-07-23 01:35:12
技术领域
本发明涉及用于肿瘤或纤维化诊断和治疗的纤连蛋白结合肽。与现有技术相比,本发明的肽表现出改善的纤连蛋白结合性质和生物分布性质。此外,本发明的肽可与有效载荷缀合,可用于治疗和/或预防与病理性纤连蛋白积累相关的疾病,包括癌症和纤维化。本发明的肽还可用于诊断与病理性纤连蛋白积累相关的疾病,包括癌症和纤维化。
背景技术
纤连蛋白(Fn)是一种细胞外基质(ECM)的高分子量(约440kDa)糖蛋白,其与称为整合素的跨膜受体蛋白结合(Hynes,R.O.(2009),Science 326(5957):1216-1219)。与整合素类似,纤连蛋白与其他结合伴侣细胞外基质(ECM)成分(例如胶原蛋白、纤维蛋白和硫酸类肝素蛋白多糖)结合。纤连蛋白以蛋白质二聚体存在,由两个几乎相同的单体通过一对二硫键连接而组成。纤连蛋白蛋白质由单个基因产生,但其pre-mRNA的可变剪接导致产生若干同种型。可溶性血浆纤连蛋白是血浆的主要蛋白质成分,其由肝细胞产生,以约300μg/mL的高浓度在体液中循环。不溶性细胞纤连蛋白是ECM的主要成分。它由多种细胞(主要是成纤维细胞)以可溶性蛋白二聚体形式来分泌,然后在复杂的细胞介导的过程中组装成不溶性基质。
纤连蛋白在细胞粘附、细胞生长、细胞迁移和细胞分化中发挥重要作用,并且对例如伤口愈合和胚胎发育等过程是重要的。
纤连蛋白表达、降解和组织化的改变与许多病状(包括癌症和纤维化)有关。在肿瘤和肿瘤来源的细胞系中观察到的若干形态学变化归因于纤连蛋白表达的改变、纤连蛋白降解的增加和/或纤连蛋白结合受体(例如不同的整合素类型(α5β1、αvβ1、αvβ3、αvβ5、αvβ6或αvβ8整合素))表达的改变。
在肺癌中(尤其是非小细胞肺癌中),纤连蛋白表达增加。肺癌细胞与纤连蛋白的粘附增强了致肿瘤性,并赋予了对诱导细胞凋亡的化疗剂的抗性。纤连蛋白已被证明刺激与脊椎动物雄激素受体相互作用的性腺类固醇,其能够控制细胞周期蛋白D和参与细胞周期控制的相关基因的表达。这些观察结果表明,纤连蛋白可促进肺肿瘤生长/存活以及对治疗的抗性,并且其可能代表开发新抗癌药物的靶点。纤连蛋白可作为抗辐射性的潜在生物标志物。FN-FGFR1融合在磷酸盐尿性间叶肿瘤中是常见的。
WO2007/128563A1教导了用于制备治疗肿瘤或慢性炎性疾病(特别是动脉粥样硬化、关节炎和银屑病)的药物的融合蛋白,其包含特异性结合癌胚胎纤连蛋白(ED-B)的胞外结构域的抗体或其功能性片段以及选自细胞因子IL-10、IL-15、IL-24和GM-CSF(粒细胞-巨噬细胞集落刺激因子)的特异性效应物。ED-B是91个氨基酸的III型同源结构域,在发生组织重塑时,其通过初级转录物水平的可变剪接机制插入到纤连蛋白分子中[Zardi et al.,Embo J.6(8):2337-42(1987)]。ED-B在健康的成人组织中基本检测不到。其表达与ECM重塑和血管生成密切相关。该结构域在许多侵袭性肿瘤中是丰富的,并且根据肿瘤类型展现出以血管为主的表达模式或弥漫性基质表达模式[Carnemolla et al.,J.Cell Biol.108(3):1139-48(1989)]。
与肽相比,靶向活生物靶标的纳米颗粒和抗体在其靶组织的渗透性和滞留性方面存在重大缺陷(参见Wilhelm et al,Analysis of nanoparticledelivery to tumours,Nature Reviews Materials 1,(2016)1-12)。
抗体是分子量为150kDa且流体动力学半径为15nm至20nm的大蛋白质。此外,抗体及其片段对环境和代谢挑战相对敏感。较小的抗体片段(例如单体和Fab识别模式的二聚体)仍然代表大小分别为约50kDa至100kDa的大分子。较小的靶向化合物包括蛋白质、肽、基于核酸的配体(例如适体)和小分子[Bertrand et al.,Advanced Drug Delivery Reviews66,(2014):2-25]。这些较小的分子具有更快扩散和更快靶向靶组织的优点,导致在病理组织如癌症或纤维化中更一致的分布。
然而,治疗肽的一个主要且普遍接受的缺点是其在血浆中的稳定性差,导致半衰期短,从而降低了治疗效果或诊断效果。经常观察到血清中肽的快速降解导致丧失对靶蛋白的亲和力。因此,必须引入稳定策略。天然肽主要来源于两栖动物和爬行动物,由于进化工程,天然肽在人类血液中比相关的人类类似物表现出更高的代谢稳定性。另一种增加稳定性的可能是通过化学方法改变肽内的代谢切割位点。这包括用非天然氨基酸代替天然氨基酸或对酰胺键进行化学修饰。
在细菌性伤口感染方面,Chabria等人(Nature Communications,1:135,2010,1-9)报道了细菌FnBR通过骨架氢键的特异性结合可通过体外“拉伸”Fn纤维来机械调节,并表明细胞产生的力足够高以使细菌粘附素与Fn纤维的特异性结合失活。因此,作者推测包含Fn的ECM的力生物学可调节细菌和细胞结合事件、毒性和感染过程。
Cao等人[PNAS,vol.109,19:7251-7256,May 8,2015]报道了基于噬菌体展示的分子探针LNLPHG和RFSAFY,其在体内区分纤维状纤连蛋白的力诱导结构状态,即Fn纤维所谓的“松弛的”(优先通过LNLPHG结合)和“紧张的”(优先通过RFSAFY结合)状态。展示SRWYRI、ARERFY和GSNSKY的噬菌体也以较低但显著的亲和力优先结合松弛状态。随机的噬菌体展示的肽探针表现出与手工挤出的纤连蛋白(Fn)纤维、细胞来源的Fn ECM和离体活肺切片的应变选择性结合。作者推测这些肽探针未来可能用于绘制未修饰的天然ECM微环境中的分子应变事件以及用于靶向与疾病相关的结构状态改变的Fn(ECM)。另一方面,作者承认仍然没有直接证据表明在人工应变条件下观察到的纤维内Fn的可延长性和Fn III型结构域展开事件实际上发生在体内。特别是因为仅测试了展示这些肽的噬菌体,而不是单独的肽,因此识别“松弛的”或“紧张的”Fn的肽是否可以用作肿瘤标志物是高度推测性的。Hertig等人(Nano Lett.,12,5132-5168,2012)公开了细菌来源的Fn结合蛋白质(FnBP)的分离和进一步的工程化。天然的FnBP与细菌细胞膜共价连接,并可包含若干内在无序的Fn结合重复(FnBR)。有趣的是,尽管若干革兰氏阳性细菌和一种螺旋菌表达的FnBR都识别并结合相同的Fn结构域,但它们几乎没有同源性。保守残基主要存在于Fnl结合基序中,其中E-D/E-T/S基序高度保守并且几乎存在于每个FnBR。Fn具有5个Fnl模块,这些模块被肽接头隔开,并且都可以作为FnBP的结合伴侣。
总之,纤连蛋白是血浆和组织ECM中普遍存在的蛋白质,其可以在纤维化组织和癌症组织中上调。纤连蛋白的剪接变异体可用于靶向剪接变异体特异的癌症类型。天然存在的FnBP和基于噬菌体展示的FnBP的结合可以随Fn的天然松弛状态和人工紧张状态而变化(S.Arnoldini,A.Moscaroli,M.Chabria,M.Hilbert,S.Hertig,R.Schibli,M.Béhé,andV.Vogel,“Novel peptide probes to assess the tensional state of fibronectinfibers in cancer.,”Nat Commun,vol.8,no.1,p.1793,Nov.2017;C.M.Fonta,S.Arnoldini,D.Jaramillo,A.Moscaroli,A.Oxenius,M.Béhé,and V.Vogel,“Fibronectinfibers are highly tensed in healthy organs in contrast to tumors and virus-infected lymph nodes.,”Matrix Biology Plus,vol.8,p.100046,Nov.2020)。
文件WO 2017/216223还教导了包含与诊断剂或治疗剂连接的纤连蛋白结合肽的组合物。
发明内容
本发明的目的是提供新的纤连蛋白结合肽序列,其对纤连蛋白(特别是对Fib1构建体)具有改善的亲和力,并且具有改善的生物分布性质。
该目的通过本文所述的并以权利要求为特征的实施方案来实现。
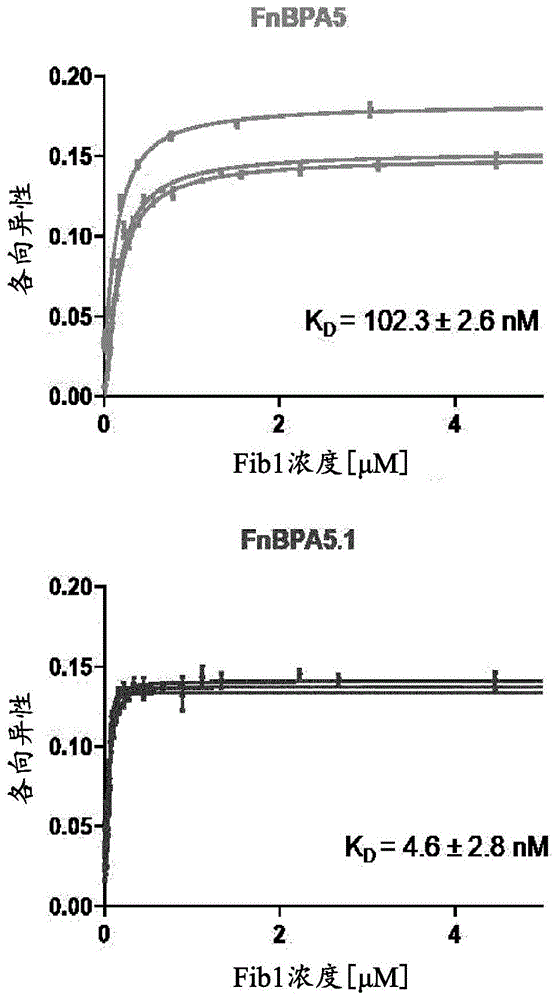
本发明人发现源自FnBPA5序列(SEQ ID NO.:13)经三个氨基酸替换和两个氨基酸缺失的FnBPA5.1序列表现出通过荧光偏振分析法测量的对Fib1令人惊讶地改善的亲和力(实施例1,图1)。本发明人还研究了本发明的纤连蛋白结合肽的生物分布,并惊奇地发现,与现有技术已知的FnBPA5序列相比,有放射性同位素标签的FnBPA5.1序列在肿瘤中的摄取得到改善,如在PC3异种移植小鼠的实验所证实的(实施例4、图4和实施例6和7、图6),以及如在67NR原位同基因乳腺肿瘤小鼠中所研究的(实施例5、图5和实施例8和9、图7)。还令人惊讶地证实,与现有技术已知的FnBPA5序列相比,本发明的纤连蛋白结合肽同时在脾脏和肝中表现出较低的摄取,技术人员已知这是从生物分布的角度所需的特征。
本发明将在以下实施方案中概括。
在第一实施方案中,本发明涉及一种纤连蛋白结合肽,其包含序列:
FnI5BS-L1-FnI4BS-L2-FnI3BS-L3-FnI2BS
其中:
FnI5BS是选自以下的多肽序列
Gln-Val-Thr-Thr-Gly-Ser-Asn(SEQ ID NO.:1),
Gln-Val-Thr-Thr-Ala-Ser-Asn(SEQ ID NO.:2),
Gln-Val-Thr-Thr-Val-Ser-Asn(SEQ ID NO.:3),和
Gln-Val-Thr-Thr-Ser-Ser-Asn(SEQ ID NO.:4);
FnI4BS是选自以下的多肽序列
Val-Glu-Phe-Thr-Glu-Glu-Ser(SEQ ID NO.:5),
Val-Glu-Phe-Ser-Glu-Glu-Ser(SEQ ID NO.:6),
Val-Glu-Phe-Cys-Glu-Glu-Ser(SEQ ID NO.:7),
Val-Glu-Phe-Asn-Glu-Glu-Ser(SEQ ID NO.:8),和
Val-Glu-Phe-Gln-Glu-Glu-Ser(SEQ ID NO.:9);
FnI3BS是序列为Gly-Ile-Val-Thr-Gly-Ala-Val(SEQ ID NO.:10)的多肽;
FnI2BS是序列为His-Thr-Thr-Val-Glu-Asp-Thr(SEQ ID NO.:11)的多肽;以及
L1、L2和L3分别是包含0、1或2个氨基酸残基的多肽序列。
在一个具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其中FnI5BS是根据SEQ ID NO.:1的序列的多肽;和/或FnI4BS是根据SEQ ID NO.:5的序列的多肽。
在进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其中FnI5BS是根据SEQ ID NO.:1的序列的多肽;以及FnI4BS是根据SEQ ID NO.:5的序列的多肽。
在又一进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其中L1是单氨基酸残基Leu;和/或L2是选自Leu、Ile、Val、Ala和Met的单氨基酸残基,优选是Leu;和/或L3是序列为Ser-Asp的二肽。
在又一进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其中L1是单氨基酸残基Leu;以及L2是单氨基酸残基Leu;以及L3是序列为Ser-Asp的二肽。
在又一进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其包含多肽序列Gln-Val-Thr-Thr-Gly-Ser-Asn-Leu-Val-Glu-Phe-Thr-Glu-Glu-Ser-Leu-Gly-Ile-Val-Thr-Gly-Ala-Val-Ser-Asp-His-Thr-Thr-Val-Glu-Asp-Thr(SEQ ID NO:12)。
在又一进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其具有根据SEQ ID NO:12的多肽序列。
在又一进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其特征在于,以5.0nM或更紧密的K
在又一进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其还与有效载荷缀合。
在又一进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其中所述有效载荷通过酰胺键直接与所述多肽序列的N末端或C末端缀合,或者其中所述有效载荷通过接头与所述多肽序列的N末端或C末端缀合。
在又一进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其中所述接头包括肽部分、PEG部分、源自尸胺的部分或C
在又一进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其中所述有效载荷是生物活性分子(BAM)或成像剂。
在又一进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其中所述有效载荷是生物活性分子(BAM)。
在又一进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其中所述生物活性分子选自由以下所组成的组:细胞抑制剂、细胞毒性剂、细胞因子、转录因子抑制剂、蛋白酶体和蛋白酶抑制剂、细胞凋亡调节剂、细胞周期调节剂、血管生成抑制剂、激素或激素衍生物、光动力治疗分子、用于热消融治疗的纳米颗粒和微粒、放射性核素、miRNA、siRNA和免疫调节抗原分子。
在又一进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其中所述生物活性分子选自由紫杉醇、苯丁酸氮芥、内皮抑素、舒尼替尼、白细胞介素-7、
在又一进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其中所述有效载荷是成像剂。
在又一进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其中所述成像剂包括放射性核素、荧光染料、化学发光剂、生物发光剂、光谱可分辨的无机荧光半导体纳米晶体、金属纳米颗粒、纳米团簇、顺磁性金属离子、酶、比色标记物、生物素、地高辛、半抗原或蛋白质。
在又一进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其中所述成像剂选自由以下所组成的组:放射性核素、MRI活性化合物、超声造影剂、荧光团、PET和SPECT标志物,优选选自
在又一进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其中所述成像剂选自
在又一进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其中所述有效载荷包括放射性核素,优选选自
在又一进一步具体的实施方案中,本发明涉及本发明的纤连蛋白结合肽,其中所述有效载荷是[
在进一步的实施方案中,本发明涉及一种药物组合物,其包含本文所述的纤连蛋白结合肽和药学上可接受的载体。
在又一进一步的实施方案中,本发明涉及本发明的纤连蛋白结合肽或本发明的药物组合物用于治疗之用途。
在又一进一步的实施方案中,本发明涉及本发明的纤连蛋白结合肽或本发明的药物组合物用于治疗或预防与病理性纤连蛋白积累相关的疾病之用途。
在一个具体的实施方案中,本发明涉及用于本发明之用途的纤连蛋白结合肽或用于本发明之用途的药物组合物,其中所述与病理性纤连蛋白积累相关的疾病选自由以下疾病所组成的组:纤维化、癌症、淋巴水肿、免疫性疾病、自身免疫性疾病和动脉粥样硬化。
在进一步具体的实施方案中,本发明涉及用于本发明之用途的纤连蛋白结合肽或用于本发明之用途的药物组合物,其中所述自身免疫性疾病选自系统性硬化症、1型糖尿病、格雷夫斯病(Graves’disease)、多发性硬化症和类风湿性关节炎。
在又一进一步具体的实施方案中,本发明涉及用于本发明之用途的纤连蛋白结合肽或用于本发明之用途的药物组合物,其中所述纤维化选自肺纤维化、肝纤维化和肾纤维化。
在又一进一步具体的实施方案中,本发明涉及用于本发明之用途的纤连蛋白结合肽或用于本发明之用途的药物组合物,其中所述癌症选自乳腺癌、头颈部鳞状细胞癌、前列腺癌、肾癌、胰腺癌和肺癌。
在又一进一步具体的实施方案中,本发明涉及用于本发明之用途的纤连蛋白结合肽或用于本发明之用途的药物组合物,其中所述肺癌是非小细胞肺癌。
在进一步的实施方案中,本发明涉及本发明的纤连蛋白结合肽或本发明的药物组合物用于诊断之用途。
在进一步的实施方案中,本发明涉及本发明的纤连蛋白结合肽或本发明的药物组合物用于诊断与病理性纤连蛋白积累相关的疾病之用途。
在一个具体的实施方案中,本发明涉及用于本发明之用途的纤连蛋白结合肽或药物组合物,其中所述与病理性纤连蛋白积累相关的疾病选自由以下疾病所组成的组:纤维化、癌症、淋巴水肿、免疫性疾病、自身免疫性疾病和动脉粥样硬化。
在进一步具体的实施方案中,本发明涉及用于本发明之用途的纤连蛋白结合肽或药物组合物,其中所述自身免疫性疾病选自系统性硬化症、1型糖尿病、格雷夫斯病、多发性硬化症和类风湿性关节炎。
在又一进一步具体的实施方案中,本发明涉及用于本发明之用途的纤连蛋白结合肽或药物组合物,其中所述纤维化选自肺纤维化、肝纤维化和肾纤维化。
在又一进一步具体的实施方案中,本发明涉及用于本发明之用途的纤连蛋白结合肽或药物组合物,其中所述癌症选自乳腺癌、头颈部鳞状细胞癌、前列腺癌、肾癌、胰腺癌和肺癌。
在又一进一步具体的实施方案中,本发明涉及用于本发明之用途的纤连蛋白结合肽或药物组合物,其中所述肺癌是非小细胞肺癌。
附图说明
图1
图2
图3
图4
图5
图6
图7:气管内灌注博来霉素14天且注射[
具体实施方式
在以下实施方案中对本发明进行详细描述。应当理解,本文所公开的特征的所有组合都是可以设想的。
纤连蛋白结合肽
在第一实施方案中,本发明涉及一种纤连蛋白结合肽,其包含序列:
FnI5BS-L1-FnI4BS-L2-FnI3BS-L3-FnI2BS。
本文定义的FnI5BS指FnI5结合序列,根据本发明,FnI5BS是选自以下的多肽序列
Gln-Val-Thr-Thr-Gly-Ser-Asn(SEQ ID NO.:1),
Gln-Val-Thr-Thr-Ala-Ser-Asn(SEQ ID NO.:2),
Gln-Val-Thr-Thr-Val-Ser-Asn(SEQ ID NO.:3),和
Gln-Val-Thr-Thr-Ser-Ser-Asn(SEQ ID NO.:4)。
优选地,FnI5BS是根据SEQ ID NO.:1的序列的多肽。
本文定义的FnI4BS指FnI4结合序列,根据本发明,FnI4BS是选自以下的多肽序列
Val-Glu-Phe-Thr-Glu-Glu-Ser(SEQ ID NO.:5),
Val-Glu-Phe-Ser-Glu-Glu-Ser(SEQ ID NO.:6),
Val-Glu-Phe-Cys-Glu-Glu-Ser(SEQ ID NO.:7),
Val-Glu-Phe-Asn-Glu-Glu-Ser(SEQ ID NO.:8),和
Val-Glu-Phe-Gln-Glu-Glu-Ser(SEQ ID NO.:9);
优选地,FnI4BS是根据SEQ ID NO.:5的序列的多肽。
因此,优选地,本发明涉及一个实施方案,其中FnI5BS是根据SEQ ID NO.:1的序列的多肽;和/或FnI4BS是根据SEQ ID NO.:5的序列的多肽。在进一步优选的实施方案中,FnI5BS是根据SEQ ID NO.:1的序列的多肽;以及FnI4BS是根据SEQ ID NO.:5的序列的多肽。
如本文所定义的,FnI3BS指FnI3结合序列,是序列为Gly-Ile-Val-Thr-Gly-Ala-Val(SEQ ID NO.:10)的多肽。
如本文进一步所定义的,FnI2BS指FnI2结合序列,是序列为His-Thr-Thr-Val-Glu-Asp-Thr(SEQ ID NO.:11)的多肽。
L1、L2和L3分别是包含0、1或2个氨基酸残基的多肽序列。L1、L2和L3分别是连接FnI5结合序列(FnI5BS)和FnI4结合序列(FnI4BS)、FnI4结合序列(FnI4BS)和FnI3结合序列(FnI3BS)、以及FnI3结合序列(FnI3BS)和FnI2结合序列(FnI2BS)的接头。同时,优选地,L1、L2和L3不必通过与纤连蛋白残基直接相互作用来提高结合亲和力。
因此,L1是包含0、1或2个氨基酸残基的多肽序列。优选地,L1是单氨基酸残基Leu。
L2是包含0、1或2个氨基酸残基的多肽序列。优选地,L2是选自Leu、Ile、Val、Ala和Met的单氨基酸残基。更优选地,L2是Leu。
L3是包含0、1或2个氨基酸残基的多肽序列。优选地,L3是序列为Ser-Asp的二肽。
最优选地,在本发明的实施方案中,L1是单氨基酸残基Leu;L2是单氨基酸残基Leu;以及L3是序列为Ser-Asp的二肽。
优选地,本发明的纤连蛋白结合肽包含多肽序列Gln-Val-Thr-Thr-Gly-Ser-Asn-Leu-Val-Glu-Phe-Thr-Glu-Glu-Ser-Leu-Gly-Ile-Val-Thr-Gly-Ala-Val-Ser-Asp-His-Thr-Thr-Val-Glu-Asp-Thr(SEQ ID NO:12)。更优选地,本发明的纤连蛋白结合肽具有根据SEQ ID NO:12的多肽序列。
本发明的优选序列FnBPA5.1(SEQ ID NO:12)与现有技术的FnBPA5序列(SEQ IDNO:13)的区别在于:
-现有技术已知的FnBPA5序列(SEQ ID NO:13)中第5位的Glu残基(对应FnI5BS序列-SEQ ID NO.:1的第5位)被甘氨酸所取代;
-现有技术的FnBPA5序列(SEQ ID NO.:13)中第12位的Asp残基(对应FnI4BS序列-SEQ ID NO:5的第4位)被Thr残基所取代;
-现有技术的FnBPA5序列(SEQ ID NO:13)中第16位的Thr残基(对应L2的第一个残基)被Leu所取代;
-现有技术的FnBPA5序列(SEQ ID NO.:13)中第17位的Lys残基和第34位的Lys残基缺失。
本发明人惊奇地发现,得到的肽序列(在本文中称为FnBPA5.1序列(SEQ ID NO:12))表现出对Fib1的亲和力提高、在肿瘤中的摄取增加、而在脾脏和肝中的摄取降低。值得注意的是,技术人员可以想象,在相同位置的类似取代可能导致如本文所述的对Fib1的亲和力产生相同的效果,和/或导致在肿瘤中的摄取增加、以及在脾脏和肝中的摄取降低。因此,本发明还包括以下实施方案:其中FnBPA5序列(SEQ ID NO:13)第5位的Glu残基用具有与甘氨酸相似性质的残基(例如选自Ala、Val和Ser的残基)取代。得到的FnI5结合序列(也称为FnI5BS)选自SEQ ID NO:2至SEQ ID NO:4。本发明还包括以下实施方案:其中现有技术FnBPA5序列(SEQ ID NO.:13)第12位的Asp残基用具有与Thr相似性质的残基(例如选自Ser、Cys、Asn和Gln的残基)取代。得到的FnI5结合序列(也称为FnI4BS)选自SEQ ID NO.:6至SEQ ID NO.:9。技术人员还可以想象,现有技术FnBPA5序列(SEQ ID NO.:13)第16位的Thr残基可以用具有与Leu相似性质的残基(例如选自Ile、Val、Ala和Met的残基)取代。
本发明包括本文所述的纤连蛋白结合肽,其与纤连蛋白结合,特别是与Fib1结合。优选地,本文所定义的本发明的纤连蛋白结合肽与纤连蛋白结合,优选地与Fib1结合,其亲和力优于根据SEQ ID NO.:13的肽(也称为现有技术已知的FnBPA5肽)测量的亲和力。如图1所示,所述FnBPA5肽对Fib1的亲和力对应于K
优选地,所述亲和力通过使用具有N末端附加Cy5标记的肽(如制备实施例1中所述)的荧光各向异性测定法来测量。测量的详细方案包括在实施例1中。
因此,在一个优选的实施方案中,本发明的纤连蛋白结合肽的特征在于与Fib1(根据SEQ ID NO:14的构建体)结合,K
纤连蛋白结合肽-有效载荷缀合物
在进一步的实施方案中,本发明涉及如上所述的本发明的纤连蛋白结合肽,其还与有效载荷缀合。换句话说,在某些实施方案中,本发明的纤连蛋白结合肽与有效载荷连接。
根据本发明,对于所述纤连蛋白结合肽和所述有效载荷如何相互连接没有具体限制,只要所述纤连蛋白结合肽和所述有效载荷在生理条件下(优选在血浆中)以足够稳定的方式连接,以物理地和/或化学地将成分连接/分配/结合在一起,直至它们到达靶点。所述纤连蛋白结合肽和所述有效载荷可以共价或非共价相互连接,例如通过疏水相互作用、范德华力、静电吸引等或通过一个或多个间隔序列或至少一个接头。在某些实施方案中,所述接头可以是可裂解接头。表述“可裂解接头”表示任何可以物理或化学地裂解的接头。物理裂解的实例是通过光、放射性发射或热进行的裂解,而化学裂解的实例包括通过氧化还原反应、水解进行的裂解、pH依赖性裂解或通过酶进行的裂解。
如本文所理解的,使用本领域已知的或本文所述的适合于将有效载荷部分优选与氨基酸残基(例如,氨基酸侧链)缀合的任何化学偶联,可使有效载荷部分直接与本发明的纤连蛋白结合肽内的任何氨基酸残基(或其中的任何合适的化学基团)缀合。因此,所述偶联可导致有效载荷部分与本发明的纤连蛋白结合肽的氨基酸(例如,氨基酸侧链)之间间隔一个或多个化学基团,这些基团是由于本领域已知的偶联反应形成的。
或者,如本文所述,有效载荷部分可以间接(即通过接头基团)与本发明的纤连蛋白结合肽内的任何氨基酸残基缀合。在这样的实施方案中,有效载荷与接头基团缀合,该接头基团与本发明的纤连蛋白结合肽内的氨基酸残基缀合。有效载荷与接头基团之间以及接头基团与本发明的纤连蛋白结合肽的氨基酸残基或化学基团之间的缀合可以是适合于实现本文所述的缀合或本领域已知的其他缀合的任何缀合方法和/或化合物。
有效载荷部分可与本发明的纤连蛋白结合肽内的任何氨基酸残基缀合。因此,有效载荷部分可直接或间接与本发明的纤连蛋白结合肽内的氨基酸残基缀合。优选地,有效载荷部分可直接或间接与位于本发明的纤连蛋白结合肽的N末端或C末端的氨基酸残基缀合。可选地或另外,有效载荷部分可直接或间接与本发明的纤连蛋白结合肽内的内部氨基酸残基缀合。如本公开中所使用的,内部残基或内部化学基团是指不在肽链末端的本发明的纤连蛋白结合肽的氨基酸残基或化学基团。如本领域已知的,缀合方法(无论是直接的还是间接的)可能需要对一个或两个缀合位点进行化学修饰(例如,对氨基酸残基进行修饰和/或对有效载荷部分进行修饰)。因此,本发明还包括对本发明的纤连蛋白结合肽进行化学修饰。
优选地,本发明的纤连蛋白结合肽涉及一个实施方案,其中所述有效载荷通过酰胺键直接与所述多肽序列的N末端或C末端缀合。进一步优选地,所述有效载荷通过酰胺键直接与所述多肽序列的N末端或C末端缀合。
或者,所述有效载荷可通过接头与所述多肽序列的N末端或C末端缀合。本发明的优选接头包括选自以下的部分:肽部分、PEG部分、源自尸胺的部分和C
优选地,所述有效载荷可通过酰胺键形成或马来酰亚胺-硫醇缀合与所述接头缀合。
本发明的有效载荷不受特别限制。在优选的实施方案中,所述有效载荷是生物活性分子(BAM)或成像剂。
在本发明的某些优选的实施方案中,所述有效载荷是生物活性分子(BAM)。
优选地,本发明所包括的生物活性分子选自由以下所组成的组:细胞抑制剂、细胞毒性剂、细胞因子、转录因子抑制剂、蛋白酶体和蛋白酶抑制剂、细胞凋亡调节剂、细胞周期调节剂、血管生成抑制剂、激素或激素衍生物、光动力治疗分子、用于热消融治疗的纳米颗粒和微粒、放射性核素、miRNA、siRNA和免疫调节抗原分子。
如本文所理解的,优选地,细胞抑制剂选自阿霉素(Doxorubicin)、紫杉醇(Paclitaxel)、苯丁酸氮芥(Chlorambucil)、拓扑替康(Topotecan)和长春新碱(Vincristine)。
如本文进一步所理解的,优选地,细胞因子选自白细胞介素-2、白细胞介素-7、干扰素-γ和肿瘤坏死因子。根据本发明,用作有效载荷的其他合适的细胞因子是例如白细胞介素2、白细胞介素7、干扰素α-2a、干扰素α-2b、干扰素-lα、干扰素-lβ、干扰素γ-lβ、肿瘤坏死因子及其任何衍生物。
如本文进一步所理解的,优选地,转录因子抑制剂选自姜黄素(Curcumin)、利巴韦林(Ribavirin)和染料木素(Genistein)。根据本发明,用作有效载荷的其他合适的转录因子抑制剂是例如抑制N F-KB活化的化合物,例如姜黄素(二阿魏酰甲烷)、表没食子儿茶素-3-没食子酸酯(EGCG;绿茶多酚)、菲啰啉、吡咯烷二硫代氨基甲酸酯(PDTC)、槲皮苷、替泊沙林(5-(4-氯苯基)-N-羟基-(4-甲氧基苯基)-N-甲基-1H-吡唑-3-丙酰胺)、PMC(2,2,5,7,8-五甲基-6-羟基色满)、苄基异氰酸酯、白藜芦醇、染料木素、羽扇豆醇、番茄红素、panepoxydone、环氧醌霉素C(epoxyquinomicin C)、脱氢甲基环氧醌霉素(DHMEQ)、环氧菌酮(cycloepoxydon)、胶霉毒素、以及1-KB-α磷酸化和/或降解抑制剂,例如PS-1,145、BAY-11-7082(E3[(4-甲基苯基)磺酰基]-2-丙烯腈)、BAY-11-7085(E3[(4-叔丁基苯基)磺酰基]-2-丙烯腈)、环氧菌酮(cycloepoxydon);1-羟基-2-羟甲基-3-戊烯基苯、血根碱(假白屈菜季铵碱,13-甲基-[l,3]-苯并二氧杂环戊烯-[5,6-c]-l,3-二氧杂环戊烯-4,5-菲啶鎓)、柳氮磺胺吡啶、辣椒素(8-甲基-N-香草基-6-壬烯酰胺)、大黄素(3-甲基-l,6,8-三羟基蒽醌)、erbstatin(酪氨酸激酶抑制剂)、雌激素(E2)、胶霉毒素、染料木素、树酯毒素和NF-KB的多种抑制剂,例如β淀粉样蛋白、糖皮质激素(地塞米松(dexamethasone)、强的松(prednisone)、甲基强的松龙(methylprednisolone))、来普霉素B(LMB)、O,Ο'-双肉豆蔻酰硫胺二硫化物(BMT)、ADP核糖基化抑制剂,例如,双环、三环或四环内酯胺、1,8-萘二甲酰亚胺(1,8-naphtalimide)衍生物、菲啶-6-酮、3,4-二氢-5-甲基-异喹啉-1(2H)-酮、苯并噁唑-4-甲酰胺、1,6-萘啶-5(6H)-酮、喹唑啉并[3,4-d]嘧啶-4(3H)-酮、1,5-二羟基异喹啉、2-甲基-喹唑啉-4[3H]-酮、l,llb-二氢-[2H]苯并吡喃并[4,3,2-de]异喹啉-3-酮、心房利钠肽(ANP)、阿托伐他汀(atrovastatin)(HMG-CoA还原酶抑制剂)、骨化三醇(1a,25-二羟基维生素D3)、E3330(醌衍生物)、除莠霉素A、金丝桃素、对苯二酚(HQ)、KT-90(吗啡合成衍生物)、美维诺林(mevinolin)、5'-甲硫腺苷(MTA)、己酮可可碱(1-(5'-氧代己基)3,7-二甲基黄嘌呤,PTX)、苯基-N-叔丁基硝酮(PBN)、垂体腺苷酸环化酶活化的多肽(PACAP)、quinadril(ACE抑制剂)、利巴韦林、分泌性白细胞蛋白酶抑制剂(SLPI)、血清素衍生物(N-(对香豆酰基)血清素)、水飞蓟素、血管活性肠肽(VIP)、D609(磷脂酰胆碱-磷脂酶C抑制剂)、R031-8220(PKG抑制剂)、SB203580(p38 MAPK抑制剂)、雷公藤甲素(PG490,中药提取物)、LY294,002、美沙拉嗪(mesalamine)、渥曼青霉素(真菌代谢物)或CHS 828(N-(6-(对氯苯氧基)-己基)-N'-氰基-N,,-4-吡啶基胍)、倍半萜内酯类,例如小白菊内酯(parthenoilde)、堆心菊内酯(helenalin)、miller-9e-enolid和巴德来因A(budlein A)。
如本文所理解的,优选地,蛋白酶体和蛋白酶抑制剂选自肽醛:ALLnL(N-乙酰基-亮氨酰-亮氨酰-正亮氨醛,MG101)、LLM(N-乙酰基-亮氨酰-亮氨酰-甲硫氨醛)、Z-LLnV(苯甲酰氧基羰基-亮氨酰-亮氨酰-正缬氨醛,MG115)、Z-LLL(苯甲酰氧基羰基-亮氨酰-亮氨酰-亮氨醛,MG132)、硼酸衍生物,例如PS-273、PS-293、PS-296、PS-303、PS-305、PS-313、PS-321、PS-325、PS-334、PS-341、PS-364、PS-352、PS-383、乳胞素、β-内酯、硼酸肽、泛素连接酶抑制剂脱氧精胍菌素、APNE(N-乙酰基-DL-苯丙氨酸-β-萘酯)、BTEE(N-苯甲酰基-L-酪氨酸乙酯)、DCIC(3,4-二氯异香豆素)、DFP(二异丙基氟磷酸酯)、TPCK(N-α-对甲苯磺酰基-L-苯丙氨酸氯甲基酮)和TLCK(N-α-对甲苯磺酰基-L-赖氨酸氯甲基酮)。
如本文进一步所理解的,优选地,细胞凋亡调节剂选自伊马替尼(Imatinib)、埃罗替尼(Erlotinib)和苔藓抑素(Bryostatin)。根据本发明用作有效载荷的其他合适的细胞凋亡调节剂是例如法尼基(farnesyl)转移酶抑制剂例如R115777、SCH66336、BMS214662、伊马替尼、17-AAG,EGFR抑制剂例如ZD1839、ZD647、BIBW 2992、或埃罗替尼,MEK抑制剂例如PD032590,RAF抑制剂例如BAY43-9006,PKG抑制剂例如UCN-01、PKC-412、苔藓抑素、ISIS-3521、LY333531、沙芬戈(safingol)、CGP-41251(米多斯替尼(midostaurin)),HDAC抑制剂例如辛二酰-3-氨基吡啶酰胺羟肟酸、氯尼达明(lonidamine)、凋亡蛋白、生存素、雷帕霉素、CCI-779、RAD001(依维莫司(everolimus))、PXD101,酪氨酸激酶抑制剂例如易瑞沙(Iressa)、OSI-774、STI-571,分裂素活化的蛋白激酶通路中的酶的抑制剂,例如PD-098059、U-0126。根据本发明使用的特别优选的细胞周期调节剂是例如夫拉平度(flavopiridol)、苔藓抑素-1(bryostain-1)、罗斯科维汀(roscovitine)、BMS-387032、哌立福辛(perifosine)或洛伐他汀(lovastatin)。
如本文进一步所理解的,优选地,细胞周期调节剂选自夫拉平度和罗斯科维汀。
如本文进一步所理解的,优选地,血管生成抑制剂选自内皮抑素、塞来昔布(Celexocib)、ADH-1(exherin)和舒尼替尼。根据本发明用作有效载荷的其他合适的血管生成抑制剂是例如沙利度胺(thalidomide)、内皮抑素、塞来昔布、ABT-510、康布雷他汀(combrestatin)A4、达肝素钠(dalteparin)、二甲基氧杂蒽酮乙酸、来那度胺(lenalidomide)、LY317615(恩扎司他林(enzastaurin))、PPI-2458、ADH-1(exherin)、AG-013736、AMG-706、AZD2171、Bay 43-9006(索拉非尼(sorafenib))、BMS-582664、CH IR-265、GW786034(帕唑帕尼(pazopanib))、PI-88、PTK787/ZK 222584(瓦他拉尼(vatalanib))、RAD001(依维莫司(everolimus))、SU 11248(舒尼替尼)、苏拉明(suramin)、XL184、ZD6474、ATN-161、或EMO 121974(西仑吉肽(cilenigtide)),以及诱导血小板反应蛋白-1的沙泊素A衍生肽(优选为美国专利2015/0320825Al的Seq.ID No.4(DWLPK)和Seq.ID No.5(DWLP))。
如本文进一步所理解的,优选地,激素和激素衍生物选自氟他米特(Flutamide)、磷雌酚(Fosfestrol)、他莫昔芬(Tamoxifen)和松弛素(Relaxin)。根据本发明用作有效载荷的其他合适的激素或激素衍生物是例如aminogluthemid、布舍瑞林(buserilin)、醋酸环丙孕酮(cyproteronacetate)、屈洛昔芬(droloxifen)、炔雌醇(ethinylestradiol)、氟他胺(flutamid)、formesta、磷雌酚(fosfestrol)、gestonoroncaproate、戈舍瑞林(goserilin)、亮丙瑞林(leuprolein)、炔诺酮(lynestrenol)、美孕诺酮(medrogeston)、醋酸甲羟孕酮(medroxyprogesteronacetate)、醋酸甲地孕酮(megestrolactetate)、奥曲肽(octreotid)、松弛素(relaxin)、他莫昔芬、托瑞米芬(toremifin)、曲普瑞林(triptorelin)、阿那曲唑(anastrazole)、依西美坦(exemestane)或来曲唑(letrozole)。
如本文进一步所理解的,合适的miRNA和siRNA是例如CD40、CD80和CD86特异性的miRNA和siRNA,以及以基因编辑为目的的靶向成簇的、规律间隔的、短回文重复序列(CRISPR)组分的任何剂,或调节免疫系统的抗原,例如胰岛素相关的抗原、P31、全醇溶蛋白、髓鞘少突胶质细胞糖蛋白(优选氨基酸35-55)、蛋白脂质蛋白1(优选氨基酸139-151和178-191)、因子V(优选氨基酸75-89、1723-1737和2191-2210)。
应当理解,放射性核素优选不直接与本发明的纤连蛋白结合肽或接头结合,而是包含在络合剂或螯合剂中,所述络合剂或螯合剂可作为有效载荷与本发明的纤连蛋白结合肽缀合。因此,如本文所理解的,提到放射性核素作为有效载荷应理解为具有放射性核素的螯合剂装载物(charger)。可与本发明的纤连蛋白结合肽缀合的螯合剂包括但不限于:1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)、二乙三胺五乙酸(DTPA)、去铁胺(DFO)和三亚乙基四胺(TETA)、1,4,8,11-四氮杂二环[6.6.2]十六烷-4,11-二乙酸(CB-TE2A)、乙二胺四乙酸(EDTA)、乙二醇双(2-氨基乙基)-N,N,N',N'-四乙酸(EGTA)、1,4,8,11-四氮杂环十四烷-1,4,8,11-四乙酸(TETA)、亚乙基双-(2-4羟基苯甘氨酸)(EHPG)、5-Cl-EHPG、5BrEHPG、5-Me-EHPG、5t-Bu-EHPG、5-sec-Bu-EHPG、苯并二乙三胺五乙酸(苯并DTPA)、二苯并DTPA、苯基DTPA、二苯基DTPA、苄基DTPA、二苄基DTPA、双-2(羟基苄基)-乙二胺二乙酸(HBED)及其衍生物、Ac-DOTA、苯并DOTA、二苯并DOTA、1,4,7-三氮杂环壬烷Ν,Ν',Ν"-三乙酸(NOTA)、苯并NOTA、1,4,7-三氮杂环壬烷-N,Ν'-二乙酸-N”-谷氨酸(NODAGA)、苯并TETA、苯并DOTMA,其中DOTMA是1,4,7,10-四氮杂环十四烷-1,4,7,10-四(甲基四乙酸)、苯并TETMA,其中TETMA是1,4,8,11-四氮杂环十四烷-1,4,8,11-(甲基四乙酸)、1,3-丙二胺四乙酸(PDTA)的衍生物、三乙四胺六乙酸(TTHA)、1,5,10-N,N',N"-三(2,3-二羟基苯甲酰基)-三儿茶酚(LICAM)的衍生物、以及1,3,5-N,N',N"-三(2,3-二羟基苯甲酰基)氨基甲基苯(MECAM),或其他金属螯合剂。在某些实施方案中,所述有效载荷可包括一种以上螯合剂。其他优选的螯合剂可选自环状DPT A(二乙烯三胺五乙酸)酐、乙二胺四乙酸(EDTA)、DOTA(1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸)和OTA(1,4,7-三氮杂壬烷-1,4,7-三乙酸)。
如本文进一步所理解的,在某些实施方案中,放射性核素优选选自
最优选地,所述生物活性分子选自紫杉醇、苯丁酸氮芥、内皮抑素、舒尼替尼、白细胞介素-7、
在本发明的进一步的实施方案中,所述有效载荷是成像剂。所述成像剂可以是本领域已知的任何成像剂。当与成像剂缀合时,本发明的纤连蛋白结合肽可用于体外和/或体内细胞和/或组织的可视化。当所述纤连蛋白结合肽用于体外靶细胞或靶组织的可视化时,必须注意选择在成像条件下发挥作用的成像剂。类似的标准适用于用于体内靶细胞和/或靶组织可视化的成像剂。然而,对于体内应用,必须额外注意所述成像剂是生物相容的,例如,所述成像剂对施用包含所述成像剂的本发明的化合物的受试者没有毒性或其他有害影响。
本文使用的术语“成像剂”指有助于检测与所述成像剂缀合的剂(例如,本发明的化合物)的任何元素、分子、官能团、化合物、其片段或部分。成像剂的实例包括但不限于:多种配体、放射性核素、荧光染料(具体的示例性荧光染料见下文)、化学发光剂(例如,例如,吖啶酯、稳定的二氧杂环丁烷等)、生物发光剂、光谱可分辨的无机荧光半导体纳米晶体(即量子点)、金属纳米颗粒(例如,金、银、铜、铂等)、纳米团簇、顺磁性金属离子、酶(酶的具体实例见下文)、比色标记物(例如,例如,染料、胶体金等)、生物素、地高辛、半抗原以及可获得抗血清或单克隆抗体的蛋白质。应当理解,所述成像剂可以直接或通过接头间接与本发明的纤连蛋白结合肽缀合,或者所述成像剂可以包含在直接或通过接头间接与本发明的化合物缀合的分子中。技术人员将理解哪些成像剂可直接与本发明的纤连蛋白结合肽或接头缀合,以及哪些成像剂需要包埋在可与本发明的化合物或接头缀合的分子中。例如,如果所述成像剂是放射性核素,则优选地,所述放射性核素包埋在可与本发明的纤连蛋白结合肽或接头缀合的分子中(例如,通过作为所述分子的一部分的螯合剂进行螯合)。
优选地,所述成像剂包括放射性核素、荧光染料、化学发光剂、生物发光剂、光谱可分辨的无机荧光半导体纳米晶体、金属纳米颗粒、纳米团簇、顺磁性金属离子、酶、比色标记物、生物素、地高辛、半抗原或蛋白质。优选地,所述成像剂包括放射性核素、荧光染料、化学发光剂或生物发光剂。
在另一个实施方案中,所述成像剂选自放射性核素、MRI活性化合物、超声造影剂、荧光团、PET和SPECT标志物,优选选自
在又一进一步具体实施方案中,本发明涉及本发明的纤连蛋白结合肽,其中所述成像剂选自
在又一进一步具体实施方案中,本发明涉及本发明的纤连蛋白结合肽,其中所述有效载荷包括放射性核素,优选选自
在某些实施方案中,本发明的纤连蛋白结合肽可与一种或多种造影剂/成像剂(例如,荧光染料、(螯合的)放射性核素(SPECT、PET)、MR活性剂、CT剂)缀合。
在某些实施方案中,造影剂/成像剂可与本发明的纤连蛋白结合肽缀合,用于医学或生物成像。本发明的纤连蛋白结合肽可用于某些成像技术,其可包括正电子发射断层扫描(PET)、单光子发射计算机断层扫描(SPECT)、计算机断层扫描(CT)、磁共振成像(MRI)、光学生物发光成像、光学荧光成像及其组合。在某些实施方案中,所述造影剂/成像剂可以是本领域已知的用于PET、SPECT、CT、MRI和光学成像的任何分子、物质或化合物。所述造影剂可以是放射性核素、放射性金属、正电子发射体、β发射体、γ发射体、α发射体、顺磁性金属离子和超顺磁性金属离子。所述造影剂包括但不限于碘、氟、Cu、Zr、Lu、At、Yt、Ga、In、Tc、Gd、Dy、Fe、Mn、Ba和BaSO
在某些实施方案中,所述成像剂可以是荧光报告物。在某些实施方案中,所述荧光报告物可以是近红外染料或远红色染料。在某些实施方案中,所述荧光报告物可以选自荧光团、荧光染料、染料、色素、荧光过渡金属和荧光蛋白。在某些实施方案中,所述荧光报告物选自Cy5、Cy5.5、Cy2、FITC、TRITC、Cy7、FAM、Cy3、Cy3.5、德克萨斯红、ROX、HEX、JA133、AlexaFluor 488、AlexaFluor 546、AlexaFluor633、AlexaFluor 555、AlexaFluor 647、DAPI、TMR、R6G、GFP、增强型GFP、CFP、ECFP、YFP、Citrine、Venus、YPet、CyPet、AMCA、光谱绿、光谱橙、光谱蓝绿、丽丝胺和铕。
示例性的成像剂包括例如以下:Cy5.5、Cy5、Cy7.5和Cy7
优选地,本发明的纤连蛋白结合肽涉及一个实施方案,其中所述有效载荷是[
药物组合物
在进一步的实施方案中,本发明涉及包含本文所述的纤连蛋白结合肽和药学上可接受的载体的药物组合物。如本文所详述的,本发明的纤连蛋白结合肽,优选包含有效载荷缀合物(即,直接或通过接头间接与本发明的纤连蛋白结合肽缀合的生物活性分子或成像剂),可以影响有效载荷对靶细胞或靶组织的靶向作用。在某些实施方案中,所述有效载荷缀合物还可以影响有效载荷进入靶细胞的胞内运输。因此,在优选的实施方案中,本发明包括一种药物组合物,其包含本发明的纤连蛋白结合肽(例如,有效载荷缀合物)和药学上可接受的载体或赋形剂。
这样的载体或赋形剂包括但不限于生理盐水、缓冲生理盐水、葡萄糖、水、甘油、乙醇和/或其组合。所述药物组合物还可以包括用于治疗待治疗的给定疾病的另外的治疗剂。制备所述制剂以适合施用方式。通常,施用多肽的方法是本领域众所周知的,并且可以应用于施用本发明的缀合物。
通过通常用于将纤连蛋白结合肽引入最终与血液接触的任何途径进行施用。在本发明背景下,可用的将这种纤连蛋白结合肽及其缀合物施用于患者的合适方法,包括口服途径和肠胃外途径。虽然可以使用超过一个的途径来施用特定的组合物,但一个具体的途径通常可以提供比另一种途径更直接且更有效的作用或反应。
优选地,本发明的纤连蛋白结合肽的有效载荷缀合物通过肠胃外施用方式施用,特别是通过静脉内、腹膜内、肌内、皮内、皮下、鞘内、眼内、眼球后、肺内或关节内方式施用。这些施用途径和合适的制剂通常是本领域技术人员已知的。适用于肠胃外施用的制剂包括水性和非水性等渗无菌注射溶液以及水性和非水性无菌悬浮液,所述水性和非水性等渗无菌注射溶液可包含抗氧化剂、缓冲液、抑菌剂和使该制剂与预期接受者的血液等渗的溶质,所述水性和非水性无菌悬浮液可包含悬浮剂、增溶剂、增稠剂、稳定剂和防腐剂。纤连蛋白结合肽及其缀合物也可通过脂质体施用。
本发明的纤连蛋白结合肽及其缀合物,单独使用或与其他合适成分组合,也可制成通过吸入施用的气溶胶(aerosol)制剂(即,它们可以被“雾化”)。气溶胶制剂可以放入加压的可接受的推进剂中,例如二氯二氟甲烷、丙烷、氮气等。
在一个优选的实施方案中,本发明的药物组合物以冻干形式提供,以在施用前复原。用于复原药物组合物的缓冲液和溶液可以与药物制剂一起提供,以产生用于施用的本发明的水性组合物。
药学上可接受的载体部分地取决于所施用的特定组合物以及用于施用所述组合物的特定方法。因此,本发明的药物组合物有多种合适的制剂。药学上可接受的载体和赋形剂在本领域是众所周知的,并且本发明的一种或多种缀合物可以通过众所周知的方法制成药物组合物(参见,例如,Remington:The Science and Practice ofPharmacy,21stedition,A.R.Gennaro,Ed.,Mack Publishing Company(2005);PharmaceuticalFormulation Development of Peptides and Proteins,S.Frokjaer and L.Hovgaard,Eds.,Taylor&Francis(2000);以及Handbook of Pharmaceutical Excipients,3rdedition,A.Kibbe,Ed.,Pharmaceutical Press(2000))。
包含本发明的一种或多种纤连蛋白结合肽和/或其有效载荷缀合物的药物组合物任选地在一种或多种合适的体外和/或体内疾病动物模型中进行测试,以根据本领域众所周知的方法确认功效、组织代谢并且估计剂量。因此,应当理解,根据本发明的组合物的合适剂量将取决于接受者的年龄、健康状况和体重、同时治疗的种类(如果有)、治疗频率以及所期望的效果的性质。然而,所述剂量是针对个体受试者定制的,可由本领域技术人员确定,而无需进行过多的实验。治疗剂的总剂量可以以多个剂量或单个剂量施用。在某些实施方案中,所述组合物单独施用,在其他实施方案中,所述组合物与针对疾病或针对该疾病其他症状的其他治疗联合施用。
本发明中的纤连蛋白结合肽可以单独施用或与佐剂联合施用,所述佐剂会增强稳定性、促进包含所述纤连蛋白结合肽的药物组合物的施用、提供增加的溶解或分散、增加抑制活性、提供附加治疗等(包括其他活性成分)。有利地,这种联合治疗利用了较低剂量的常规治疗剂,从而避免了当这些剂用作单一治疗时可能产生的毒性和不良副作用。上述纤连蛋白结合肽可与常规治疗剂或其他佐剂物理组合成单一药物组合物。
在本发明的上下文中,取决于应用情况,施用于患者的剂量足以随着时间推移在患者中产生有益的治疗反应,或者,例如,抑制病原体的感染、减少或预防疾病状态的症状、或其他合适的活性。所述剂量由以下因素决定:特定组合物/制剂的疗效、所使用的BAM多肽缀合物的活性、稳定性或血清半衰期、患者的状态以及待治疗患者的体重或体表面积。所述剂量的大小还取决于在特定患者中施用特定组合物/制剂等所伴随的任何不良副作用的存在、性质和程度。在一些实施方案中,对于70kg的患者,剂量水平范围为约0.5μg/剂至100mg/剂。虽然每天一剂可能就足够了,但每天最多可以给5剂。对于口服剂量,可能需要高达2000mg/天。对于放射性核素治疗,每4周至8周施用一剂,共2次至8次可能适用。如本领域技术人员将理解的,根据特定因素,可能需要更低或更高的剂量。例如,具体的剂量和治疗方案将取决于以下因素:例如患者的总体健康概况、患者疾病的严重程度和病程或对疾病的处置、以及治疗医生的判断。例如,本发明的纤连蛋白结合肽的施用方式可以与其他基于肽的药物的相同。
本发明中的纤连蛋白结合肽可以以与配制其他基于肽的药物相同的方式制成胶囊。每粒胶囊可包含100mg至500mg、优选150mg至300mg、更优选200mg至250mg的本发明化合物。例如,用于本发明化合物的胶囊中的非药用成分为:胶囊壳:D&C黄色10号、FD&C蓝色1号、FD&C红色3号、FD&C黄色6号、明胶和二氧化钛。每瓶100粒。(另参见Martindale:thecomplete drug reference,34Edition,2005,Pharmaceutical Press,p 612.)。
治疗应用
在一个实施方案中,本发明涉及如上所述的本发明的纤连蛋白结合肽或如上所述的本发明的药物组合物用于治疗的用途。所述治疗在本文中优选理解为治疗和/或预防,更优选理解为治疗。
在进一步的实施方案中,本发明涉及如上所述的本发明的纤连蛋白结合肽或本发明的药物组合物用于治疗或预防与病理性纤连蛋白积累相关的疾病的用途。本文所用的术语“病理性纤连蛋白积累”是指纤连蛋白在给定位点沉积的量高于健康状态的任何疾病或病症。例如,经常在纤维化或癌症中发现病理性纤连蛋白积累。
如本文所用,术语“纤维化”可以指以纤维化为特征的任何疾病,包括但不限于系统性硬化症、多灶性纤维硬化症、硬皮病样移植物抗宿主病、肾源性系统性纤维化、器官特异性纤维化、纵隔纤维化、骨髓纤维化、腹膜后纤维化、进行性大块纤维化、克罗恩病、瘢痕疙瘩、关节纤维化、佩罗尼氏病、掌腱膜挛缩症、粘连性关节囊炎等。示例性的器官特异性纤维化包括但不限于肺纤维化、肺动脉高压、囊性纤维化、哮喘、慢性阻塞性肺病、肝纤维化、肾纤维化、胰腺纤维化、非酒精性脂肪性肝炎(NASH)、淋巴结纤维化、角膜纤维化、纤维化软骨、子宫内膜异位等。许多纤维化疾病、病症或病况在受影响组织中具有紊乱的和/或过度的细胞外基质沉积。纤维化可能与炎症相关,作为潜在疾病的症状出现,和/或由外科手术或伤口愈合能力有限的损伤引起。
本文使用的“癌症”或“肿瘤”指细胞不受控制生长,其干扰身体器官和系统的正常功能。癌症的实例包括但不限于B细胞淋巴瘤(霍奇金淋巴瘤和/或非霍奇金淋巴瘤)、脑瘤、乳腺癌、结肠癌、肺癌、肝细胞癌、胃癌、胰腺癌、宫颈癌、卵巢癌、肝癌、膀胱癌、泌尿道癌、甲状腺癌、肾癌、癌、黑色素瘤和其他皮肤癌、头颈癌(优选头颈部鳞状细胞癌)、脑癌和前列腺癌(包括但不限于雄激素依赖性前列腺癌和雄激素非依赖性前列腺癌)。
优选地,与致病性纤连蛋白积累相关的疾病是与可溶性血浆纤连蛋白和/或不溶性ECM纤连蛋白异常积累相关的疾病。因此,本发明涉及如上所述的本发明的纤连蛋白结合肽或如上所述的本发明的药物组合物用于治疗和/或预防与可溶性血浆纤连蛋白和/或不溶性ECM纤连蛋白异常积累相关的疾病的用途。
进一步优选地,所述与病理性纤连蛋白积累相关的疾病选自纤维化、癌症、淋巴水肿、免疫性疾病、自身免疫性疾病和动脉粥样硬化。因此,本发明涉及如上所述的本发明的纤连蛋白结合肽或如上所述的本发明的药物组合物用于治疗和/或预防选自纤维化、癌症、淋巴水肿、免疫性疾病、自身免疫性疾病和动脉粥样硬化的疾病的用途。
如本文所理解的,所述自身免疫性疾病优选选自系统性硬化症、1型糖尿病、格雷夫斯病、多发性硬化症和类风湿性关节炎。因此,本发明涉及如上所述的本发明的纤连蛋白结合肽或如上所述的本发明的药物组合物用于治疗和/或预防选自系统性硬化症、1型糖尿病、格雷夫斯病、多发性硬化症和类风湿性关节炎的疾病的用途。
如本文进一步所理解的,所述纤维化优选选自肺纤维化、肝纤维化和肾纤维化。因此,本发明涉及如上所述的本发明的纤连蛋白结合肽或如上所述的本发明的药物组合物用于治疗和/或预防选自肺纤维化、肝纤维化和肾纤维化的疾病的用途。
如本文进一步所理解的,所述癌症优选选自乳腺癌、头颈部鳞状细胞癌、前列腺癌、肾癌、胰腺癌和肺癌。因此,本发明涉及如上所述的本发明的纤连蛋白结合肽或如上所述的本发明的药物组合物用于治疗和/或预防选自乳腺癌、头颈部鳞状细胞癌、前列腺癌、肾癌、胰腺癌和肺癌的疾病的用途。
优选地,所述肺癌是非小细胞肺癌。因此,本发明涉及如上所述的本发明的纤连蛋白结合肽或如上所述的本发明的药物组合物用于治疗和/或预防非小细胞肺细胞癌的用途。
本发明还涉及如上所述的本发明的纤连蛋白结合肽或本发明的药物组合物在制备用于治疗或预防与病理性纤连蛋白积累相关的疾病的药物中的用途。与病理性纤连蛋白积累相关的疾病如上所述。
因此,本发明还涉及如上所述的本发明的纤连蛋白结合肽或本发明的药物组合物在制备用于治疗或预防与可溶性血浆纤连蛋白和/或不溶性ECM纤连蛋白异常积累相关的疾病的药物中的用途。
进一步因此,本发明还涉及如上所述的本发明的纤连蛋白结合肽或本发明的药物组合物在制备用于治疗或预防选自纤维化、癌症、淋巴水肿、免疫性疾病、自身免疫性疾病和动脉粥样硬化的疾病的药物中的用途。
进一步因此,本发明还涉及如上所述的本发明的纤连蛋白结合肽或本发明的药物组合物在制备用于治疗或预防选自系统性硬化症、1型糖尿病、格雷夫斯病、多发性硬化症和类风湿性关节炎的疾病的药物中的用途。
进一步因此,本发明还涉及如上所述的本发明的纤连蛋白结合肽或本发明的药物组合物在制备用于治疗或预防选自肺纤维化、肝纤维化和肾纤维化的疾病的药物中的用途。
进一步因此,本发明还涉及如上所述的本发明的纤连蛋白结合肽或本发明的药物组合物在制备用于治疗或预防选自乳腺癌、头颈部鳞状细胞癌、前列腺癌、肾癌、胰腺癌和肺癌的疾病的药物中的用途。
进一步因此,本发明还涉及如上所述的本发明的纤连蛋白结合肽或本发明的药物组合物在制备用于治疗或预防非小细胞肺细胞癌的药物中的用途。
在进一步的实施方案中,本发明涉及治疗或预防与病理性纤连蛋白积累相关的疾病的方法(优选治疗与病理性纤连蛋白积累相关的疾病的方法)。所述方法包括向有此需要的受试者施用治疗有效量的本发明的纤连蛋白结合肽或本发明的药物组合物的步骤。本文的受试者优选是指人类受试者,优选为患有与病理性纤连蛋白积累相关的疾病的人类受试者。所述与病理性纤连蛋白积累相关的疾病如上定义。
因此,本发明还涉及治疗或预防与可溶性血浆纤连蛋白和/或不溶性ECM纤连蛋白异常积累相关的疾病的方法(优选治疗与可溶性血浆纤连蛋白和/或不溶性ECM纤连蛋白异常积累相关的疾病的方法)。所述方法包括向有此需要的受试者施用治疗有效量的本发明的纤连蛋白结合肽或本发明的药物组合物的步骤。
进一步因此,本发明还涉及治疗或预防选自纤维化、癌症、淋巴水肿、免疫性疾病、自身免疫性疾病和动脉粥样硬化的疾病的方法(优选治疗选自纤维化、癌症、淋巴水肿、免疫性疾病、自身免疫性疾病和动脉粥样硬化的疾病的方法)。所述方法包括向有此需要的受试者施用治疗有效量的本发明的纤连蛋白结合肽或本发明的药物组合物的步骤。
进一步因此,本发明还涉及治疗或预防选自系统性硬化症、1型糖尿病、格雷夫斯病、多发性硬化症和类风湿性关节炎的疾病的方法(优选治疗选自系统性硬化症、1型糖尿病、格雷夫斯病、多发性硬化症和类风湿性关节炎的疾病的方法)。所述方法包括向有此需要的受试者施用治疗有效量的本发明的纤连蛋白结合肽或本发明的药物组合物的步骤。
进一步因此,本发明还涉及治疗或预防选自肺纤维化、肝纤维化和肾纤维化的疾病的方法(优选治疗选自肺纤维化、肝纤维化和肾纤维化的疾病的方法)。所述方法包括向有此需要的受试者施用治疗有效量的本发明的纤连蛋白结合肽或本发明的药物组合物的步骤。
进一步因此,本发明还涉及治疗或预防选自乳腺癌、头颈部鳞状细胞癌、前列腺癌、肾癌、胰腺癌和肺癌的疾病的方法(优选治疗选自乳腺癌、头颈部鳞状细胞癌、前列腺癌、肾癌、胰腺癌和肺癌的疾病的方法)。所述方法包括向有此需要的受试者施用治疗有效量的本发明的纤连蛋白结合肽或本发明的药物组合物的步骤。
进一步因此,本发明还涉及治疗或预防非小细胞肺细胞癌的方法(优选治疗非小细胞肺细胞癌的方法)。所述方法包括向有此需要的受试者施用治疗有效量的本发明的纤连蛋白结合肽或本发明的药物组合物的步骤。
如上所述,本发明中特别有用的纤连蛋白结合肽是负载生物活性分子作为有效载荷的纤连蛋白结合肽。
诊断用途
在进一步的实施方案中,本发明涉及本发明的纤连蛋白结合肽或本发明的药物组合物用于诊断的用途。优选地,本发明涉及本发明的纤连蛋白结合肽或本发明的药物组合物用于诊断与病理性纤连蛋白积累相关的疾病的用途。与病理性纤连蛋白积累相关的疾病如上所述。
本发明的纤连蛋白结合肽或本发明的药物组合物可用于诊断选自纤维化、癌症、淋巴水肿、免疫性疾病、自身免疫性疾病和动脉粥样硬化的疾病。因此,本发明涉及本发明的纤连蛋白结合肽或本发明的药物组合物用于诊断选自纤维化、癌症、淋巴水肿、免疫性疾病、自身免疫性疾病和动脉粥样硬化的疾病的用途。
进一步因此,本发明涉及本发明的纤连蛋白结合肽或本发明的药物组合物用于诊断自身免疫性疾病的用途,所述自身免疫性疾病优选选自系统性硬化症、1型糖尿病、格雷夫斯病、多发性硬化症和类风湿性关节炎。
进一步因此,本发明涉及本发明的纤连蛋白结合肽或本发明的药物组合物用于诊断纤维化的用途,所述纤维化优选选自肺纤维化、肝纤维化和肾纤维化。
进一步因此,本发明涉及本发明的纤连蛋白结合肽或本发明的药物组合物用于诊断癌症的用途,所述癌症优选选自乳腺癌、头颈部鳞状细胞癌、前列腺癌、肾癌、胰腺癌和肺癌。
进一步因此,本发明涉及本发明的纤连蛋白结合肽或本发明的药物组合物用于诊断非小细胞肺癌的用途。
如上所述,本发明中特别有用的纤连蛋白结合肽是负载成像剂作为有效载荷的纤连蛋白结合肽。
实施例
以下实施例仅是对本发明的说明,不应被解释为限制本发明的范围,本发明的范围由所附权利要求限定。
制备实施例1-NODAGA或Cy5标记的纤连蛋白结合肽的制备
合成NODAGA缀合的纤连蛋白结合肽和/或青色素5(Cy5)缀合的纤连蛋白结合肽(根据SEQ ID NO:12的FnBPA5.1序列或根据SEQ ID NO.:13的FnBPA5序列)以获得大于95%的HPLC纯度。通过酰胺键形成或马来酰亚胺-硫醇缀合在纤连蛋白结合肽的N末端引入所需的部分(例如NODAGA或Cy5)来合成肽缀合物。在纤连蛋白结合肽的最后一个N末端氨基酸和有效载荷(在此为NODAGA、Cy5)之间添加三个甘氨酸的短间隔序列(在通过马来酰亚胺-硫醇化学反应获得缀合物的情况下还有一个额外的半胱氨酸残基),形成以下结构:
有效载荷-GGG-纤连蛋白结合肽
或
有效载荷-CGGG-纤连蛋白结合肽
获得HPLC纯度大于95%的为冻干粉末的肽缀合物。通过采用标准Fmoc/tBu方案的自动化固相肽合成来合成线性肽序列,随后通过马来酰亚胺-硫醇缀合在纤连蛋白结合序列的N末端进行最后的缀合步骤,提供最终的NODAGA缀合物或Cy5缀合物。在纤连蛋白结合序列的最后一个N末端氨基酸与功能物(螯合剂、染料)之间引入三个甘氨酸和一个额外的半胱氨酸残基的短间隔序列。
NODAGA-FnBPA5.1
Cy5-FnBPA5.1
为了制备[
实施例1-使用荧光偏振法测定Cy5标记的FnBPA5.1对Fib1的亲和力
对于亲和力测量实验,将Cy5-FnBPA5.1(根据SEQ ID NO:12)和Cy5-FnBPA5(根据SEQ ID NO:13)(48nM)与不同浓度的根据SEQ ID NO.:14的纤连蛋白的Fib 1-N末端30kDa片段(0nM-4.5μM)在PBS pH7.4中混合。将样品孵育1h(37℃,70rpm),使用Pherastar FSX酶标仪(BMG Labtech;光学模块:FP 590-50 675-50 675-50)测量荧光偏振(三份)。减去背景荧光,使用Pallicer等人(Pallicer,J.M.,and Kramer,S.D.(2012)Evaluation offluorescence anisotropy to assess drug-lipid membrane partitioning,J PharmBiomed Anal 71,219-227)描述的结合等式将荧光偏振转换为各向异性并进行拟合,以获得解离常数K
Fib1是包含N末端FnI1-5模块的纤连蛋白的30kDa N端片段,在人胚胎肾细胞(HEK-293)中表达。为此,将C末端包含用于通过Ni-NTA琼脂糖(Qiagen,巴塞尔,瑞士)进行亲和纯化的6-His标签的Fib1 cDNA克隆到哺乳动物表达载体pcDNA3.1+(Invitrogen,巴塞尔,瑞士)的HindIII/BamHI位点。通过DNA测序(Microsynth,巴尔加赫,瑞士)证实cDNA正确插入载体。采用磷酸钙法转染HEK-293细胞。在遗传霉素选择后,将最有效的细胞克隆用于生产,并如前所述从细胞培养上清中纯化Fib1(Grunberg,J.,Knogler,K.,Waibel,R.,andNovak-Hofer,I.(2003).High-yield production of recombinant antibody fragmentsin HEK-293cells using sodium butyrate,Biotechniques 34,968-972)。最后,用PBSpH7.4透析Fib1。
实施例2-纤连蛋白纤维拉伸试验
使用明胶琼脂糖色谱法从人血浆(Zürcher Blutspendedienst SRK,瑞士)中提取纤连蛋白。使用尖锐的移液管尖从PBS中的纤连蛋白浓缩液滴(95%未标记的蛋白质和5%A488标记的蛋白质)中手动拉出纤连蛋白纤维,并将其沉积在柔性硅胶片(SMI,美国)上,在PBS中冲洗和再水化。此后,按照Little等人(Little,W.C.,Smith,M.L.,Ebneter,U.&Vogel,V.Assay to mechanically tune and optically probe fibrillar fibronectinconformations from fully relaxed to breakage.Matrix Biol.27,451–461(2008))所定义的,松弛(约7%应力)或拉伸(约380%应力)纤维。在用BSA(Sigma-Aldrich,布克斯,瑞士)进行封闭步骤以避免结合配体非特异性附着在纤维或硅胶片上后,将纤维与Cy5标记的FnBPA5或FnBPA5.1(150nM)孵育1h,并在洗涤步骤后通过共聚焦显微镜成像。结果如图2所示。
实施例3–血浆稳定性研究
将7.5MBq的人血浆(Kantonsspital Aarau,瑞士)中的111In[In]-NODAGAFnBPA5.1于37℃温和搅动下孵育,以评估FnBPA5.1的血浆稳定性。在不同的时间点(0h、0.5h、1h、4h和24h)取出等分试样,加入等体积的MeCN沉淀蛋白质。离心(14000rpm,10min)后,通过Mini-UniPrep过滤器将上清过滤到MiniPrep Whatman管(Whatman Inc.,NJ,USA)中,并通过RP-γHPLC进行分析。数据表示为以0min时间的参考样品标准化的各个时间点的回收的测试化合物的百分比。结果如图3所示。
实施例4-PC-3异种移植物的生物分布
根据瑞士动物保护法,在AG75700许可证下进行动物研究。对于肿瘤移植,在异氟烷/氧气麻醉下,将100μL PBS中的5×10
实施例5-原位同基因乳腺肿瘤模型中的生物分布
根据瑞士动物保护法,在AG75700许可证下进行动物研究。对于肿瘤移植,在异氟烷/氧气麻醉下,将50μL PBS中的40,000个67NR细胞皮下注射到雌性Balb/c小鼠(CharlesRiver,德国)的第4乳头的乳腺脂肪垫。定期检查肿瘤生长,并使用卡尺测量肿瘤。肿瘤移植2周后,小鼠经尾静脉注射约100kBq至150kBq相应的
实施例6-原位同基因乳腺肿瘤模型-SPECT/CT成像研究。
将10MBq至15MBq的
实施例7-原位同基因乳腺肿瘤模型-放射自显影
对实施例6的SPECT/CT小鼠实施CO
实施例8-博来霉素诱导的实验性纤维化肺病模型-SPECT/CT成像研究
向雌性C57BL/6小鼠灌注2U/kg体重的博来霉素(Bleomycin Baxter)。为此,通过腹腔注射氯胺酮(80mg/kg体重)和甲苯噻嗪(10mg/kg)的混合物麻醉小鼠。在气管内施用博来霉素前,将小鼠在含100%氧气的室内放置5min至10min。
在灌注博来霉素2周后,将10MBq至15MBq的预先用PBS稀释至10MBq/mL至15MBq/mL的浓度的
实施例9-博来霉素诱导的实验性纤维化肺病模型-放射自显影
对实施例8的SPECT/CT小鼠实施CO
- 用于各种肿瘤免疫治疗的新型肽和肽组合物
- 包含纤连蛋白结合蛋白或纤连蛋白结合肽的疫苗组合物
- 包含纤连蛋白结合蛋白或纤连蛋白结合肽的疫苗组合物
