一种合成姜黄素葡萄糖苷的基因工程菌构建及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及一种合成姜黄素葡萄糖苷的基因工程菌构建及其应用,属于基因工程领域。
背景技术
姜黄素是从姜科、天南星科中的一些植物的根茎中提取的一种二酮类化合物,化学式为C
据报道,提高酮类化合物的溶解性,主要依靠糖苷化修饰,而糖苷化修饰研究最多的是葡萄糖苷化反应。使用化学方法进行葡萄糖苷化修饰步骤复杂,收率低,副产物多,难以进行规模化放大和生产,不具生产实用价值。微生物酶法进行葡萄糖苷化修饰,反应条件温和,无需进行保护和脱保护反应,立体和区域选择性高,可以定向高效地对酮类化合物进行葡萄糖苷化。不过,由于酶促反应需要添加活化的糖基供体UDP-葡萄糖,而此前体较为昂贵,难以实现反应的放大。
发明内容
本发明的目的在于提供一种UDP-葡萄糖合成途径及姜黄素葡萄糖苷合成基因工程菌,从而提高细胞内源性UDP-葡萄糖水平,提高姜黄素溶解性,从而增大其利用范围。
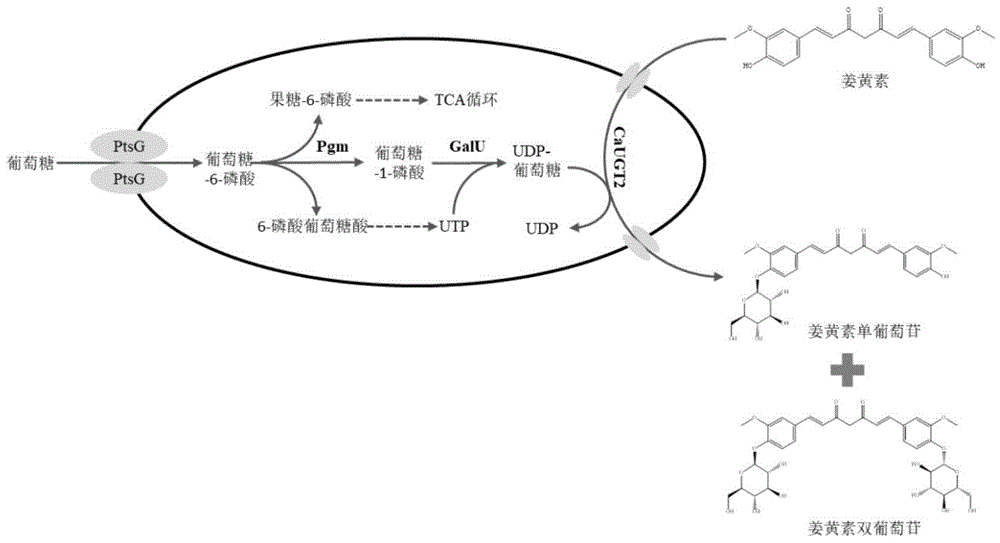
大肠杆菌作为模式菌株,具有生长快、易培养、遗传背景清晰、易于进行遗传改造等优点,同时还可以高表达UDP-葡萄糖转移酶进行葡萄糖苷化修饰,是进行微生物全细胞催化进行葡萄糖苷化修饰的绝佳选择。本发明以大肠杆菌BL21(DE3)为工程菌株,过表达大肠杆菌2个参与UDP-葡萄糖合成的关键酶,即葡萄糖-6-磷酸变位酶(phosphoglucomutase,Pgm)和UDP-葡萄糖焦磷酸化酶(UTP-glucose-1-phosphate uridylyltransferase,GalU),提高细胞内源性UDP-葡萄糖水平,有效提高了全细胞催化合成姜黄素葡萄糖苷的合成效率。
本发明提供了一种基因工程菌,所述基因工程菌过表达了大肠杆菌来源的葡萄糖-6-磷酸变位酶Pgm和大肠杆菌来源的UDP-葡萄糖焦磷酸化酶GalU,同时过表达了Catharanthus roseus来源的UDP-葡萄糖基转移酶CaUGT2。
在本发明的一种实施方式中,所述葡萄糖-6-磷酸变位酶Pgm的氨基酸序列如SEQID No.1所示;UDP-葡萄糖焦磷酸化酶GalU的氨基酸序列如SEQ ID No.2所示;所述UDP-葡萄糖基转移酶CaUGT2的氨基酸序列如SEQ ID No.3所示。
在本发明的一种实施方式中,编码所述葡萄糖-6-磷酸变位酶Pgm的核苷酸序列如SEQ ID No.4所示;编码所述UDP-葡萄糖焦磷酸化酶GalU的核苷酸序列如SEQ ID No.5所示;编码所述UDP-葡萄糖基转移酶CaUGT2的核苷酸序列如SEQ ID No.6所示。
在本发明的一种实施方式中,所述基因工程菌是以pGEX、pZSH、pBAD或pET为表达载体。
在本发明的一种实施方式中,所述基因工程菌是采用pACYCDuet-1质粒表达葡萄糖-6-磷酸变位酶和UDP-葡萄糖焦磷酸化酶;采用pGEX表达UDP-葡萄糖基转移酶。
在本发明的一种实施方式中,所述基因工程菌是以大肠杆菌、枯草芽孢杆菌或毕赤酵母为表达宿主。
在本发明的一种实施方式中,所述基因工程菌是以大肠杆菌为表达宿主。
在本发明的一种实施方式中,所述大肠杆菌为大肠杆菌BL21(DE3)。
本发明还提供了一种全细胞转化制备姜黄素葡萄糖苷的方法,所述方法为,将上述重组大肠杆菌添加至含有底物姜黄素、葡萄糖的反应体系中,进行反应,制备得到姜黄素葡萄糖苷。
在本发明的一种实施方式中,所述姜黄素葡萄糖苷(Ⅰ)和姜黄素双葡萄糖苷(Ⅱ),其结构式如下:
/>
在本发明的一种实施方式中,所述方法为:
挑取上述重组大肠杆菌,接种至含氨苄霉素和氯霉素抗性液体LB培养基中,培养至其OD
在本发明的一种实施方式中,挑取上述重组大肠杆菌,接种至含氨苄霉素和氯霉素抗性液体LB培养基中,于37℃,200rpm摇床培养至其OD
在本发明的一种实施方式中,所述葡萄糖浓度为0g/L-10g/L之间。
在本发明的一种实施方式中,所述葡萄糖浓度为2g/L。
在本发明的一种实施方式中,所述的姜黄素的浓度为0.1-2.5g/L之间。
在本发明的一种实施方式中,所述的姜黄素的浓度为1.0g/L。
在本发明的一种实施方式中,所述姜黄素底物添加时间为诱导后0-48h之间的某个时间点。
在本发明的一种实施方式中,所述姜黄素底物添加时间为诱导后0h。
在本发明的一种实施方式中,所述基因工程菌诱导温度为16-30℃。
在本发明的一种实施方式中,所述基因工程菌诱导温度为30℃
在本发明的一种实施方式中,所述反应的时间为24~72h。
在本发明的一种实施方式中,所述反应的时间为30h。
本发明还提供了上述重组大肠杆菌在制备姜黄素葡萄糖苷或含有姜黄素葡萄糖苷的产品中的应用。
有益效果
(1)本发明通过在宿主细胞内过表达葡萄糖-6-磷酸变位酶(phosphoglucomu-tase,Pgm)和UDP-葡萄糖焦磷酸化酶(UTP-glucose-1-phosphateuridylyltrans-ferase,GalU),提高细胞代谢池内UDP-葡萄糖的浓度。通常状态下细胞代谢池内UDP-葡萄糖浓度很低,即便细胞内过表达了具有催化姜黄素形成姜黄素葡萄糖苷化活性的UDP-葡萄糖基转移酶,也难以高效大量地获得姜黄素葡萄糖苷。本发明通过工程菌提供UDP-葡萄糖,以姜黄素为底物,全细胞催化高效合成姜黄素单葡萄糖苷及姜黄素双葡萄糖苷,可以有效解决姜黄素的溶解性问题,提高姜黄素生物体吸收率及生物学利用度,拓展其在医药品、化妆品及食品的应用价值。
(2)与现有技术相比,本发明通过构建基因工程菌,使其自身提供UDP-葡萄糖,以姜黄素为底物,可以高效合成姜黄素葡萄糖苷及姜黄素双葡萄糖苷,在有效解决了姜黄素的溶解性问题,大大提高了其生物体吸收率及生物学利用度,拓展了其在医药品、化妆品及食品的应用价值。本发明提供的方法在反应30h后,姜黄素转化为姜黄素葡萄糖苷的转化率为62%,转化为姜黄素双葡萄糖苷的转化率为28%。
附图说明
图1:姜黄素葡萄糖苷合成途径。
图2:姜黄素、姜黄素葡萄糖单糖苷和姜黄素葡萄糖双糖苷含量随时间变化图。
图3:液相检测结果。
图4:质谱检测结果;其中,A为姜黄素葡萄糖单糖苷质谱检测结果,B为姜黄素葡萄糖双糖苷质谱检测结果。
图5:不同来源的UDP-葡萄糖基转移酶转化效果;其中,图5A为采用基因工程菌BL21-AhUGT83A1的转化效果、图5B为采用基因工程菌BL21-UGT75B1的转化效果、图5C为采用基因工程菌BL21-UGT74F2的转化效果、图5D为采用基因工程菌BL21-Ugt3的转化效果。
具体实施方式
下面结合具体实施例来进一步描述本发明,但是应理解所述实施例仅是范例性的,不对本发明的范围构成任何限制,本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明的技术方案的细节和形式进行修改或替换,但这些修改或替换均落入本发明的保护范围。
下述实施例中所涉及的培养基如下:
LB培养基:酵母粉5.0g/L,胰蛋白胨10.0g/L,NaCl 10.0g/L。
下述实施例中所涉及的检测方法如下:
姜黄素单葡萄糖苷、姜黄素双葡萄糖苷的检测:
HPLC检测:
收集发酵液,按体积比1:3比例加入甲醇,稀释发酵液,使用0.22μm滤膜过滤。色谱条件:色谱柱:InfinityLab Poroshell 120EC-C18,4.6x 150mm,2.7μm;流动相A:水(0.1%三氟乙酸),流动相B:甲醇(0.1%三氟乙酸)。洗脱程序:0~15min,40-79%B;15~20min,100%B。流速:1.0mL/min,柱温:30℃,进样体积:15μL。检测器:UV Detector,检测波长:423nm。
质谱条件:
离子源:ESI,正负模式同时测定;加热气流速:10.0L/min;雾化气流速:3.0L/min;干燥气流速:10.0L/min;加热模块温度:400℃;DL温度:250℃;接口温度:300℃。
实施例1:基因工程菌的构建
具体步骤如下:
(1)葡萄糖-6-磷酸变位酶Pgm(pgm,GenBank no.NP_415214)、UDP-葡萄糖焦磷酸化酶GalU(galU,Genbank no.NP_415752)均来自大肠杆菌,UDP-葡萄糖基转移酶CaUGT2(caUGT2 Genbank no.AB159213)来自于Catharanthus roseus,将上述酶的DNA序列经密码子优化后由北京擎科生物科技有限公司体外合成。
(2)重组载体pACYCDuet-pgm-galU和pGEX-caUGT2的制备
1)将步骤(1)得到的基因pgm和galU按照ClonExpress MultiS One Step CloningKit(Vazyme,China)试剂盒所述方法按pgm、galU的顺序与载体pACYCDuet-1进行无缝连接,连接产物转入E.coli Trans1-T1(北京全式金生物科技有限公司)感受态细胞中,涂布于含有氯霉素的LB平板,通过菌落PCR筛选分别验证阳性转化子并获得重组质粒pACYCDuet-pgm-galU。
2)将步骤(1)得到的caUGT2基因也按照ClonExpress MultiS One Step CloningKit(Vazyme,China)试剂盒所述方法按顺序与载体pGEX进行无缝连接,连接产物转入E.coli Trans1-T1(北京全式金生物科技有限公司)感受态细胞中,涂布于含有氨苄青霉素的LB平板,通过菌落PCR筛选分别验证阳性转化子并获得重组质粒pGEX-caUGT2。通过菌落PCR筛选分别验证阳性转化子并提取重组质粒。
3)将重组质粒pACYCDuet-pgm-galU和pGEX-caUGT2转化至E.coli BL21(DE3)中,挑取在能在氨苄青霉素和氯霉素的LB平板上长出的菌落,摇瓶培养,即得到基因工程菌E.coli BL21(DE3)/pACYCDuet-pgm-galU/pGEX-caUGT2,命名为BL21-I。
实施例2:基因工程菌BL21-I对姜黄素的全细胞转化
姜黄素葡萄糖苷合成途径如图1所示,具体步骤如下:
(1)挑取实施例1中得到的重组菌株BL21-I的单克隆,接种至含终浓度100μg/ml氨苄霉素和17μg/ml氯霉素抗性液体LB培养基中,于37℃,200rpm摇床培养至其OD
(2)按时取样,收集发酵液,采用HPLC检测姜黄素单葡萄糖苷、姜黄素双葡萄糖苷的含量。
结果显示(图2~3):避光培养72h,姜黄素和姜黄素单葡萄糖苷大部分都转化为姜黄素双葡萄糖苷,所述姜黄素双葡萄糖苷的含量达到682mg/L,摩尔转化率为72.6%。
(3)同时,姜黄素单葡萄糖苷和姜黄素双葡萄糖苷质谱结果如表1和图4A、4B所示。
表1:姜黄素单葡萄糖苷和姜黄素双葡萄糖苷质谱结果
结果表明,构建基因工程菌BL21-I生物转化姜黄素体系中,姜黄素的含量减少,并生成两种姜黄素糖苷化衍生物——姜黄素单葡萄糖苷和姜黄素双葡萄糖苷。
该结果验证了构建的基因工程菌BL21-I重组菌株能细胞内部大量生成UDP-葡萄糖,并且催化体外姜黄素合成姜黄素单葡萄糖苷和姜黄素双葡萄糖苷。
对姜黄素单葡萄糖苷和姜黄素双葡萄糖苷进行定量分析,发现在反应72h后,姜黄素和姜黄素单葡萄糖苷大部分都转化为姜黄素双葡萄糖苷,所述姜黄素双葡萄糖苷的含量达到682mg/L,摩尔转化率为72.6%。
实施例3:不同来源的UDP-葡萄糖基转移酶对姜黄素的全细胞转化的影响
本发明对不同来源的UDP-葡萄糖基转移酶进行了评估。除实施例1中来自于Catharanthus roseus的UDP-葡萄糖基转移酶CaUGT2(Genbank no.AB159213)外,另有Arachis hypogaea L.来源的AhUGT83A1-like(GenBank no.KF411463),Arabidopsisthaliana来源的UGT75B1(GenBank no.NC_003070.9),Arabidopsis thaliana来源的UGT74F2(GenBank no.NC_003071.7)以及Bombyx mori来源的Ugt3(GenBank no.NC_051364.1)。
具体实施方式同实施例1~2,区别在于,将实施例1中来自于Catharanthusroseus的UDP-葡萄糖基转移酶CaUGT2(caUGT2 Genbank no.AB159213)分别更换为:Arachis hypogaea L.来源的AhUGT83A1-like(GenBank no.KF411463)、Arabidopsisthaliana来源的UGT75B1(GenBank no.NC_003070.9)、Arabidopsis thaliana来源的UGT74F2(GenBank no.NC_003071.7)、Bombyx mori来源的Ugt3(GenBank no.NC_051364.1),分别制备得到基因工程菌:BL21-AhUGT83A1、BL21-UGT75B1、BL21-UGT74F2、BL21-Ugt3;
按照实施例2的方法,进行全细胞转化制备得到姜黄素双葡萄糖苷,避光培养72h,检测姜黄素双葡萄糖苷的含量及摩尔转化率,结果如表2及图5A~D所示。
表2:不同基因工程菌制备得到的姜黄素双葡萄糖苷的含量及摩尔转化率
结果显示:其它来源的转移酶效率均不如实施例1中Catharanthus roseus来源的UDP-葡萄糖基转移酶CaUGT2(Genbank no.AB159213)高。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 一种以生物质水解液为原料合成苯乙烯的基因工程菌及其构建方法与应用
- 一种产棘白菌素B的基因工程菌及其构建方法和应用
- 一种黄原胶产量相关基因及其构建高产黄原胶工程菌的应用
- 一种温郁金来源的姜黄素合成酶、基因、载体、工程菌及应用
- 一种全细胞催化合成阿魏酸葡萄糖苷的基因工程菌及其应用
