补体因子B(CFB)iRNA组合物及其使用方法
文献发布时间:2024-07-23 01:35:12
相关申请
本申请要求2021年10月29日提交的美国临时申请No.63/273,215的优先权利益。上述申请的全部内容通过引用并入本文。
背景技术
在19世纪90年代,当发现补体通过存在于正常血清中的热稳定性抗体帮助或“补充”杀死细菌时,首次发现了补体(Walport,M.J.(2001)N Engl J Med.344:1058)。补体系统由多于30种蛋白质组成,这些蛋白质或者作为可溶性蛋白存在于血液中或者作为膜相关蛋白存在。补体的激活引起依序的酶促反应级联(称为补体激活途径),从而导致有效的过敏毒素C3a和C5a的形成,这些过敏毒素诱发从化学吸引到细胞凋亡范围内的多种生理学反应。最初,补体被认为在先天免疫方面起主要作用,其中对抗入侵病原体发动有力和快速的反应。然而,最近越发明显的是,补体还在适应性免疫方面起重要作用,该适应性免疫涉及帮助消除病原体(Dunkelberger JR和Song WC.(2010)Cell Res.20:34;Molina H等人(1996)Proc Natl Acad Sci USA.93:3357)、帮助维持防止病原性再入侵的免疫记忆T细胞和B细胞,并且补体涉及许多人体病理学病况(Qu H等人(2009)Mol Immunol.47:185;Wagner E.和Frank MM.(2010)Nat Rev Drug Discov.9:43)。
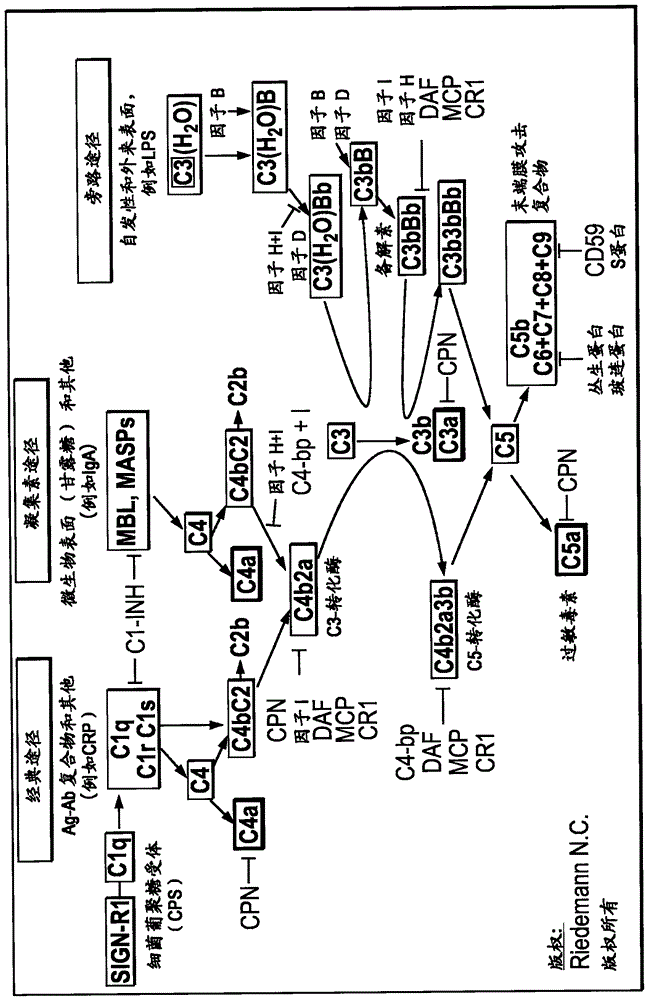
已知补体激活通过三种不同途径发生:旁路途径、经典途径和凝集素途径(图1),涉及主要作为非活性酶原存在的蛋白质,然后这些非活性酶原依序地裂解并且激活。
经典途径通常被抗体-抗原复合物或C反应蛋白(CRP)激活,两者都与补体组分C1q相互作用。此外,经典途径可以在不存在免疫复合物的情况下被凋亡小体中存在的磷脂酰丝氨酸激活。
凝集素途径由与病原体表面上的复合糖残基结合的甘露糖结合凝集素(MBL)启动。经典途径或凝集素途径的活化导致(C4b2b)C3转化酶的激活。
旁路途径通过C3b的结合激活,C3b通过在靶向表面上的C3水解自发产生。然后该表面结合的C3b被因子B识别,从而形成复合物C3bB。C3bB复合物又被因子D切割以产生AP的C3转化酶的活性形式(C3bBb)。两种类型的C3转化酶裂解C3,从而形成C3b。然后C3b结合更多的因子B,从而增强通过AP的补体激活(所谓的替代或扩增环),或导致活性C5转化酶(C3bBbC3b或C4bC2bC3b)的形成,其切割C5并触发导致膜攻击复合物(MAC)(C5b-9)形成的晚期事件。
补体系统的不适当激活导致许多不同疾病中的病理学传播或起始,所述疾病包括例如C3肾小球病、系统性红斑狼疮(SLE),例如狼疮性肾炎、IgA肾病、糖尿病性肾病、多囊肾病、膜性肾病、年龄相关性黄斑变性、非典型溶血性尿毒综合征、血栓性微血管病、重症肌无力、缺血和再灌注损伤、阵发性睡眠性血红蛋白尿症和类风湿性关节炎。
迄今为止,仅一种靶向旁路途径(例如C5-C5a轴)的治疗剂可用于治疗补体组分相关疾病,抗C5抗体依库珠单抗
因此,本领域需要通过例如激活补体因子B活性来治疗与补体激活相关的疾病、障碍和病症的组合物和方法。
发明内容
本发明提供实现RNA诱导沉默复合物(RISC)介导的编码补体因子B(CFB)的基因的RNA转录物的裂解的iRNA组合物。补体因子B(CFB)可以在细胞内,例如受试者(如人类受试者)内的细胞。
因此,在一个方面,本发明提供了用于抑制细胞中补体因子B(CFB)表达的双链核糖核酸(dsRNA)剂,其中所述dsRNA剂包含形成双链区的有义链和反义链,其中所述有义链包含与SEQ ID NO:1的核苷酸序列相差不超过0、1、2或3个核苷酸的至少15个,例如15、16、17、18、19、20或21个连续核苷酸,并且所述反义链包含与SEQ ID NO:8的核苷酸序列的相应部分相差不超过1、2或3个核苷酸的至少15个,例如15、16、17、18、19、20、21、22或23个连续核苷酸。
在另一个方面,本发明提供了用于抑制细胞中补体因子B(CFB)表达的双链核糖核酸(dsRNA),其中所述dsRNA包含形成双链区的有义链和反义链,其中所述反义链包含与编码补体因子B(CFB)的mRNA的互补区,并且其中所述互补区包含与表2-3任一中的任一个反义核苷酸序列相差不超过0、1、2或3个核苷酸的至少15个,例如15、16、17、18、19、20、21、22或23个连续核苷酸。
在一个实施方案中,所述dsRNA剂包含有义链,所述有义链包含表2-3任一中的任何有义核苷酸序列。
在一个实施方案中,所述dsRNA剂包含反义链,所述反义链包含表2-3任一中的任何反义核苷酸序列。
在一个实施方案中,所述dsRNA剂包含有义链和反义链,所述有义链包含表2-3任一中的任何有义核苷酸序列,所述反义链包含表2-3任一中的任何反义核苷酸序列。
在一个实施方案中,所述dsRNA剂包含有义链和反义链,所述有义链包含与表2-3任一中的任何有义核苷酸序列相差不超过4个核苷酸的核苷酸序列,所述反义链包含与表2-3任一中的任何反义核苷酸序列相差不超过4个核苷酸的核苷酸序列。
在一个实施方案中,所述dsRNA剂包含有义链和反义链,所述有义链包含与表2-3任一中的任何有义核苷酸序列相差不超过3个核苷酸的核苷酸序列,所述反义链包含与表2-3任一中的任何反义核苷酸序列相差不超过3个核苷酸的核苷酸序列。
在一个实施方案中,所述dsRNA剂包含有义链和反义链,所述有义链包含与表2-3任一中的任何有义核苷酸序列相差不超过2个核苷酸的核苷酸序列,所述反义链包含与表2-3任一中的任何反义核苷酸序列相差不超过2个核苷酸的核苷酸序列。
在一个实施方案中,所述dsRNA剂包含有义链和反义链,所述有义链包含与表2-3任一中的任何有义核苷酸序列相差不超过1个核苷酸的核苷酸序列,所述反义链包含与表2-3任一中的任何反义核苷酸序列相差不超过1个核苷酸的核苷酸序列。
在另一方面,本发明提供用于抑制细胞中补体因子B(CFB)表达的双链核糖核酸(dsRNA),其中所述dsRNA包含形成双链区的有义链和反义链,其中所述有义链包含与SEQID NO:1的核苷酸504-526、640-662、641-663、995-1017、997-1019、1034-1056、1141-1163、1145-1167、1389-1411、1473-1495、1826-1848、1828-1850、1842-1864、2242-2264、2391-2413、2393-2415、2438-2460或2453-2475的核苷酸序列中的任一个相差不超过0、1、2、3或4个核苷酸的至少15个,例如15、16、17、18、19、20、21个连续核苷酸,和所述反义链包含SEQID NO:8的相应核苷酸序列的至少15个,例如15、16、17、18、19、20、21、22或23个连续核苷酸。
在一个实施方案中,反义链包含与选自AD-1726057;AD-1725763;AD--1725777;AD--1725057;AD-1725096;AD-1728786;AD-1725059;AD-1728276;AD-1728278;AD-1726936;AD-1725472;AD-1724715;AD-1727292;AD-1730477;AD-1727288;AD-1730167;AD-1725408;和AD-1725761的双链体的反义链核苷酸序列中的任一个相差不超过0、1、2、3或4个核苷酸的至少15个,例如15、16、17、18、19、20、21、22或23个连续核苷酸。
在一个实施方案中,有义链和反义链包含与选自AD-1726057;AD-1725763;AD-1725777;AD-1725057;AD-1725096;AD-1728786;AD-1725059;AD-1728276;AD-1728278;AD-1726936;AD-1725472;AD-1724715;AD-1727292;AD-1730477;AD-1727288;AD-1730167;AD-1725408;和AD-1725761的双链体的有义链和反义链核苷酸序列中的任一个相差不超过0、1、2、3或4个核苷酸的至少15个,例如15、16、17、18、19、20、21、22或23个连续核苷酸。
在一个实施方案中,有义链和反义链包含选自AD-1726057;AD-1725763;AD-1725777;AD-1725057;AD-1725096;AD-1728786;AD-1725059;AD-1728276;AD-1728278;AD-1726936;AD-1725472;AD-1724715;AD-1727292;AD-1730477;AD--1727288;AD-1730167;AD-1725408;和AD-1725761的双链体的有义链和反义链核苷酸序列。
在一个实施方案中,有义链和反义链由选自AD-1726057;AD-1725763;AD-1725777;AD-1725057;AD-1725096;AD-1728786;AD-1725059;AD-1728276;AD-1728278;AD-1726936;AD-1725472;AD-1724715;AD-1727292;AD-1730477;AD-1727288;AD-1730167;AD-1725408;和AD-1725761的双链体的有义链和反义链核苷酸序列组成。
在一个实施方案中,dsRNA剂包含至少一个修饰的核苷酸。
在一个实施方案中,有义链的基本上所有核苷酸;反义链的基本上所有核苷酸包含修饰;或有义链的基本上所有核苷酸和反义链的基本上所有核苷酸包含修饰。
在一个实施方案中,有义链的所有核苷酸包含修饰;反义链的所有核苷酸包含修饰;或有义链的所有核苷酸和反义链的所有核苷酸包含修饰。
在一个实施方案中,至少一个修饰的核苷酸选自脱氧核苷酸修饰、3′-末端脱氧胸苷(dT)核苷酸修饰、2′-O-甲基核苷酸修饰、2′-氟核苷酸修饰、2′-脱氧核苷酸修饰、锁核苷酸修饰、解锁核苷酸修饰、构象受限的核苷酸修饰、约束乙基核苷酸修饰、脱碱基核苷酸修饰、2′-氨基核苷酸修饰、2′-O-烯丙基核苷酸修饰、2′-C-烷基核苷酸修饰、2′-甲氧基乙基核苷酸修饰、2′-O-烷基核苷酸修饰、吗啉代核苷酸修饰、氨基磷酸酯核苷酸修饰、包含非天然碱基的核苷酸修饰、四氢吡喃核苷酸修饰、1,5-失水己糖醇核苷酸修饰、环己烯基核苷酸修饰、包含硫代磷酸酯基团的核苷酸修饰、包含甲基膦酸酯基团的核苷酸修饰、包含5′-磷酸酯的核苷酸修饰、包含5′-磷酸酯模拟物的核苷酸修饰、包含2′-磷酸酯的核苷酸修饰(例如胞苷-2’-磷酸(C2p);鸟苷-2’-磷酸(G2p);尿苷-2’-磷酸(U2p);腺苷-2’-磷酸(A2p))、热去稳定的核苷酸修饰、二醇修饰核苷酸(GNA)核苷酸修饰和2-O-(N-甲基乙酰胺)核苷酸修饰;及其组合。
在一个实施方案中,核苷酸上的修饰选自LNA、HNA、CeNA、2’-甲氧基乙基、2’-O-烷基、2’-O-烯丙基、2’-C-烯丙基、2’-氟、2’-脱氧、2′-羟基和二醇修饰的核苷酸(GNA);及其组合。
在一个实施方案中,至少一个修饰的核苷酸选自脱氧核苷酸、2′-O-甲基修饰的核苷酸、2′-氟修饰的核苷酸、2′-脱氧修饰的核苷酸、二醇修饰的核苷酸(GNA)(例如,Ggn、Cgn/Tgn或Agn)、包含2′-磷酸酯的核苷酸修饰和乙烯基-膦酸酯核苷酸;及其组合。
在另一个实施方案中,核苷酸上的至少一个修饰是热去稳定核苷酸修饰。
在一个实施方案中,热去稳定核苷酸修饰选自由脱碱基修饰组成的组;与双链体中的相对核苷酸错配;和去稳定糖修饰、2′-脱氧修饰、无环核苷酸、解锁核酸(UNA)和甘油核酸(GNA)。
双链区的长度可以是19-30个核苷酸对;长度19-25个核苷酸对;长度19-23个核苷酸对;长度23-27个核苷酸对;或长度21-23个核苷酸对。
在一个实施方案中,每条链独立地长度不超过30个核苷酸。
在一个实施方案中,有义链长度为21个核苷酸,反义链长度为23个核苷酸。
互补区的长度可以为至少17个核苷酸;长度19-23个核苷酸;或长度19个核苷酸。
在一个实施方案中,至少一条链包含至少1个核苷酸的3′突出端。在另一个实施方案中,至少一条链包含至少2个核苷酸的3′突出端。
在一个实施方案中,dsRNA剂还包含配体。
在一个实施方案中,配体缀合至dsRNA剂的有义链的3′端。
在一个实施方案中,配体是N-乙酰基半乳糖胺(GalNAc)衍生物。
在一个实施方案中,配体是通过单价、二价或三价分支接头附连的一个或多个GalNAc衍生物。
在一个实施方案中,配体是
在一个实施方案中,dsRNA剂缀合至配体,如以下示意图中所示
并且,其中X是O或S。
在一个实施方案中,X是O。
在一个实施方案中,dsRNA剂还包含至少一个硫代磷酸酯或甲基膦酸酯核苷酸间键。
在一个实施方案中,硫代磷酸酯或甲基膦酸酯核苷酸间键在一条链,例如反义链或有义链的3′-末端。
在另一个实施方案中,硫代磷酸酯或甲基膦酸酯核苷酸间键在一条链,例如反义链或有义链的5′-末端。
在一个实施方案中,硫代磷酸酯或甲基膦酸酯核苷酸间键在一条链的5′-和3′-末端。在一个实施方案中,所述链是反义链。
在一个实施方案中,双链体的反义链的5’末端1位的碱基对是AU碱基对。
本发明还提供含有本发明的任何dsRNA剂的细胞和包含本发明的任何dsRNA剂的药物组合物。
本发明的药物组合物可包括在未缓冲溶液(例如盐水或水)中的dsRNA剂,或本发明的药物组合物可包括在缓冲溶液中的dsRNA剂,例如包含乙酸盐、柠檬酸盐、醇溶谷蛋白、碳酸盐或磷酸盐或其任何组合的缓冲溶液;或磷酸盐缓冲盐水(PBS)。
在一个方面,本发明提供抑制细胞中补体因子B(CFB)基因表达的方法。该方法包括使细胞与本发明的任何dsRNA或本发明的任何药物组合物接触,从而抑制细胞中CFB基因的表达。
在一个实施方案中,细胞在受试者(例如人类受试者,例如患有补体因子B相关病症的受试者)体内。此类病症通常与炎症或免疫系统活化相关,例如膜攻击复合物介导的溶解、过敏症或溶血。补体因子B相关病症的非限制性实例包括阵发性睡眠性血红蛋白尿症(PNH)、非典型溶血性尿毒综合征(aHUS)、哮喘、类风湿性关节炎(RA);抗磷脂抗体综合征;狼疮肾炎;缺血-再灌注损伤;典型的或感染性溶血性尿毒综合征(tHUS);致密沉积物病(DDD);视神经脊髓炎(NMO);多灶性运动神经病(MMN);多发性硬化(MS);黄斑变性(例如,年龄相关性黄斑变性(AMD));溶血、肝酶升高和低血小板(HELLP)综合征;血栓性血小板减少性紫癜(TTP);自发性流产;寡免疫血管炎;大疱性表皮松解症;习惯性流产;先兆子痫、创伤性脑损伤、重症肌无力、冷凝集素病、皮肌炎大疱性类天疱疮、志贺毒素大肠杆菌相关的溶血性尿毒综合征、C3肾病、抗嗜中性粒细胞细胞质抗体相关血管炎(例如,肉芽肿病伴多血管炎(以前称为Wegener肉芽肿病)、变应性肉芽肿性血管炎和显微镜下多血管炎)、体液和血管移植排斥、移植物功能异常、心肌梗塞(例如,心肌梗塞中的组织损伤和缺血)、同种异体移植、脓毒症(例如,脓毒病不良结果)、冠状动脉病、皮肌炎、格雷夫斯病、动脉粥样硬化、阿尔茨海默病、全身性炎症反应脓毒症、脓毒性休克、脊髓损伤、肾小球肾炎、桥本氏甲状腺炎、I型糖尿病、银屑病、天疱疮、自身免疫性溶血性贫血(AIHA)、ITP、古德帕斯彻综合征、德戈斯病、抗磷脂综合征(APS)、灾难性APS(CAPS)、心血管障碍、心肌炎、脑血管障碍、外周(例如,肌肉骨骼)血管障碍、肾血管障碍、肠系膜/肠血管障碍、血管炎、
在一个实施方案中,补体因子B相关疾病选自C3肾小球病、系统性红斑狼疮(SLE),例如狼疮性肾炎、IgA肾病、糖尿病性肾病、多囊肾病、膜性肾病、年龄相关性黄斑变性、非典型溶血性尿毒综合征、血栓性微血管病、重症肌无力、缺血和再灌注损伤、阵发性睡眠性血红蛋白尿症和类风湿性关节炎。
在另一个实施方案中,补体因子B相关疾病选自C3肾小球病、系统性红斑狼疮(SLE),例如狼疮性肾炎、IgA肾病、糖尿病性肾病和多囊肾病。
在一个实施方案中,使细胞与dsRNA剂接触将CFB的表达抑制至少50%、60%、70%、80%、90%或95%。
在一个实施方案中,抑制CFB的表达使受试者血清中的CFB蛋白水平降低至少50%、60%、70%、80%、90%或95%。
在一个方面,本发明提供了治疗患有受益于补体因子B(CFB)表达降低的病症的受试者的方法。该方法包括向受试者施用治疗有效量的本发明的任何dsRNA或本发明的任何药物组合物,从而治疗患有受益于CFB表达降低的病症的受试者。
在另一方面,本发明提供了在尚未满足一种受益于补体因子B(CFB)表达降低的病症的诊断标准的具有疾病的至少一种体征或症状的受试者中预防病症的发生的方法。该方法包括向受试者施用预防有效量的本发明的任何dsRNA或本发明的任何药物组合物,从而预防受试者进展至满足该受益于CFB表达降低的病症的诊断标准。
在一个实施方案中,所述病症是补体因子B(CFB)相关病症。
在一个实施方案中,受试者是人。
在一个实施方案中,以约0.01mg/kg至约50mg/kg的剂量向受试者施用dsRNA剂。
在一个实施方案中,将dsRNA剂皮下施用于受试者。
在一个实施方案中,受试者样品中的CFB水平是血液或血清样品中的CFB蛋白水平。
在一个实施方案中,向受试者施用药剂导致溶血减少或CFB蛋白积聚减少。
在某些实施方案中,本发明的方法还包括向受试者施用另外的治疗剂。
在一些方面,另外的治疗剂是靶向C5基因的iRNA剂,如在美国专利号:9,249,415中所述,其全部内容通过引用并入本文。
在其他方面,另外的治疗剂是靶向补体因子B(CFB)基因的iRNA剂,如在美国专利号:10,465,194中所述,其全部内容通过引用并入本文。
在其他方面,另外的治疗剂是C5的抑制剂,如抗补体组分C5抗体或其抗原结合片段(例如,依库珠单抗、ravulizumab-cwvz或pozelimab(REGN3918))或C5肽抑制剂(例如,zilucoplan)。依库珠单抗是人源化单克隆IgG2/4,κ轻链抗体,其以高亲和力特异性结合补体组分C5并抑制C5裂解为C5a和C5b,从而抑制终末补体复合物C5b-9的产生。依库珠单抗描述于美国专利号6,355,245中,其全部内容通过引用并入本文。ravulizumab-cwvz是人源化IgG2/4单克隆抗体,其以高亲和力特异性结合补体组分C5并抑制C5裂解为C5a和C5b,从而抑制终末补体复合物C5b-9的产生。ravulizumab-cwvz描述于WO2015134894中,其全部内容通过引用并入本文。Pozelimab(也称为H4H12166P,描述于US20170355757中,其全部内容通过引用并入本文)是设计用于阻断补体因子C5的全人IgG4单克隆抗体。zilucoplan是合成的大环肽,其以亚纳摩尔亲和力结合补体组分5(C5),并且在经典途径、旁路途径或凝集素途径活化时变构地抑制其裂解成C5a和C5b(参见,例如WO2017105939,其全部内容通过引用并入本文)。
还在其它方面,另外的治疗剂是C3肽抑制剂或其类似物。在一个实施方案中,C3肽抑制剂是坎普他汀(compstatin)。坎普他汀是具有有效和选择性C3抑制活性的环状十三肽。坎普他汀及其类似物描述于美国专利号7,888,323、7,989,589和8,442,776,美国专利公开号2012/0178694和2013/0053302以及PCT公开号WO2012/174055、WO2012/2178083、WO2013/036778中,其各自的全部内容以引用的方式并入本文中。
在某些实施方案中,本领域已知用于各种CFB相关疾病的治疗与本发明的RNAi剂组合使用。
本发明还提供了试剂盒,其包含本发明的任何dsRNA或本发明的任何药物组合物,以及任选地使用说明书。
本发明还提供了包含本发明的任何dsRNA剂的反义链的RNA诱导沉默复合物(RISC)。
在另一实施方案中,RNAi剂是其药学上可接受的盐。本文中每种RNAi剂的“药学上可接受的盐”包括但不限于钠盐、钙盐、锂盐、钾盐、铵盐、镁盐,其混合物。本领域技术人员将认识到,RNAi剂,当作为任选修饰的磷酸二酯主链的每游离酸基团具有一个阳离子和/或任何其他酸性修饰(例如,5′-末端膦酸酯基)的多阳离子盐提供时。例如,长度为“n”个核苷酸的寡核苷酸含有n-1个任选修饰的磷酸二酯,使得长度为21nt的寡核苷酸可作为具有至多20个阳离子(例如,20个钠阳离子)的盐提供。类似地,具有21nt长度的有义链和23nt长度的反义链的RNAi剂可以作为具有多达42个阳离子(例如,42个钠阳离子)的盐提供。在前述实例中,在RNAi剂还包含5′-末端磷酸酯或5′-末端乙烯基膦酸酯基团的情况下,RNAi剂可以作为具有多达44个阳离子(例如,44个钠阳离子)的盐提供。
通过以下详细描述和附图进一步说明本发明。
附图说明
图1描述了三种补体途径:旁路、经典和凝集素。
图2是描述在第7天皮下施用单一1mg/kg剂量的所示dsRNA双链体的小鼠(每组n=3)中人CFB蛋白水平的图。显示了相对于用PBS处理测定的对照水平的人CFB蛋白水平。
具体实施方式
本发明提供了实现RNA诱导沉默复合物(RISC)介导的补体因子B(CFB)基因的RNA转录物的裂解的iRNA组合物。基因可以在细胞内,例如在受试者如人的体内的细胞内。使用这些iRNA能够实现哺乳动物中相应基因(补体因子B基因)的mRNA的靶向降解。
本发明的iRNA被设计成靶向人补体因子B基因,包括在其它哺乳动物物种的补体因子B直向同源物中保守的基因部分。不意图受理论的限制,据信前述性质和这些iRNA中的特定靶位点或特定修饰的组合或子组合赋予本发明的iRNA改善的功效、稳定性、效力、持久性和安全性。
因此,本发明提供使用实现RNA诱导沉默复合物(RISC)介导的补体因子B基因的RNA转录物裂解的iRNA组合物治疗和预防补体因子B相关障碍、疾病或病症的方法,例如具有炎症或免疫系统活化的障碍、疾病或病症,例如膜攻击复合物介导的溶解、过敏症或溶血,例如C3肾小球病、系统性红斑狼疮(SLE),例如狼疮肾炎、IgA肾病、糖尿病性肾病和多囊肾病。
本发明的iRNA包括具有长度至多约30个核苷酸或更少的区域的RNA链(反义链),例如长度19-30、19-29、19-28、19-27、19-26、19-25、19-24、19-23、19-22、19-21、19-20、20-30、20-29、20-28、20-27、20-26、20-25、20-24、20-23、20-22、20-21、21-30、21-29、21-28、21-27、21-26、21-25、21-24、21-23或21-22个核苷酸,该区域与补体因子B基因的mRNA转录物的至少一部分基本上互补。在某些实施方案中,本公开的RNAi剂包括具有长度约21-23个核苷酸的区域的RNA链(反义链),该区域与补体因子B基因的mRNA转录物的至少一部分基本上互补。
在某些实施方案中,本发明的双链RNAi剂的一条链或两条链长度高达66个核苷酸,例如长度36-66、26-36、25-36、31-60、22-43、27-53个核苷酸,其中至少19个连续核苷酸的区域与补体因子B基因的mRNA转录物的至少一部分基本上互补。在一些实施方案中,这种具有较长反义链的iRNA剂可包括长度为20-60个核苷酸的第二RNA链(有义链),其中有义链和反义链形成18-30个连续核苷酸的双链体。
使用本发明的iRNA能够实现哺乳动物中相应基因(补体因子B基因)的mRNA的靶向降解。使用体外和体内试验,本发明人已证明靶向补体因子B基因的iRNA可有效介导RNAi,导致补体因子B基因表达的显著抑制。因此,包含这些iRNA的方法和组合物可用于治疗患有补体因子B相关病症的受试者,例如C3肾小球病、系统性红斑狼疮(SLE),例如狼疮肾炎、IgA肾病、糖尿病性肾病和多囊肾病。
因此,本发明提供使用实现RNA诱导沉默复合物(RISC)介导的CFB基因的RNA转录物的裂解的iRNA组合物治疗患有受益于抑制或减少补体因子B基因的表达的病症(例如补体因子B相关疾病,如C3肾小球病、系统性红斑狼疮(SLE),例如狼疮肾炎、IgA肾病、糖尿病性肾病和多囊肾病)的受试者的方法和组合疗法。
本发明还提供了在患有受益于抑制或减少补体因子B基因表达的病症的受试者中预防至少一种症状的方法,例如C3肾小球病、系统性红斑狼疮(SLE),例如狼疮肾炎、IgA肾病、糖尿病性肾病和多囊肾病。
在某些实施方案中,向受试者施用dsRNA引起CFB mRNA水平、CFB蛋白水平、CH
以下详细描述公开了如何制备和使用含有iRNA的组合物以抑制补体因子B基因的表达,以及用于治疗受益于补体因子B基因的表达的抑制或降低的受试者,例如易患或诊断患有补体因子B相关病症的受试者的组合物、用途和方法。
I.定义
为了使本发明可更容易理解,首先定义某些术语。此外,应该注意的是,每当列举一个参数的一个值或取值范围时,目的是表明这些列举的值的中间值和范围也意在成为本发明的部分。
在此使用冠词“一个”和“一种”是指一个或多于一个(即,至少一个)该冠词的语法对象。通过举例,“一个元件”意指一个元件或多于一个元件,例如多个元件。
在此使用术语“包括”意指短语“包括但不限于”,并且与该短语可互换使用。
在此使用术语“或”意指术语“和/或”,并且与该术语可互换使用,除非上下文清楚地另外指明。例如,“有义链或反义链”理解成“有义链或者反义链或者有义链和反义链”。
术语“约”在本文中用于意指在本领域的典型公差范围内。例如,“约”可以被理解为平均值的约2个标准偏差。在某些实施方案中,“约”意指±10%。在某些实施方案中,“约”意指±5%。当“约”存在于一系列数字或范围之前时,应当理解“约”可以修饰所述系列或范围中的数字中的每个数字。
在数字或一系列数字之前的术语“至少”、“不少于”或“或更多”应理解为包括与术语“至少”相邻的数字,以及逻辑上可包括的所有后续数字或整数,如从上下文清楚的。例如,核酸分子中的核苷酸数目必须是整数。例如,“21个核苷酸的核酸分子的至少19个核苷酸”是指19、20或21个核苷酸具有指定的性质。当“至少”存在于一系列数字或范围之前时,应理解“至少”可以修饰该系列或范围中的每个数字。
如本文使用的,“不大于”或“或更小”被理解为与该短语相邻的值以及逻辑上较低的值或整数,如从上下文的逻辑理解的,至零。例如,具有“不超过2个核苷酸”的突出端的双链体具有2、1或0个核苷酸的突出端。当在一系列数字或范围之前存在“不多于”时,应理解“不多于”可以修饰该系列或范围中的每个数字。如本文所使用的,范围包括上限和下限两者。
如本文所使用的,检测方法可包括确定存在的分析物的量低于该方法的检测水平。
在所示靶位点和有义或反义链的核苷酸序列之间冲突的情况下,所示序列优先。
在序列和其在转录物或其它序列上的指定位点之间发生冲突的情况下,说明书中所述的核苷酸序列优先。
如本文所使用的,与术语“CFB”互换使用的术语“补体因子B”是指公知的基因和多肽,在本领域中也称为AHUS、BF、CFAB、BFD、FB、GBG、FBI12、B因子、备解素(Properdin)、H2-Bf、富含甘氨酸的β糖蛋白、C3Proaccelerator、备解素因子2B、C3前活化剂、PBF2、富含甘氨酸的β-糖蛋白、C3/C5转化酶、EC3.4.21和EC3.4.21.473。
术语“CFB”包括人CFB,其氨基酸和核苷酸序列可见于例如GeneBank登录号GI:1732746151;小鼠CFB,其氨基酸和核苷酸序列可见于例如GeneBank登录号GI:218156288和GI:218156290;大鼠CFB,其氨基酸和核苷酸序列可见于例如GeneBank登录号GI:218156284;和黑猩猩CFB,其氨基酸和核苷酸序列可见于例如GeneBank登录号GI:57114201。术语“CFB”还包括食蟹猴CFB,其氨基酸和核苷酸序列可以在例如GeneBank登记号GI:544428919和基因条目ENSMMUP00000000985(基因座=scaffold3881:47830:53620)中,在Macaca基因组工程网站(
本文所用的术语“CFB”也指CFB基因的天然存在的DNA序列变异。CFB基因内序列变异的非限制性实例包括外显子12中的1598A>G,其导致在氨基酸残基533处赖氨酸变为精氨酸;外显子6中的858C>G,其导致在氨基酸残基286处苯丙氨酸变为亮氨酸;和外显子7中967A>G,其导致氨基酸残基323处的赖氨酸变为丙氨酸(Tawadrous H.等(2010)PediatrNephrol.25:947;Goicoechea de Jorge E等(2007)Proc Natl Acad Sci.USA 104:240)。本文所用的术语“CFB”也指CFB基因中的单核苷酸多态性。已经鉴定了CFB基因内的许多序列变异,并且可以在例如NCBI dbSNP和UniProt(参见,例如,ncbi.nlm.nih.gov/snp)处发现。
关于CFB的进一步信息可以在例如
CFB mRNA序列的其它实例可通过公众可获得的数据库容易地获得,例如GenBank、UniProt、OMIM和Macaca基因组工程网站。
上述各GeneBank登录号和基因数据库号的全部内容如在本申请的提交日期通过引用并入本文。
如本文所使用的,“靶序列”是指在补体因子B基因转录期间形成的mRNA分子的核苷酸序列的连续部分,包括作为初级转录产物的RNA加工产物的mRNA。该序列的靶部分至少足够长以用作在CFB基因转录期间形成的mRNA分子的核苷酸序列该部分处或附近的iRNA定向切割的底物。在一个实施方案中,靶序列在CFB的蛋白质编码区内。
靶序列可以是约19-36个核苷酸长,例如约19-30个核苷酸长。例如,靶序列的长度可以是约19-30个核苷酸,19-30、19-29、19-28、19-27、19-26、19-25、19-24、19-23、19-22、19-21、19-20、20-30、20-29、20-28、20-27、20-26、20-25、20-24、20-23、20-22、20-21、21-30、21-29、21-28、21-27、21-26、21-25、21-24、21-23或21-22个核苷酸。在一些实施方案中,靶序列的长度为约19至约30个核苷酸。在其它实施方案中,靶序列长度为约19至约25个核苷酸。在其它实施方案中,靶序列的长度为约19至约23个核苷酸。在一些实施方案中,靶序列的长度为约21至约23个核苷酸。上述范围和长度中间的范围和长度也被认为是本发明的部分。
如本文所使用的,术语“包含序列的链”是指包含一个核苷酸链的寡核苷酸,该核苷酸链通过使用标准核苷酸命名法提到的顺序来描述。
“G”、“C”、“A”、“T”和“U”各自通常代表对应地含有鸟嘌呤、胞嘧啶、腺嘌呤、胸苷和尿嘧啶作为碱基的核苷酸。然而,将理解的是,术语“核糖核苷酸”或“核苷酸”还可以指如下进一步详细描述的修饰的核苷酸、或替代物置换部分(参见,例如表1)。技术人员应很好地意识到,鸟嘌呤、胞嘧啶、腺嘌呤以及尿嘧啶可以被其他部分置换而基本上不改变一种寡核苷酸(包含一种具有这种置换部分的核苷酸)的碱基配对特性。例如非限制性地,包含肌苷作为其碱基的核苷酸可以与含有腺嘌呤、胞嘧啶或尿嘧啶的核苷酸进行碱基配对。因此,含有尿嘧啶、鸟嘌呤或腺嘌呤的核苷酸可以在本发明中体现的dsRNA的核苷酸序列中由含有例如肌苷的核苷酸置换。在另一个实例中,寡核苷酸中任何地方的腺嘌呤和胞嘧啶可以对应地置换为鸟嘌呤和尿嘧啶,以便形成与靶mRNA碱基配对的G-U摇摆。含有这类置换部分的序列适用于在本发明中体现的组合物和方法。
如在此可互换使用的术语“iRNA”、“RNAi剂”、“iRNA试剂”、“RNA干扰试剂”是指含有作为在此定义的所述术语的RNA的试剂,并且该试剂通过一种RNA诱导沉默复合体(RISC)途径介导RNA转录物的靶向裂解。iRNA通过称为RNA干扰(RNAi)的方法引导mRNA的序列特异性降解。该iRNA在细胞(例如,受试者如哺乳动物受试者内的细胞)中调节(例如,抑制)补体因子B的表达。
在一个实施方案中,本发明的RNAi剂包括与靶RNA序列例如补体因子B靶mRNA序列相互作用的一个单链RNA,以便引导靶RNA的裂解。不希望受理论约束,认为通过称为Dicer的III型核酸内切酶来将引入到细胞中的长双链RNA分解成siRNA(Sharp等(2001)GenesDev.15:485)。Dicer(核糖核酸酶-III样酶)使dsRNA加工成具有特征性的两个碱基3′突出端的19-23个碱基对短干扰RNA(Bernstein等(2001)Nature 409:363)。然后将siRNA结合到一种RNA诱导沉默复合体(RISC)中,其中一种或多种螺旋酶使siRNA双链体展开,从而能够实现互补反义链导引靶标识别(Nykanen等(2001)Cell 107:309)。当结合至适当的靶mRNA时,RISC内的一种或多种核酸内切酶裂解该靶标以便诱导沉默(Elbashir等(2001)GenesDev.15:188)。因此,一方面,本发明涉及一种在细胞内产生的单链RNA(siRNA)并且该单链RNA促进RISC复合体形成以实现靶基因即补体因子B(CFB)基因的沉默。因此,在此使用术语“siRNA”还指如上所述的iRNA。
在某些实施方案中,RNAi剂可以是引入到细胞或生物体中以便抑制靶mRNA的单链siRNA(ssRNAi)。单链RNAi剂结合至RISC核酸内切酶(Argonaute 2),然后该RISC核酸内切酶裂解靶mRNA。这些单链siRNA通常是15-30个核苷酸并且是化学修饰的。单链siRNA的设计和测试被描述于美国专利号8,101,348和Lima等(2012)Cell 150:883-894中,这些参考文献中的每一个的全部内容特此通过引用结合在此。本文描述的任何反义核苷酸序列可以被用作如本文所描述或如通过描述于Lima等(2012)Cell 150:883-894中的方法化学修饰的单链siRNA。
在某些实施方案中,用于本发明的这些组合物、用途和方法中的“iRNA”是双链RNA,并且在此称为“双链RNA剂”、“双链RNA(dsRNA)分子”、“dsRNA剂”或“dsRNA”。术语“dsRNA”是指核糖核酸分子的复合体,该复合体具有包含两个反平行和基本上互补的核酸链的双链体结构,称为相对于靶RNA即补体因子B(CFB)基因具有“有义”和“反义”取向。在本发明的一些实施例中,双链RNA(dsRNA)通过在此称为RNA干扰或RNAi的转录后基因沉默机理来引发靶RNA例如mRNA的降解。用于本发明的组合物,用途和方法中的“iRNA”是双链RNA,并且在本文中被称为“双链RNA剂”,“双链RNA(dsRNA)分子”,“dsRNA剂”或“dsRNA”。术语“dsRNA”是指核糖核酸分子的复合物,其具有包含两条反平行且基本上互补的核酸链的双链结构,被称为相对于靶RNA(即基因)具有“有义”和“反义”取向。在本发明的一些实施方案中,双链RNA(dsRNA)通过转录后基因沉默机制(本文称为RNA干扰或RNAi)触发靶RNA(例如mRNA)的降解。
如本文所使用的,术语“修饰的核苷酸”是指独立地具有修饰的糖部分、修饰的核苷酸间键或修饰的核碱基或其任何组合的核苷酸。因此,术语修饰的核苷酸包括对核苷间键、糖部分或核碱基的例如官能团或原子取代、添加或去除。适用于本发明试剂的修饰包括本文公开的或本领域已知的所有类型的修饰。出于本说明书和权利要求书的目的,“iRNA”或“RNAi剂”涵盖在siRNA型分子中使用的任何此类修饰。
在本公开的某些实施方案中,如果存在于RNAi剂中,包含脱氧核苷酸(其被公认为核苷酸的天然存在形式)可以被认为构成修饰的核苷酸。
双链体区可以是允许通过RISC途径特异性降解所需靶RNA的任何长度,并且可以是长度约19-36个碱基对的范围,例如长度约19-30个碱基对,例如长度约9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35或36个碱基对,例如长度约19-30、19-29、19-28、19-24、19-23、19-22、19-21、19-20、20-30、20-29、20-28、20-27、20-26、20-25、20-24、20-23、20-22、20-21、21-30、21-29、21-28、21-27、21-26、21-25、21-24、21-23或21-22个碱基对,例如长度约21个碱基对。在某些实施方案中,双链体区的长度为19-21个碱基对,例如长度21个碱基对。上述范围和长度中间的范围和长度也被认为是本公开的部分。
形成双链体结构的两条链可以是一个更大的RNA分子的不同部分,或它们可以是单独的RNA分子。当这两条链是一个更大的分子的部分时,并且因此通过一条链的3’-端与形成双链体结构的对应的另一条链的5’-端之间的不间断核苷酸链来连接,连接的RNA链称为“发夹环”。发夹环可以包含至少一个未配对的核苷酸。在一些实施方案中,发夹环可包含至少4、5、6、7、8、9、10、20、23或更多个未配对的核苷酸。在一些实施方案中,发夹环可以是10个或更少的核苷酸。在一些实施方案中,发夹环可以是8个或更少的未配对核苷酸。在一些实施方案中,发夹环可以是4-10个未配对的核苷酸。在一些实施方案中,发夹环可以是4-8个核苷酸。
在某些实施方案中,双链低聚化合物的两条链可以连接在一起。两条链可在两端或仅仅在一端彼此连接。在一端连接是指第一链的5′-端连接到第二链的3′-端或第一链的3′-端连接到第二链的5′-端。当两条链在两端彼此连接时,所述第一链的5′-末端连接至所述第二链的3′-末端并且所述第一链的3′-末端连接至所述第二链的5′-末端。两条链可以通过寡核苷酸接头连接在一起,包括但不限于(N)n;其中N独立地是修饰的或未修饰的核苷酸并且n是3-23。在一些实施方案中,n为3-10,例如3、4、5、6、7、8、9或10。在一些实施方案中,寡核苷酸接头选自GNRA、(G)4、(U)4和(dT)4,其中N是修饰的或未修饰的核苷酸,R是修饰的或未修饰的嘌呤核苷酸。接头中的一些核苷酸可参与与接头中的其它核苷酸的碱基配对相互作用。两条链也可以通过非核苷接头,例如本文所述的接头连接在一起。本领域技术人员将理解,本文描述的任何寡核苷酸化学修饰或变异可用于寡核苷酸接头。
发夹和哑铃型寡聚化合物具有等于或至少14、15、15、16、17、18、19、29、21、22、23、24或25个核苷酸对的双链体区。双链体区的长度可以等于或小于200、100或50。在一些实施方案中,双链体区的长度范围为15-30、17-23、19-23和19-21个核苷酸对。
发夹寡聚化合物可具有单链突出端或末端未配对区,在一些实施方案中在3′侧,并且在一些实施方案中在发夹的反义侧上。在一些实施方案中,突出端长度为1-4个,更通常2-3个核苷酸。可诱导RNA干扰的发夹寡聚化合物在本文中也称为“shRNA”。
当dsRNA的两条基本上互补的链包含单独的RNA分子时,这些分子不是必须的,但是可以共价连接。当这两条链通过除了一条链的3’-端与形成双链体结构的对应的另一条链的5’-端之间的不间断核苷酸链以外的方式共价连接时,连接的结构称为“接头”。这些RNA链可以具有相同或不同数目的核苷酸。碱基对的最大数目是该dsRNA的最短链中的核苷酸数目减去存在于该双链体中的任何突出端。除了双链体结构以外,RNAi可以包含一个或多个核苷酸突出端。在RNAi剂的一个实施方案中,至少一条链包含至少1个核苷酸的3′突出端。在另一个实施方案中,至少一条链包含至少2个核苷酸,例如2、3、4、5、6、7、9、10、11、12、13、14或15个核苷酸的3′突出端。在其他实施方案中,RNAi剂的至少一条链包含至少1个核苷酸的5′突出端。在某些实施方案中,至少一条链包含至少2个核苷酸,例如2、3、4、5、6、7、9、10、11、12、13、14或15个核苷酸的5′突出端。还在其他实施方案中,RNAi剂的一条链的3′端和5′端都包含至少1个核苷酸的突出端。
在某些实施方案中,本发明的iRNA剂是dsRNA,其每条链包含19-23个核苷酸,其与靶RNA序列,例如补体因子B(CFB)基因相互作用,以指导靶RNA的切割。
在一些实施方案中,本发明的iRNA是24-30个核苷酸的dsRNA,其与靶RNA序列例如CFB靶mRNA序列相互作用以指导靶RNA的切割。
如本文所使用的,术语“核苷酸突出端”是指从双链iRNA的双链体结构突出的至少一个未配对的核苷酸。例如,当dsRNA的一条链的3′端延伸超过另一条链的5′端,或反之亦然时,存在核苷酸突出端。dsRNA可以包含具有至少一个核苷酸的突出端;替代地该突出端可以包含至少两个核苷酸、至少三个核苷酸、至少四个核苷酸、至少五个核苷酸或更多。核苷酸突出端可以包含核苷酸/核苷类似物(包括脱氧核苷酸/核苷)或由其组成。一个或多个突出端可以处于有义链、反义链或其任何组合上。此外,突出端的一个或多个核苷酸可以存在于dsRNA的或者反义链或者有义链的5′-端、3′-端或这两端上。
在dsRNA的一个实施方案中,至少一条链包含至少1个核苷酸的3′突出端。在另一个实施方案中,至少一条链包含至少2个核苷酸,例如2、3、4、5、6、7、9、10、11、12、13、14或15个核苷酸的3′突出端。在其他实施方案中,RNAi剂的至少一条链包含至少1个核苷酸的5′突出端。在某些实施方案中,至少一条链包含至少2个核苷酸,例如2、3、4、5、6、7、9、10、11、12、13、14或15个核苷酸的5′突出端。还在其他实施方案中,RNAi剂的一条链的3′端和5′端都包含至少1个核苷酸的突出端。
在一个实施方案中,dsRNA的反义链在3′-端或5′-端具有1-10个核苷酸,例如1、2、3、4、5、6、7、8、9或10个核苷酸的突出端。在一个实施方案中,dsRNA的有义链在3′-端或5′-端具有1-10个核苷酸,例如1、2、3、4、5、6、7、8、9或10个核苷酸的突出端。在另一个实施方案中,突出端中的一个或多个核苷酸被核苷硫代磷酸替代。
在某些实施方案中,dsRNA的反义链在3′-端或5′-端具有1-10个核苷酸,例如1、2、3、4、5、6、7、8、9或10个核苷酸的突出端。在某些实施方案中,有义链或反义链或两者上的突出端可包括长于10个核苷酸的延伸长度,例如长度1-30个核苷酸、2-30个核苷酸、10-30个核苷酸、10-25个核苷酸、10-20个核苷酸或10-15个核苷酸。在某些实施方案中,延伸的突出端在双链体的有义链上。在某些实施方案中,延伸的突出端存在于双链体的有义链的3′端。在某些实施方案中,延伸的突出端存在于双链体的有义链的5′端。在某些实施方案中,延伸的突出端在双链体的反义链上。在某些实施方案中,延伸的突出端存在于双链体反义链的3′端。在某些实施方案中,延伸的突出端存在于双链体反义链的5′端。在某些实施方案中,延伸的突出端中的一个或多个核苷酸被核苷硫代磷酸替代。在某些实施方案中,突出端包括自身互补部分,使得突出端能够形成在生理条件下稳定的发夹结构。
“钝端”或“平端”是指在双链RNA剂的该端没有未配对的核苷酸,即没有核苷酸突出端。“平端”双链RNA剂在其全长上是双链的,即在分子的任一端没有核苷酸突出端。本发明的RNAi剂包括在一端不具有核苷酸突出端的RNAi剂(即,具有一个突出端和一个平端的RNAi剂)或在任一端不具有核苷酸突出端的RNAi剂。最通常,这种分子在其整个长度上是双链的。
术语“反义链”或“引导链”是指iRNA的链,例如dsRNA,其包含与靶序列(例如CFBmRNA)基本互补的区域。
如本文所使用的,术语“互补区”是指反义链上与如本文所定义的序列(例如靶序列,例如补体因子B核苷酸序列)基本上互补的区域。当在互补区与靶序列不完全互补的情况下,错配可以处于分子的内部或末端区中。通常,最可容忍的错配在末端区域,例如在iRNA的5′-或3′端的5个、4个或3个核苷酸内。在一些实施方案中,本发明的双链RNA剂包含反义链中的核苷酸错配。在一些实施方案中,本发明的双链RNA剂的反义链包含与靶mRNA的不超过4个错配,例如,反义链包含与靶mRNA的4个、3个、2个、1个或0个错配。在一些实施方案中,本发明的反义链双链RNA剂包含与有义链的不超过4个错配,例如,反义链包含与有义链的4个、3个、2个、1个或0个错配。在一些实施方案中,本发明的双链RNA剂包含有义链中的核苷酸错配。在一些实施方案中,本发明的双链RNA剂的有义链包含与反义链的不超过4个错配,例如,有义链包含与反义链的4个、3个、2个、1个或0个错配。在一些实施方案中,核苷酸错配在例如距离iRNA的3′端5个、4个、3个核苷酸内。在另一个实施方案中,核苷酸错配在例如在iRNA剂的3′末端核苷酸中。在一些实施方案中,错配不在种子区中。
因此,如本文所描述的RNAi剂可以含有与靶序列的一个或多个错配。在一个实施方案中,如本文所描述的RNAi剂含有不超过3个错配(即,3个、2个、1个或0个错配)。在一个实施方案中,如本文所描述的RNAi剂含有不超过2个错配。在一个实施方案中,如本文所描述的RNAi剂含有不超过1个错配。在一个实施方案中,如本文所描述的RNAi剂含有0个错配。在某些实施方案中,如果RNAi剂的反义链含有与靶序列的错配,则错配可以任选地被限制在距互补区的5′-或3′端的最后5个核苷酸内。例如,在此类实施方案中,对于23个核苷酸的RNAi剂,与CFB基因的区域互补的链通常在中心13个核苷酸内不含有任何错配。本文所描述的方法或本领域已知的方法可以用于确定含有与靶序列的错配的RNAi剂是否有效抑制CFB基因的表达。考虑具有错配的RNAi剂在抑制CFB基因表达方面的功效很重要,特别是如果已知CFB基因中的特定互补区在群体内具有多态性序列变异。
如本文所使用的,术语“有义链”或“随从链”是指包含与如本文所定义的术语的反义链的区域基本上互补的区域的iRNA链。
如本文所使用的,“基本所有核苷酸都是修饰的”在很大程度上但不是完全为修饰的,并且可以包含不超过5个、4个、3个、2个或1个未修饰的核苷酸。
如本文所使用的,术语“切割区”是指紧邻切割位点的区域。切割位点是靶上发生切割的位点。在一些实施方案中,切割区在切割位点的任一端上并紧邻切割位点包括三个碱基。在一些实施方案中,切割区在切割位点的任一端上并紧邻切割位点包括两个碱基。在一些实施方案中,切割位点特异性地出现在反义链的核苷酸10和11结合的位点处,并且切割区包括核苷酸11、12和13。
如本文所使用的,并且除非另外指明,否则术语“互补”当用于相对于第二核苷酸序列描述第一核苷酸序列时是指包括第一核苷酸序列的寡核苷酸或多核苷酸在某些条件下与包括第二核苷酸序列的寡核苷酸或多核苷酸杂交并且形成双链体结构的能力,如技术人员将理解的。例如,此类条件可以是严格条件,其中严格条件可以包含:400mM NaCl,40mMPIPES,pH 6.4,1mM EDTA,50℃或70℃,持续12小时至16小时,然后洗涤(参见例如,Molecular Cloning:A Laboratory Manual,Sambrook等人(1989)Cold Spring HarborLaboratory Press)。可以应用其它条件,如生物体内部可能遇到的生理学上相关的条件。技术人员将能够根据杂交核苷酸的最终应用确定最适合于两个序列的互补性测试的条件集。
iRNA内(例如,如本文所描述的dsRNA内)的互补序列包含包括第一核苷酸序列的寡核苷酸或多核苷酸与包括第二核苷酸序列的寡核苷酸或多核苷酸在一个或两个核苷酸序列的全长上的碱基配对。此类序列在本文中可以被称为彼此“完全互补”。然而,当第一序列在本文中被称为相对于第二序列“基本互补”时,这两个序列可以是完全互补的,或其可以形成一个或多个,但通常不超过5个、4个、3个或2个杂交后错配的碱基对用于至多30个碱基对的双链体,同时保留在与其最终应用最相关的条件下杂交的能力,例如体外或体内抑制基因表达。然而,在两个寡核苷酸被设计以在杂交时形成一个或多个单链突出端的情况下,此类突出端不应视为相对于互补性的确定的错配。例如,包括一个长度为21个核苷酸的寡核苷酸和另一个长度为23个核苷酸的寡核苷酸的dsRNA,其中较长的寡核苷酸包括与较短的寡核苷酸完全互补的21个核苷酸的序列,仍可以被称为出于本文所描述的目的“完全互补”。
如本文所使用的,“互补”序列还可以包含非沃森-克里克碱基对或由非天然和修饰的核苷酸形成的碱基对,或完全由其形成,只要满足关于其杂交能力的以上要求即可。此类非沃森-克里克碱基对包括但不限于G:U摆动碱基配对或Hoogsteen碱基配对。
本文中的术语“互补”、“完全互补”和“基本互补”可以相对于dsRNA的有义链和反义链之间的碱基匹配,或两个寡核苷酸或多核苷酸(如双链RNA剂的反义链和靶序列)之间的碱基匹配使用,如根据其使用的上下文所理解的。
如本文所使用的,与信使RNA(mRNA)的“至少部分基本上互补”的多核苷酸是指与所关注的mRNA(例如,编码补体因子B基因的mRNA)的连续部分基本上互补的多核苷酸。例如,如果序列与编码补体因子B基因的mRNA的不间断部分基本上互补,则多核苷酸与补体因子B mRNA的至少一部分互补。
因此,在一些实施方案中,本文公开的反义多核苷酸与靶CFB序列完全互补。
在其它实施方案中,本文公开的反义多核苷酸与靶CFB序列基本上互补并且包含在其全长上与SEQ ID NO:1-7中任一个的核苷酸序列或SEQ ID NO:1-7中任一个的片段的等同区域至少80%互补,如约85%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%或约99%互补的连续核苷酸序列。
在一些实施方案中,本文公开的反义多核苷酸与靶CFB序列的片段基本上互补并且包含在其全长上与选自SEQ ID NO:1的核苷酸504-526、640-662、641-663、995-1017、997-1019、1034-1056、1141-1163、1145-1167、1389-1411、1473-1495、1826-1848、1828-1850、1842-1864、2242-2264、2391-2413、2393-2415、2438-2460或2453-2475的SEQ ID NO:1的片段至少80%互补,如约85%、约90%、约91%、约92%、约93%、约95%、约96%、约97%、约98%或约99%互补的连续核苷酸序列。
在其它实施方案中,本文所公开的反义多核苷酸与靶CFB序列基本上互补,并且包含在其完整长度上与表2-3中的任一个表中的任一个表中的有义链核苷酸序列中的任一个有义链核苷酸序列,或表2-3中的任一个表中的有义链核苷酸序列中的任一个有义链核苷酸序列的片段至少约80%互补,如约85%、约90%、约95%或完全互补的连续核苷酸序列。
在一个实施方案中,本公开的RNAi剂包含与反义多核苷酸基本上互补的有义链,该反义多核苷酸又与靶CFB序列相同,并且其中所述有义链多核苷酸包含在其全长上与SEQID NO:8-14的核苷酸序列或SEQ ID NO:8-14中任一个的片段的等同区域至少约80%互补,如约85%、约90%、约95%或完全互补的连续核苷酸序列。
在一些实施方案中,本发明的iRNA包括与反义多核苷酸基本上互补的有义链,所述反义多核苷酸又与靶补体因子B序列互补,并且其中所述有义链多核苷酸包含在其全长上与表2-3任一中的任一反义链核苷酸序列或表2-3任一中的任一反义链核苷酸序列的片段至少约80%互补,如约85%、约90%、约95%或完全互补的连续核苷酸序列。
在一些实施方案中,有义链和反义链选自AD-1726057;AD-1725763;AD-1725777;AD-1725057;AD-1725096;AD-1728786;AD-1725059;AD-1728276;AD-1728278;AD-1726936;AD-1725472;AD-1724715;AD-1727292;AD-1730477;AD-1727288;AD-1730167;AD-1725408;和AD-1725761。
在一个实施方案中,有义链和反义链选自双链体AD-1726057。
在一个实施方案中,有义链和反义链选自双链体AD-1725763。
在一个实施方案中,有义链和反义链选自双链体AD-1725777。
在一个实施方案中,有义链和反义链选自双链体AD-1725057。
在一个实施方案中,有义链和反义链选自双链体AD-1725096。
在一个实施方案中,有义链和反义链选自双链体AD-1728786。
在一个实施方案中,有义链和反义链选自双链体AD-1725059。
在一个实施方案中,有义链和反义链选自双链体AD-1728276。
在一个实施方案中,有义链和反义链选自双链体AD-1728278。
在一个实施方案中,有义链和反义链选自双链体AD-1726936。
在一个实施方案中,有义链和反义链选自双链体AD-1725472。
在一个实施方案中,有义链和反义链选自双链体AD-1724715。
在一个实施方案中,有义链和反义链选自双链体AD-1727292。
在一个实施方案中,有义链和反义链选自双链体AD-1730477。
在一个实施方案中,有义链和反义链选自双链体AD-1727288。
在一个实施方案中,有义链和反义链选自双链体AD-1730167。
在一个实施方案中,有义链和反义链选自双链体AD-1725408。
在一个实施方案中,有义链和反义链选自双链体AD-1725761。
在一些实施方案中,双链iRNA剂的双链区的长度等于或至少为17、18、19、20、21、22、23、23、24、25、26、27、28、29、30或更多个核苷酸对。
在一些实施方案中,双链iRNA剂的反义链长度等于或至少为17、18、19、20、21、22、23、23、24、25、26、27、28、29或30个核苷酸。
在一些实施方案中,双链iRNA剂的有义链长度等于或至少为17、18、19、20、21、22、23、23、24、25、26、27、28、29或30个核苷酸。
在一个实施方案中,双链iRNA剂的有义链和反义链的长度各自为18至30个核苷酸。
在一个实施方案中,双链iRNA剂的有义链和反义链的长度各自为19至25个核苷酸。
在一个实施方案中,双链iRNA剂的有义链和反义链的长度各自为21至23个核苷酸。
在一个实施方案中,iRNA剂的有义链长度为21个核苷酸,反义链长度为23个核苷酸,其中所述链形成21个连续碱基对的双链区域,所述双链区在3′末端具有2个核苷酸长的单链突出端。
在一些实施方案中,每条链的大部分核苷酸是核糖核苷酸,但如本文详细描述的,每条链或两条链还可包含一个或多个非核糖核苷酸,例如脱氧核糖核苷酸或修饰的核苷酸。此外,“iRNA”可包括具有化学修饰的核糖核苷酸。此类修饰可包括本文公开的或本领域已知的所有类型的修饰。出于本说明书和权利要求书的目的,“iRNA”涵盖在iRNA分子中使用的任何此类修饰。
在本公开的某些实施方案中,如果存在于RNAi剂中,包含脱氧核苷酸可以被认为构成修饰的核苷酸。
在一个实施方案中,CFB基因表达的至少部分抑制通过CFB mRNA量的减少来评估,所述CFB mRNA可从CFB基因在其中被转录且已被处理使得CFB基因的表达被抑制的第一细胞或细胞组分离或在第一细胞或细胞组中检测,如与第一细胞或细胞组基本上相同但未如此处理的第二细胞或细胞群(对照细胞)相比的。抑制程度可以表示为:
如本文所使用的,短语“使细胞与iRNA(如dsRNA)接触”包含通过任何可能的方式接触细胞。使细胞与iRNA接触包含使细胞在体外与iRNA接触或使细胞在体内与iRNA接触。可以直接或间接地进行接触。因此,例如可以通过执行所述方法的个体使iRNA与细胞物理接触,或可替代地,可以使iRNA处于允许或使其随后与细胞接触的情况。
体外接触细胞可以通过例如将细胞与iRNA一起温育来进行。体内接触细胞可以通过例如将iRNA注射到细胞所在的组织中或其附近,或通过将iRNA注射到另一个区域中,例如血流或皮下空间,使得药剂随后到达待接触细胞所在的组织来进行。例如,iRNA可以含有配体(例如,GalNAc)或与配体偶联,所述配体将iRNA引导到所关注的位点,例如肝脏。体外和体内接触方法的组合也是可能的。例如,细胞也可以与iRNA体外接触,并且随后移植到受试者体内。
在某些实施方案中,使细胞与iRNA接触包含通过促进或影响细胞的摄取或吸收来“引入”或“将iRNA递送到细胞中”。iRNA的吸收或摄取可以通过无辅助的扩散或活性细胞过程发生,或通过辅助剂或装置发生。将iRNA引入细胞中可以是体外的或体内的。例如,对于体内引入,可以将iRNA注射到组织部位中或全身施用。体外引入细胞包含本领域已知的方法,如电穿孔和脂质转染。另外的方法在下文中描述或在本领域中是已知的。
术语“脂质纳米颗粒”或“LNP”是包括脂质层的囊泡,所述脂质层封装药物活性分子,如核酸分子,例如iRNA或从其转录iRNA的质粒。LNP在例如美国专利第6,858,225号、第6,815,432号、第8,158,601号和第8,058,069号中进行了描述,所述美国专利的全部内容特此通过引用并入本文。
如本文所使用的,“受试者”是内源性或异源性表达靶基因的动物,如哺乳动物,包含灵长类动物(如人、非人灵长类动物,例如猴子和黑猩猩)、非灵长类动物(如兔子、绵羊、仓鼠、豚鼠、狗、大鼠或小鼠)或鸟类。在一个实施方案中,受试者是人,如正在治疗或评估将受益于CFB表达减少的疾病或病症的人;处于疾病或病症风险中的人,所述疾病或病症将受益于CFB表达减少;患有将受益于CFB表达减少的疾病或病症的人;或正在治疗将受益于如本文所描述的CFB表达减少的疾病或病症的人。在一些实施方案中,受试者是女性人类。在其它实施例中,受试者是男性人类。在一个实施方案中,受试者是成年受试者。在另一个实施例中,受试者是儿科受试者。
如本文所使用的,术语“治疗(treating)”或“治疗(treatment)”是指有益或期望的结果,如减少受试者的CFB相关病症的至少一种体征或症状。治疗还包含减少与不期望的CFB表达相关的一种或多种体征或症状;减轻不期望的CFB激活或稳定的程度;改善或缓和不期望的CFB激活或稳定。“治疗”也可以意指与没有治疗的预期存活期相比,延长存活期。
在受试者或疾病标志物或症状中CFB水平的上下文中,术语“较低”是指此类水平在统计学上显著降低。降低可以是例如至少10%、15%、20%、25%、30%、%、40%、45%、50%、55%、60%、65%、70%、75%,80%、85%、90%、95%或更多。在某些实施方案中,降低为至少20%。在某些实施方案中,疾病标志物,例如蛋白质或基因表达水平的降低为至少50%。受试者的CFB水平的“较低”是降低到没有此类病症的个体的正常范围内的被接受的水平。在某些实施方案中,靶标有表达正常化,即朝向没有此类病症的个体的正常范围内的被接受的水平降低或降低至该水平,例如,体重、血压或血清脂质水平的正常化。如本文所使用的,受试者中的“降低”可指降低受试者细胞中的基因表达或蛋白质产生,而不需要降低受试者的所有细胞或组织中的表达。例如,如本文所使用的,受试者中的降低可包括受试者肝脏中基因表达或蛋白质产生的降低。
术语“降低”还可以与使疾病或病症的症状正常化相关联地使用,即降低患有CFB相关疾病的受试者中的水平与未患CFB相关疾病的正常受试者中的水平之间的差异。例如,如果正常体重为70kg的受试者在治疗前体重为90kg(超重20kg),在治疗后体重为80kg(超重10kg),则受试者的体重向正常体重降低50%(10/20×100%)。类似地,如果妇女的HDL水平从50mg/dL(差)增加到57mg/dL,正常水平为60mg/dL,则受试者的先前水平和正常水平之间的差异降低70%(受试者水平和正常水平之间的10mg/dL的差异降低7mg/dL,7/10×100%)。如本文所使用的,如果疾病与症状的升高值相关,则“正常”被认为是正常值的上限。如果疾病与症状的降低值相关,则“正常”被认为是正常值的下限。
如本文所使用的,“预防(prevention)”或“防止(preventing)”当用于提及将受益于CFB基因表达或CFB蛋白产生的减少的疾病、障碍或病症时,是指防止具有疾病的至少一种体征或症状的受试者发生进一步的体征和症状而满足该疾病的诊断标准。在某些实施方案中,预防包括与通过自然史研究或疾病的典型进展预测的相比,延迟达到满足疾病的诊断标准的进展数天、数周、数月或数年。
如本文所使用的,术语“补体因子B疾病”或“CFB相关疾病”是由补体活化引起或与补体活化相关的疾病或病症。术语“CFB相关疾病”包括将受益于CFB基因表达、复制或蛋白质活性降低的疾病、障碍或病症。CFB相关疾病的非限制性实例包括例如阵发性睡眠性血红蛋白尿症(PNH)、非典型溶血性尿毒综合征(aHUS)、哮喘、类风湿性关节炎(RA);抗磷脂抗体综合征;狼疮肾炎;缺血-再灌注损伤;典型的或感染性溶血性尿毒综合征(tHUS);致密沉积物病(DDD);视神经脊髓炎(NMO);多灶性运动神经病(MMN);多发性硬化(MS);黄斑变性(例如,年龄相关性黄斑变性(AMD));溶血、肝酶升高和低血小板(HELLP)综合征;血栓性血小板减少性紫癜(TTP);自发性流产;寡免疫血管炎;大疱性表皮松解症;习惯性流产;先兆子痫、创伤性脑损伤、重症肌无力、冷凝集素病、皮肌炎大疱性类天疱疮、志贺毒素大肠杆菌相关的溶血性尿毒综合征、C3肾病、抗嗜中性粒细胞细胞质抗体相关血管炎(例如,肉芽肿病伴多血管炎(以前称为Wegener肉芽肿病)、变应性肉芽肿性血管炎和显微镜下多血管炎)、体液和血管移植排斥、移植物功能异常、心肌梗塞(例如,心肌梗塞中的组织损伤和缺血)、同种异体移植、脓毒症(例如,脓毒病不良结果)、冠状动脉病、皮肌炎、格雷夫斯病、动脉粥样硬化、阿尔茨海默病、全身性炎症反应脓毒症、脓毒性休克、脊髓损伤、肾小球肾炎、桥本氏甲状腺炎、I型糖尿病、银屑病、天疱疮、自身免疫性溶血性贫血(AIHA)、ITP、古德帕斯彻综合征、德戈斯病、抗磷脂综合征(APS)、灾难性APS(CAPS)、心血管障碍、心肌炎、脑血管障碍、外周(例如,肌肉骨骼)血管障碍、肾血管障碍、肠系膜/肠血管障碍、血管炎、
在一个实施方案中,补体因子B相关疾病选自C3肾小球病、系统性红斑狼疮(SLE),例如狼疮性肾炎、IgA肾病、糖尿病性肾病、多囊肾病、膜性肾病、年龄相关性黄斑变性、非典型溶血性尿毒综合征、血栓性微血管病、重症肌无力、缺血和再灌注损伤、阵发性睡眠性血红蛋白尿症和类风湿性关节炎。
在另一个实施方案中,补体因子B相关疾病选自C3肾小球病、系统性红斑狼疮(SLE),例如狼疮性肾炎、IgA肾病、糖尿病性肾病和多囊肾病。
关于各种疾病或病症的体征和症状的进一步细节在本文中提供并且是本领域公知的。
如本文所使用的,“治疗有效量”旨在包含当向患有CFB相关疾病的受试者施用时足以影响疾病的治疗(例如,通过减少、改善或维持现有疾病或一种或多种疾病症状)的RNAi剂的量。“治疗有效量”可能因RNAi剂、药剂如何施用、疾病和其严重程度以及病史、年龄、体重、家族史、基因组成、先前或伴随治疗的类型(如果有的话)以及待治疗受试者的其它个体特征而异。
如本文所使用的,“预防有效量”旨在包括当施用于具有CFB相关病症的至少一种体征或症状的受试者时足以预防或延迟受试者进展至满足该疾病的全部诊断标准的RNAi剂的量。疾病的预防包括减缓发展为完全爆发的疾病的进程。“预防有效量”可以根据RNAi剂、药剂如何给予的、疾病的风险程度以及病史、年龄、体重、家族史、遗传组成、先前或伴随治疗的类型(如果有的话),以及有待治疗的患者的其他个体特征而变化。
“治疗有效量”或“预防有效量”还包含一定量的RNAi剂,所述药剂以适用于任何治疗的合理收益/风险比产生一些期望的效果。本发明的方法中采用的iRNA可以以足够的量施用,以产生适用于此类治疗的合理益处/风险比。
短语“药学上可接受的”在本文中用于指在正确医学判断的范围内适合于与人受试者和动物受试者的组织接触使用而不会产生过多毒性、刺激、过敏应答或其它问题或并发症的、与合理的益处/风险比相称的那些化合物、材料、组合物或剂型。
如本文所使用的,短语“药学上可接受的载体”是指药学上可接受的材料(包括盐)、组合物或媒剂,如液体或固体填充剂、稀释剂、赋形剂、制造助剂(例如,润滑剂、滑石镁、硬脂酸钙或硬脂酸锌、或硬脂酸)、或溶剂封装材料(涉及将主题化合物从身体的一个器官或部分携带或运送到身体的另一个器官或部分)。在与制剂的其它成分相容并且对被治疗的受试者无害的意义上来讲,每种载体必须是“可接受的”。此类载体在本领域中是已知的。药学上可接受的载体包含用于通过注射施用的载体。
如本文所使用的,术语“样品”包含从受试者分离的类似流体、细胞或组织的集合,以及受试者体内存在的流体、细胞和组织。生物流体的实例包含血液、血清和浆膜流体、血浆、脑脊液、眼流体、淋巴、尿液、唾液等。组织样品可以包含来自组织、器官或局部区域的样品。例如,样品可以源自特定的器官、器官的一部分或这些器官内的液体或细胞。在某些实施方案中,样品可以源自肝脏(例如,整个肝脏或肝脏的某些部分或肝脏中的某些类型的细胞,例如,肝细胞)。在一些实施方案中,“源自受试者的样品”是指从受试者获得的尿液。“源自受试者的样品”可以指源自受试者的血液或血源性血清或血浆。
II.本发明的iRNA
本发明提供了抑制补体因子B基因表达的iRNA。在某些实施方案中,iRNA包括双链核糖核酸(dsRNA)分子,其用于抑制细胞中CFB基因的表达,所如受试者(例如哺乳动物,如易患补体因子B相关病症的人)中的细胞。dsRNAi剂包含具有互补区的反义链,所述互补区与在CFB基因的表达中形成的mRNA的至少一部分互补。互补区的长度为约19个至30个核苷酸(例如,长度约30个、29个、28个、27个、26个、25个、24个、23个、22个、21个、20个或19个核苷酸)。
在与表达CFB基因的细胞接触时,iRNA抑制CFB基因(例如,人、灵长类动物、非灵长类动物或大鼠CFB基因)的表达至少约50%,如通过例如PCR或基于支链DNA(bDNA)的方法或通过基于蛋白质的方法(如通过免疫荧光分析,使用例如蛋白质印迹或流式细胞术技术)所测定的。在某些实施方案中,通过本文实例中提供的qPCR方法,在其中提供的合适的生物体细胞系中,用例如10nM浓度的siRNA确定表达的抑制。在某些实施方案中,体内表达的抑制是通过在表达人基因的啮齿类动物,例如表达人靶基因的小鼠或AAV感染的小鼠中敲低人基因来确定的,例如,当以单剂量施用时,例如在RNA表达的最低点以3mg/kg施用。
dsRNA包含两条互补并且在将使用dsRNA的条件下杂交以形成双链体结构的RNA链。dsRNA的一条链(反义链)包含与靶序列基本上互补且通常完全互补的互补区。靶序列可以源自在CFB基因的表达期间形成的mRNA的序列。另一条链(有义链)包含与反义链互补的区,使得两条链在适当条件下组合时杂交并形成双链体结构。如本文中其它地方所描述且如本领域已知的,dsRNA的互补序列可以作为单一核酸分子的自身互补区被包含,与位于单独寡核苷酸上相反。
通常,双链体结构的长度为15个至30个碱基对,例如长度为15个至29个、15个至28个、15个至27个、15个至26个、15个至25个、15个至24个、15个至23个、15个至22个、15个至21个、15个至20个、15个至19个、15个至18个、15个至17个、18个至30个、18个至29个、18个至28个、18个至27个、18个至26个、18个至25个、18个至24个、18个至23个、18个至22个、18个至21个、18个至20个、19个至30个、19个至29个、19个至28个、19个至27个、19个至26个、19个至25个、19个至24个、19个至23个、19个至22个、19个至21个、19个至20个、20个至30个、20个至29个、20个至28个、20个至27个、20个至26个、20个至25个、20个至24,20个至23个、20个至22个、20个至21个、21个至30个、21个至29个、21个至28个、21个至27个、21个至26个、21个至25个、21个至24个、21个至23个或21个至22个碱基对。在某些实施方案中,双链体结构的长度为18个至25个碱基对,例如,长度为18个至25个、18个至24个、18个至23个、18个至22个、18个至21个、18个至20个、19个至25个、19个至24个、19个至23个、19个至22个、19个至21个、19个至20个、20个至25个、20个至24,20个至23个、20个至22个、20个至21个、21个至25个、21个至24个、21个至23个、21个至22个、22个至25个、22个至24个、22个至23个、23个至25个、23个至24个或24个至25个碱基对,例如长度为19个至21个碱基对。上述范围和长度中间的范围和长度也被认为是本公开的一部分。
类似地,与靶序列互补的区的长度为15个至30个核苷酸,例如长度为15个至29个、15个至28个、15个至27个、15个至26个、15个至25个、15个至24个、15个至23个、15个至22个、15个至21个、15个至20个、15个至19个、15个至18个、15个至17个、18个至30个、18个至29个、18个至28个、18个至27个、18个至26个、18个至25个、18个至24个、18个至23个、18个至22个、18个至21个、18个至20个、19个至30个、19个至29个、19个至28个、19个至27个、19个至26个、19个至25个、19个至24个、19个至23个、19个至22个、19个至21个、19个至20个、20个至30个、20个至29个、20个至28个、20个至27个、20个至26个、20个至25个、20个至24,20个至23个、20个至22个、20个至21个、21个至30个、21个至29个、21个至28个、21个至27个、21个至26个、21个至25个、21个至24个、21个至23个或21个至22个核苷酸,例如长度为19个至23个核苷酸或长度为21个至23个核苷酸。上述范围和长度中间的范围和长度也被认为是本公开的一部分。
在一些实施方案中,双链体结构的长度为19个至30个碱基对。类似地,与靶序列互补的区域的长度为19个至30个核苷酸。
在一些实施方案中,dsRNA的长度为约19个至约23个核苷酸,或长度为约25个至约30个核苷酸。一般而言,dsRNA足够长以用作Dicer酶的底物。例如,本领域众所周知,长度超过约21个至23个核苷酸的dsRNA可以用作Dicer的底物。如普通技术人员还将认识到的,靶向切割的RNA的区域通常将是较大RNA分子的部分,通常是mRNA分子。在相关情况下,mRNA靶的一“部分”是mRNA靶的连续序列,其长度足以使其成为RNAi定向切割(即通过RISC通路切割)的底物。
本领域技术人员也将认识到双链体区是dsRNA的主要功能部分,例如约19个至约30个碱基对(例如,约19个至30个、19个至29个、19个至28个、19个至27个、19个至26个、19个至25个、19个至24个、19个至23个、19个至22个、19个至21个、19个至20个、20个至30个、20个至29个、20个至28个、20个至27个、20个至26个、20个至25个、20个至24,20个至23个、20个至22个、20个至21个、21个至30个、21个至29个、21个至28个、21个至27个、21个至26个、21个至25个、21个至24个、21个至23个或21个至22个碱基对)的双链体区。因此,在一个实施方案中,在其被加工成靶向所需RNA进行切割的例如15个至30个碱基对的功能性双链体的程度上,具有大于30个碱基对的双链体区的RNA分子或RNA分子复合物是dsRNA。因此,普通技术人员将认识到,在一个实施方案中,miRNA是dsRNA。在另一个实施例中,dsRNA不是天然存在的miRNA。在另一个实施方案中,用于靶向补体因子B基因表达的iRNA剂不是通过切割较大的dsRNA在靶细胞中产生的。
如本文所描述的dsRNA可以进一步包含一个或多个单链核苷酸突出端,例如,1个至4个、2个至4个、1个至3个、2个至3个、1个、2个、3个或4个核苷酸。具有至少一个核苷酸突出端的dsRNA相对于其钝端对应物具有更好的抑制特性。核苷酸突出端可以包括以下或由以下组成:核苷酸/核苷类似物,包含脱氧核苷酸/核苷。突出端可以在有义链、反义链或其任何组合上。此外,突出端的核苷酸可以存在于dsRNA的反义链或有义链的5′端、3′端或两端上。
dsRNA可以通过本领域已知的标准方法合成。本发明的双链RNAi化合物可以使用两步程序制备。首先,单独制备双链RNA分子的单个链。然后,对组分链进行退火。siRNA化合物的单个链可以使用溶液相或固相有机合成或两者制备。有机合成提供的优点是可以容易地制备包括非天然或修饰的核苷酸的寡核苷酸链。类似地,本发明的单链寡核苷酸可以使用溶液相或固相有机合成或两者制备。
不管合成方法如何,siRNA制备物可以在适合于配制的溶液(例如水溶液或有机溶液)中制备。例如,可以将siRNA制备物沉淀并再溶解在纯的双蒸水中,并冻干。然后可以将干燥的siRNA重新悬浮在适合于预期配制过程的溶液中。
在一个方面,本发明的dsRNA包含至少两个核苷酸序列,有义序列和反义序列。有义链选自由表2-3中的任一个表中提供的序列组成的组,并且所述有义链的对应的反义链选自由表2-3中的任一个表中的序列组成的组。在这方面,两个序列中的一个序列与两个序列中的另一个序列互补,其中所述序列中的一个序列与在补体因子B基因表达中产生的mRNA序列基本上互补。因此,在这方面,dsRNA将包含两个寡核苷酸,其中一个寡核苷酸在表2-3中的任一个表中被描述为有义链,并且第二个寡核苷酸被描述为表2-3中的任一个表中的有义链的对应反义链。
在某些实施方案中,dsRNA的基本互补序列包含在分离的寡核苷酸上。在其它实施例中,dsRNA的基本互补序列包含在单个寡核苷酸上。
应当理解,例如尽管表2中的序列没有被描述为修饰的或缀合的序列,但本发明的iRNA的RNA,例如本发明的dsRNA可以包括表2-3中的任一个表中所述的未修饰、未缀合或与其中所述的不同的修饰或缀合的序列中的任一者。换言之,本发明涵盖表2-3的dsRNA,其是未修饰、未缀合、修饰的或缀合的,如本文所描述的。
本领域技术人员充分了解,具有约20个至23个碱基对(例如,21个碱基对)的双链体结构的dsRNA已被誉为在诱导RNA干扰方面特别有效(Elbashir等人,EMBO 2001,20:6877-6888)。然而,其它人已经发现,较短或较长的RNA双链体结构也可以是有效的(Chu和Rana(2007)RNA 14:1714-1719;Kim等人(2005)Nat Biotech 23:222-226)。在上述实施方案中,由于表2-3中的任一个表中提供的寡核苷酸序列的性质,本文所描述的dsRNA可以包含至少一条长度为最少21个核苷酸的链。可以合理地预期,与上述dsRNA相比,具有表2-3中的任一个表的序列中的任一个序列在一端或两端仅减去很少核苷酸的较短的双链体可以类似地有效。因此,具有源自表2-3中的任一个表的序列中的任一个序列的至少19个、20个或更多个连续核苷酸的序列的dsRNA,并且其抑制补体因子B基因表达的能力与包括完整序列的dsRNA相差不超过约5%、10%、15%、20%、25%或30%的抑制,被认为在本发明的范围内。
另外,表2-3中提供的RNA鉴定了补体因子B转录物中对RISC介导的切割敏感的位点。因此,本发明的进一步特征在于靶向在这些位点之一内的iRNA。如本文所使用的,如果iRNA促进转录物在所述特定位点内任何位置的切割,则iRNA被称为靶向RNA转录物的特定位点内。此类iRNA通常包含来自表2-3中的任一个表中提供的序列中的任一个序列的至少约19个连续核苷酸,其与取自补体因子B基因中所选序列的连续区域的另外的核苷酸序列偶联。
本文所述的RNAi剂可含有与靶序列的一个或多个错配。在一个实施方案中,如在此描述的RNAi剂包含不多于3个错配(即,3、2、1或0个错配)。在一个实施方案中,如本文所述的RNAi剂含有不超过2个错配。在一个实施方案中,如本文所述的RNAi剂含有不超过1个错配。在一个实施方案中,如本文所述的RNAi剂含有0个错配。在某些实施方案中,如果RNAi剂的反义链含有与靶序列的错配,错配可以任选地被限制在互补区的5′-或3′-端的最后5个核苷酸内。例如,在这样的实施方案中,对于23个核苷酸的RNAi剂,与CFB基因的区域互补的链通常在中心13个核苷酸内不含任何错配。本文所述的方法或本领域已知的方法可用于确定含有与靶序列错配的RNAi剂是否有效抑制CFB基因的表达。考虑具有错配的RNAi剂在抑制CFB基因表达中的功效是重要的,尤其是如果已知CFB基因中的特定互补区在群体中具有多态性序列变异。
III.本发明的修饰的iRNA
在某些实施方案中,本发明的iRNA的RNA,例如dsRNA,是未修饰的,并且不包括例如本领域已知的和本文所描述的化学修饰或缀合。在其它实施例中,本发明的iRNA的RNA,例如dsRNA被化学修饰以增强稳定性或其它有益特性。在本发明的某些实施例中,本发明的iRNA的基本上所有核苷酸都被修饰。在本发明的其它实施例中,iRNA的所有核苷酸或iRNA的基本上所有核苷酸被修饰,即在iRNA的链中存在不超过5个、4个、3个、2个或1个未修饰的核苷酸。
本发明特征的核酸可以通过本领域公认的方法合成或修饰,例如“Currentprotocols in nucleic acid chemistry”,Beaucage,S.L等人(编辑),John Wiley &Sons,Inc.,New York,NY,USA中描述的那些方法,所述方法特此通过引用并入本文。修饰包含例如端修饰,例如5′端修饰(磷酸化、缀合、反向连接等)、3′端修饰(缀合、DNA核苷酸、反向连接等);碱基修饰,例如,用稳定碱基、去稳定碱基或与扩展的伙伴库碱基配对的碱基替换、去除碱基(无碱基核苷酸)或缀合的碱基;糖修饰(例如,在2′位置或4′位置处)或糖的置换;或主链修饰,包含磷酸二酯键的修饰或置换。可用于本文所描述的实施例的iRNA化合物的具体实例包括但不限于含有修饰的主链或不含天然核苷间键的RNA。除此之外,具有修饰的主链的RNA包含在主链中不具有磷原子的那些。出于本说明书的目的,并且如本领域中有时提及的,在其核苷间主链中不具有磷原子的修饰的RNA也可以被视为寡核苷。在一些实施方案中,修饰的iRNA将在其核苷间主链中具有磷原子。
修饰的RNA主链包含例如硫代磷酸酯、手性硫代磷酸酯、二硫代磷酸酯、磷酸三酯、氨基烷基磷酸三酯、甲基和其它烷基膦酸酯(包含3′-亚烷基膦酸酯和手性膦酸酯)、次膦酸酯、氨基磷酸酯(包含3′-氨基磷酰胺酯和氨基烷基磷酸胺酯)、硫代羰基磷酰胺酯、硫代羰基烷基膦酸酯、硫代羰基烷基磷酸三酯、以及具有正常3′-5′键的硼烷磷酸酯、这些酯的2′-5′连接类似物、以及具有反向极性的那些酯,其中相邻对的核苷单位以3′-5′至5′-3′或2′-5′至5′-2′连接。也包含了各种盐、混合盐和游离酸形式。在本发明的一些实施例中,本发明的dsRNA剂是游离酸形式。在本发明的其它实施例中,本发明的dsRNA剂是盐形式。在一个实施方案中,本发明的dsRNA剂是钠盐形式。在某些实施方案中,当本发明的dsRNA剂为钠盐形式时,钠离子作为药剂中存在的基本上所有磷酸二酯或硫代磷酸酯基团的抗衡离子存在于药剂中。其中基本上所有的磷酸二酯或硫代磷酸酯键都具有钠抗衡离子的药剂包含不超过5个、4个、3个、2个或1个不具有钠抗衡离子的磷酸二酯键或硫代磷酸酯键。在一些实施方案中,当本发明的dsRNA剂为钠盐形式时,钠离子作为药剂中存在的所有磷酸二酯或硫代磷酸酯基团的抗衡离子存在于药剂中。
教导制备上述含磷键的代表性美国专利包括但不限于美国专利第3,687,808号;第4,469,863号;第4,476,301号;第5,023,243号;第5,177,195号;第5,188,897号;第5,264,423号;第5,276,019号;第5,278,302号;第5,286,717号;第5,321,131号;第5,399,676号;第5,405,939号;第5,453,496号;第5,455,233号;第5,466,677号;第5,476,925号;第5,519,126号;第5,536,821号;第5,541,316号;第5,550,111号;第5,563,253号;第5,571,799号;第5,587,361号;第5,625,050号;第6,028,188号;第6,124,445号;第6,160,109号;第6,169,170号;第6,172,209号;第6,239,265号;第6,277,603号;第6,326,199号;第6,346,614号;第6,444,423号;第6,531,590号;第6,534,639号;第6,608,035号;第6,683,167号;第6,858,715号;第6,867,294号;第6,878,805号;第7,015,315号;第7,041,816号;第7,273,933号;第7,321,029号;以及美国专利RE39464,所述美国专利中的每一个的全部内容特此通过引用并入本文。
其中不包含磷原子的修饰的RNA主链具有由以下形成的主链:短链烷基或环烷基核苷间键、混合杂原子和烷基或环烷基核苷间键或一个或多个短链杂原子或杂环核苷间键。这些包含具有吗啉代键的那些(部分地由核苷的糖部分形成);硅氧烷主链;硫化物、亚砜和砜主链;甲酰乙酰基和硫代甲酰乙酰基主链;亚甲基甲酰乙酰基和硫代甲酰乙酰基主链;含烯烃的主链;氨基磺酸酯主链;亚甲基亚氨基和亚甲基肼基主链;磺酸酯和磺酰胺主链;酰胺主链;和其它具有混合的N、O、S和CH
教导制备上述寡核苷的代表性美国专利包括但不限于美国专利第5,034,506号;第5,166,315号;第5,185,444号;第5,214,134号;第5,216,141号;第5,235,033号;第5,64,562号;第5,264,564号;第5,405,938号;第5,434,257号;第5,466,677号;第5,470,967号;第5,489,677号;第5,541,307号;第5,561,225号;第5,596,086号;第5,602,240号;第5,608,046号;第5,610,289号;第5,618,704号;第5,623,070号;第5,663,312号;第5,633,360号;第5,677,437号;以及第5,677,439号,所述美国专利中的每一个的全部内容特此通过引用并入本文。
考虑在本文提供的iRNA中使用合适的RNA模拟物,其中核苷酸单元的糖和核苷间键,即主链被新基团替代。维持碱基单元以与适当的核酸靶化合物杂交。一种此类寡聚化合物(其中已示出具有极佳杂交特性的RNA模拟物)被称作肽核酸(PNA)。在PNA化合物中,RNA的糖主链被含酰胺的主链替代,尤其是氨基乙基甘氨酸主链。核碱基被保留并且直接或间接地与主链的酰胺部分的氮杂氮原子结合。教导PNA化合物的制备的代表性美国专利包括但不限于美国专利第5,539,082号;第5,714,331号;以及第5,719,262号,所述美国专利中的每一个的全部内容特此通过引用并入本文。适用于本发明iRNA的另外的PNA化合物在例如Nielsen等人,Science,1991,254,1497-1500中进行了描述。
本发明特征的一些实施例包含具有硫代磷酸酯主链的RNA和具有杂原子主链的寡核苷,特别是上文引用的美国专利第5,489,677号的--CH
修饰的RNA还可以包括一个或多个经取代的糖部分。本文特征的iRNA,例如dsRNA可以在2′位置处包含以下之一:OH;F;O-、S-或N-烷基;O-、S-或N-烯基;O-、S-或N-炔基;或O-烷基-O-烷基,其中烷基、烯基和炔基可以是经取代的或未经取代的C
其它修饰包含2′-甲氧基(2′-OCH
iRNA还可以包含核碱基(在本领域中通常被简称为“碱基”)修饰或取代。如本文所使用的,“未修饰的”或“天然”核碱基包含嘌呤碱基腺嘌呤(A)和鸟嘌呤(G),以及嘧啶碱基胸腺嘧啶(T)、胞嘧啶(C)和尿嘧啶(U)。修饰的核碱基包含其它合成和天然核碱基,如脱氧胸腺嘧啶(dT)、5-甲基胞嘧啶(5-me-C)、5-羟甲基胞嘧啶、黄嘌呤、次黄嘌呤、2-氨基腺嘌呤、腺嘌呤和鸟嘌呤的6-甲基和其它烷基衍生物、腺嘌呤和鸟嘌呤的2-丙基和其它烷基衍生物、2-硫尿嘧啶、2-硫代胸腺嘧啶和2-硫代胞嘧啶、5-卤代尿嘧啶和胞嘧啶、5-丙炔基尿嘧啶和胞嘧啶、6-偶氮尿嘧啶、胞嘧啶和胸腺嘧啶、5-尿嘧啶(假尿嘧啶)、4-硫代尿嘧啶、8-卤基、8-氨基、8-硫基、8-硫烷基、8-羟基和其它8-取代的腺嘌呤和鸟嘌呤、5-卤基,具体地5-溴、5-三氟甲基和其它5-取代的尿嘧啶和胞嘧啶、7-甲基鸟嘌呤和7-甲基腺嘌呤、8-氮杂鸟嘌呤和8-氮杂腺嘌呤、7-脱氮鸟嘌呤和7-脱氮腺嘌呤以及3-脱氮鸟嘌呤和3-脱氮腺嘌呤。另外的核碱基包含美国专利第3,687,808号中公开的那些,在Modified Nucleosidesin Biochemistry,Biotechnology and Medicine,Herdewijn,P.编辑,Wiley-VCH,2008年中公开的那些;在The Concise Encyclopedia Of Polymer Science And Engineering,第858-859页,Kroschwitz,J.L编辑,John Wiley & Sons,1990中公开的那些,Englisch等人,Angewandte Chemie,International Edition,1991,30,613中公开的那些,以及Sanghvi,YS.,第15章,dsRNA Research and Applications,第289-302页,Crooke,S.T.和Lebleu,B.编辑,CRC Press,1993中公开的那些。这些核碱基中的某些核碱基对提高本发明特征的寡聚化合物的结合亲和力特别有用。这些包含5-取代的嘧啶、6-氮杂嘧啶和N-2、N-6和0-6取代的嘌呤,包含2-氨基丙基腺嘌呤、5-丙炔基尿嘧啶和5-丙炔基胞嘧啶。已经示出5-甲基胞嘧啶取代使核酸双链体稳定性提高0.6℃至1.2℃(Sanghvi,Y.S.,Crooke,S.T.和Lebleu,B.编辑,dsRNA Research and Applications,CRC Press,Boca Raton,1993,第276-278页),并且是示例性碱基取代,甚至更具体地在与2′-O-甲氧基乙基糖修饰组合时。
教导制备某些上述修饰的核碱基以及其它修饰的核碱基的代表性美国专利包含但不限于上述美国专利第3,687,808号、第4,845,205号;第5,130,30号;第5,134,066号;第5,175,273号;第5,367,066号;第5,432,272号;第5,457,187号;第5,459,255号;第5,484,908号;第5,502,177号;第5,525,711号;第5,552,540号;第5,587,469号;第5,594,121号、5,596,091号;第5,614,617号;第5,681,941号;第5,750,692号;第6,015,886号;第6,147,200号;第6,166,197号;第6,222,025号;第6,235,887号;第6,380,368号;第6,528,640号;第6,639,062号;第6,617,438号;第7,045,610号;第7,427,672号;以及第7,495,088号,所述美国专利中的每一个的全部内容特此通过引用并入本文。
在一些实施方案中,本公开的iRNA剂还可以被修饰成包括一个或多个双环糖部分。“双环糖”是通过两个原子的桥接修饰的呋喃糖基环。“双环糖”是由两个碳(无论是相邻的还是非相邻的)原子桥连形成的环修饰的呋喃糖基环。“双环核苷”(“BNA”)是具有糖部分的核苷,其包含桥连糖环的两个碳原子(无论是相邻的还是非相邻的)的桥连形成的桥环,从而形成双环环体系。在某些实施方案中,桥任选地经由2′-无环氧原子连接糖环的4′-碳和2′-碳。因此,在一些实施方案中,本发明的药剂可以包含一种或多种锁核酸(LNA)。锁核酸是具有修饰的核糖部分的核苷酸,其中核糖部分包括连接2′和4′碳的额外桥。换言之,LNA是包括双环糖部分的核苷酸,所述双环糖部分包括4′-CH
锁核苷可由以下结构表示(省略立体化学),
其中B是核碱基或修饰的核碱基,并且L是将核糖环的2′-碳与4′-碳连接的连接基团。
此类4′至2′桥接的双环核苷的实例包含但不限于4′-(CH
教导制备锁核酸核苷酸的其它代表性美国专利和美国专利公开包含但不限于以下:美国专利第6,268,490号;第6,525,191号;第6,670,461号;第6,770,748号;第6,794,499号;第6,998,484号;第7,053,207号;第7,034,133;7,084,125号;第7,399,845号;第7,427,672号;第7,569,686号;第7,741,457号;第8,022,193号;第8,030,467号;第8,278,425号;第8,278,426号;第8,278,283号;US 2008/0039618;以及US 2009/0012281,所述美国专利中的每一个的全部内容特此通过引用并入本文。
可以制备具有一种或多种立体化学糖构型的任何前述双环核苷,包含例如α-L-呋喃核糖和β-D-呋喃核糖(参见WO 99/14226)。
本公开的iRNA剂也可以被修饰以包含一个或多个约束乙基核苷酸。如本文所使用的,“约束乙基核苷酸”或“cEt”为包括包含4′-CH(CH
本发明的iRNA还可以包含一个或多个“构象限制性核苷酸”(“CRN”)。CRN是具有连接核糖的C2′和C4′碳或核糖的CFB和-C5′碳的接头的核苷酸类似物。CRN将核糖环锁定为稳定的构象,并且增加对mRNA的杂交亲和力。接头具有足够的长度以将氧放置在稳定性和亲和力的最佳位置,从而导致较少的核糖环褶皱。
教导制备上述CRN的某些代表性公开出版物包括但不限于US2013/0190383;和WO2013/036868,其各自的全部内容通过引用并入本文。
在一些实施方案中,本发明的iRNA包括一种或多种为UNA(解锁核酸)核苷酸的单体。UNA是未锁定的无环核酸,其中糖的任何键都已被去除,形成未锁定的“糖”残基。在一个实例中,UNA还涵盖C1′-C4′之间的键已被去除的单体(即C1′与C4′碳之间的共价碳-氧-碳键)。在另一个实例中,糖的C2′-C3′键(即C2′与C3′碳之间的共价碳-碳键)已被去除(参见Nuc.Acids Symp.Series,52,133-134(2008)和Fluiter等人,Mol.Biosyst.,2009,10,1039,特此通过引用并入)。
教导UNA制备的代表性美国公开包括但不限于US8,314,227;和US2013/0096289;US2013/0011922;和US2011/0313020,其各自的全部内容通过引用并入本文。
对RNA分子末端的潜在稳定修饰可以包含N-(乙酰氨基己酰基)-4-羟脯氨醇(Hyp-C6-NHAc)、N-(己酰基-4-羟脯氨醇)(Hyp-C6)、N-(乙酰基-4-羟脯氨醇)(Hyp-NHAc)、胸苷-2′-O-脱氧胸苷(醚)、N-(氨基己酰基)-4-羟脯氨醇(Hyp-C6-氨基)、2-二十二烷酰基-尿苷-3′-磷酸酯、反向2′-脱氧修饰的核糖核苷酸,如反向dT(idT)、反向dA(idA)和反向无碱基2′-脱氧核糖核苷酸(iAb)等。此修饰的公开内容可以在WO 2011/005861中找到。
在一个实例中,寡核苷酸的3′或5′末端与反向2′-脱氧修饰的核糖核苷酸连接,如反向dT(idT)、反向dA(idA)或反向无碱基2′-脱氧核糖核苷酸(iAb)。在一个特定实例中,反向2′-脱氧修饰的核糖核苷酸与寡核苷酸的3′端连接,如本文所描述的有义链的3′端,其中连接是通过3′-3′磷酸二酯键或3′-3′-硫代磷酸酯键。
在另一个实例中,有义链的3′端通过3′-3′-硫代磷酸酯键与反向无碱基核糖核苷酸(iAb)连接。在另一个实例中,有义链的3′端通过3′-3′-硫代磷酸酯键与反向dA(idA)连接。
在一个特定实例中,反向2′-脱氧修饰的核糖核苷酸与寡核苷酸的3′端连接,如本文所描述的有义链的3′端,其中连接是通过3′-3′磷酸二酯键或3′-3′-硫代磷酸酯键。
在另一个实例中,有义链的3′末端核苷酸是反向dA(idA),并且通过3′-3′-键(例如,3′-3′-硫代磷酸酯键)与前述核苷酸连接。
本发明的iRNA的核苷酸的其他修饰包括5′磷酸酯或5′磷酸酯模拟物,例如iRNA的反义链上的5′-末端磷酸酯或磷酸酯模拟物。合适的磷酸酯模拟物在例如US2012/0157511中公开,其全部内容通过引用并入本文。
A.包含本发明的基序的修饰的iRNA
在本发明的某些方面,本发明的双链RNA剂包含具有化学修饰的药剂,如在例如WO2013/075035中公开的,所述文献中的每一个的全部内容通过引用并入本文。如本文和WO2013/075035所示,通过将在三个连续核苷酸上具有三个相同修饰的一个或多个基序引入dsRNAi剂的有义链或反义链,特别是在切割位点处或附近,可以获得优异的结果。在一些实施方案中,dsRNAi剂的有义链和反义链可以以其它方式被完全修饰。这些基序的引入中断了有义或反义链的修饰模式(如果存在的话)。dsRNAi剂可以任选地与GalNAc衍生物配体缀合,例如在有义链上。
更具体地,当双链RNA剂的有义链和反义链被完全修饰为在dsRNAi剂的至少一条链的切割位点处或附近的三个连续核苷酸上具有三个相同修饰的一个或多个基序时,观察到dsRNAi剂的基因沉默活性。
因此,本发明提供了能够在体内抑制靶基因(即,CFB基因)的表达的双链RNA剂。RNAi剂包括有义链和反义链。RNAi剂的每条链可以是,例如,长度为17个至30个核苷酸、长度为25个至30个核苷酸、长度为27个至30个核苷酸、长度为19个至25个核苷酸、长度为19个至23个核苷酸、长度为19个至21个核苷酸、长度为21个至25个核苷酸或长度为21个至23个核苷酸。
有义链和反义链通常形成双链体双链RNA(“dsRNA”),本文也称为“dsRNAi剂”。dsRNAi剂的双链体区可以是,例如,双链体区的长度可以为27个至30个核苷酸对、长度为19个至25个核苷酸对、长度为19个至23个核苷酸对、长度为19个至21个核苷酸对、长度为21个至25个核苷酸对或长度为21个至23个核苷酸对。在另一个实例中,双链体区的长度选自19个、20个、21个、22个、23个、24个、25个、26个和27个核苷酸。
在某些实施例中,dsRNAi剂可以在一条或两条链的3′端、5′端或两端含有一个或多个突出端区或封端基团。突出端的长度可以独立地为1个至6个核苷酸,例如长度为2个至6个核苷酸、长度为1个至5个核苷酸、长度为2个至5个核苷酸、长度为1个至4个核苷酸、长度为2个至4个核苷酸、长度为1个至3个核苷酸、长度为2个至3个核苷酸或长度为1个至2个核苷酸。在某些实施例中,突出端区可以包含如上提供的延伸的突出端区。突出端可以是一条链比另一条链长的结果,或是两条相同长度的链交错的结果。突出端可以与靶mRNA形成错配,或其可以与被靶向的基因序列互补,或可以是另一个序列。第一链和第二链也可以连接,例如通过另外的碱基形成发夹,或通过其它非碱基接头。
在某些实施例中,dsRNAi剂的突出端区中的核苷酸可以各自独立地是修饰或未修饰的核苷酸,包含但不限于2′-糖修饰的,如2′-F、2′-O-甲基、胸苷(T)、2`-O-甲氧基乙基-5-甲基尿苷(Teo)、2`-O-甲氧基乙基腺苷(Aeo)、2`-O-甲氧基乙基-5-甲基胞苷(m5Ceo)以及其任何组合。
例如,TT可以是任一条链上任一端的突出端序列。突出端可以与靶mRNA形成错配,或其可以与被靶向的基因序列互补,或可以是另一个序列。
dsRNAi剂的有义链、反义链或两条链上的5′-或3′-突出端可以被磷酸化。在一些实施方案中,突出端区含有在两个核苷酸之间具有硫代磷酸酯的两个核苷酸,其中两个核苷酸可以是相同的或不同的。在一些实施方案中,突出端存在于有义链、反义链或两条链的3′端处。在一些实施方案中,这种3′-突出端存在于反义链中。在一些实施方案中,这种3′-突出端存在于有义链中。
RNAi剂可只含有单个突出端,这可以增强RNAi的干扰活性,而不会影响其整体稳定性。例如,单链突出端可以位于有义链的3′端处,或可替代地,位于反义链的3′端处。RNAi也可能具有平端,位于反义链的5′端(即,有义链的3′端)处,反之亦然。通常,dsRNAi剂的反义链在3′端处有核苷酸突出端,并且5′端是钝的。虽然不希望受理论的束缚,但反义链5′端的不对称钝端和反义链3′端突出端有利于引导链装载到RISC过程中。
在某些实施方案中,dsRNAi剂是长度为19个核苷酸的双端钝化剂,其中所述有义链在从5′端开始的位置7、8和9处的三个连续核苷酸上含有三个2′-F修饰的至少一个基序。反义链在从5′端开始的位置11、12和13处的三个连续核苷酸上含有三个2′-O-甲基修饰的至少一个基序。
在其它实施方案中,dsRNAi剂是长度为20个核苷酸的双端钝化剂,其中所述有义链在从5′端开始的位置8、9和10处的三个连续核苷酸上含有三个2′-F修饰的至少一个基序。反义链在从5′端开始的位置11、12和13处的三个连续核苷酸上含有三个2′-O-甲基修饰的至少一个基序。
还在其它实施方案中,dsRNAi剂是长度为21个核苷酸的双端钝化剂,其中所述有义链在从5′端开始的位置9、10、11处的三个连续核苷酸上含有三个2′-F修饰的至少一个基序。反义链在从5′端开始的位置11、12和13处的三个连续核苷酸上含有三个2′-O-甲基修饰的至少一个基序。
在某些实施例中,dsRNAi剂包括21个核苷酸的有义链和23个核苷酸的反义链,其中所述有义链在从5′端开始的位置9、10和11处的三个连续核苷酸上含有三个2′-F修饰的至少一个基序;所述反义链在从5′端开始的位置11、12和13处的三个连续核苷酸上含有三个2′-O-甲基修饰的至少一个基序,其中所述RNAi剂的一端是钝的,而另一端包括2核苷酸突出端。在一个实施方案中,2核苷酸突出端位于反义链的3′端处。
当2核苷酸突出端位于反义链的3′端处时,在末端三个核苷酸之间可能存在两个硫代磷酸酯核苷酸间键,其中所述三个核苷酸中的两个是突出端核苷酸,并且第三个核苷酸是紧挨着突出端核苷酸的配对核苷酸。在一个实施方案中,RNAi剂在有义链的5′端和反义链的5′端两者的末端三个核苷酸之间另外具有两个硫代磷酸酯核苷酸间键。在某些实施例中,dsRNAi剂的有义链和反义链中的每个核苷酸,包含为基序一部分的核苷酸,都是修饰的核苷酸。在某些实施例中,每个残基用2′-O-甲基或2′-氟独立地修饰,例如在交替的基序中。任选地,dsRNAi剂进一步包括配体(如GalNAc)。
在某些实施方案中,dsRNAi剂包括有义链和反义链,其中所述有义链的长度为25个至30个核苷酸残基,其中从第一链的5′末端核苷酸(位置1)位置1至23开始,包括至少8个核糖核苷酸;反义链的长度为36个至66个核苷酸残基,并且从3′末端核苷酸开始,在与有义链的位置1至23配对以形成双链体的位置中包括至少8个核糖核苷酸;其中至少反义链的3′末端核苷酸与有义链不配对,并且至多6个连续3′末端核苷酸与有义链不配对,由此形成1个至6个核苷酸的3′单链突出端;其中反义链的5′末端包括10个至30个与有义链不配对的连续核苷酸,由此形成10个至30个核苷酸单链5′突出端;其中当有义链和反义链比对以获得最大互补性时,至少有义链5′末端和3′末端核苷酸与反义链的核苷酸碱基配对,由此在有义链与反义链之间形成基本上双链的区域;并且反义链沿着反义链长度的至少19个核糖核苷酸与靶RNA充分互补,以在将双链核酸引入哺乳动物细胞时减少靶基因表达;并且其中所述有义链含有在三个连续核苷酸上的三个2′-F修饰的至少一个基序,其中至少一个所述基序出现在切割位点处或附近。反义链在切割位点处或其附近的三个连续核苷酸上含有三个2′-O-甲基修饰的至少一个基序。
在某些实施方案中,dsRNAi剂包括有义链和反义链,其中dsRNAi剂包括长度为至少25个和最多29个核苷酸的第一链和长度为最多30个核苷酸的第二链,在从5′端起的位置11、12和13处的三个连续核苷酸上具有三个2′-O-甲基修饰的至少一个基序;其中所述第一链的3′端和所述第二链的5′端形成钝端,并且所述第二链在其3′端处比所述第一链长1个至4个核苷酸,其中所述双链体区的长度为至少25个核苷酸,并且所述第二链沿着所述第二链长度的至少19个核苷酸与靶mRNA充分互补,以在将所述RNAi剂引入哺乳动物细胞中时减少靶基因表达,并且其中所述dsRNAi剂的Dicer切割产生包括所述第二链的3′端的siRNA,由此减少所述靶基因在哺乳动物中的表达。任选地,dsRNAi剂进一步包括配体。
在某些实施方案中,dsRNAi剂的有义链含有在三个连续核苷酸上的三个相同修饰的至少一个基序,其中一个基序出现在有义链中的切割位点处。
在某些实施方案中,dsRNAi剂的反义链也可以含有在三个连续核苷酸上的三个相同修饰的至少一个基序,其中一个基序出现在反义链中的切割位点处或附近。
对于具有长度为19个至23个核苷酸的双链体区的dsRNAi剂,反义链的切割位点通常在距离5′端的10、11和12位置附近。因此,三个相同修饰的基序可以出现在反义链的9、10和11位置;10、11和12位置;11、12和13位置;12、13和14位置;或13、14和15个位置,计数从反义链的5′端的第一个核苷酸开始,或计数从反义链的5′端双链体区内的第一个配对核苷酸开始。反义链中的切割位点也可以根据dsRNAi剂的双链体区从5′端开始的长度而改变。
dsRNAi剂的有义链可以在链的切割位点处的三个连续核苷酸上含有三个相同修饰的至少一个基序;并且反义链可以在链的切割位点处或附近的三个连续核苷酸上具有三个相同修饰的至少一个基序。当有义链和反义链形成dsRNA双链体时,有义链与反义链可以如此排列,使得有义链上的三个核苷酸的一个基序与反义链上的三个核苷酸的一个基序具有至少一个核苷酸重叠,即有义链中的基序的三个核苷酸中的至少一个与反义链中基序的三个核苷酸中的至少一个形成碱基对。可替代地,至少两个核苷酸可以重叠,或所有三个核苷酸都可以重叠。
在一些实施方案中,dsRNAi剂的有义链可以含有在三个连续核苷酸上的三个相同修饰的多于一个的基序。第一个基序可以出现在链的切割位点处或附近,并且其它基序可以是翼修饰。本文中的术语“翼修饰”是指出现在链的另一部分处的基序,所述部分在同一链的切割位点处或附近与基序分离。翼修饰要么与第一基序相邻,或被至少一个或多个核苷酸分开。当基序彼此紧邻时,则基序的化学性质彼此不同,并且当基序由一个或多个核苷酸分开时,化学性质可以相同或不同。可能存在两个或更多个翼修饰。例如,当存在两个翼修饰时,每个翼修饰可以出现在相对于第一基序的一端,所述第一基序位于切割位点处或附近,或在前导基序的任一侧。
与有义链一样,dsRNAi剂的反义链可以含有在三个连续核苷酸上的三个相同修饰的多于一个基序,其中至少一个基序出现在链的切割位点处或附近。此反义链还可以含有与可能存在于有义链上的翼修饰相似的排列的一个或多个翼修饰。
在一些实施方案中,dsRNAi剂的有义链或反义链上的翼修饰通常不包含链的3′端、5′端或两端处的第一个或前两个末端核苷酸。
在其它实施方案中,dsRNAi剂的有义链或反义链上的翼修饰通常不包含链的3′端、5′端或两端处双链体区内的第一个或前两个配对核苷酸。
当dsRNAi剂的有义链和反义链各自含有至少一个翼修饰时,翼修饰可以落在双链体区的同一端,并且具有一个、两个或三个核苷酸的重叠。
当dsRNAi剂的有义链和反义链各自含有至少两个翼修饰时,有义链和反义链可以如此排列,使得各自来自一条链的两个修饰落在双链体区的一端,具有一个、两个或三个核苷酸的重叠;各自来自一条链的两个修饰落在双链体区的另一端,具有一个、两个或三个核苷酸的重叠;两个修饰一条链落在前导基序的每一侧,在双链体区中具有一个、两个或三个核苷酸的重叠。
在一些实施方案中,dsRNAi剂的有义链和反义链中的每个核苷酸,包含为基序一部分的核苷酸,可以是修饰的。每个核苷酸可以用相同或不同的修饰进行修饰,所述修饰可以包含一个或两个非连接磷酸酯氧或一个或多个连接磷酸酯氧的一种或多种改变;核糖的成分的改变,例如,核糖上的2′-羟基的改变;用“去磷酸”接头大规模取代磷酸酯部分;天然存在的碱基的修饰或替换;以及核糖-磷酸酯主链的替换或修饰。
由于核酸是亚基的聚合物,许多修饰发生在核酸内重复的位置,例如碱基或磷酸酯部分的修饰,或磷酸酯部分的非连接O。在一些情况下,修饰将发生在核酸中的所有主体位置,但在许多情况下不会。例如,修饰可以仅发生在3′-或5′末端位置,可以仅发生于末端区域,例如,在末端核苷酸上的位置处或在链的最后2个、3个、4个、5个或10个核苷酸中。修饰可以发生在双链区、单链区或两者中。修饰可以只发生在RNA的双链区中,或可以只发生于RNA的单链区中。例如,非连接O位置处的硫代磷酸酯修饰可以仅发生在一个或两个末端处,可以仅发生于末端区中,例如,在末端核苷酸上的位置处或在链的最后2个、3个、4个、5个或10个核苷酸中,或可以发生在双链和单链区中,特别是在末端处。一个或多个5′端可以被磷酸化。
例如,为增强稳定性,可以在突出端中包含特定的碱基,或在单链突出端中,例如在5′-或3′-突出端中或在两者中包含修饰的核苷酸或核苷酸替代物。例如,在突出端中包含嘌呤核苷酸是期望的。在一些实施方案中,3′-或5′-突出端中的所有或一些碱基可以被修饰,例如,通过本文所描述的修饰。修饰可以包含,例如使用本领域已知的修饰在核糖糖的2′位置处的修饰,例如,用脱氧核糖核苷酸、2′-脱氧-2′-氟(2′-F)或2′-O-甲基修饰代替核碱基的核糖,以及磷酸酯基团的修饰,例如硫代磷酸酯修饰。突出端不需要与靶序列同源。
在一些实施方案中,有义链和反义链的每个残基独立地用LNA、CRN、cET、UNA、HNA、CeNA、2′-甲氧基乙基、2′-O-甲基、2′-O-烯丙基、2′-C-烯丙基、2′-脱氧、2′-羟基或2′-氟修饰。链可以含有多于一种修饰。在一个实施方案中,有义链和反义链的每个残基独立地用2′-O-甲基或2′-氟修饰。
在有义链和反义链上通常存在至少两种不同的修饰。这两种修饰可以是2′-O-甲基或2′-氟修饰,或其它修饰。
在某些实施方案中,N
包含在交替基序中的修饰的类型可以是相同的或不同的。例如,如果A、B、C、D各自表示核苷酸上的一种修饰类型,则交替模式,即每隔一个核苷酸上的修饰可以是相同的,但每个有义链或反义链可以选自交替基序内的若干种修饰可能性,如“ABABAB...”、“ACACAC...”、“BDBDBD...”或“CDCDCD...”等。
在一些实施方案中,本发明的dsRNAi剂包括相对于反义链上的交替基序的修饰模式,有义链上交替基序的修饰模式发生了偏移。所述偏移可以使得有义链的核苷酸的修饰的基团对应于反义链的核苷酸的不同修饰的基团,并且反之亦然。例如,有义链当与dsRNA双链体中的反义链配对时,有义链中的交替基序可以从链的5′到3′以“ABABAB”开始,并且反义链中的交替基序可以在双链体区内从链的5′到3′以“BABABA”开始。作为另一个实例,有义链中的交替基序可以从链的5′到3′以“AABBAABB”开始,并且反义链中的交替基序在双链体区内可以从链5′到3′以“BBAABBAA”开始,因此在有义链与反义链之间存在修饰模式的完全或部分转移。
在一个具体实例中,有义链中的交替基序是该链的5′-3′的“ABABAB”,其中每个A是未修饰的核糖核苷酸并且每个B是2′-甲基修饰的核苷酸。
在一个具体实例中,有义链中的交替基序是该链的5′-3′的“ABABAB”,其中每个A是2′-脱氧-2′-氟修饰的核苷酸并且每个B是2′-甲基修饰的核苷酸。
在另一个具体实例中,反义链中的交替基序是链的3′-5′的“BABABA”,其中每个A是2′-脱氧-2′-氟修饰的核苷酸并且每个B是2′-甲基修饰的核苷酸。
在一个具体实例中,有义链中的交替基序是链的5′-3′的“ABABAB”,且反义链中的交替基序是链的3′-5′的“BABABA”,其中每个A是未修饰的核糖核苷酸,和每个B是2′-甲基修饰的核苷酸。
在一个具体实例中,有义链中的交替基序是链5′-3′的“ABABAB”,且反义链中的交替基序是链3′-5′的“BABABA”,其中每个A是2′-脱氧-2′-氟修饰的核苷酸,并且每个B是2′-甲基修饰的核苷酸。
在一些实施方案中,dsRNAi剂包括2′-O-甲基修饰和2′-F修饰的交替基序在有义链上的模式最初相对于反义链上2′-O-甲基修饰和2′-F修饰的交替基序的模式具有偏移,即有义链碱基上的2′-O-甲基修饰的核苷酸与反义链上的2′-F修饰的核苷酸配对,并且反之亦然。有义链的1位置可以从2′-F修饰开始,并且反义链的1位置可以从2′-O-甲基修饰开始。
将在三个连续核苷酸上的三个相同修饰的一个或多个基序引入有义链或反义链中断了存在于有义链或者反义链中的初始修饰模式。通过将在三个连续核苷酸上的三个相同修饰的一个或多个基序引入有义链或反义链来中断有义链或反义链的修饰模式,可以增强针对靶基因的基因沉默活性。
在一些实施方案中,当三个连续核苷酸上的三个相同修饰的基序被引入任何链时,基序旁边的核苷酸的修饰是与基序的修饰不同的修饰。例如,含有基序的序列部分是“...N
iRNA可以进一步包括至少一个硫代磷酸酯或甲基膦酸酯核苷酸间键。硫代磷酸酯或甲基膦酸酯核苷酸间键修饰可以发生在链的任何位置中的有义链、反义链或两条链的任何核苷酸上。例如,核苷酸间键修饰可以发生在有义链或反义链上的每个核苷酸上;每个核苷酸间键修饰可以在有义链或反义链上以交替模式发生;或有义链或反义链可以以交替模式含有两种核苷酸间键修饰。有义链上的核苷酸间键修饰的交替模式可以与反义链相同或不同,并且有义链上核苷酸间键修饰的交替模式可以相对于反义链上核苷酸间键的交替模式具有偏移。在一个实施方案中,双链RNAi剂包括6个至8个硫代磷酸酯核苷酸间键。在一些实施方案中,反义链在5′端处包括两个硫代磷酸酯核苷酸间键,并且在3′端处包括两个硫代磷酸酯核酸间键,并且有义链在5′端或3′端处包括至少两个硫代磷酸酯核苷酸间键。
在一些实施方案中,dsRNAi剂包括突出端区中的硫代磷酸酯或甲基膦酸酯核苷酸间键修饰。例如,突出端区可以含有两个核苷酸,所述两个核苷酸之间具有硫代磷酸酯或甲基膦酸酯核苷酸间键。还可以进行核苷酸间键修饰,以将突出端核苷酸与双链体区内的末端配对核苷酸连接。例如,至少2个、3个、4个或所有突出端核苷酸可以通过硫代磷酸酯或甲基膦酸酯核苷酸间键连接,并且任选地,可以存在另外的硫代磷酸酯或甲基膦酸酯核酸间连接,将突出端核苷酸与紧挨着突出端核苷酸的配对核苷酸连接。例如,在末端三个核苷酸之间可能存在至少两个硫代磷酸酯核苷酸间键,其中三个核苷酸中的两个是突出端核苷酸,并且第三个是与突出端核苷酸相邻的配对核苷酸。这些末端三个核苷酸可以位于反义链的3′端、有义链的3′端、反义链5′端或反义链5′端。
在一些实施方案中,2-核苷酸突出端位于反义链的3′端处时,并且在末端三个核苷酸之间有两个硫代磷酸核苷酸间键,其中所述三个核苷酸中的两个是突出端核苷酸,并且第三个核苷酸是紧挨着突出端核苷酸的配对核苷酸。任选地,dsRNAi剂在有义链的5′端和反义链的5′端两者的末端三个核苷酸之间可以另外具有两个硫代磷酸核苷酸间键。
在一个实施方案中,dsRNAi剂包括与靶标、在双链体内或其组合的错配。所述错配可能发生在突出端区或双链体区中。碱基对可以基于其促进解离或熔化的倾向进行排序(例如,根据特定配对的缔合或离解的自由能,最简单的方法是在单个配对的基础上检查配对,尽管也可以使用下一个临近点或类似分析)。在促进解离方面:A∶U优于G∶C;G∶U优于G∶C;并且I∶C优于G∶C(I=肌苷)。错配,例如非规范或规范外配对(如本文其它地方所述)优于规范(A∶T、A∶U、G∶C)配对;并且包含通用碱基的配对优于规范配对。
在某些实施方案中,dsRNAi剂在反义链5′端的双链体区内包括前1个、2个、3个、4个或5个碱基对中的至少一个,所述双链体区独立地选自:A∶U、G∶U、I∶C和错配对,例如非规范或规范外配对或包含通用碱基的配对,以促进双链体的5′端处反义链的解离。
在某些实施方案中,反义链中从5′端开始的双链体区内1位置处的核苷酸选自A、dA、dU、U和dT。可替代地,从反义链的5′端开始的双链体区内的前1个、2个或3个碱基对中的至少一个是AU碱基对。例如,从反义链5′端起的双链体区内的第一个碱基对是AU碱基对。
在其它实施方案中,有义链的3′端处的核苷酸是脱氧胸腺嘧啶(dT),或反义链的3′端处的核苷酸是脱氧胸腺嘧啶(dT)。例如,存在脱氧胸腺嘧啶核苷酸的短序列,例如,在有义链、反义链或两条链的3′端上有两个dT核苷酸。
在某些实施方案中,有义链序列可以由式(I)表示:
5′n
其中:
i和j各自独立地为0或1;
p和q各自独立地为0至6;
每个N
每个N
每个n
其中Nb和Y不具有相同的修饰;并且
XXX、YYY和ZZZ各自独立地表示在三个连续核苷酸上的三个相同修饰的一个基序。在一个实施方案中,YYY是所有2′-F修饰的核苷酸。
在一些实施方案中,N
在一些实施方案中,YYY基序出现在有义链的切割位点处或附近。例如,当dsRNAi剂具有长度为17个至23个核苷酸的双链体区时,YYY基序可以出现在有义链的切割位点处或附近(例如,可以出现在位置6、7、8;7、8、9;8、9、10;9、10、11;10、11、12;或11、12、13处),计数从第一个核苷酸开始,从5′端开始;或任选地,计数从5′端开始,从双链体区内的第一配对核苷酸开始。
在一个实施方案中,i是1并且j是0,或者i是0并且j是1,或i和j两者都是1。因此,有义链可以由下式表示:
5′n
5′n
5′n
当有义链由式(Ib)表示时,N
当有义链表示为式(Ic)时,N
当有义链表示为式(Id)时,每个N
X、Y和Z中的每一个可以彼此相同或不同。
在其它实施方案中,i是0并且j是0,并且有义链可以由下式表示:
5′n
当有义链由式(Ia)表示时,每个N
在一个实施方案中,RNAi的反义链序列可以由式(II)表示:
5′n
其中:
k和l各自独立地为0或1;
p′和q′各自独立地为0至6;
每个N
每个N
每个n
其中N
X′X′X′、Y′Y′Y′和Z′Z′Z′各自独立地表示在三个连续核苷酸上的三个相同修饰的一个基序。
在一些实施方案中,N
Y′Y′Y′基序出现在反义链的切割位点处或附近。例如,当dsRNAi剂具有长度为17个至23个核苷酸的双链体区时,Y′Y′Y′基序可以出现在反义链的位置9、10、11;10、11、12;11、12、13;12、13、14;或13、14、15处,计数从第一个核苷酸开始,从5′端开始;或任选地,计数从5′端开始,从双链体区内的第一配对核苷酸开始。在一个实施方案中,Y′Y′Y′基序出现在位置11、12、13处。
在某些实施方案中,Y′Y′Y′基序全部是2′-OMe修饰的核苷酸。
在某些实施方案中,k是1并且l是0,或k是0并且l是1,或k和l两者都是1。
因此,反义链可以由下式表示:
5′n
5′n
5′n
当反义链表示由式(IIb)表示时,N
当反义链表示为式(IIc)时,N
当反义链表示为式(IId)时,每个N
在其它实施方案中,k是0并且l是0,并且反义链可以由下式表示:
5′n
当反义链表示为式(IIa)时,每个N
X′、Y′和Z′中的每一个可以彼此相同或不同。
有义链和反义链的每个核苷酸可以独立地用LNA、CRN、UNA、cEt、二醇核酸(GNA)、己糖醇核酸(HNA)、CeNA、2′-甲氧基乙基、2′-O-甲基、2′-O-烯丙基、2′-C-烯丙基、2′-羟基或2′-氟修饰。例如,有义链和反义链的每个核苷酸独立地用2′-O-甲基或2′-氟修饰。具体地,每个X、Y、Z、X′、Y′和Z′可以表示2′-O-甲基修饰或2′-氟修饰。
在一些实施方案中,当双链体区为21nt时,dsRNAi剂的有义链可以含有出现在链的9、10和11位置处的YYY基序,计数从5′端的第一个核苷酸开始,或任选地,计数从5′端的双链体区内的第一配对核苷酸开始;并且Y表示2′-F修饰。有义链可以另外含有XXX基序或ZZZ基序作为在双链体区的相对端处的翼修饰;并且XXX和ZZZ各自独立地表示2′-OMe修饰或2′-F修饰。
在一些实施方案中,反义链可以含有出现在链的11、12、13位处的Y′Y′Y′基序,计数从5′端的第一核苷酸开始,或任选地,计数从5′端的双链体区内的第一配对核苷酸开始;并且Y表示2′-O-甲基修饰。反义链可以另外含有X′X′X′基序或Z′Z′Z′基序作为在双链体区的相对端处的翼修饰;并且X′X′X′和Z′Z′Z′各自独立地表示2′-OMe修饰或2′-F修饰。
由上述式(Ia)、(Ib)、(Ic)和(Id)中的任一个表示的有义链与分别由式(IIa)、(IIb)、(IIc)和(IId)中的任一个表示的反义链形成双链体。
因此,用于本发明方法的dsRNAi剂可以包括有义链和反义链,每条链具有14个至30个核苷酸,iRNA双链体由式(III)表示:
有义:5′n
反义:3′n
其中:
i、j、k和l各自独立地为0或1;
p、p′、q和q′各自独立地为0至6;
每个N
每个N
其中每个可能存在或不存在的n
XXX、YYY、ZZZ、X′X′X′、Y′Y′Y′和Z′Z′Z′各自独立地表示在三个连续核苷酸上的三个相同修饰的一个基序。
在一个实施方案中,i是0并且j是0;或i是1并且j是0;或i是0并且j是1;或i和j两者都是0;或i和j两者都是1。在另一个实施例中,k是0并且l是0;或k是1并且l是0;k是0并且l是1;或k和l两者都是0;或k和l两者都是1。
形成iRNA双链体的有义链和反义链的示例性组合包含下式:
5′n
3′n
5′n
3′n
5′n
3′n
5′n
3′n
当dsRNAi剂由式(IIIa)表示时,每个N
当dsRNAi剂由式(IIIb)表示时,每个N
当dsRNAi剂表示为式(IIIc)时,每个N
当dsRNAi剂表示为式(IIId)时,每个N
式(III)、(IIIa)、(IIIb)、(IIIc)和(IIId)中的X、Y和Z中的每一个可以彼此相同或不同。
当dsRNAi剂由式(III)、(IIIa)、(IIIb)、(IIIc)和(IIId)表示时,至少一个Y核苷酸可以与至少一个Y′核苷酸形成碱基对。可替代地,至少两个Y核苷酸与对应的Y′核苷酸形成碱基对;或所有三个Y核苷酸都与相应的Y′核苷酸形成碱基对。
当dsRNAi剂由式(IIIb)或(IIId)表示时,至少一个Z核苷酸可以与一个Z′核苷酸形成碱基对。可替代地,至少两个Z核苷酸与对应的Z′核苷酸形成碱基对;或所有三个Z核苷酸都与相应的Z′核苷酸形成碱基对。
当dsRNAi剂表示为式(IIIc)或(IIId)时,至少一个X核苷酸可以与一个X′核苷酸形成碱基对。可替代地,至少两个X核苷酸与对应的X′核苷酸形成碱基对;或所有三个X核苷酸都与相应的X′核苷酸形成碱基对。
在某些实施方案中,Y核苷酸上的修饰不同于Y′核苷酸上的修饰,Z核苷酸上的修饰不同于Z′核苷酸上的修饰,或X核苷酸上的修饰不同于X′核苷酸上的修饰。
在某些实施方案中,当dsRNAi剂由式(IIId)表示时,N
在一些实施方案中,当dsRNAi剂由式(IIIa)表示时,N
在一些实施方案中,dsRNAi剂是含有至少两个由式(III)、(IIIa)、(IIIb)、(IIIc)和(IIId)表示的双链体的多聚体,其中所述双链体通过接头连接。接头可以是可切割的或不可切割的。任选地,多聚体进一步包括配体。每个双链体可以靶向相同的基因或两个不同的基因;或每个双链体可以靶向两个不同的靶位点处的相同的基因。
在一些实施方案中,所述dsRNAi剂是含有由式(III),(IIIa),(IIIb),(IIIc)和(IIId)表示的三个,四个,五个,六个或更多个双链体的多聚体,其中所述双链体通过接头连接。接头可以是可切割的或不可切割的。任选地,多聚体还包含配体。每个双链体可以靶向相同的基因或两种不同的基因;或者,每个双链体可以在两个不同的靶位点处靶向相同的基因。
在一个实施方案中,由式(III),(IIIa),(IIIb),(IIIc)和(IIId)中的至少一个表示的两种dsRNAi剂在5′端和3′端中的一个或两个处彼此连接,并且任选地缀合至配体。每种试剂可以靶向相同的基因或两种不同的基因;或者每种试剂可以在两个不同的靶位点靶向相同的基因。
在某些实施方案中,本发明的RNAi剂可以含有低数目的含有2′-氟修饰的核苷酸,例如10个或更少的具有2′-氟修饰的核苷酸。例如,该RNAi剂可以包含具有2′-氟修饰的10,9,8,7,6,5,4,3,2,1或0个核苷酸。在一个具体实施例中,本发明的RNAi剂包含10个具有2′-氟修饰的核苷酸,例如在有义链中具有2′-氟修饰的4个核苷酸和在反义链中具有2′-氟修饰的6个核苷酸。在另一个具体实施例中,本发明的RNAi剂包含6个具有2′-氟修饰的核苷酸,例如在有义链中具有2′-氟修饰的4个核苷酸和在反义链中具有2′-氟修饰的2个核苷酸。
在其他实施方案中,本发明的RNAi剂可以含有超低数目的含有2′-氟修饰的核苷酸,例如2个或更少的含有2′-氟修饰的核苷酸。例如,该RNAi剂可以包含具有2′-氟修饰的2,1或0个核苷酸。在一个具体实施例中,该RNAi剂可以包含2个具有2′-氟修饰的核苷酸,例如,在有义链中具有2-氟修饰的0个核苷酸和在反义链中具有2′-氟修饰的2个核苷酸。
各种出版物描述了可用于本发明方法的多聚体iRNA。此类出版物包括WO2007/091269,美国专利No.7,858,769,WO2010/141511,WO2007/117686,WO2009/014887和WO2011/031520,其各自的全部内容通过引用并入本文。
在某些实施方案中,本公开的组合物和方法包含如本文所描述的RNAi剂的膦酸乙烯酯(VP)修饰。在示例性实施例中,本公开的5′乙烯基膦酸酯修饰的核苷酸具有以下结构:
其中X是O或S;
R是氢、羟基、氟或C
R
B是核碱基或经修饰的核碱基,任选地其中B是腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶或尿嘧啶。
在一个实施方案中,R
本公开的膦酸乙烯酯可以与本公开的dsRNA的反义链或有义链连接。在某些实施方案中,本公开的膦酸乙烯酯与dsRNA的反义链连接,任选地在dsRNA反义链的5′端处。
膦酸乙烯酯修饰也设想用于本公开的组合物和方法。示例性乙烯基膦酸酯结构包含前述结构,其中R5′是=C(H)-OP(O)(OH)2,并且C5′碳与R5′之间的双键处于E或Z取向(例如,E取向)。
如下文更详细描述的,含有一个或多个碳水化合物部分与iRNA的缀合的iRNA可以优化iRNA的一个或多个特性。在许多情况下,碳水化合物部分将与iRNA的经修饰的亚基连接。例如,iRNA的一个或多个核糖核苷酸亚基的核糖糖可以被另一个部分替代,例如,与碳水化合物配体连接的非碳水化合物(如环状)载体。其中亚基的核糖糖已经被如此替代的核糖核苷酸亚基在本文中被称为核糖替代修饰亚基(RRMS)。环状载体可以是碳环系统,即所有环原子都是碳原子,或杂环系统,即一个或多个环原子可以是杂原子,例如氮、氧、硫。环状载体可以是单环系统,或可以含有两个或多个环,例如稠环。环状载体可以是完全饱和的环系统,或其可以含有一个或多个双键。
配体可以通过载体与多核苷酸连接。载体包含(i)至少一个“主链连接点”,如两个“骨干连接点”以及(ii)至少一个“系链连接点”。如本文所使用的,“主链连接点”是指官能团,例如羟基,或通常是可用于并适合将载体结合到主链中的键,例如核糖核酸的磷酸酯或经修饰的磷酸酯(例如,含硫)主链。在一些实施方案中,“系链连接点”(TAP)是指连接所选部分的环状载体的组成环原子,例如碳原子或杂原子(不同于提供主链连接点的原子)。所述部分可以是例如碳水化合物,例如单糖、二糖、三糖、四糖、寡糖或多糖。任选地,所选择的部分通过中间系链与环状载体连接。因此,环状载体将通常包含官能团,例如氨基,或通常提供适合于另一个化学实体(例如,组成环的配体)的结合或系留的键。
iRNA可以通过载体与配体缀合,其中载体可以是环状基团或无环基团。在一些实施方案中,环状基团选自吡咯烷基、吡唑啉基、吡唑烷基、咪唑啉基、咪唑烷基、哌啶基、哌嗪基、[1,3]二氧戊环、噁唑烷基、异噁唑烷基、吗啉基、噻唑烷基、异噻唑烷基、喹喔啉基、哒嗪壬基、四氢呋喃基和十氢化萘。在一些实施方案中,无环基团是丝氨酸醇主链或二乙醇胺主链。
i.热去稳定修饰
在某些实施方案中,可以通过在反义链的种子区掺入热去稳定修饰来优化dsRNA分子的RNA干扰。如本文所使用的,“种子区”意指参考链的5′端的位置2-9或参考链的5′端的位置2-8。例如,可以将热去稳定修饰掺入反义链的种子区,以减少或抑制脱靶基因沉默。
术语“热去稳定修饰”包含将导致dsRNA的总熔融温度(T
已经发现,具有反义链的dsRNA具有降低脱靶基因沉默活性的作用,所述反义链包括前9个核苷酸位置内的双链体的至少一个热去稳定修饰,从所述反义链的5′端开始计数。因此,在一些实施方案中,反义链在反义链的5′区的前9个核苷酸位置内包括至少一个(例如,一个、两个、三个、四个、五个或更多个)双链体的热去稳定修饰。在一些实施方案中,双链体的一个或多个热去稳定修饰位于从反义链5′端起的位置2至9处,如位置4至8。在一些另外的实施例中,双链体的热去稳定修饰位于从反义链的5′端起的位置6、7或8处。在仍一些另外的实施例中,双链体的热去稳定修饰位于从反义链的5′端起的位置7处。在一些实施方案中,双链体的热去稳定修饰位于从反义链的5′端起的位置2、3、4、5或9处。
热去稳定修饰可以包括但不限于脱碱基修饰;与相对链中的相对核苷酸的错配;和糖修饰如2′-脱氧修饰、无环核苷酸,例如,解锁核酸(UNA)或二醇核酸(GNA);和2′-5′-连接的核糖核苷酸(“3′-RNA”)。
iRNA剂包含有义链和反义链,每条链具有14至40个核苷酸。RNAi剂可以由式(L)表示:
在式(L)中,B1、B2、B3、B1′、B2′、B3′和B4′各自独立地为含有选自由以下组成的组的修饰的核苷酸:2′-O-烷基、2′-取代的烷氧基、2′-取代的烷基、2′-卤基、ENA和BNA/LNA。在一个实施方案中,B1、B2、B3、B1′、B2′、B3′和B4′各自含有2′-OMe修饰。在一个实施方案中,B1、B2、B3、B1′、B2′、B3′和B4′各自含有2′-OMe或2′-F修饰。在一个实施方案中,B1、B2、B3、B1′、B2′、B3′和B4′中的至少一个含有2′-O-N-甲基乙酰氨基(2′-O-NMA)修饰。
C1是一种热不稳定核苷酸,位于与反义链的种子区相对的位点(即位于反义链的5′端的位置2-8处或参考链的5′端的位置2-9处)处。例如,C1位于有义链的一个位置处,所述位置与反义链的5′端的位置2至8处的核苷酸配对。在一个实例中,C1位于从有义链的5′端起的位置15处。C1核苷酸具有热不稳定修饰,所述热不稳定修饰可以包含无碱基修饰;与双链体中的相对核苷酸的错配;以及糖修饰,如2′-脱氧修饰或无环核苷酸,例如解锁核酸(UNA)或甘油核酸(GNA)或2′-5′连接的核糖核苷酸(“3′-RNA”)。在一个实施方案中,C1具有选自由以下组成的组的热不稳定修饰:i)与反义链中的相对核苷酸的错配;ii)选自由以下组成的组的无碱基修饰:
和iii)选自以下的糖修饰:
其中B是经修饰或未修饰的核碱基,R
T1、T1′、T2′和T3′各自独立地表示包括修饰的核苷酸,所述修饰为核苷酸提供小于或等于2′-OMe修饰的空间体积的空间体积。空间体积是指修饰的空间效应的总和。用于确定核苷酸修饰的空间效应的方法是本领域技术人员已知的。修饰可以在核苷酸的核糖糖的2′位置处,或对非核糖核苷酸、无环核苷酸的修饰,或与核糖糖的2′位置相似或等效的核苷酸的主链,并且为核苷酸提供小于或等于2′-OMe修饰的空间体积的空间体积。例如,T1、T1′、T2′和T3′各自独立地选自DNA、RNA、LNA、2′-F和2′-F-5′-甲基。在一个实施方案中,T1是DNA。在一个实施方案中,T1′是DNA、RNA或LNA。在一个实施方案中,T2′是DNA或RNA。在一个实施方案中,T3′是DNA或RNA。
n
n
n
q
n
可替代地,n
在一个实施方案中,n
在一个实施方案中,n
在一个实施方案中,n
在一个实施方案中,当有义链的长度为19个至22个核苷酸,并且n
在一个实施方案中,T3′从反义链的5′端的位置2处开始。在一个实例中,T3′位于从反义链的5′端起的位置2处,并且q
在一个实施方案中,T1′从反义链的5′端的位置14处开始。在一个实例中,T1′位于从反义链的5′端起的位置14处,并且q
在一个示例性实施例中,T3′从反义链的5′端中的位置2开始,并且T1′从反义链的5′端中的位置14开始。在一个实例中,T3′从反义链的5′端中的位置2开始,并且q
在一个实施方案中,T1′和T3′以11个核苷酸的长度分开(即不计数T1′和T3′核苷酸)。
在一个实施方案中,T1′位于从反义链的5′端起的位置14处。在一个实例中,T1′位于从反义链的5′端起的位置14处,并且q
在一个实施方案中,T3′位于从反义链的5′端起的位置2处。在一个实例中,T3′位于从反义链的5′端起的位置2处,并且q
在一个实施方案中,T1位于有义链的切割位点处。在一个实例中,当有义链的长度为19个至22个核苷酸,并且n
在一个实施方案中,T2′从反义链的5′端的位置6处开始。在一个实例中,T2′位于从反义链的5′端起的位置6至10处,并且q
在一个示例性实施例中,当有义链长度为19个至22个核苷酸,并且n
在一个实施方案中,T2′从反义链的5′端的位置8处开始。在一个实例中,T2′从反义链的5′端的位置8开始,并且q
在一个实施方案中,T2′从反义链的5′端的位置9处开始。在一个实例中,T2′位于从反义链的5′端起的位置9处,并且q
在一个实施方案中,B1′是2′-OMe或2′-F,q
在一个实施方案中,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
RNAi剂可以在有义链或反义链的5′端包括含磷基团。5′端含磷基团可以是5′端磷酸酯(5′-P)、5′端硫代磷酸酯(5′-PS)、5-′端硫代磷酸二酯(5′-PS2)、5′端乙烯基膦酸酯(5′-VP)、5′端甲基膦酸酯(MePhos)或5′-脱氧-5′-C-丙二酰
在一个实施方案中,RNAi剂包括在有义链的5′端处的含磷基团。在一个实施方案中,RNAi剂包括在反义链的5′端处的含磷基团。
在一个实施方案中,RNAi剂包括5′-P。在一个实施方案中,RNAi剂包括反义链中的5′-P。
在一个实施方案中,RNAi剂包括5′-PS。在一个实施方案中,RNAi剂包括在反义链中的5′-PS。
在一个实施方案中,RNAi剂包括5′-VP。在一个实施方案中,RNAi剂包括在反义链中的5′-VP。在一个实施方案中,RNAi剂包括在反义链中的5′-E-VP。在一个实施方案中,RNAi剂包括在反义链中的5′-Z-VP。
在一个实施方案中,RNAi剂包括5′-PS2。在一个实施方案中,RNAi剂包括在反义链中的5′-PS2。
在一个实施方案中,RNAi剂包括5′-PS2。在一个实施方案中,RNAi剂包括在反义链中的5′-脱氧-5′-C-丙二酰。
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,5′-VP位于反义链的5′端处,并且靶向配体位于有义链的3′端处。
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个实施方案中,B1是2′-OMe或2′-F,n
在一个具体实施方案中,本发明的RNAi剂包含:
(a)有义链,所述有义链具有:
(i)21个核苷酸的长度;
(ii)与3′端连接的ASGPR配体,其中所述ASGPR配体包括通过三价支链接头连接的三种GalNAc衍生物;以及
(iii)位置1、3、5、7、9至11、13、17、19和21处的2′-F修饰,以及位置2、4、6、8、12、14至16、18和20处的2′-OMe修饰(从5′端开始计数);
以及
(b)反义链,所述反义链具有:
(i)23个核苷酸的长度;
(ii)位置1、3、5、9、11至13、15、17、19、21和23处的2′-OMe修饰,以及位置2、4、6至8、10、14、16、18、20和22处的2′F修饰(从5′端开始计数);以及
(iii)核苷酸位置21与22之间以及核苷酸位置22与23之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
其中dsRNA剂在反义链的3′端处具有两个核苷酸突出端,并且在反义链的5′端处具有钝端。
在另一个特定实施方案中,本发明的RNAi剂包括:
(a)有义链,所述有义链具有:
(i)21个核苷酸的长度;
(ii)与3′端连接的ASGPR配体,其中所述ASGPR配体包括通过三价支链接头连接的三种GalNAc衍生物;
(iii)位置1、3、5、7、9至11,13、15、17、19和21处的2′-F修饰,以及位置2、4、6、8、12、14、16、18和20处的2′-OMe修饰(从5′端开始计数);以及
(iv)核苷酸位置1与2之间以及核苷酸位置2与3之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
以及
(b)反义链,所述反义链具有:
(i)23个核苷酸的长度;
(ii)位置1、3、5、7、9、11至13、15、17、19以及21至23处的2′-OMe修饰,以及位置2、4、6、8、10、14、16、18和20处的2′F修饰(从5′端开始计数);以及
(iii)核苷酸位置1与2之间、核苷酸位置2与3之间、核苷酸位置21与22之间以及核苷酸位置22与23之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
其中RNAi剂在反义链的3′端处具有两个核苷酸突出端,并且在反义链的5′端处具有钝端。
在另一个特定实施方案中,本发明的RNAi剂包括:
(a)有义链,所述有义链具有:
(i)21个核苷酸的长度;
(ii)与3′端连接的ASGPR配体,其中所述ASGPR配体包括通过三价支链接头连接的三种GalNAc衍生物;
(iii)位置1至6、8、10以及12至21处的2′-OMe修饰,位置7和9处的2′-F修饰,以及位置11处的脱氧核苷酸(例如,dT)(从5′端开始计数);以及
(iv)核苷酸位置1与2之间以及核苷酸位置2与3之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
以及
(b)反义链,所述反义链具有:
(i)23个核苷酸的长度;
(ii)位置1、3、7、9、11、13、15、17以及19至23处的2′-OMe修饰,以及位置2、4至6、8、10、12、14、16和18处的2′-F修饰(从5′端开始计数);以及
(iii)核苷酸位置1与2之间、核苷酸位置2与3之间、核苷酸位置21与22之间以及核苷酸位置22与23之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
其中RNAi剂在反义链的3′端处具有两个核苷酸突出端,并且在反义链的5′端处具有钝端。
在另一个特定实施方案中,本发明的RNAi剂包括:
(a)有义链,所述有义链具有:
(i)21个核苷酸的长度;
(ii)与3′端连接的ASGPR配体,其中所述ASGPR配体包括通过三价支链接头连接的三种GalNAc衍生物;
(iii)位置1至6、8、10、12、14以及16至21处的2′-OMe修饰,以及位置7、9、11、13和15处的2′-F修饰;以及
(iv)核苷酸位置1与2之间以及核苷酸位置2与3之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
以及
(b)反义链,所述反义链具有:
(i)23个核苷酸的长度;
(ii)位置1、5、7、9、11、13、15、17、19以及21至23处的2′-OMe修饰,以及位置2至4、6、8、10、12、14、16、18和20处的2′-F修饰(从5′端开始计数);以及
(iii)核苷酸位置1与2之间、核苷酸位置2与3之间、核苷酸位置21与22之间以及核苷酸位置22与23之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
其中RNAi剂在反义链的3′端处具有两个核苷酸突出端,并且在反义链的5′端处具有钝端。
在另一个特定实施方案中,本发明的RNAi剂包括:
(a)有义链,所述有义链具有:
(i)21个核苷酸的长度;
(ii)与3′端连接的ASGPR配体,其中所述ASGPR配体包括通过三价支链接头连接的三种GalNAc衍生物;
(iii)位置1至9和12至21处的2′-OMe修饰,以及位置10和11处的2′-F修饰;以及
(iv)核苷酸位置1与2之间以及核苷酸位置2与3之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
以及
(b)反义链,所述反义链具有:
(i)23个核苷酸的长度;
(ii)位置1、3、5、7、9、11至13、15、17、19以及21至23处的2′-OMe修饰,以及位置2、4、6、8、10、14、16、18和20处的2′-F修饰(从5′端开始计数);以及
(iii)核苷酸位置1与2之间、核苷酸位置2与3之间、核苷酸位置21与22之间以及核苷酸位置22与23之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
其中RNAi剂在反义链的3′端处具有两个核苷酸突出端,并且在反义链的5′端处具有钝端。
在另一个特定实施方案中,本发明的RNAi剂包括:
(a)有义链,所述有义链具有:
(i)21个核苷酸的长度;
(ii)与3′端连接的ASGPR配体,其中所述ASGPR配体包括通过三价支链接头连接的三种GalNAc衍生物;
(iii)位置1、3、5、7、9至11和13处的2′-F修饰,以及位置2、4、6、8、12以及14至21处的2′-OMe修饰;以及
(iv)核苷酸位置1与2之间以及核苷酸位置2与3之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
以及
(b)反义链,所述反义链具有:
(i)23个核苷酸的长度;
(ii)位置1、3、5至7、9、11至13、15、17至19以及21至23处的2′-OMe修饰,以及位置2、4、8、10、14、16和20处的2′-F修饰(从5′端开始计数);以及
(iii)核苷酸位置1与2之间、核苷酸位置2与3之间、核苷酸位置21与22之间以及核苷酸位置22与23之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
其中RNAi剂在反义链的3′端处具有两个核苷酸突出端,并且在反义链的5′端处具有钝端。
在另一个特定实施方案中,本发明的RNAi剂包括:
(a)有义链,所述有义链具有:
(i)21个核苷酸的长度;
(ii)与3′端连接的ASGPR配体,其中所述ASGPR配体包括通过三价支链接头连接的三种GalNAc衍生物;
(iii)位置1、2、4、6、8、12、14、15、17以及19至21处的2′-OMe修饰,以及位置3、5、7、9至11、13、16和18处的2′-F修饰;以及
(iv)核苷酸位置1与2之间以及核苷酸位置2与3之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
以及
(b)反义链,所述反义链具有:
(i)25个核苷酸的长度;
(ii)位置1、4、6、7、9、11至13、15、17以及19至23处的2′-OMe修饰、位置2、3、5、8、10、14、16和18处的2′-F修饰,以及位置24和25处的脱氧核苷酸(例如,dT)(从5′端开始计数);以及
(iii)核苷酸位置1与2之间、核苷酸位置2与3之间、核苷酸位置21与22之间以及核苷酸位置22与23之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
其中RNAi剂在反义链的3′端处具有四个核苷酸突出端,并且在反义链的5′端处具有钝端。
在另一个特定实施方案中,本发明的RNAi剂包括:
(a)有义链,所述有义链具有:
(i)21个核苷酸的长度;
(ii)与3′端连接的ASGPR配体,其中所述ASGPR配体包括通过三价支链接头连接的三种GalNAc衍生物;
(iii)位置1至6、8和12至21处的2′-OMe修饰,以及位置7和9至11处的2′-F修饰;以及
(iv)核苷酸位置1与2之间以及核苷酸位置2与3之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
以及
(b)反义链,所述反义链具有:
(i)23个核苷酸的长度;
(ii)位置1、3至5、7、8、10至13、15以及17至23处的2′-OMe修饰,以及位置2、6、9、14和16处的2′-F修饰(从5′端开始计数);以及
(iii)核苷酸位置1与2之间、核苷酸位置2与3之间、核苷酸位置21与22之间以及核苷酸位置22与23之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
其中RNAi剂在反义链的3′端处具有两个核苷酸突出端,并且在反义链的5′端处具有钝端。
在另一个特定实施方案中,本发明的RNAi剂包括:
(a)有义链,所述有义链具有:
(i)21个核苷酸的长度;
(ii)与3′端连接的ASGPR配体,其中所述ASGPR配体包括通过三价支链接头连接的三种GalNAc衍生物;
(iii)位置1至6、8和12至21处的2′-OMe修饰,以及位置7和9至11处的2′-F修饰;以及
(iv)核苷酸位置1与2之间以及核苷酸位置2与3之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
以及
(b)反义链,所述反义链具有:
(i)23个核苷酸的长度;
(ii)位置1、3至5、7、10至13、15以及17至23处的2′-OMe修饰,以及位置2、6、8、9、14和16处的2′-F修饰(从5′端开始计数);以及
(iii)核苷酸位置1与2之间、核苷酸位置2与3之间、核苷酸位置21与22之间以及核苷酸位置22与23之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
其中RNAi剂在反义链的3′端处具有两个核苷酸突出端,并且在反义链的5′端处具有钝端。
在另一个特定实施方案中,本发明的RNAi剂包括:
(a)有义链,所述有义链具有:
(i)19个核苷酸的长度;
(ii)与3′端连接的ASGPR配体,其中所述ASGPR配体包括通过三价支链接头连接的三种GalNAc衍生物;
(iii)位置1至4、6和10至19处的2′-OMe修饰,以及位置5和7至9处的2′-F修饰;以及
(iv)核苷酸位置1与2之间以及核苷酸位置2与3之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
以及
(b)反义链,所述反义链具有:
(i)21个核苷酸的长度;
(ii)位置1、3至5、7、10至13、15以及17至21处的2′-OMe修饰,以及位置2、6、8、9、14和16处的2′-F修饰(从5′端开始计数);以及
(iii)核苷酸位置1与2之间、核苷酸位置2与3之间、核苷酸位置19与20之间以及核苷酸位置20与21之间的硫代磷酸酯核苷酸间键(从5′端开始计数);
其中RNAi剂在反义链的3′端处具有两个核苷酸突出端,并且在反义链的5′端处具有钝端。
在某些实施方案中,用于本发明的方法的iRNA是选自表2-3中的任一个表中列出的药剂的药剂。这些药剂可以进一步包括配体。
III.与配体缀合的iRNA
本发明的iRNA的RNA的另一种修饰涉及将一种或多种配体、部分或缀合物与iRNA化学连接,所述一种或多种配体、部分或缀合物增强iRNA的活性、细胞分布或细胞摄取(例如,进入细胞)。此类部分包含但不限于脂质部分,例如胆固醇部分(Letsinger等人,Proc.Natl.Acid.Sci.USA,1989,86:6553-6556)。在其他实施方案中,配体是胆酸(Manoharan等人,Biorg.Med.Chem.Let.,1994,4:1053-1060)、硫醚,例如beryl-S-三苯甲基硫醇(Manoharan等人,Ann.N.Y.Acad.Sci.,1992,660:306-309;Manoharan等人,Biorg.Med.Chem.Let.,1993,3:2765-2770)、硫代胆固醇(Oberhauser等人,Nucl.AcidsRes.,1992,20:533-538)、脂族链,例如十二烷二醇或十一烷基残基(Saison-Behmoaras等人,EMBOJ,1991,10:1111-1118;Kabanov等人,FEBS Lett.,1990,259:327-330;Svinarchuk等人,Biochimie,1993,75:49-54)、磷脂,例如双十六烷基-rac-甘油或三乙基铵1,2-双-O-十六烷基-rac-甘油-3-膦酸酯(Manoharan等人,Tetrahedron Lett.,1995,36:3651-3654;Shea等人,Nucl.Acids Res.,1990,18:3777-3783)、多胺或聚乙二醇链(Manoharan等人,Nucleosides&Nucleotides,1995,14:969-973)或金刚烷乙酸(Manoharan等人,Tetrahedron Lett.,1995,36:3651-3654)、棕榈基部分(Mishra等人,Biochim.Biophys.Acta,1995,1264:229-237)或十八烷基胺或己胺基-羰基氧胆固醇部分(Crooke等人,J.Pharmacol.Exp.Ther.,1996,277:923-937)。。
在某些实施方案中,配体改变其并入其中的iRNA剂的分布、靶向或寿命。在某些实施方案中,例如,与不存在此类配体的物种相比,配体为选定靶标(例如,分子、细胞或细胞类型)、区室(例如,细胞或器官区室、组织、器官或身体区)提供增强的亲和力。在一些实施方案中,配体不参与双链体核酸中的双链体配对。
配体可以包含天然存在的物质,如蛋白质(例如,人血清白蛋白(HSA)、低密度脂蛋白(LDL)或球蛋白);碳水化合物(例如,葡聚糖、支链淀粉、几丁质、壳聚糖、菊粉、环糊精、N-乙酰氨基葡萄糖、N-乙酰基半乳糖胺或透明质酸);或脂质。配体也可以是重组分子或合成分子,如合成聚合物,例如合成聚氨基酸。聚氨基酸的实例包含聚氨基酸,即聚赖氨酸(PLL)、聚L-天冬氨酸、聚L-谷氨酸、苯乙烯-马来酸酐共聚物、聚(L-丙交酯-共-乙交酯)共聚物、二乙烯基醚-马来酸酐共聚物、N-(2-羟丙基)甲基丙烯酰胺共聚物(HMPA)、聚乙二醇(PEG)、聚乙烯醇(PVA)、聚氨酯、聚(2-乙基丙烯酸)、N-异丙基丙烯酰胺聚合物或聚膦嗪。多胺的实例包含:聚乙烯亚胺、聚赖氨酸(PLL)、精胺、亚精胺、多胺、假肽-多胺、拟肽多胺、树枝状多胺、精氨酸、脒、鱼精蛋白、阳离子脂质、阳离子卟啉、多胺的季盐或α螺旋肽。
配体还可以包含靶向基团,例如细胞或组织靶向剂,例如凝集素、糖蛋白、脂质或蛋白质,例如与特定细胞类型(如肾细胞)结合的抗体。靶向基团可以是促甲状腺素、促黑素、凝集素、糖蛋白、表面活性剂蛋白A、粘蛋白碳水化合物、多价乳糖、多价半乳糖、N-乙酰基-半乳糖胺、N-乙酰基-葡糖胺多价甘露糖、多价岩藻糖、糖基化多氨基酸、多价半乳糖、转铁蛋白、双膦酸酯、聚谷氨酸酯、聚天冬氨酸酯、脂质、胆固醇、类固醇、胆汁酸、叶酸、维生素B12、维生素A、生物素或RGD肽或RGD肽模拟物。在某些实施方案中,配体是多价半乳糖,例如,N-乙酰基-半乳糖胺。
配体的其它实例包含染料、嵌入剂(例如,吖啶)、交联剂(例如,补骨脂烯、丝裂霉素C(mitomycin C))、卟啉(TPPC4、德克萨斯卟啉(texaphyrin)、扩环卟啉(Sapphyrin))、多环芳香族烃(例如,吩嗪、二氢吩嗪)、人工核酸内切酶(例如,EDTA)、亲脂性分子(例如,胆固醇、胆酸、金刚烷乙酸、1-芘丁酸、二氢睾酮、1,3-双-O(十六烷基)甘油、香叶基氧基己基、十六烷基甘油、冰片、薄荷醇、1,3-丙二醇、十七烷基、棕榈酸、肉豆蔻酸、O3-(油酰基)石胆酸、O3-(油酰基)胆烯酸、二甲氧基三苯甲基或吩噁嗪)、肽缀合物(例如,触角足突变肽、Tat肽)、烷化剂、磷酸盐、氨基、巯基、PEG(例如,PEG-40K)、MPEG、[MPEG]
配体可以是蛋白质(例如,糖蛋白)或肽(例如,对共配体具有特异性亲和力的分子)或抗体(例如,与特定细胞类型,如肝细胞结合的抗体)。配体还可以包含激素和激素受体。配体还可以包含非肽物质,如脂质、凝集素、碳水化合物、维生素、辅因子、多价乳糖、多价半乳糖、N-乙酰基-半乳糖胺、N-乙酰基-葡糖胺多价甘露糖或多价岩藻糖。配体可以是例如脂多糖、p38MAP激酶的激活剂或NF-κB的激活剂。
配体可以是物质,例如药物,其可以例如通过破坏细胞的细胞骨架,例如通过破坏细胞的微管、微丝或中间丝来增加iRNA剂摄取到细胞中。药物可以是例如紫杉醇(taxol)、长春新碱(vincristine)、长春碱(vinblastine)、细胞松弛素(cytochalasin)、诺考达唑(nocodazole)、杰斯内酯(iaplakinolide)、拉春库林A(latrunculin A)、毒伞素(phalloidin)、斯文赫利A(swinholide A)、印丹诺辛(indanocine)或麦司文(myoservin)。
在一些实施方案中,与如本文所描述的iRNA连接的配体充当药代动力学调节剂(PK调节剂)。PK调节剂包含亲脂性物质、胆汁酸、类固醇、磷脂类似物、肽、蛋白质结合剂、PEG、维生素等。示例性PK调节剂包含但不限于胆固醇、脂肪酸、胆酸、石胆酸、二烷基甘油酯、二酰基甘油酯、磷脂、鞘脂、萘普生(naproxen)、布洛芬(ibuprofen)、维生素E、生物素。还已知包括许多硫代磷酸酯键的与血清蛋白结合的寡核苷酸,因此在主链中包括多个硫代磷酸酯键的短寡核苷酸(例如,具有约5个碱基、10个碱基、15个碱基或20个碱基的寡核苷酸)也适于本发明作为配体(例如,作为PK调节配体)。另外,与血清组分(例如,血清蛋白)结合的适体也适于用作本文所描述的实施例中的PK调节配体。
本发明的配体缀合的iRNA可以通过使用具有侧反应功能的寡核苷酸来合成,如源自连接分子连接到寡核苷酸上的寡核苷酸(如下文所描述的)。这种反应性寡核苷酸可以直接与可商购获得的配体、合成的带有多种保护基团中的任一种的配体、或具有与其连接的连接部分的配体反应。
本发明的缀合物中使用的寡核苷酸可以通过众所周知的固相合成技术方便且常规地制备。用于此类合成的设备由若干个供应商销售,例如,包含Applied
在本发明的配体缀合的iRNA和带有序列特异性连接的核苷的配体分子中,寡核苷酸和寡核苷可以利用标准核苷酸或核苷前体或已经带有连接部分的核苷酸或核苷缀合物前体、已经带有配体分子的配体-核苷酸或核苷缀合物前体或带有构建块的非核苷配体组装在合适的DNA合成器上。
当使用已经带有连接部分的核苷酸缀合物前体时,通常完成序列特异性连接核苷的合成,并且然后配体分子与连接部分反应以形成配体缀合的寡核苷酸。在一些实施方案中,本发明的寡核苷酸或连接的核苷通过自动合成器合成,使用源自配体-核苷缀合物的磷脒以及可商购获得的和常规用于寡核苷酸合成的标准磷脒和非标准磷酰胺。
A.脂质缀合物
在某些实施方案中,配体或缀合物是脂质或基于脂质的分子。此类脂质或基于脂质的分子可以与血清蛋白,例如人血清白蛋白(HSA)结合。HSA结合配体允许缀合物分布到靶组织,例如身体的非肾靶组织。例如,靶组织可以是肝,包含肝的实质细胞。可以与HSA结合的其它分子也可以用作配体。例如,可以使用萘普生或阿司匹林。脂质或基于脂质的配体可以(a)增加对缀合物降解的抗性,(b)增加靶向或转运到靶细胞或细胞膜中,或(c)可以用于调节与血清蛋白,例如HSA的结合HSA。
基于脂质的配体可以用于抑制(例如,控制)缀合物与靶组织的结合。例如,更强地与HSA结合的脂质或基于脂质的配体将较不可能被靶向到肾脏,并且因此较不可能从身体清除。较不强烈地与HSA结合的脂质或基于脂质的配体可以用于将缀合物靶向到肾脏。
在某些实施方案中,基于脂质的配体与HSA结合。在一个实施方案中,其以足够的亲和力与HSA结合,使得缀合物将分布到非肾组织。然而,优选的是亲和力不要强到HSA配体结合不能被逆转。
在其它实施方案中,基于脂质的配体与HSA结合很弱或根本不结合,使得缀合物将被分配到肾脏。靶向到肾细胞的其它部分也可以代替基于脂质的配体或在其之外使用。
在另一方面,配体是被靶细胞(例如,增殖细胞)摄取的部分,例如维生素。这些对于治疗以不期望的细胞增殖为特征的疾病特别有用,例如恶性或非恶性类型的疾病,例如癌细胞。示例性维生素包含维生素A、E和K。包含的其它示例性维生素是B族维生素,例如叶酸、B 12、核黄素、生物素、吡哆醛或被靶细胞(如肝细胞)摄取的其它维生素或营养素。还包含HSA和低密度脂蛋白(LDL)。
B.细胞渗透剂
另一方面,配体是细胞渗透剂,如螺旋细胞渗透剂。在一个实施方案中,药剂为两亲性的。示例性药剂为肽,如tat或触角足突变肽。如果药剂为肽,那么其可以被修饰,包含肽基模拟物、反演体、非肽或假肽键和使用D-氨基酸。在一个实施方案中,螺旋试为α螺旋剂,例如具有亲脂性和疏脂性相。
配体可以是肽或肽模拟物。肽模拟物(在本文中也称为寡肽模拟物)是能够折叠成类似于天然肽的所定义三维结构的分子。肽和肽模拟物与iRNA剂的连接可能影响iRNA的药代动力学分布,如通过增强细胞识别和吸收。肽或肽模拟物部分的长度可以为约5个至50个氨基酸,例如约5个、10个、15个、20个、25个、30个、35个、40个、45个或50个氨基酸长。
肽或肽模拟物可以是例如细胞渗透肽、阳离子肽、两亲性肽或疏水肽(例如,主要由Tyr、Trp或Phe组成)。肽部分可以是树状体肽、约束肽或交联肽。在另一个替代方案中,肽部分可以包含疏水性膜易位序列(MTS)。示例性疏水性含MTS肽是具有氨基酸序列AAVALLPAVLLALLAP(SEQ ID NO:15)的RFGF。含疏水性MTS的RFGF类似物(例如,氨基酸序列AALLPVLLAAP(SEQ ID NO:16))也可以是靶向部分。肽部分可以是“递送”肽,所述肽可以携带包含肽、寡核苷酸和蛋白质在内的大极性分子穿过细胞膜。例如,已发现来自HIV Tat蛋白(GRKKRRQRRRPPQ(SEQ ID NO:17)和果蝇触角足突变蛋白(RQIKIWFQNRRMKWKK(SEQ IDNO:18))的序列能够充当递送肽。肽或肽模拟物可以由DNA的随机序列编码,如从噬菌体展示文库或一珠一化合物(OBOC)组合文库中鉴定的肽(Lam等人,Nature,354:82-84,1991)。为了细胞靶向目的,通过掺入的单体单元与dsRNA剂连接的肽或肽模拟物的实例是精氨酸-甘氨酸-天冬氨酸(RGD)-肽或RGD模拟物。肽部分的长度可以在约5个氨基酸至约40个氨基酸的范围内。肽部分可以具有结构修饰,如增加稳定性或直接构象特性。可以使用下面描述的任何结构修饰。
用于本发明的组合物和方法的RGD肽可以是线性或环状的,并且可以被修饰,例如糖基化或甲基化,以促进靶向特定组织。含有RGD的肽和肽二聚体可以包含D-氨基酸以及合成的RGD模拟物。除了RGD,还可以使用靶向整合素配体的其它部分,例如PECAM-1或VEGF。
“细胞渗透肽”能够渗透细胞,例如微生物细胞(如细菌或真菌细胞)或哺乳动物细胞(如人细胞)。微生物细胞渗透肽可以是例如α-螺旋线性肽(例如,LL-37或Ceropin P1)、含二硫键的肽(例如,α-防御素、B-防御素或细菌素)或仅含有一个或两个主要氨基酸的肽(例如,PR-39或吲哚西丁(indolicidin))。细胞渗透肽还可以包含核定位信号(NLS)。例如,细胞渗透肽可以是二分两亲性肽,如MPG,其源自HIV-1 gp41的融合肽结构域和SV40大T抗原的NLS(Simeoni等,Nucl.Acids Res.31:2717-2724,2003)。
C.碳水化合物缀合物
在本发明的组合物和方法的一些实施方案中,iRNA进一步包括碳水化合物。碳水化合物缀合的iRNA对于核酸的体内递送以及适于如本文所描述的体内治疗用途的组合物而言是有利的。如本文所使用的,“碳水化合物”是指化合物,所述化合物是碳水化合物,所述碳水化合物本身由一个或多个单糖单元构成,所述单糖单元具有至少6个碳原子(可以是直链、支链或环状),其中氧、氮或硫原子与每个碳原子结合;或是具有碳水化合物部分作为其部分的化合物,所述碳水化合物部分由一个或多个单糖单元构成,每个单糖单元具有至少六个碳原子(可以是直链、支链或环状),其中氧、氮或硫原子与每个碳原子结合。代表性碳水化合物包含糖(单糖、二糖、三糖和含有约4个、5个、6个、7个、8个或9个单糖单元的寡糖)和多糖如淀粉、糖原、纤维素和多糖胶。特定单糖包含C5及以上(例如,C5、C6、C7或C8)糖;二糖和三糖包含具有两个或三个单糖单元(例如,C5、C6、C7或C8)的糖。
在某些实施方案中,用于本发明的组合物和方法的碳水化合物缀合物是单糖。
在某些实施方案中,单糖是N-乙酰基半乳糖胺(GalNAc)。包括一种或多种N-乙酰基半乳糖胺(GalNAc)衍生物的GalNAc缀合物在例如US 8,106,022中进行了描述,所述文献的完整内容特此通过引用的方式并入本文。在一些实施方案中,GalNAc缀合物用作将iRNA靶向特定细胞的配体。在一些实施方案中,GalNAc缀合物将iRNA靶向肝细胞,例如,通过充当肝细胞(例如,肝细胞(hepatocyte))的去唾液酸糖蛋白受体的配体。
在一些实施方案中,碳水化合物缀合物包括一种或多种GalNAc衍生物。GalNAc衍生物可以通过接头连接,例如二价或三价支链接头。在一些实施方案中,GalNAc缀合物与有义链的3′端缀合。在一些实施方案中,GalNAc缀合物通过接头,例如本文所描述的接头与iRNA剂缀合(例如,与有义链的3′端)。在一些实施方案中,GalNAc缀合物与有义链的5′端缀合。在一些实施方案中,GalNAc缀合物通过接头,例如本文所描述的接头与iRNA剂缀合(例如,与有义链的5′端)。
在本发明的某些实施例中,GalNAc或GalNAc衍生物通过单价接头与本发明的iRNA剂连接。在一些实施方案中,GalNAc或GalNAc衍生物通过二价接头与本发明的iRNA剂连接。在本发明的又其它实施例中,GalNAc或GalNAc衍生物通过三价接头与本发明的iRNA剂连接。在本发明的其它实施例中,GalNAc或GalNAc衍生物通过四价接头与本发明的iRNA剂连接。
在某些实施方案中,本发明的双链RNAi剂包括与iRNA剂连接的一种GalNAc或GalNAc衍生物。在某些实施方案中,本发明的双链RNAi剂包括多个(例如,2个、3个、4个、5个或6个)GalNAc或GalNAc衍生物,每个所述衍生物通过多个单价接头独立地与双链RNAi剂的多个核苷酸连接。
在一些实施方案中,例如,当本发明的iRNA剂的两条链是一个较大分子的一部分时,所述较大分子由一条链的3′端和相应的另一条链的5′端之间的不间断核苷酸链连接,形成包括多个未配对核苷酸的发夹环,发夹环内的每个未配对核苷酸可以独立地包括通过单价接头连接的GalNAc或GalNAc衍生物。发夹环也可以由双链体的一条链中的延伸突出端形成。
在一些实施方案中,例如,当本发明的iRNA剂的两条链是一个较大分子的一部分时,所述较大分子由一条链的3′端和相应的另一条链的5′端之间的不间断核苷酸链连接,形成包括多个未配对核苷酸的发夹环,发夹环内的每个未配对核苷酸可以独立地包括通过单价接头连接的GalNAc或GalNAc衍生物。发夹环也可以由双链体的一条链中的延伸突出端形成。
在一个实施方案中,用于本发明的组合物和方法的碳水化合物缀合物选自:
其中Y是O或S,并且n是3至6(式XXIV);
其中Y是O或S,并且n是3至6(式XXV);
其中X是O或S(式XXVII);
以及
用于本发明的组合物和方法的碳水化合物缀合物是单糖。在一个实施方案中,单糖是N-乙酰基半乳糖胺,如
在一些实施方案中,RNAi剂通过接头与碳水化合物缀合物连接,如以下示意所示,其中X是O或S
在一些实施方案中,RNAi剂缀合至L96,如表1中所定义且如下所示:
用于本文所描述的实施例中的另一代表性碳水化合物缀合物包含但不限于:
(式XXXVI),当X或Y中的一个是寡核苷酸时,另一个是氢。
在一些实施方案中,合适的配体是WO 2019/055633中公开的配体,所述文献的全部内容通过引用并入本文。在一个实施方案中,配体包括以下结构:
在本发明的某些实施例中,GalNAc或GalNAc衍生物通过单价接头与本发明的iRNA剂连接。在一些实施方案中,GalNAc或GalNAc衍生物通过二价接头与本发明的iRNA剂连接。在本发明的又其它实施例中,GalNAc或GalNAc衍生物通过三价接头与本发明的iRNA剂连接。
在一个实施方案中,本发明的双链RNAi剂包括与iRNA剂连接的一种或多种GalNAc或GalNAc衍生物。GalNAc可以通过有义链或反义链上的接头与任何核苷酸连接。GalNac可以与有义链的5′端、有义链的3′端、反义链的5′端或反义链的3′端连接。在一个实施方案中,GalNAc例如通过三价接头与有义链的3′端连接。
在其它实施方案中,本发明的双链RNAi剂包括多个(例如,2个、3个、4个、5个或6个)GalNAc或GalNAc衍生物,每个所述衍生物通过多个接头(例如,单价接头)独立地与双链RNAi剂的多个核苷酸连接。
在一些实施方案中,例如,当本发明的iRNA剂的两条链是一个较大分子的一部分时,所述较大分子由一条链的3′端和相应的另一条链的5′端之间的不间断核苷酸链连接,形成包括多个未配对核苷酸的发夹环,发夹环内的每个未配对核苷酸可以独立地包括通过单价接头连接的GalNAc或GalNAc衍生物。
在一些实施方案中,碳水化合物缀合物进一步包括一个或多个如上文所描述的另外的配体,如但不限于PK调节剂或细胞渗透肽。
适用于本发明的另外的碳水化合物缀合物和接头包含PCT公开第WO 2014/179620号和第WO 2014/179627号中所描述的那些,所述文献中的每一个的全部内容通过引用并入本文。
D.接头
在一些实施方案中,本文所描述的缀合物或配体可以通过各种接头与iRNA寡核苷酸连接,所述接头可以是可切割的或不可切割的。
术语“接头”或“连接基团”意指连接化合物两部分的有机部分,例如,共价连接化合物的两部分。接头通常包括直接键或原子,如氧或硫;单元,如NR8、C(O)、C(O)NH、SO、SO
可切割连接基团是在细胞外部充分稳定的连接基团,但其在进入靶细胞之后切割以释放接头保持在一起的两个部分。在一个实施方案中,可切割连接基团在靶细胞中或在第一参考条件下(其可以例如被选择以模拟或代表细胞内条件)的切割是在受试者的血液中或在第二参考条件下(其可以例如被选择以模拟或代表在血液或血清中发现的条件)的切割速度的至少约10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或更多,或至少100倍。
可切割连接基团易受切割剂(例如,pH、氧化还原电位或降解分子的存在)影响。一般来说,切割剂在细胞内部比在血清或血液中更普遍,或以更高的水平或活性找到。此类降解剂的实例包含:针对特定底物选择的或不具有底物特异性的氧化还原剂,包括例如存在于细胞中的氧化或还原酶或还原剂,如硫醇,所述氧化或还原酶或还原剂可以通过还原降解氧化还原可切割连接基团;酯酶;可以产生酸性环境的核内体或药剂,例如,产生pH为五或更低的那些核内体或药剂;可以通过充当广义酸、肽酶(其可以是底物特异性的)和磷酸酶来水解或降解酸可切割连接基团的酶。
可切割键基团,如二硫键可能对pH敏感。人血清的pH为7.4,而细胞内pH的平均值略低,范围为约7.1-7.3。核内体具有更酸性的pH,范围为5.5-6.0,并且溶酶体具有甚至更酸性的pH,为约5.0。一些接头将具有可切割连接基团,所述连接基团在所选pH下切割,由此从细胞内的配体释放阳离子脂质,或释放到细胞的期望的区室中。
接头可以包含可由特定酶切割的可切割连接基团。并入到接头中的可切割连接基团的类型可以取决于所靶向的细胞。例如,肝脏靶向配体可以通过包含酯基的接头与阳离子脂质连接。肝细胞富含酯酶,并且因此接头在肝细胞中将比在非富含酯酶的细胞类型中更高效地切割。其它富含酯酶的细胞类型包含肺、肾皮质和睾丸中的细胞。
当靶向富含肽酶的细胞类型,如肝细胞和滑膜细胞时,可以使用含有肽键的接头。
一般来说,可以通过测试降解剂(或条件)切割候选连接基团的能力来评价候选可切割连接基团的适合性。还将期望测试候选可切割连接基团抵抗在血液中或当与其它非靶组织接触时切割的能力。因此,可以确定第一条件与第二条件之间对切割的相对易感性,其中选择第一条件以指示靶细胞中的切割,并且选择第二条件以指示其它组织或生物流体,例如血液或血清中的切割。评价可以在无细胞系统、在细胞、在细胞培养物、在器官或组织培养物或在整只动物中进行。在无细胞或培养条件下进行初始评价并且通过在整只动物中进一步评价来确认可以是有用的。在某些实施方案中,有用的候选化合物在细胞中(或在被选择以模拟细胞内条件的体外条件下)的切割是在血液或血清中(或在被选择以模拟细胞外条件的体外条件下)的切割速度的至少约2倍、4倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍。
i.氧化还原可切割连接基团
在某些实施方案中,可切割连接基团是在还原或氧化时切割的氧化还原可切割连接基团。还原性可切割连接基团的实例是二硫化物连接基团(-S-S-)。为了确定候选可切割连接基团是否是合适的“还原性可切割连接基团”,或者例如是否适合与特定iRNA部分和特定靶向剂一起使用,可以参考本文所描述的方法。例如,可以通过使用本领域已知的试剂与二硫苏糖醇(DTT)或其它还原剂一起温育来评估候选物,这模拟将在细胞(例如,靶细胞)中观察到的切割速率。候选物还可以在被选择以模拟血液或血清条件的条件下评价。在一个中,候选化合物在血液中被切割至多约10%。在其它实施方案中,有用的候选化合物在细胞中(或在被选择以模拟细胞内条件的体外条件下)的降解是在血液中(或在被选择以模拟细胞外条件的体外条件下)的切割速度的至少约2倍、4倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或约100倍。候选化合物的切割速率可以使用标准酶动力学测定在被选择以模拟细胞内介质的条件下确定并且与被选择以模拟细胞外介质的条件进行比较。
ii.基于磷酸酯的可切割连接基团
在其它实施方案中,可切割接头包括基于磷酸酯的可切割连接基团。基于磷酸酯的可切割连接基团被降解或水解磷酸酯基团的药剂切割。细胞中使磷酸酯基团切割的药剂的实例为细胞中的酶,如磷酸酶。基于磷酸酯的连接基团的实例为-O-P(O)(ORk)-O-、-O-P(S)(ORk)-O-、-O-P(S)(SRk)-O-、-S-P(O)(ORk)-O-、-O-P(O)(ORk)-S-、-S-P(O)(ORk)-S-、-O-P(S)(ORk)-S-、-S-P(S)(ORk)-U-、-O-P(O)(Rk)-O-、-O-P(S)(Rk)-O-、-S-P(O)(Rk)-O-、-S-P(S)(Rk)-O-、-S-P(O)(Rk)-S-、-O-P(S)(Rk)-S-,其中Rk在每次出现时可以独立地为C1-C20烷基、C1-C20卤代烷基、C6-C10芳基或C7-C12芳烷基。示例性实施例包含-O-P(O)(OH)-O-、-O-P(S)(OH)-O-、-O-P(S)(SH)-O-、-S-P(O)(OH)-O-、-O-P(O)(OH)-S-、-S-P(O)(OH)-S-、-O-P(S)(OH)-S-、-S-P(S)(OH)-O-、-O-P(O)(H)-O-、-O-P(S)(H)-O-、-S-P(O)(H)-O、-S-P(S)(H)-O-、-S-P(O)(H)-S-和-O-P(S)(H)-S-。在某些实施方案中,基于磷酸酯的连接基团为-O-P(O)(OH)-O-。可以使用与上文所描述的方法类似的方法来评价这些候选物。
iii.酸可切割连接基团
在其它实施方案中,可切割接头包括基于酸可切割连接基团。酸可切割连接基团是在酸性条件下被切割的连接基团。在某些实施方案中,酸可切割连接基团在pH为约6.5或更低(例如,约6.0、5.5、5.0或更低)的酸性环境中或通过可以充当广义酸的试剂,如酶被切割。在细胞中,特定低pH细胞器,如核内体和溶酶体可以提供酸可切割连接基团的切割环境。酸可切割连接基团的实例包含但不限于腙、酯和氨基酸的酯。酸可切割基团可以具有通式-C=NN-、C(O)O或-OC(O)。示例性实施例是与酯的氧连接的碳(烷氧基)为芳基、经取代的烷基或叔烷基,如二甲基戊基或叔丁基。可以使用与上文所描述的方法类似的方法来评价这些候选物。
iv.基于酯的连接基团
在其它实施方案中,可切割接头包括基于酯的可切割连接基团。基于酯的可切割连接基团通过细胞中的酶,如酯酶和酰胺酶切割。基于酯的可切割连接基团的实例包含但不限于亚烷基、亚烯基和亚炔基的酯。酯可切割连接基团具有通式-C(O)O-或-OC(O)-。可以使用与上文所描述的方法类似的方法来评价这些候选物。
v.基于肽的切割基团
还在其它实施方案中,可切割接头包括基于肽的可切割连接基团。基于肽的可切割连接基团通过细胞中的酶,如肽酶和蛋白酶切割。基于肽的可切割连接基团是在氨基酸之间形成以产生寡肽(例如,二肽、三肽等)和多肽的肽键。基于肽的可切割基团不包含酰胺基(-C(O)NH-)。酰胺基可以在任何亚烷基、亚烯基或亚炔基之间形成。肽键是在氨基酸之间形成以产生肽和蛋白质的特殊类型的酰胺键。基于肽的切割基团通常限于在产生肽和蛋白质的氨基酸之间形成的肽键(即酰胺键)并且不包含整个酰胺官能团。基于肽的可切割连接基团具有通式-NHCHRAC(O)NHCHRBC(O)-,其中RA和RB为两个相邻氨基酸的R基团。可以使用与上文所描述的方法类似的方法来评价这些候选物。
在一些实施方案中,本发明的iRNA通过接头与碳水化合物缀合。iRNA碳水化合物缀合物与本发明的组合物和方法的接头的非限制性实例包含但不限于:
(式XLIV),当X或Y中的一个是寡核苷酸时,另一个是氢。
在本发明的组合物和方法的某些实施例中,配体为通过二价或三价支链接头连接的一个或多个“GalNAc”(N-乙酰基半乳糖胺)衍生物。
在一个实施方案中,本发明的dsRNA与二价或三价支链接头缀合,所述二价或三价支链接头选自由式(XLV)至(XLVIII)中任一项所示的结构组成的组:
其中:
q2A、q2B、q3A、q3B、q4A、q4B、q5A、q5B和q5C在每次出现时独立地表示0-20,并且其中重复单元可以相同或不同;
P
Q
R
L
式XLIX
其中L
适合的缀合GalNAc衍生物的二价和三价支链接头基团的实例包含但不限于上文所提及的式II、式VII、式XI、式X和式XIII的结构。
教导RNA缀合物的制备的代表性美国专利包含但不限于美国专利第4,828,979号;第4,948,882号;第5,218,105号;第5,525,465号;第5,541,313号;第5,545,730号;第5,552,538号;第5,578,717号、第5,580,731号;第5,591,584号;第5,109,124号;第5,118,802号;第5,138,045号;第5,414,077号;第5,486,603号;第5,512,439号;第5,578,718号;第5,608,046号;第4,587,044号;第4,605,735号;第4,667,025号;第4,762,779号;第4,789,737号;第4,824,941号;第4,835,263号;第4,876,335号;第4,904,582号;第4,958,013号;第5,082,830号;第5,112,963号;第5,214,136号;第5,082,830号;第5,112,963号;第5,214,136号;第5,245,022号;第5,254,469号;第5,258,506号;第5,262,536号;第5,272,250号;第5,292,873号;第5,317,098号;第5,371,241号、第5,391,723号;第5,416,203号、第5,451,463号;第5,510,475号;第5,512,667号;第5,514,785号;第5,565,552号;第5,567,810号;第5,574,142号;第5,585,481号;第5,587,371号;第5,595,726号;第5,597,696号;第5,599,923号;第5,599,928号;第5,688,941号;第6,294,664号;第6,320,017号;第6,576,752号;第6,783,931号;第6,900,297号;第7,037,646号;以及第8,106,022号,所述美国专利中的每一个的全部内容特此通过引用并入本文。
不需要均匀地修饰给定化合物中的所有位置,并且事实上,可以将上述修饰中的多于一个修饰并入单一化合物中或甚至iRNA内的单个核苷处。本发明还包含作为嵌合化合物的iRNA化合物。
在本发明的上下文中,“嵌合”iRNA化合物或“嵌合体”是iRNA化合物,如dsRNAi剂,其含有两个或更多个化学上不同的区,每个区由至少一个单体单元构成,即在dsRNA化合物的情况下的核苷酸。这些iRNA通常含有至少一个区,其中RNA被修饰以赋予iRNA增加的对核酸酶降解的抗性、增加的细胞摄取或增加的对靶核酸的结合亲和力。iRNA的另外的区可以作为能够切割RNA:DNA或RNA:RNA杂交体的酶的底物。举例来说,RNase H是细胞核酸内切酶,所述细胞核酸内切酶切割RNA:DNA双链体的RNA链。因此,RNase H的激活使RNA靶标切割,由此大大增强iRNA抑制基因表达的效率。因此,与杂交到同一靶标区的硫代磷酸酯脱氧dsRNA相比,当使用嵌合dsRNA时,使用更短的iRNA通常可以获得相当的结果。可以通过凝胶电泳和必要时本领域已知的相关核酸杂交技术常规检测RNA靶标的切割。
在某些情况下,iRNA的RNA可以被非配体基团修饰。许多非配体分子已与iRNA缀合以增强iRNA的活性、细胞分布或细胞摄取,并且进行此类缀合的程序可在科学文献中获得。此类非配体部分已经包含脂质部分,如胆固醇(Kubo,T.等人,Biochem.Biophys.Res.Comm.,2007,365(1):54-61;Letsinger等人,Proc.Natl.Acad.Sci.USA,1989,86:6553)、胆酸(Manoharan等人,Bioorg.Med.Chem.Lett.,1994,4:1053)、硫醚,例如己基-S-三苯甲基硫醇(Manoharan等人,Ann.N.Y.Acad.Sci.,1992,660:306;Manoharan等人,Bioorg.Med.Chem.Let.,1993,3:2765)、硫代胆固醇(Oberhauser等人,Nucl.Acids Res.,1992,20:533)、脂肪族链,例如,十二烷二醇或十一烷基残基(Saison-Behmoaras等人,EMBO J.,1991,10:111;Kabanov等人,FEBS Lett.,1990,259:327;Svinarchuk等人,Biochimie,1993,75:49)、磷脂,例如双-十六烷基-rac-甘油或三乙基铵1,2-双-O-十六烷基-rac-甘油-3-H-膦酸酯(Manoharan等人,Tetrahedron Lett.,1995,36:3651;Shea等人,Nucl.Acids Res.,1990,18:3777)、聚胺或聚乙二醇链(Manoharan等人,Nucleosides&Nucleotides,1995,14:969)或金刚烷乙酸(Manoharan等人,Tetrahedron Lett.,1995,36:3651)、棕榈基部分(Mishra等人,Biochim.Biophys.Acta,1995,1264:229)或十八胺或己氨基-羰基-氧基胆固醇部分(Crooke等人,J.Pharmacol.Exp.Ther.,1996,277:923)。上面列出了教导制备此类RNA缀合物的代表性美国专利。典型的缀合方案涉及合成在序列的一个或多个位置处具有氨基接头的RNA。随后使用适当偶联试剂或激活试剂使氨基与所缀合的分子反应。缀合反应可以在RNA仍与固相载体结合的情况下或在RNA切割之后在溶液相中进行。通过HPLC纯化RNA缀合物通常产生纯缀合物。
IV.本发明的iRNA的递送
将本发明的iRNA递送至细胞,例如受试者体内的细胞,所述受试者如人受试者(例如有需要的受试者,如易患或被诊断患有补体因子B相关病症)可以多种不同方式实现。例如,可以通过在体外或体内使细胞与本发明的iRNA接触来进行递送。还可以通过向受试者施用包括iRNA的组合物(例如,dsRNA)直接进行体内递送。可替代地,体内递送可以通过施用一种或多种编码和引导iRNA的表达的载体间接进行。下文将进一步讨论这些替代方案。将本发明的iRNA递送至细胞,例如受试者如人类受试者(例如有需要的受试者,如易患或诊断为相关病症的受试者)内的细胞可以多种不同方式实现。例如,递送可以通过使细胞与本发明的iRNA在体外或体内接触来进行。体内递送也可通过向受试者施用包含iRNA(例如dsRNA)的组合物来直接进行。或者,可通过施用一种或多种编码并指导iRNA表达的载体间接进行体内递送。下面进一步讨论这些替代方案。
一般而言,任何递送核酸分子的方法(体外或体内)均可适用于本发明的iRNA(参见例如,Akhtar S.和Julian RL.(1992)Trends Cell.Biol.2(5):139-144及WO94/02595,其全部内容通过引用并入本文)。对于体内递送,为递送iRNA分子需要考虑的因素包括,例如,所递送分子的生物稳定性、非特异性效应的预防以及所递送分子在靶组织中的积累。RNA干扰也显示出通过直接注射局部递送至CNS的成功(Dorn,G.等人(2004)Nucleic Acids32:e49;Tan,PH.等人(2005)GeneTher.12:59-66;Makimura,H.等人(2002)BMCNeurosci.3:18;Shishkina,GT.等人(2004)Neuroscience 129:521-528;Thakker,ER.等人(2004)Proc.Natl.Acad.Sci.U.S.A.101:17270-17275;Akaneya,Y.等人(2005)J.Neurophysiol.93:594-602)。RNA或药物载体的修饰也可以允许iRNA靶向靶组织并避免不希望的脱靶效应。iRNA分子可以通过与亲脂性基团(如胆固醇)化学缀合进行修饰,以增强细胞摄取并防止降解。例如,与亲脂性胆固醇部分缀合的针对ApoB的iRNA系统性注射到小鼠体内,并导致肝脏和空肠中apoB mRNA的敲低(Soutschek,J.等人(2004)Nature 432:173-178)。
在替代实施方案中,可以使用药物递送系统例如纳米颗粒、树枝状聚合物、聚合物、脂质体或阳离子递送系统来递送iRNA。带正电荷的阳离子递送系统促进iRNA分子(带负电荷)的结合,并且还增强带负电荷的细胞膜处的相互作用以允许细胞有效摄取iRNA。阳离子脂质、树枝状聚合物或聚合物可以与iRNA结合,或诱导形成包裹iRNA的囊泡或胶束(参见例如,Kim SH等人(2008)Journal of Controlled Release 129(2):107-116)。当全身施用时,囊泡或胶束的形成进一步防止iRNA的降解。制备和施用阳离子-iRNA复合物的方法完全在本领域技术人员的能力范围之内(参见例如,Sorensen,DR等人(2003)J.Mol.Biol 327:761-766;Verma,UN等人(2003)Clin.Cancer Res.9:1291-1300;Arnold,AS等人(2007)J.Hypertens.25:197-205,其全部内容通过引用并入本文)。用于全身递送iRNA的药物递送系统的一些非限制性实例包括DOTAP(Sorensen,DR.等人(2003),同上;Verma,UN等人(2003),同上)、“固体核酸脂质颗粒”(Zimmermann,TS等人(2006)Nature 441:111-114)、心磷脂(Chien,PY等人(2005)Cancer Gene Ther.12:321-328;Pal,A等人(2005)IntJ.Oncol.26:1087-1091)、聚乙烯亚胺(Bonnet ME等人(2008)Pharm.Res.8月16日电子版提前印刷;Aigner,A.(2006)J.Biomed.Biotechnol.71659)、Arg-Gly-Asp(RGD)肽(Liu,S.(2006)Mol.Pharm.3:472-487)和聚酰胺胺((Tomalia,DA等人(2007)Biochem.Soc.Trans.35:61-67;Yoo,H.等人(1999)Pharm.Res.16:1799-1804)。在一些实施方案中,iRNA与环糊精形成复合物用于全身施用。iRNA和环糊精的施用方法和药物组合物可以在美国专利号7,427,605中找到,该专利通过引用整体并入本文。
A.本发明的载体编码的iRNA
靶向补体因子B基因的iRNA可从插入至DNA或RNA载体内的转录单元表达(参见,如,Couture,A等人,TIG.(1996),12:5-10;Skillern,A,等人,国际PCT公开号WO 00/22113,Conrad,国际PCT公开号WO 00/22114,以及Conrad,美国专利号6,054,299。表达可以是瞬时的(大约数小时至数周)或持续的(数周至数月或更长时间),具体取决于所使用的具体构建体以及目标组织或细胞类型。这些转基因可以作为线性构建体、环状质粒或病毒载体引入,其可以是整合或非整合载体。还可以构建转基因以允许其作为染色体外质粒遗传(Gassmann,等人,Proc.Natl.Acad.Sci.USA(1995)92:1292)。
可与本文中描述的方法及组合物一起使用的病毒载体系统包括,但不限于,(a)腺病毒载体;(b)逆转录病毒载体,包括但不限于,慢病毒载体、莫罗尼鼠白血病病毒等;(c)腺相关病毒载体;(d)单纯疱疹病毒载体;(e)SV 40载体;(f)多瘤病毒载体;(g)乳头状瘤病毒载体;(h)小核糖核酸病毒载体;(i)痘病毒载体,如天花,例如牛痘病毒载体,或禽痘如金丝雀痘病毒或鸡痘病毒载体;和(j)辅助细胞依赖性或无肠腺病毒。复制缺陷型病毒也可能是有利的。不同的载体会或不会变成整合到细胞的基因组中。如果需要,构建体可以包括用于转染的病毒序列。可选地,可以将构建体并入能够游离复制的载体中,例如EPV和EBV载体。iRNA重组表达的构建体通常需要调控元件,例如,启动子、增强子等,以确保iRNA在靶细胞中的表达。对于载体和构建体要考虑的其他方面是本领域已知的。
V.本发明的药物组合物
本发明进一步包括包含本发明的iRNA的药物组合物和制剂。在一个实施方案中,本文提供了含有本文所述的iRNA和药学上可接受的载体的药物组合物。含有iRNA的药物组合物可用于预防或治疗补体因子B相关病症。此类药物组合物是根据递送模式配制的。一个实例是被配制用于经由胃肠外递送,例如通过皮下(SC)、肌内(IM)或静脉内(IV)递送来全身施用的组合物。本发明的药物组合物可以足以抑制补体因子B基因的表达的剂量施用。
在一些实施方案中,本发明的药物组合物是无菌的。在另一个实施例中,本发明的药物组合物是不含热原的。
本发明的药物组合物可以以足以抑制补体因子B基因的表达的剂量施用。通常,本发明的iRNA的合适剂量的范围将为约0.001至约200.0毫克/受体的千克体重/天,通常范围为约1至50毫克/千克体重/天。通常,本发明的iRNA的合适剂量将在约0.1mg/kg至约5.0mg/kg的范围内,如约0.3mg/kg和约3.0mg/kg。重复剂量方案可以包含定期施用治疗量的iRNA,如每月、每3个月至6个月一次或每年一次。在某些实施方案中,iRNA是约每月一次至约每六个月一次施用。
在初始治疗方案之后,可以在不太频繁的基础上施用治疗。治疗的持续时间可以基于疾病的严重程度来确定。
在其它实施方案中,单剂量的药物组合物可以是持久的,使得剂量以不超过1个月、2个月、3个月或4个月的间隔施用。在本发明的一些实施方案中,单剂量的本发明药物组合物约每月施用一次。在本发明的其它实施例中,每季度(即约每三个月)施用单剂量的本发明药物组合物。在本发明的其它实施例中,每年施用两次(即约每六个月一次)单剂量的本发明的药物组合物。
本领域技术人员将理解,某些因素可能影响有效治疗受试者所需的剂量和时间安排,所述因素包含但不限于受试者中存在的突变、之前的治疗、所述受试者的总体健康或年龄以及存在的其它疾病。此外,用预防或治疗有效量的组合物(视情况而定)治疗受试者可以包含单次治疗或系列治疗。
iRNA可以以靶向特定组织(例如,肝细胞)的方式递送。
本发明的药物组合物包含但不限于溶液、乳液和含有脂质体的制剂。这些组合物可以由多种组分产生,所述组分包含但不限于预成型液体、自乳化固体和自乳化半固体。制剂包含靶向肝脏的那些。
本发明的药物制剂可以方便地以单位剂型存在,可以根据制药工业中众所周知的常规技术制备。此类技术包含使活性成分与药物载体或赋形剂结合的步骤。通常,通过将活性成分与液体载体均匀且紧密地缔合来制备制剂。
A.另外的制剂
i.乳液
本发明的组合物可以制备并配制为乳液。乳液通常是一种液体分散在另一种液体中的非均相体系,其液滴形式通常直径超过0.1μm(参见,例如,Ansel′s PharmaceuticalDosage Forms and Drug Delivery Systems,Allen,LV.,Popovich NG.和Ansel HC.,2004,Lippincott Williams&Wilkins(第8版),纽约,NY;Idson,Pharmaceutical DosageForms,Lieberman,Rieger和Banker(编辑),1988,Marcel Dekker,Inc.,纽约,NY,第1卷,第199页;Rosoff,Pharmaceutical Dosage Forms,Lieberman,Rieger和Banker(编辑),1988,Marcel Dekker,Inc.,纽约,N.Y.,第1卷,第245页;Block in Pharmaceutical DosageForms,Lieberman,Rieger和Banker(编辑),1988,Marcel Dekker,Inc.,纽约,N.Y.,第2卷,第335页;Higuchi等人,Remington′s Pharmaceutical Sciences,Mack Publishing Co.,Easton,Pa.,1985,第301页)。乳液通常是包含两个彼此紧密混合和分散的不混溶液相的双相系统。一般来说,乳液可以是油包水(w/o)或水包油(o/w)类型。当水相被细分为微小液滴并分散到大量油相中时,所得组合物称为油包水(w/o)乳液。或者,当油相被细分为微小液滴并分散到大量水相中,所得组合物称为水包油(o/w)乳液。除了分散相和活性药物之外,乳液还可以含有另外的组分,活性药物可以作为溶液存在于水相、油相中或者其本身作为单独的相。根据需要,药物赋形剂如乳化剂、稳定剂、染料和抗氧化剂也可以存在于乳液中。药物乳液还可以是由多于两个相构成的多重乳液,例如在油包水包油(o/w/o)和水包油包水(w/o/w)乳液情况下。这种复杂的制剂通常提供简单二元乳液所没有的某些优点。多重乳液(其中o/w乳液的单个油滴包围小水滴)构成w/o/w乳液。同样,封闭在稳定在油性连续相中的水滴中的油滴系统提供了o/w/o乳液。
乳液的特征是热力学稳定性很小或没有。通常,乳液的分散相或不连续相很好地分散到外相或连续相中,并通过乳化剂或制剂的粘度保持这种形式。其他稳定乳液的方式需要使用可掺入乳液任一相中的乳化剂。乳化剂大致可分为四类:合成表面活性剂、天然存在的乳化剂、吸收基质及精细分散的固体(参见,如,Ansel′s Pharmaceutical DosageForms and Drug Delivery Systems,Allen,LV.,Popovich NG.和Ansel HC.,2004,Lippincott Williams&Wilkins(第8版),纽约,NY;Idson,Pharmaceutical Dosage Forms,Lieberman,Rieger和Banker(编辑),1988,Marcel Dekker,Inc.,纽约,N.Y.,第1卷,第199页)。
合成表面活性剂,也称为表面活性试剂,在乳液制剂中具有广泛的适用性,并已在文献中进行了综述(参见,如,Ansel′s Pharmaceutical Dosage Forms and DrugDelivery Systems,Allen,LV.,Popovich NG.和Ansel HC.,2004,Lippincott Williams&Wilkins(第8版),纽约,NY;Rieger,Pharmaceutical Dosage Forms,Lieberman,Rieger和Banker(编辑),1988,Marcel Dekker,Inc.,纽约,N.Y.,第1卷,第285页;Idson,Pharmaceutical Dosage Forms,Lieberman,Rieger和Banker(编辑),Marcel Dekker,Inc.,纽约,N.Y.,1988,第1卷,第199页)。表面活性剂通常是两亲性的并且包含亲水部分和疏水部分。表面活性剂的亲水性与疏水性特性的比率被称为亲水/亲油平衡(HLB),并且是在制剂制备中对表面活性剂进行分类和选择的有价值的工具。根据亲水基团的性质,表面活性剂可以分为不同的种类:非离子型、阴离子型、阳离子型和两性型(参见,如,Ansel′sPharmaceutical Dosage Forms and Drug Delivery Systems,Allen,LV.,Popovich NG.和Ansel HC.,2004,Lippincott Williams&Wilkins(第8版),纽约,NY;Rieger,Pharmaceutical Dosage Forms,Lieberman,Rieger和Banker(编辑),1988,MarcelDekker,Inc.,纽约,N.Y.,第1卷,第285页)。
乳液制剂中进一步包含众多非乳化材料,它们有助于乳液的性能。这些包括脂肪、油、蜡、脂肪酸、脂肪醇、脂肪酯、保湿剂、亲水胶体、防腐剂和抗氧化剂(Block,Pharmaceutical Dosage Forms,Lieberman,Rieger和Banker(编辑),1988,MarcelDekker,Inc.,纽约,N.Y.,第1卷,第335页;Idson,Pharmaceutical Dosage Forms,Lieberman,Rieger和Banker(编辑),1988,Marcel Dekker,Inc.,纽约,N.Y.,第1卷,第199页)。
乳液制剂通过皮肤病学、口服和肠胃外途径的应用及其制造方法已在文献中进行了综述(参见,如,Ansel′s Pharmaceutical Dosage Forms and Drug Delivery Systems,Allen,LV.,Popovich NG.和Ansel HC.,2004,Lippincott Williams&Wilkins(第8版),纽约,NY;Idson,Pharmaceutical Dosage Forms,Lieberman,Rieger和Banker(编辑),1988,Marcel Dekker,Inc.,纽约,N.Y.,第1卷,第199页)。
ii.微乳液
在本发明的一个实施方案中,iRNA和核酸的组合物被配制为微乳液。微乳液可以定义为水、油和两亲物的系统,它是单一光学各向同性和热力学稳定的液体溶液(参见,如,Ansel′s Pharmaceutical Dosage Forms and Drug Delivery Systems,Allen,LV.,Popovich NG.和Ansel HC.,2004,Lippincott Williams&Wilkins(第8版),纽约,NY;Rosoff,Pharmaceutical Dosage Forms,Lieberman,Rieger和Banker(编辑),1988,MarcelDekker,Inc.,纽约,N.Y.,第1卷,第245页)。通常,微乳液是通过以下方式制备的系统:首先将油分散在表面活性剂水溶液中,然后添加足够量的第四组分(通常是中等链长的醇)以形成透明系统。因此,微乳液也被描述为两种不混溶液体的热力学稳定、各向同性透明分散体,其通过表面活性分子的界面膜进行稳定(Leung和Shah,Controlled Release ofDrugs:Polymers and Aggregate Systems,Rosoff,M.,Ed.,1989,VCH Publishers,纽约,第185-215页)。
iii.微粒
本发明的iRNA可以掺入到颗粒中,例如微颗粒中。微颗粒可以通过喷雾干燥生产,但也可以通过其它方法生产,包含冻干、蒸发、流化床干燥、真空干燥或这些技术的组合。
iv.渗透增强剂
在一个实施方案中,本发明采用多种渗透增强剂来实现核酸、特别是iRNA向动物皮肤的有效递送。大多数药物以离子化和非离子化形式存在于溶液中。然而,通常只有脂溶性或亲脂性药物才容易跨过细胞膜。已经发现,如果要跨过的膜用渗透增强剂处理,则即使是非亲脂性药物也可以跨过细胞膜。除了帮助非亲脂性药物跨细胞膜扩散外,渗透增强剂还增强亲脂性药物的渗透性。
渗透增强剂可分为五大类之一,即表面活性剂、脂肪酸、胆汁盐、螯合剂和非螯合非表面活性剂(参见例如,Malmsten,M.Surfactants and polymers in drug delivery,Informa Health Care,纽约,NY,2002;Lee等人,Critical Reviews in Therapeutic DrugCarrier Systems,1991,第92页)。上述每一类渗透增强剂及其在药物组合物的制造和药剂的递送中的用途是本领域众所周知的。
v.赋形剂
与载体化合物相反,“药学载体”或“赋形剂”是药学可接受的溶剂、悬浮剂或任何其他用于将一种或多种核酸递送至动物的药理学惰性媒剂。赋形剂可以是液体或固体,并根据计划的施用方式进行选择,以便在与核酸和给定药物组合物的其他组分组合时提供所需的体积、稠度等。这种试剂是本领域众所周知的。
vi.其他组分
本发明的组合物可以另外含有在药物组合物中常规存在的其它附属组分,处于其现有技术确定的使用水平。因此,例如,组合物可以含有另外的相容性药物活性材料,例如,止痒药、收敛剂、局部麻醉剂或抗炎剂,或者可以含有可用于物理调配本发明的组合物的各种剂型的另外的材料,如染料、调味剂、防腐剂、抗氧化剂、不透明剂、增稠剂和稳定剂。然而,此类材料,在添加时,不应该不适当地干扰本发明的组合物的成分的生物活性。调配物可以进行灭菌,并且如果期望的话,可以与不与所述调配物的核酸有害地相互作用的助剂,例如润滑剂、防腐剂、稳定剂、润湿剂、乳化剂、用于影响渗透压的盐、缓冲液、着色剂、调味剂或芳香物质等混合。
含水悬浮液可以含有增加悬浮液粘度的物质,包含例如羧甲基纤维素钠、山梨醇或右旋糖酐。悬浮液也可以含有稳定剂。
在一些实施方案中,本发明特征的药物组合物包含(a)一种或多种iRNA和(b)一种或多种通过非iRNA机制起作用并可用于治疗补体因子B相关病症的药剂。
此类化合物的毒性和预防功效可以通过细胞培养物或实验动物中的标准制药程序测定,例如,用于确定LD50(对50%群体致死的剂量)和ED50(对50%群体预防有效的剂量)。毒性作用与治疗效果之间的剂量比为治疗指数并且所述治疗指数可以被表示为比率LD50/ED50。表现出高治疗指数的化合物是优选的。
从细胞培养测定和动物研究获得的数据可以用于调配用于在人中使用的剂量范围。本发明中本文特征的组合物的剂量通常在包含ED50(如ED80或ED90)的循环浓度范围内,几乎没有或没有毒性。根据所采用的剂型和所利用的施用通路,剂量可以在此范围内变化。对于本发明特征的方法中使用的任何化合物,预防有效剂量可以最初根据细胞培养测定估计。可以在动物模型中调配剂量,以达到化合物的循环血浆浓度范围,或者在适当的情况下,达到靶序列的多肽产物的循环血浆浓度范围(例如,实现多肽浓度的降低),所述范围包含细胞培养中确定的IC50或更高水平的抑制(即达到症状的一半最大抑制的测试化合物的浓度)。可以使用此类信息来更精确地确定人体中的有用剂量。可以测量血浆中的水平,例如通过高效液相色谱。
除了其施用之外,如上文所讨论的,本发明特征的iRNA可以与用于预防或治疗补体因子相关病症的其它已知药物组合施用。在任何情况下,施用医师可以基于使用本领域已知或本文所描述的功效的标准测量观察到的结果来调节iRNA施用的量和时机。
VI.抑制补体因子B表达的方法
本发明还提供了抑制细胞中的CFB基因的表达的方法。所述方法包含将细胞与RNAi剂,例如双链RNA剂接触,所述药剂的量有效地抑制细胞中CFB的表达,由此抑制细胞中的CFB的表达。
细胞与iRNA,例如双链RNA剂的接触可以在体外或体内进行。使细胞与iRNA体内接触包含使受试者(例如,人受试者)体内的细胞或细胞组与iRNA接触。体外和体内接触细胞方法的组合也是可能的。如上文所讨论的,接触细胞可以是直接的或间接的。此外,接触细胞可以通过靶向配体实现,包含本文所描述的或本领域已知的任何配体。在某些实施方案中,靶向配体是碳水化合物部分,例如GalNAc配体,或将RNAi剂引导到所关注的位点的任何其它配体。
如本文所使用的,术语“抑制(inhibiting)”可以与“减少”、“沉默”、“下调”、“抑制(suppressing)”和其它类似术语互换使用,并且包含任何水平的抑制。
短语“抑制补体因子B的表达”旨在是指抑制任何补体因子B基因(例如,小鼠补体因子B 3基因、大鼠补体因子B基因、猴补体因子B基因或人补体因子B基因)以及补体因子B基因的变体或突变体的表达。因此,在基因操纵的细胞、细胞组或生物体的背景下,补体因子B基因可以是野生型补体因子B基因、突变体补体因子B基因或转基因补体因子B基因。
“抑制补体因子B基因的表达”包括补体因子B基因的任何水平的抑制,例如补体因子B基因表达的至少部分抑制,如临床相关的抑制水平。补体因子B基因的表达可基于与补体因子B基因表达相关的任何变量的水平或水平变化来评估,例如补体因子B mRNA水平或补体因子B蛋白质水平,或例如作为总溶血补体的量度的CH
可以通过与对照水平相比与补体因子B表达相关的一个或多个变量的绝对或相对水平的降低来评估抑制。对照水平可以是本领域中使用的任何类型的对照水平,例如,给药前基线水平,或从未经治疗或用对照(例如,仅缓冲液对照或无活性药剂对照)治疗的类似受试者、细胞或样品中确定的水平。
在本发明的方法的一些实施方案中,补体因子B基因的表达被抑制至少50%、55%、60%、65%、70%、75%、80%、85%、90%或95%,或低于测定的检测水平。在某些实施方案中,补体因子B基因的表达被抑制至少70%。应进一步理解,在某些组织中,例如,胆囊中抑制补体因子B表达,而在其它组织,例如,脑中不显著抑制表达可能是期望的。在某些实施方案中,使用实例2中提供的测定方法在合适的物种匹配的细胞系中以10nM siRNA浓度确定表达水平。
在某些实施方案中,体内表达的抑制是通过在表达人基因的啮齿类动物,例如,表达人靶基因(即,补体因子B)的AAV感染小鼠中敲低人基因来确定的,例如当以单剂量施用时,例如在RNA表达的最低点以3mg/kg施用。模型动物系统中内源性基因表达的敲低也可以确定,例如,在RNA表达的最低点以例如3mg/kg施用单剂量后。当人基因和模型动物基因的核酸序列足够接近使得人iRNA提供模型动物基因有效敲低时,此类系统是有用的。使用实例2中提供的PCR方法确定肝脏中的RNA表达。
补体因子B基因表达的抑制可以通过第一细胞或细胞组(例如,此类细胞可以存在于源自受试者的样品中)表达的mRNA的量的减少来表现,在所述细胞或细胞组中,补体因子B基因被转录并且已经被处理(例如,通过使一个或多个细胞与本发明的iRNA接触,或通过向存在或曾经存在所述细胞的受试者施用本发明的iRNA),从而与基本上与第一细胞或细胞组相同但尚未如此处理的第二细胞或细胞组(未用iRNA处理或未用靶向所关注的基因的iRNA处理的对照细胞)相比,补体因子B基因的表达受到抑制。在某些实施方案中,通过实例2中提供的方法评估抑制,使用10nM siRNA浓度在物种匹配的细胞系中,并且使用下式将处理的细胞中的mRNA水平表达为对照细胞中mRNA水平的百分比:
在其它实施方案中,可以根据与补体因子B基因表达功能性相关的参数,例如,来自受试者的血液或血清中的补体因子B蛋白水平的降低来评估补体因子B基因表达的抑制。补体因子B基因沉默可以在任何表达补体因子B的细胞中确定,无论是内源性的还是来自表达构建体的异源性的,并且通过本领域已知的任何测定。
补体因子B蛋白的表达的抑制可以通过细胞或细胞组或受试者样品中(例如,源自受试者的血样中的蛋白质水平)表达的补体因子B蛋白水平的降低来表现。如上文所解释的,为了评估mRNA抑制,处理的细胞或细胞组中蛋白质表达水平的抑制可以类似地表达为对照细胞或细胞组中蛋白质水平的百分比,或表达为受试者样品(例如,源自其的血液或血清)中蛋白质水平变化。
可以用于评估补体因子B基因的表达的抑制的对照细胞、细胞组或受试者样品包含尚未与本发明的RNAi剂接触的细胞、细胞组或受试物样品。例如,在用RNAi剂或适当匹配的群体对照治疗受试者之前,对照细胞、细胞组或受试者样品可以源自个体受试者(例如,人或动物受试者)。
细胞或细胞组表达的补体因子B mRNA的水平可以使用本领域已知的用于评估mRNA表达的任何方法来确定。在一个实施方案中,通过检测转录的多核苷酸或其部分,例如补体因子B基因的mRNA来确定样品中补体因子B的表达水平。可以使用RNA提取技术从细胞中提取RNA,包含例如使用酸酚/异硫氰酸胍提取(RNAzol B;Biogenesis)、RNeasy
在一些实施方案中,使用核酸探针确定补体因子B的表达水平。如本文所使用的,术语“探针”是指能够与特定补体因子B选择性地结合的任何分子。探针可以由本领域技术人员合成,或源自适当的生物制剂。探针可以专门设计成被标记。可以用作探针的分子的实例包含但不限于RNA、DNA、蛋白质、抗体和有机分子。
分离的mRNA可以用于杂交或扩增测定,包含但不限于Southern分析或northern分析、聚合酶链式反应(PCR)分析和探针阵列。一种用于确定mRNA水平的方法涉及将分离的mRNA与可以与补体因子B mRNA杂交的核酸分子(探针)接触。在一个实施方案中,mRNA被固定在固体表面上并与探针接触,例如通过在琼脂糖凝胶上运行分离的mRNA并将mRNA从凝胶转移到膜,如硝酸纤维素。在替代性实施例中,探针固定在固体表面上,并且mRNA与探针接触,例如,在
用于确定样品中补体因子B的表达水平的替代性方法涉及样品中例如mRNA的核酸扩增或逆转录酶(以制备cDNA)的过程,例如通过RT-PCR(Mullis,1987,美国专利第4,683,202号中所述的实验实施例)、连接酶链式反应(Barany(1991)Proc.Natl.Acad.Sci.USA,88:189-193)、自持序列复制(Guatelli等人(1990)Proc.Natl.Acad.Sci.USA 87:1874-1878)、转录扩增系统(Kwoh等人(1989)Proc.Natl.Acad.Sci.USA 86:1173-1177)、Q-β复制酶(Lizardi等人(1988)Bio/Technology 6:1197)、滚环复制(Lizard等人,美国专利第5,854,033号)或任何其它核酸扩增方法,然后使用本领域技术人员众所周知的技术检测扩增的分子。如果此类核酸分子以非常低的数量存在,则这些检测方案对于检测核酸分子特别有用。在本发明的特定方面,补体因子B的表达水平通过定量荧光RT-PCR(即,TaqMan
补体因子B mRNA的表达水平可以使用膜印迹(如用于杂交分析,如RNA、DNA、斑点等)或微孔、样品管、凝胶、珠或纤维(或任何包括结合核酸的固相载体)来监测。参见美国专利第5,770,722号、第5,874,219号、第5,744,305号、第5,677,195号和第5,445,934号,所述美国专利通过引用并入本文。补体因子B表达水平的确定也可以包括在溶液中使用核酸探针。
在一些实施方案中,使用支链DNA(bDNA)测定或实时PCR(qPCR)来评估mRNA表达的水平。这些方法的使用在本文给出的实例中进行了描述和例示。在一些实施方案中,通过实例2中提供的方法,使用例如10nM siRNA浓度,在物种匹配的细胞系中确定表达水平。
CFB蛋白表达的水平可以使用本领域已知的任何用于测量蛋白质水平的方法来确定。此类方法包含,例如,电泳、毛细管电泳、高效液相色谱法(HPLC)、薄层色谱法(TLC)、超扩散色谱法、流体或凝胶沉淀反应、吸收光谱法、比色测定、分光光度测定、流式细胞术、免疫扩散(单或双)、免疫电泳、蛋白质印迹、放射免疫测定(RIA)、酶联免疫吸附测定(ELISA)、免疫荧光测定、电化学发光测定等。
在一些实施方案中,通过补体因子B mRNA或蛋白质水平的降低(例如,在肝活检中)来评估本发明的方法的功效。
在本发明的方法的一些实施方案中,向受试者施用iRNA,从而将iRNA递送到受试者体内的特定位点。补体因子B表达的抑制可以使用源自受试者体内特定部位(例如,肝脏或血液)的流体或组织的样品中补体因子B mRNA或补体因子B蛋白的水平或水平变化的测量来评估。
如本文所使用的,术语检测或确定分析物的水平被理解为执行步骤以确定是否存在材料(例如,蛋白质、RNA)。如本文所使用的,检测或确定的方法包含检测或确定低于所使用的方法的检测水平的分析物水平。
VII.本发明的预防和治疗方法
本发明还提供了使用本发明的iRNA或含有本发明的iRNA的组合物来抑制补体因子B的表达的方法,由此预防或治疗补体因子B相关的病症,例如阵发性睡眠性血红蛋白尿症(PNH)、非典型溶血性尿毒综合征(aHUS)、哮喘、类风湿性关节炎(RA);抗磷脂抗体综合征;狼疮肾炎;缺血-再灌注损伤;典型的或感染性溶血性尿毒综合征(tHUS);致密沉积物病(DDD);视神经脊髓炎(NMO);多灶性运动神经病(MMN);多发性硬化(MS);黄斑变性(例如,年龄相关性黄斑变性(AMD));溶血、肝酶升高和低血小板(HELLP)综合征;血栓性血小板减少性紫癜(TTP);自发性流产;寡免疫血管炎;大疱性表皮松解症;习惯性流产;先兆子痫、创伤性脑损伤、重症肌无力、冷凝集素病、皮肌炎大疱性类天疱疮、志贺毒素大肠杆菌相关的溶血性尿毒综合征、C3肾病、抗嗜中性粒细胞细胞质抗体相关血管炎(例如,肉芽肿病伴多血管炎(以前称为Wegener肉芽肿病)、变应性肉芽肿性血管炎和显微镜下多血管炎)、体液和血管移植排斥、移植物功能异常、心肌梗塞(例如,心肌梗塞中的组织损伤和缺血)、同种异体移植、脓毒症(例如,脓毒病不良结果)、冠状动脉病、皮肌炎、格雷夫斯病、动脉粥样硬化、阿尔茨海默病、全身性炎症反应脓毒症、脓毒性休克、脊髓损伤、肾小球肾炎、桥本氏甲状腺炎、I型糖尿病、银屑病、天疱疮、自身免疫性溶血性贫血(AIHA)、ITP、古德帕斯彻综合征、德戈斯病、抗磷脂综合征(APS)、灾难性APS(CAPS)、心血管障碍、心肌炎、脑血管障碍、外周(例如,肌肉骨骼)血管障碍、肾血管障碍、肠系膜/肠血管障碍、血管炎、
在一个实施方案中,补体因子B相关疾病选自C3肾小球病、系统性红斑狼疮(SLE),例如狼疮性肾炎、IgA肾病、糖尿病性肾病、多裳肾病、膜性肾病、年龄相关性黄斑变性、非典型溶血性尿毒综合征、血栓性微血管病、重症肌无力、缺血和再灌注损伤、阵发性睡眠性血红蛋白尿症和类风湿性关节炎。
在另一个实施方案中,补体因子B相关疾病选自C3肾小球病、系统性红斑狼疮(SLE),例如狼疮性肾炎、IgA肾病、糖尿病性肾病和多囊肾病。
在本发明的方法中,细胞可以在体外或体内与siRNA接触,即细胞可以在受试者体内。
适用于使用本发明的方法进行处理的细胞可以是表达补体因子B基因的任何细胞,例如,肝细胞、脑细胞、胆囊细胞、心脏细胞或肾细胞。在一个实施方案中,细胞是肝细胞。适用于本发明的方法的细胞可以是哺乳动物细胞,例如灵长类动物细胞(如人细胞,包含嵌合非人动物中的人细胞,或非人灵长类动物细胞,例如猴细胞或黑猩猩细胞)或非灵长类动物细胞。在某些实施方案中,细胞是人细胞,例如人肝细胞。在本发明的方法中,补体因子B在细胞中的表达被抑制至少50、55、60、65、70、75、80、85、90或95,或抑制到低于测定的检测水平的水平。
本发明的体内方法可包含向受试者施用含有iRNA的组合物,其中所述iRNA包含核苷酸序列,所述核苷酸序列与待施用RNAi剂的哺乳动物的补体因子B基因的RNA转录物的至少一部分互补。组合物可以通过本领域已知的任何方式施用,包含但不限于口服、腹膜内或肠胃外通路,包含颅内(例如,脑室内、脑实质内和鞘内)、静脉内、肌内、皮下、透皮、气道(气溶胶)、鼻内、直肠和局部(包含经颊和舌下)施用。在某些实施方案中,组合物通过静脉输注或注射施用。在某些实施方案中,组合物通过皮下注射施用。在某些实施方案中,组合物通过肌内注射施用。
在一些实施方案中,施用是经由贮库注射。贮库注射可以在延长的时间段内以一致的方式释放iRNA。因此,贮库注射可降低获得所需效果(例如所需的CFB抑制或者治疗或预防效果)所需的给药频率。贮库注射也可提供更一致的血清浓度。贮库注射可包括皮下注射或肌内注射。在某些实施方案中,贮库注射是皮下注射。
在一些实施方案中,通过泵施用。泵可以是外部泵或手术植入泵。在某些实施方案中,泵是皮下植入的渗透泵。在其它实施方案中,泵是输注泵。输注泵可用于静脉内、皮下、动脉或硬膜外输注。在某些实施方案中,输注泵是皮下输注泵。在其它实施方案中,泵是将iRNA递送至肝脏的手术植入泵。
施用方法可以根据是否需要局部或全身治疗以及基于待治疗的区域来选择。可以选择施用途径和部位以增强靶向。
在一个方面,本发明还提供了用于抑制哺乳动物的补体因子B基因的表达的方法。所述方法包含向哺乳动物施用包括靶向哺乳动物的细胞中的补体因子B基因的dsRNA的组合物,并且维持哺乳动物足够的时间以获得补体因子B基因的mRNA转录物的降解,由此抑制细胞中补体因子B基因的表达。基因表达的减少可以通过本领域已知的任何方法和通过本文所描述的(例如,实例2中)方法(例如,qRT-PCR)来评估。蛋白质产生的减少可以通过本领域已知的任何方法来评估,例如ELISA。在某些实施方案中,穿刺肝活检样品用作组织材料,用于监测补体因子B基因或蛋白质表达的减少。在其它实施方案中,血样用作用于监测补体因子B蛋白表达减少的受试者样品。
本发明还提供了对有需要的受试者的治疗方法,例如诊断患有补体因子B相关病症的受试者,如C3肾小球病、系统性红斑狼疮(SLE),例如狼疮肾炎、IgA肾病、糖尿病性肾病和多囊肾病。
本发明进一步提供了在有需要的受试者中进行预防的方法。本发明的治疗方法包含将本发明的iRNA以预防有效量的靶向补体因子B基因的dsRNA或包括靶向补体因子B基因的iRNA的药物组合物向受试者施用,例如将受益于补体因子B表达减少的受试者。
在一个实施方案中,补体因子B相关疾病选自阵发性睡眠性血红蛋白尿症(PNH)、非典型溶血性尿毒综合征(aHUS)、哮喘、类风湿性关节炎(RA);抗磷脂抗体综合征;狼疮肾炎;缺血-再灌注损伤;典型的或感染性溶血性尿毒综合征(tHUS);致密沉积物病(DDD);视神经脊髓炎(NMO);多灶性运动神经病(MMN);多发性硬化(MS);黄斑变性(例如,年龄相关性黄斑变性(AMD));溶血、肝酶升高和低血小板(HELLP)综合征;血栓性血小板减少性紫癜(TTP);自发性流产;寡免疫血管炎;大疱性表皮松解症;习惯性流产;先兆子痫、创伤性脑损伤、重症肌无力、冷凝集素病、皮肌炎大疱性类天疱疮、志贺毒素大肠杆菌相关的溶血性尿毒综合征、C3肾病、抗嗜中性粒细胞细胞质抗体相关血管炎(例如,肉芽肿病伴多血管炎(以前称为Wegener肉芽肿病)、变应性肉芽肿性血管炎和显微镜下多血管炎)、体液和血管移植排斥、移植物功能异常、心肌梗塞(例如,心肌梗塞中的组织损伤和缺血)、同种异体移植、脓毒症(例如,脓毒病不良结果)、冠状动脉病、皮肌炎、格雷夫斯病、动脉粥样硬化、阿尔茨海默病、全身性炎症反应脓毒症、脓毒性休克、脊髓损伤、肾小球肾炎、桥本氏甲状腺炎、I型糖尿病、银屑病、天疱疮、自身免疫性溶血性贫血(AIHA)、ITP、古德帕斯彻综合征、德戈斯病、抗磷脂综合征(APS)、灾难性APS(CAPS)、心血管障碍、心肌炎、脑血管障碍、外周(例如,肌肉骨骼)血管障碍、肾血管障碍、肠系膜/肠血管障碍、血管炎、
在一个实施方案中,补体因子B相关疾病选自C3肾小球病、系统性红斑狼疮(SLE),例如狼疮性肾炎、IgA肾病、糖尿病性肾病、多囊肾病、膜性肾病、年龄相关性黄斑变性、非典型溶血性尿毒综合征、血栓性微血管病、重症肌无力、缺血和再灌注损伤、阵发性睡眠性血红蛋白尿症和类风湿性关节炎。
在另一个实施方案中,补体因子B相关疾病选自C3肾小球病、系统性红斑狼疮(SLE),例如狼疮性肾炎、IgA肾病、糖尿病性肾病和多囊肾病。
本发明的iRNA可以作为“游离iRNA”施用。在不存在药物组合物的情况下施用游离iRNA。裸露的iRNA可以在合适的缓冲溶液中。缓冲溶液可以包括乙酸盐、柠檬酸盐、醇溶蛋白、碳酸盐或磷酸盐,或其任何组合。在一个实施方案中,缓冲溶液是磷酸盐缓冲盐水(PBS)。可以调节含有iRNA的缓冲溶液的pH和渗透压,使得其适合向受试者施用。
可选地,本发明的iRNA可以作为药物组合物,如dsRNA脂质体调配物施用。
受益于补体因子B基因表达的抑制的受试者是易患或诊断为CFB相关病症的受试者,例如C3肾小球病、系统性红斑狼疮(SLE),例如狼疮肾炎、IgA肾病、糖尿病性肾病和多囊肾病。
在一个实施方案中,所述方法包括施用本文特征的组合物,使得靶补体因子B基因的表达降低,如每剂量约1、2、3、4、5、6、1-6、1-3或3-6个月。在某些实施方案中,组合物每3个月至6个月施用一次。
在一个实施方案中,可用于本文所述的方法和组合物的iRNA特异性靶向靶补体因子B基因的RNA(初级或加工的)。使用iRNA抑制这些基因的表达的组合物和方法可以如本文所描述的制备和进行。
根据本发明方法施用iRNA可导致补体因子B相关病症的预防或治疗,例如C3肾小球病、系统性红斑狼疮(SLE),例如狼疮肾炎、IgA肾病、糖尿病性肾病和多囊肾病。
受试者可以施用治疗量的iRNA,例如约0.01mg/kg至约200mg/kg。受试者可以施用治疗量的iRNA,例如约5mg至约1000mg作为固定剂量,与体重无关。
在一些实施方案中,iRNA皮下施用,即通过皮下注射。可使用一次或多次注射将所需剂量的iRNA递送至受试者。可以在一段时间内重复注射。
可以定期重复施用。在某些实施方案中,在初始治疗方案之后,可以在不太频繁的基础上施用治疗。重复剂量方案可以包含定期施用治疗量的iRNA,如每月一次至每年一次。在某些实施方案中,iRNA约每月施用一次至约每三个月施用一次,或约每三个月施用一次至约每六个月施用一次。
本发明还提供了iRNA剂或其药物组合物用于治疗将受益于CFB基因表达的减少或抑制的受试者,例如患有CFB相关病症的受试者的方法和用途,其与其它药物或其它治疗方法组合,例如,与已知药物或已知治疗方法组合,例如目前用于治疗这些病症的那些药物或治疗方法。
因此,在本发明的一些方面,包含本发明的单个iRNA剂的方法进一步包含向受试者施用一种或多种另外的治疗剂。iRNA剂和另外的治疗剂或治疗可以同时施用或以相同的组合施用,例如胃肠外施用,或另外的治疗剂可以作为单独组合物的部分或在单独时间施用或者通过本领域已知或本文所述的另一种方法施用。
在一个实施方案中,本发明的iRNA剂与抗补体组分C5抗体或其抗原结合片段(例如依库珠单抗或ravulizumab-cwvz)、靶向补体组分C5的iRNA剂、靶向补体组分C3的iRNA剂或C3肽抑制剂(例如坎普他汀)组合施用。在一个实施方案中,本发明的iRNA剂施用于患者,然后将另外的治疗剂施用于患者(或反之亦然)。在另一个实施方案中,本发明的iRNA剂和另外的治疗剂同时施用。
本发明的iRNA剂和另外的治疗剂或治疗可以同时施用或以相同的组合施用,例如胃肠外施用,或另外的治疗剂可以作为单独的组合物的部分或在单独的时间施用或者通过本领域已知的或本文描述的另一种方法施用。
VIII.试剂盒
在某些方面,本公开提供了试剂盒,所述试剂盒包含含有siRNA化合物(例如,双链siRNA化合物或ssiRNA化合物(例如,前体,例如可以加工成ssiRNA化合物的较大siRNA化合物,或编码siRNA化合物的DNA,例如双链siRNA化合物或siRNA化合物,或其前体))的药物调配物的合适容器。
此类试剂盒包含一种或多种dsRNA剂和使用说明书,例如,施用预防或治疗有效量的dsRNA剂的说明书。dsRNA剂可以在小瓶或预先填充的注射器中。试剂盒可以任选地进一步包括用于施用dsRNA剂的装置(例如,注射装置,如预填充注射器),或用于测量CFB的抑制的装置(例如,用于测量CFB mRNA、CFB蛋白或补体因子CFB活性的抑制的装置)。用于测量CFB的抑制的此类装置可以包括用于从受试者获得样品,例如血浆样品的装置。本发明的试剂盒可以任选地进一步包括用于确定治疗有效量或预防有效量的装置。
在某些实施方案中,药物制剂的单个组分可以提供在一个容器中,例如小瓶或预填充的注射器。可替代地,可能期望在两个或更多个容器中单独提供药物调配物的组分,例如,一个容器用于siRNA化合物制剂,并且至少另一个用于载体化合物。试剂盒可以包装在许多不同的配置中,如单个盒子中的一个或多个容器。可以将不同的组分组合,例如,根据随试剂盒提供的说明书。这些组分可以根据本文所描述的方法进行组合,例如,以制备和施用药物组合物。试剂盒还可以包含递送装置。
本发明通过以下实例进一步说明,所述实例不应被解释为限制性的。在本申请中引用的所有公开出版物、专利和公开的专利申请的全部内容以及非正式序列表和附图特此通过引用并入本文。
实施例
实施例1.iRNA合成
试剂来源
在本文没有具体给出试剂来源的情况下,此类试剂可以从任何分子生物学试剂供应商处获得,其质量/纯度标准适用于分子生物学。
siRNA设计
靶向人补体因子B(CFB)基因(人:NCBI refseqID NM_001710.6,NCBI GeneID:629)的siRNA是使用定制R和Python脚本设计的。人NM_001710 REFSEQ mRNA,版本6,具有2476个碱基的长度。未修饰的CFB有义和反义链核苷酸序列的详细列表如表2所示。修饰的CFB有义和反义链核苷酸序列的详细列表如表3所示。
应理解,在整个申请中,没有小数的双链体名称对应于具有仅引用双链体的批号的具有小数的双链体名称。例如,AD-959917对应于AD-959917.1。
siRNA合成
使用本领域已知的常规方法合成siRNA并退火。
简而言之,siRNA序列是使用Mermade 192合成器(BioAutomation)在1umol的规模上合成的,所述合成器在固相载体上具有亚磷酰胺化学。固相载体是受控孔玻璃
固相合成完成后,用300μL的甲胺(40%水溶液)在室温下在96孔板中处理固相支持的寡核糖核苷酸大约2小时,以从固相载体中切割,并且随后去除所有另外的碱不稳定保护基。对于含有用叔丁基二甲基甲硅烷基(TBDMS)基团保护的任何天然核糖核苷酸键(2′-OH)的序列,使用TEA.3HF(三乙基胺三氢氟酸盐)进行第二次脱保护步骤。向甲胺水溶液中的每个寡核苷酸溶液中添加200μL的二甲基亚砜(DMSO)和300μL TEA.3HF,并且将溶液在60℃下温育大约30分钟。温育后,使板达到室温,并且通过添加1mL的9∶1乙腈∶乙醇或1∶1乙醇∶异丙醇沉淀粗寡核苷酸。然后将板在4℃下离心45分钟,并且在多通道移液管的帮助下小心倾析上清液。将寡核苷酸颗粒重悬于20mM NaOAc中,并且随后在配备有自动进样器、UV检测器、电导率计和级分收集器的Agilent LC系统上使用HiTrap尺寸排除柱(5mL,GEHealthcare)脱盐。在96孔板中收集脱盐样品,并且然后通过LC-MS和UV光谱法进行分析,以分别证实材料的同一性和定量。
在Tecan液体处理机器人上进行单链的双面折叠。在96孔板中,将有义和反义单链以等摩尔比组合到1x PBS中的最终浓度10μM,将板密封,在100℃下温育10分钟,并且随后允许其在2小时至3小时内缓慢恢复到室温。证实每个双链体的浓度和同一性,并且然后用于体外筛选测定。
表1:用于核酸序列表示的核苷酸单体的缩略语。应理解,当这些单体存在于寡核苷酸中时,通过5′-3′-磷酸二酯键相互连接;并且应理解,当核苷酸含有2′-氟修饰时,则氟替代亲本核苷酸中该位置处的羟基(即,其为2′-脱氧-2′-氟核苷酸)。还应理解,当置于寡核苷酸的3′-末端位置时,表中的核苷酸缩写省略3′-磷酸(即,它们是3′-OH)。
L10N-(胆固醇甲酰胺基己酰基)-4-羟基脯氨醇(Hyp-C6-Chol)
实施例2.体外筛选方法
细胞培养和转染:
在原代人肝细胞(PHH,BioIVT)中进行转染测定。向384孔板中通过加入5μl Opti-MEM加0.1μl Lipofectamine RNAiMaX(Invitrogen,Carl sbad CA.cat#13778-150)至每孔5μl siRNA双链体,室温下孵育15分钟。然后将40μl含有~10x10
使用DYNABEADS mRNA分离试剂盒的总RNA分离:
使用Dynabeads
通过进行RT-qPCR分析定量CFB mRNA水平。将2μl cDNA加入到384孔板中每孔含有0.5μl人或食蟹猴GAPDH TaqMan探针,0.5μl人或食蟹猴CFB探针(Hs00156060_ml)和5μlLightcycler 480探针主混合物(Roche Cat#04887301001)的主混合物中。在LightCycler480实时PCR系统(Roche)中进行实时PCR。为了计算相对倍数变化,使用Δ-Δ阈值循环(相对定量)(ΔΔC
表2和表3中dsRNA剂在PHH细胞中的单剂量转染筛选结果如表4所示。
表4.原代人肝细胞中的体外单剂量筛选
实施例3.体外筛选方法
还通过在原代人肝细胞和原代食蟹猴肝细胞中的转染和自由摄取来评估双链体的子集。
在原代人肝细胞(PHH,BioIVT)和原代食蟹猴肝细胞(PCH,BioIVT)中进行转染和自由摄取测定。通过向384孔板中加入5μl Opti-MEM加0.1μl Lipofectamine RNAiMaX(Invitrogen,Carlsbad CA.cat#13778-150)至每孔5μl siRNA双链体,室温下孵育15分钟。然后将40μl含有~10x10
使用Dynabeads
通过进行RT-qPCR分析定量CFB mRNA水平。将2μl cDNA加入到384孔板中每孔含有0.5μl人或食蟹猴GAPDH TaqMan探针,0.5μl人或食蟹猴CFB探针(Hs00156060_ml)和5μlLightcycler 480探针主混合物(Roche Cat#04887301001)的主混合物中。在LightCycler480实时PCR系统(Roche)中进行实时PCR。为了计算相对倍数变化,使用Δ-Δ阈值循环(相对定量)(ΔΔC
PHH和PCH细胞中单剂量转染筛选和自由摄取筛选的结果分别显示在表5和6中。
实施例4. dsRNA双链体的体内筛选
单剂量研究(1mg/kg)
在体内评价从上述体外研究中鉴定的目的双链体。特别地,在给药前第-21天,通过眼眶后递送,用编码人CFB的腺伴随病毒8(AAV8)载体的2×10
在第0天,对三只小鼠的各组皮下施用单一1mg/kg剂量的目的双链体或磷酸盐缓冲盐水(PBS)。表7提供了治疗设计并提供了目的双链体。在给药前第0天和给药后第7天,收集K2EDTA血浆并通过ELISA(测定Ppro#EF7001)分析样品的人CFB蛋白。所有血浆样品在lx稀释液中以1∶1000稀释,并根据制造商的方案进行ELISA。数据使用GraphPad Prism软件使用4-参数逻辑曲线内插。
对于所有样品,将人CFB蛋白水平针对个体动物的第0天水平标准化以计算相对%剩余人CFB蛋白。对于各组,计算平均%剩余CFB蛋白(±标准差[SD])。
数据表示为基线值的百分比并呈现为平均值加标准偏差。列于表8和示于图2中的结果表明,所测试的示例性双链体剂有效降低体内人CFB蛋白的水平。
表7.处理组
表8.体内筛选
等同
本领域技术人员将认识到或能够仅使用常规实验确定本文所述的具体实施方案和方法的许多等同物。这些等同物旨在包括在所附权利要求的范围内。
非正式序列表
SEQ ID NO:1
>gi|1732746151|ref|NM_001710.6人补体因子B(CFB),mRNA
SEQ ID NO:2
>gi|218156288|ref|NM_008198.2|小鼠补体因子B(Cfb),转录物变体1,mRNA
SEQ ID NO:3
>gi|218156290|ref|NM_001142706.1|小鼠补体因子B(Cfb),转录物变体2,mRNA
SEQ ID NO:4
>gi|218156284|ref|NM_212466.3|大鼠补体因子B(Cfb),mRNA
SEQ ID NO:5
>gi|57114201|ref|NM_001009169.1|黑猩猩补体因子B(CFB),mRNA
SEQ ID NO:6-食蟹猴补体因子B
>ENSMMUP00000000985[mRNA]基因座=scaffold3881:47830:53620:-
SEQ ID NO:7
>gi|544428919|ref|XM_005553440.1|PREDICTED:食蟹猴补体因子B(CFB),转录物变体X1,mRNA
SEQ ID NO:8
SEQ ID NO:1的反向互补序列
SEQ ID NO:9
SEQ ID NO:2的反向互补序列
SEQ ID NO:10
SEQ ID NO:3的反向互补序列
SEQ ID NO:11
SEQ ID NO:4的反向互补序列
SEQ ID NO:12
SEQ ID NO:5的反向互补序列
SEQ ID NO:13
SEQ ID NO:6的反向互补序列
SEQ ID NO:14
SEQ ID NO:7的反向互补序列
- 包含聚乳酸聚合物、聚乙酸乙烯酯聚合物和增塑剂的泡沫组合物、制品及其制备和使用方法
- 选择用于抛光中氮化物去除的含水二氧化硅浆料和胺羧酸组合物及其使用方法
- 作为免疫抑制化合物的糖原和植物糖原纳米颗粒、和组合物及它们的使用方法
- 因子XII(哈格曼因子)(F12)、激肽释放酶B、血浆(夫列契因子)1(KLKB1)和激肽原1(KNG1)iRNA组合物及其使用方法
- 因子XII(哈格曼因子)(F12)、激肽释放酶B、血浆(夫列契因子)1(KLKB1)和激肽原1(KNG1)iRNA组合物及其使用方法
