通过抑制转录因子来使中枢神经系统胶质细胞群恢复活力的方法和组合物
文献发布时间:2024-07-23 01:35:12
本申请要求2021年10月20日提交的美国临时申请号63/257,827和2022年6月8日提交的美国临时申请号63/350,039、63/350,041、63/350,042的优先权,这些申请通过引用并入本文。
本发明是在美国国立卫生研究院授予的NS110776和AG072298下的政府支持下完成的。政府对本发明享有一定的权利。
技术领域
本申请涉及用抑制转录因子的试剂使CNS胶质细胞群恢复活力的方法和组合物。
背景技术
胶质祖细胞(GPC,也称为少突胶质细胞祖细胞和NG2细胞)在发育期间定植于人脑中,并且在整个成年期持续大量存在。在发育过程中,人类GPC(hGPC)是高度增殖的双能细胞,产生新的少突胶质细胞和星形胶质细胞(French-Constant and Raff,“ProliferatingBipotential Glial Progenitor Cells in Adult Rat Optic Nerve,”Nature 319:499-502(1986)and Raff et al.,“A Glial Progenitor Cell that Develops in Vitro intoan Astrocyte or an Oligodendrocyte Depending on Culture Medium,”Nature 303:390-396(1983))。在啮齿类动物中,这种能力在正常衰老过程中减弱,老年GPC的增殖、迁移和分化能力都会减弱(Chari et al.,“Decline in Rate of Colonization ofOligodendrocyte Progenitor Cell(OPC)-depleted Tissue by Adult OPCs With Age,”J.Neuropathol.Exp.Neurol.62:908-916(2003);Gao and Raff,“Cell Size Control anda Cell-intrinsic Maturation Programin Proliferating Oligodendrocyte PrecursorCells,”J.Cell Biol.138:1367-1377(1997);Moyon et al.,“TET1-mediated DNAHydroxymethylation Regulates Adult Remyelination in Mice,”NatureCommunications 12:3359-3359(2021);Segel et al.,“Niche Stiffness Underlies theAgeing of Central Nervous System Progenitor Cells,”Nature 573:130-134(2019);Tang et al.,“Long-Term Culture of Purified Postnatal OligodendrocytePrecursor Cells.Evidence for an Intrinsic Maturation Program that Plays OutOver Months,”J.Cell Biol.148:971-984(2000);Temple&Raff,“Clonal Analysis ofOligodendrocyte Development in Culture:Evidence for aDevelopmental Clock thatCounts Cell Divisions,”Cell 44:773-779(1986);Wolswijk&Noble,“Identificationof an Adult-Specific Glial Progenitor Cell,”Development 105:387-400(1989);和Wren et al.,“In Vitro Analysis of the Origin and Maintenance of O-2AadultProgenitor Cells,”J.Cell Biol.116,:167-176(1992))。同样,之前发现,当被移植到先天性髓鞘发育不良的小鼠宿主中时,成人GPC的增殖能力、迁移能力均低于胎儿GPC并且比胎儿GPC更容易分化(Windrem et al.,“Fetal and Adult Human OligodendrocyteProgenitor Cell Isolates Myelinate the Congenitally Dysmyelinated Brain,”Nat.Med.10:93-97(2004))。然而,尽管胎儿和成人hGPC的能力明显不同,以及关于衰老啮齿动物模型中GPC转录的丰富数据(Bouhrara et al.,“Evidence of Demyelination inMild Cognitive Impairment and Dementia Using a Direct and Specific MagneticResonance Imaging Measure of Myelin Content,”Alzheimers Dement.14:998-1004(2018);de la Fuente et al.,“Changes in the Oligodendrocyte Progenitor CellProteome with Ageing,”Mol.Cell Proteomics 19:1281-1302(2020);Neumann et al.,“Metformin Restores CNS Remyelination Capacity by Rejuvenating Aged StemCells,”Cell Stem Cell 25:473-485e478(2019);和Spitzer et al.,“OligodendrocyteProgenitor Cells Become Regionally Diverse and Heterogeneous with Age,”Neuron101:459-471e455(2019)),很少有数据可以解决人类衰老过程中GPC基因表达的变化(Perlman et al.,“Developmental Trajectory of Oligodendrocyte Progenitor Cellsin the Human Brain Revealed by Single Cell RNA Sequencing,”Glia 68:1291-1303(2020)和Sim et al.,“Complementary Patterns of Gene Expression by HumanOligodendrocyte Progenitors and their Environment Predict Determinants ofProgenitor Maintenance and Differentiation,”Ann.Neurol.59:763-779(2006)),或者提供胎儿和成人GPC转录的清晰的头对头比较。
本公开旨在克服本领域的缺陷。
发明内容
本申请的一个方面涉及一种诱导成体胶质祖细胞群恢复活力的方法。该方法包括向成体胶质祖细胞群施用有效量的抑制选自下组的一种或多种转录因子的试剂的步骤:(i)锌指蛋白274(ZNF274),(ii)Myc相关因子X(MAX),(iii)E2F转录因子6(E2F6),(iv)锌指蛋白Aiolos(IKZF3),以及(v)信号转导因子和转录激活子3(STAT3)。
本申请的另一个方面涉及治疗患有胶质细胞相关病症的受试者的方法。该方法包括向受试者施用有效量的抑制选自ZNF274、MAX、E2F6、IKZF3和STAT3的一种或多种转录因子的试剂的步骤。
附图说明
图1显示人胎儿GPC的批量RNA-Seq表征。A图.CD140a+、CD140a-和A2B5+/PSA-NCAM-选择的妊娠中期人胎儿脑分离物的批量测序和scRNA测序工作流程。B图.两批所有样品的主成分分析。C图.CD140a+vs CD140a-、CD140+vs A2B5+/PSA-NCAM-差异表达基因集的维恩图(p<0.01,绝对log2倍数变化>1)。D图.两个基因集的显著性Ingenuity通路分析项。大小表示-log10 p值,颜色表示激活Z-评分(蓝色,CD140a+;红色,A2B5+或CD140a-)。E图.两个基因集的显著性基因的log2倍数变化。缺失的条形图为不显著。F图.E图19中所选基因的每百万转化转录本(TPM)热图。
图2显示CD140a和A2B5选择的人胎儿GPC的单细胞RNA测序。A图.来源于20周胎龄人类胎儿VZ/SVZ的FACS分离的hGPC的scRNA-Seq分析期间鉴定的原代细胞类型的UMAP图。B图-C图.仅PSA-NCAM-/A2B5+(B)或CD140a+(C)人胎儿细胞的UMAP。D图.细胞类型选择性标记基因的小提琴图。E图.GPC vs pre-GPC群的火山图。F图.GPC和pre-GPC之间选择的差异表达基因的特征图。G图.选择显著富集的GPC和pre-GPC IPA项,表示其-log10 p值和激活Z-评分。H图.选择预测在胎儿hGPC中被显著激活的转录因子的特征图。相对转录因子调节子激活显示为使用SCENIC软件包计算。
图3显示成体人GPC在转录和功能上与胎儿GPC不同。A图.人类成体和胎儿GPC的批量RNA-Seq分析的工作流程。B图.三批所有样品的主成分分析。C图.成体vs胎儿差异表达基因集的维恩图。D图.精选项和基因的IPA网络。节点大小与节点度成比例。标记颜色对应于成体(红色)或胎儿(蓝色)群中的富集。E图.按模块分列的显著IPA项的条形图。Z-评分表示胎儿(蓝色)或成体(红色)hGPC的预测激活。F图.log2倍数变化的条形图和网络基因TPM的热图。
图4显示转录因子活性的推断表明在成体hGPC身份的建立中涉及一组转录阻遏物。A图.预测在胎儿和成体GPC中具有活性的显著富集转录因子的归一化富集评分图。每个点都是一个基序,其大小表示该基序预计有多少个基因处于活跃状态,颜色代表启动子周围的窗口,在该窗口中发现该基序富集。对于两种胎儿hGPC分离物,B图.富集的TF TPM的热图,和C图,相对于成人GPC的log倍数变化。D图-G图.预测精选基因的直接转录因子活性分为D胎儿激活子,E图,胎儿阻遏物,F图,成体激活子,图G,成体阻遏物。颜色表示在成体(红色)或胎儿(蓝色)hGPC中的差异表达;形状表示节点的类型(八角形,阻遏物;矩形,激活子;椭圆形,其他靶基因)。加框和圈出的基因表示有助于神经胶质祖细胞/少突胶质细胞身份、衰老/增殖靶点或也被认为激活的上游或下游TF的功能相关基因。
图5显示通过成体hGPC富集的阻遏物对老化的GPC转录组的诱导。A图.概述四种不同的多西环素(Dox)诱导的EGFP慢病毒表达载体的结构示意图,每种载体编码一种转录阻遏物:E2F6、IKZF3、MAX或ZNF274。B图.将诱导多能干细胞(iPSC)衍生的hGPC培养物(细胞系C27(Chambers等,Nature biotechnology,27,275-280,2009;Wang等,cell stem cell 12,252-264,2013))用单一慢病毒或载体转导一天,然后用Dox处理剩余的实验。在Dox诱导的转基因表达开始后的3、7和10天,通过FACS分离hGPC用于qPCR。C图.Dox处理的细胞的qPCR显示每种转录因子表达,与匹配的时间点对照相比。D图.选择衰老相关基因的qPCR倍数变化热图。在时间点内与对照组的比较是通过回归细胞批次效应后线性模型的事后最小二乘均值检验来计算的。FDR调整后的p值:*<0.05,**<0.01,***<0.001。
图6显示miRNA与转录因子活性平行地驱动成体GPC转录差异。A图.人A2B5+成体和CD140a+胎儿GPC的miRNA微阵列样本的主成分分析。B图.差异表达miRNA的Log2倍数变化条形图和热图。C图.miRNA富集的特征气泡图,相对于其预测基因靶标的平均log2 FC。D图-E图.D图,胎儿(上)和E图,成体(下)富集的miRNA及其预测靶标的精选信号网络。
图7,与图1相关,显示了通过CD140a+或A2B5+/PSA-NCAM-选择人胎儿GPC的富集:A图.CD140a+和A2B5+胎儿GPC的主成分分析。B图.火山图显示显著的A2B5(绿色)和CD140a(蓝色)富集基因。C图.CD140a+和CD140a-胎儿细胞的主成分分析。D图.火山图显示显著的CD140a-(品红色)和CD140a(蓝色)富集基因。E图.两个基因集中显著上调和下调基因的集合图(upset plot)。
图8,与图2相关,显示单细胞RNA-Seq质量滤波:未过滤的A图.A2B5+/PSA-NCAM-和B图.CD140a scRNA-Seq捕获的小提琴图。C-D图,对C图,A2B5+/PSA-NCAM-和D图,CD140a+捕获进行质量过滤(线粒体基因表达百分比<15%和>500个独特基因)后的小提琴图。
图9,与图2相关,显示PSA-NCAM-/A2B5+vs CD140a+胎儿hGPC的单细胞RNA测序:A图.A2B5+和CD140a+胎儿hGPC的UMAP图。B图.每个分类模式分离的细胞类型频率。C图.CD140a+和A2B5+胎儿hGPC分离物之间差异表达的批量RNA-Seq log2倍数变化vs伪批量(pseudobulk)log2倍数变化的散点图。
图10,与图4相关,显示胎儿或成体hGPC中活性转录因子的共享基序:胎儿和成体GPC中所有预测的活性转录因子的矩阵。大小和颜色表示转录因子之间共享的基序的程度。
图11,与图5相关,显示成体阻遏物同种型的表达。每个GPC组中所有编码蛋白质的成体阻遏物同种型的每百万个的转录本条形图(TPM)。
图12,与图5相关,显示iPSC衍生的hGPC的批量RNA-Seq揭示了年龄相关基因的一致性丰度。通过CD140a+FACS分离iPSC衍生的hGPC(C27),并通过批量RNA测序进行测定。相关胶质老化相关基因的丰度,包括我们的活性转录因子队列中的基因,与胎儿和成体hGPC数据一起显示。
图13,与图6相关,显示miRNA的转录因子调控提供了胶质老化基因表达的转录后调节:(A)图预测为差异表达的成体vs胎儿GPC miRNA的上游的重要成体vs胎儿GPC转录因子的Log2 FC小提琴图。(B)图图2中鉴定的转录因子网络及其对成体vs胎儿hGPC miRNA差异表达的预测调节。
图14显示:A图.CBh-BCL11 A-GFP和对照CBh-GFP慢病毒的设计。B图:从AAVS1基因座生成表达tRFP-mScarlet的CRISPR-Cas9改造的C27 iPSC细胞系。C图:Rag1小鼠长期嵌合和BCL 11A过表达的实验范式示意图。D图.在体外利用ddPCR通过CBh-BCL11A-GFP以及体内利用免疫组化(E图)确认BCL11A 过表达。
图15显示:A图.在注射CBh-BCL11A-GFP(L)或CBh-GFP(R)后三周Rag1-C271RFP小鼠胼胝体(CC)的冠状切面。B图.CC的放大冠状切面,显示BCL11A-GFP和仅GFP半球之间RFP标记的人细胞和OLIG2的差异,在C)图中量化。D图.CC的放大冠状切面,显示BCL11A-GFP和仅GFP半球之间RFP滞后的人类细胞和小鼠NG2的差异,在E)图中量化。
图16显示:A图.注射CBh-BCL11A-GFP)左或CBh-GFP(右)后三周嵌合小鼠胼胝体(CC)的冠状图像。人细胞用红色的tRFP/mScarlet和人核抗原(hNA)标记,OLIG2用绿色染色。B图.注射后6周的嵌合小鼠CC的冠状图像,人细胞用红色的tRFP/mScarlet和hNA标记,OLIG2为绿色。C)图注射后三周嵌合小鼠CC的冠状图像,人细胞用红色的tRFP/mScarlet和hNA标记,PDGFRa为绿色。D图.注射后三周嵌合小鼠CC的冠状图像,用红色的tRFP/mScarlet和hNA标记人类细胞,小鼠NG2为绿色。
图17示出了BCL11A表达载体的示例性设计。
具体实施方式
将详细参考本申请的某些方面和示例性实施方式,在所附结构和附图中示出实施例。将结合示例性实施方式来描述本申请的各方面,包括方法、材料和实施例,这样的描述是非限制性的,并且本申请的范围旨在涵盖所有等同物、替代物和修改,不管是公知的或是并入本文的。所描述的本发明的方面、特征、优点和特性可以以任何合适的方式组合在一个或多个另外的实施方式中。相关领域的技术人员将认识到,可以在没有特定实施方式的一个或多个具体方面或优点的情况下实践本发明。在其他情况下,可以在某些实施方式中认识并要求保护可能不存在于本发明的所有实施方式中的附加方面、特征和优点。此外,本领域技术人员将认识到与本文所描述的技术和材料类似或等同的许多技术和材料,其可以在本申请的各方面和实施方式的实践中使用。本申请的所描述的方面和实施方式不限于所描述的方法和材料。
除非另外定义,本文中使用的所有技术和科学术语具有与本申请所属领域的普通技术人员通常理解的相同含义。
如本说明书和所附权利要求书中所使用的,除非内容另外明确指出,否则单数形式“一”、“一个”和“所述”包括复数指示物。因此,例如,提及“肽”包括“一个或多个”肽或“多个”这样的肽。
I.定义
如本文所使用的,以下术语或短语(在括号中)应具有以下含义:
如本说明书和所附权利要求书中所使用的,除非内容另外明确指出,否则单数形式“一”、“一个”和“所述”包括复数指示物。因此,例如,提及“肽”包括“一个或多个”肽或“多个”这样的肽。
术语“约”或“大约”包括在统计上有意义的值范围内。这样的范围可以在给定值或范围的一个数量级内,优选在给定值或范围的50%内,更优选在20%内,还更优选在10%内,甚至更优选在5%内。术语“约”或“大约”所涵盖的允许变化取决于所研究的特定系统,并且可以被本领域普通技术人员容易地理解。
本文使用的术语“和/或”是指所列出的项目单独或组合地存在或使用。实际上,该术语意味着使用或存在列出的项目中的“至少一个”或“一个或多个”。
如本领域技术人员将理解的,出于任何和所有目的,例如就提供书面描述而言,本文公开的所有范围还涵盖任何和所有可能的子范围及其子范围的组合。任何列出的范围都可以很容易地被认为充分描述并允许将同一范围分解为至少相等的一半、三分之一、四分之一、五分之一、十分之一等。作为非限制性示例,本文讨论的每个范围可以容易地分解为下三分之一、中三分之一和上三分之一等。本领域技术人员还应当理解,诸如“最多”、“至少”等的所有语言都包括所列举的数字并且指的是随后可以分解为如上所述的子范围的范围。最后,如本领域技术人员将理解的,范围包括每个单独的成员。
在理解本申请的范围时,本文使用的术语“包括”及其派生词旨在是开放式术语,其指定所述特征、元件、组分、基团、整数和/或步骤存在,但不排除其他未说明的特征、元件、组分、基团、整数和/或步骤的存在。上述内容也适用于具有类似含义的词语,例如术语“包括”、“涉及”、“具有”及其派生词。如本文所用,术语“由……组成”及其派生词旨在表示封闭术语,其指定所陈述的特征、元件、组分、基团、整数和/或步骤的存在,但排除其他未陈述的特征、元件、组分、基团、整数和/或步骤的存在。如本文所用,术语“基本上由......组成”旨在指定所陈述的特征、元件、组分、基团、整数和/或步骤的存在,以及不实质上影响特征、元件、组分、基团、整数和/或步骤的基本和新颖特征的那些的存在。在使用术语“包括”(或类似术语)作为过渡短语的实施方式或权利要求中,这样的实施方式还可以被设想为将术语“包括”替换为术语“由......组成”或“基本上由......组成”。本公开的方法、试剂盒、系统和/或组合物可包含所公开的组分、基本上由所公开的组分组成、或由所公开的组分组成。
在包括“附加”或“第二”组分的实施方式中,本文所用的第二组分不同于其他组分或第一组分。“第三”组分不同于其他第一和第二组分,并且进一步列举的或“附加”组分也类似地不同。
术语“互补”当与核酸结合使用时,是指碱基A与T或U配对,以及G与C配对。术语“互补”是指完全互补的核酸分子,即,在整个参考序列中形成A-T或U对和G-C对,以及部分(例如,至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%)互补。
除非另有说明,否则术语“核酸”、“核苷酸”和“多核苷酸”涵盖DNA和RNA。
术语“多肽”、“肽”或“蛋白质”可互换使用并且指氨基酸残基的聚合物。该术语涵盖所有种类的天然存在的和合成的蛋白质,包括所有长度的蛋白质片段、融合蛋白和修饰的蛋白质,包括但不限于糖蛋白,以及所有其他类型的修饰的蛋白质(例如,由磷酸化、乙酰化、肉豆蔻酰化、棕榈酰化、糖基化、氧化、甲酰化、酰胺化、多谷氨酰化、ADP-核糖基化、聚乙二醇化、生物素化等产生的蛋白)。
基因或基因产物(例如,RNA或蛋白质)的表达的术语“废除(abrogate)”、“废除(abrogation)”、“消除(eliminate)”或“消除(elimination)”是指基因的转录和/或翻译的完全丧失,或基因产物(例如RNA或蛋白质)的完全丧失。与对照(例如未修饰的细胞)相比,基因或基因产物(例如RNA或蛋白质)的表达可以通过标准领域已知的方法(例如本文描述的那些方法)来检测。
术语“表达(express)”和“表达(expression)”意指允许或引起基因或DNA序列中的信息产生,例如通过激活参与相应的基因或DNA序列的转录和/或翻译的细胞功能来产生RNA或蛋白质。DNA序列在细胞中或由细胞表达以形成“表达产物”,例如RNA或蛋白质。表达产物本身,例如所得蛋白质,也可以说是由细胞“表达”的。表达产物可以表征为细胞内、细胞外或跨膜的。
如本文所用,术语“胶质细胞”是指提供支持和营养、维持稳态、形成髓磷脂或促进髓鞘形成、并参与神经系统中的信号传递的非神经元细胞群。本文所用的“胶质细胞”涵盖胶质谱系的完全分化的细胞,例如少突胶质细胞或星形胶质细胞,以及胶质祖细胞,其中的每一种都可以被称为大胶质细胞。
如本文所用,术语“成体胶质祖细胞”是指存在于出生后任何发育阶段的哺乳动物中的胶质祖细胞。在一些实施方式中,术语“成体胶质祖细胞”是指存在于以下人类受试者中的胶质祖细胞:1岁、2岁、3岁、4岁、5岁、6岁、7岁、8岁、9岁、10岁、11岁、12岁、13岁、14岁、15岁、16岁、17岁、或18岁或更大。在一些实施方式中,术语“成体胶质祖细胞”是指存在于以下人类受试者中的胶质祖细胞:20岁以上、25岁以上、30岁以上、35岁以上、40岁以上、45岁以上、50岁以上。在一些实施方式中,术语“成体胶质祖细胞”是指存在于高龄人类受试者中的胶质祖细胞,例如55岁以上、60岁以上、65岁以上、70岁以上、75岁以上、或80岁以上的成人。
术语基因产物的“功能变体”(例如,转录因子)是指修饰的转录因子(例如,通过缺失、取代、插入、糖基化等),其在竞争测定中保留了至少50%的未修饰(野生型)转录因子的生物活性。
术语“有效量”是指研究人员、兽医、医生或其他临床医生寻求的在组织、系统、动物、个体或人中引发生物或医学反应的活性化合物或药剂的量。
术语“调控序列”或“调控元件”是指控制、调控、引起或允许基因表达受此类调控序列或元件调控的核酸序列或元件。调控元件/序列可以位于待调控基因的编码区的5'或3'侧,或在编码区内,或内含子内。调控序列/元件的例子包括但不限于启动子、增强子、RNA聚合酶起始位点、核糖体结合位点和其他促进编码的多肽在给定表达系统中表达的序列。
本文使用的术语“启动子”是指能够控制编码序列或功能性RNA的表达的核苷酸序列。一般而言,目的多核苷酸位于启动子序列的3'。在一些实施方式中,启动子完全源自天然基因。在一些实施方式中,启动子由来自不同天然存在的启动子的不同元件组成。在一些实施方式中,启动子包含合成的核苷酸序列。本领域技术人员应当理解,不同的启动子将指导基因在不同的组织或细胞类型中、或在不同的发育阶段、或响应于不同的环境条件或响应于药物或转录辅助因子存在或不存在的表达。普遍存在的、细胞类型特异性的、组织特异性的、发育阶段特异性的和条件启动子,例如药物响应启动子(例如四环素响应启动子)是本领域技术人员众所周知的。启动子的实例包括但不限于磷酸甘油酸激酶(PKG)启动子,CAG、NSE(神经元特异性烯醇化酶)、突触蛋白或NeuN启动子,SV40早期启动子,小鼠乳腺肿瘤病毒LTR启动子;腺病毒主要晚期启动子(Ad MLP);单纯疱疹病毒(HSV)启动子,巨细胞病毒(CMV)启动子(例如CMV立即早期启动子区(CMVIE))、SFFV启动子、劳氏肉瘤病毒(RSV)启动子、合成启动子、杂合启动子等。启动子可以是人类来源的或来自其他物种,包括来自小鼠。此外,衍生自非病毒基因的序列,例如鼠金属硫蛋白基因启动子,也可用于本文。在一些实施方式中,启动子是异源启动子。在一些实施方式中,启动子序列由近端和更远端的上游元件组成,并且可以包含增强子元件。
本文所用的术语“异源启动子”是指未发现在自然界中可操作地连接至给定编码序列的启动子。
术语“增强子”指可以刺激启动子活性的核苷酸序列,并且可以是启动子的固有元件或插入以增强启动子的水平或组织特异性的异源元件。
术语“可操作地连接(operatively linked)”或“可操作地连接(operablylinked)”是指两个或更多个核酸片段在单个核酸片段上的缔合,使得一个核酸片段的功能受到另一个的影响。例如,当启动子能够影响编码序列的表达时(例如,编码序列处于启动子的转录控制之下),则启动子与编码序列可操作地连接。编码序列可以以有义或反义方向操作性地连接至调控序列。
术语“转录因子”是指调节特定基因表达的DNA结合蛋白。
转录因子可以对基因转录具有积极作用,因此可以被称为“转录激活子”、“激活子”或“转录激活因子”。示例性激活子(或转录激活因子)是信号转导子和转录激活子3(STAT3)。如本公开的图4F所示,在成体胶质祖细胞的背景下,STAT3预计会激活一组衰老相关基因(例如,BIN1、DMTF1、CD47、CTNNA1、RUNX2、RUNX1、MAP3K7和OGT)、胶质细胞相关基因(例如PLP1、CNP、PMP22、SEMA4D、CLDN11、GPR37、MYRF、MAG、BCAS1、ST18、ERBB4、CERS2、LPAR1和GJB1)和下游转录因子(例如MAX、E2F6和IKZF3)。
转录因子还可以负面影响基因表达,因此可以被称为“转录阻遏物”、“阻遏物”或“转录阻遏因子”。参与胶质祖细胞衰老的示例性阻遏物(或转录阻遏因子)包括但不限于ZNF274、MAX、E2F6和IKZF3。如本公开的图4G所示,在成体胶质祖细胞的背景下,预测ZNF274、MAX、E2F6和IKZF3抑制增殖相关基因靶标(例如YAP1、LMNB1、PATZ1、TEAD1、FN1、TP53、CDK1、CCND2、CDKN2D、CENPH、MKI67、CDK4、CENPF、CDK5、CDKN3和CHEK1)、胶质细胞相关基因(例如CHRDL1、ST8SIA1、PTPRZ1、CA10、PDGFRA、BCAN、NXPH1、CSPG4和PCDH15)和下游转录因子(例如BLC11A、EZH2、HDAC2、NF1B、MYC、HMGA2和TEAD)的组。
术语“转录因子的抑制物”或“转录因子阻遏物”是指抑制转录因子的活性或表达的试剂。“转录因子的抑制物”或“转录因子阻遏物”可以是小分子、多肽、多核苷酸,例如反义寡核苷酸(ASO)、shRNA或miRNA。
说明书、实施例和权利要求中使用的某些术语被收集在本文中。除非另外定义,本公开中使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的相同含义。
除非上下文另有指示,否则本公开的给定方面、特征、实施方式或参数的偏好和选项应当被视为已经与本公开的所有其他方面、特征、实施方式或参数的任何和所有偏好和选项组合地公开。
II.涉及转录因子激活的方法
本申请的一个方面涉及一种通过激活某些转录因子来诱导成体胶质祖细胞恢复活力的方法。在一些实施方式中,该方法涉及在成体胶质祖细胞中表达有效量的选自下组的一种或多种转录因子:B细胞淋巴瘤/白血病11A(BCL11A)、组蛋白脱乙酰酶2(HDAC2)、组蛋白-赖氨酸N-甲基转移酶EZH2(EZH2)、myc原癌基因蛋白(MYC)、高15迁移率族蛋白HMGI-C(HMGA2)、核因子1B型(NFIB)和转录增强子因子TEF-4(TEAD2)。
如本文所述,术语“恢复活力(rejuvenation)”或“恢复活力(rejuvenating)”是指逆转细胞的衰老过程并返回到年轻的细胞状态,特别是关于增殖和/或分化能力,而不丧失细胞身份。
适用于本文公开的方法的成体胶质祖细胞包括哺乳动物胶质祖细胞,例如人胶质祖细胞、啮齿动物胶质祖细胞、非人灵长类胶质祖细胞、羊胶质祖细胞、牛胶质祖细胞、猪胶质祖细胞、犬胶质祖细胞和猫胶质祖细胞。在一些实施方式中,成体胶质祖细胞是成人胶质祖细胞。
在一些实施方式中,胶质祖细胞是成人胶质祖细胞。在一些实施方式中,表达步骤是离体进行的。在一些实施方式中,表达步骤在体内进行。
本申请的另一个方面涉及通过激活受试者的胶质祖细胞中的某些转录因子来治疗受试者的髓磷脂缺乏的方法。在一些实施方式中,该方法涉及在受试者的胶质祖细胞中表达有效量的选自BCL11A、HDAC2、EZH2、MYC、HMGA2、NFIB和TEAD2的一种或多种转录因子。
在一些实施方式中,表达步骤是离体进行的。在一些实施方式中,表达步骤在体内进行。
根据本申请的这个方面,髓磷脂缺乏可以与选自以下各项的病症相关:多发性硬化症、视神经脊髓炎、横贯性脊髓炎、视神经炎、皮质下中风、糖尿病性白质脑病、高血压性白质脑病、年龄相关白质疾病、脊髓损伤、放疗或化疗引起的脱髓鞘、感染后和疫苗接种后白质脑炎、脑室周围白质软化、小儿脑白质营养不良(例如佩利扎乌斯-梅茨巴赫病、泰-萨二氏病、桑德霍夫神经节苷脂病、克拉伯病、异染性脑白质营养不良、粘多糖贮积症、尼曼-匹克A病、肾上腺脑白质营养不良、卡纳万病、白质消失病和亚历山大病)、溶酶体贮积病、先天性髓鞘脱失、炎性脱髓鞘、血管性脱髓鞘和脑瘫。
在一些实施方式中,髓磷脂缺乏与神经变性疾病例如亨廷顿病相关。如本文所用,“亨廷顿氏病”是指通常在成年后表现出来的常染色体显性遗传性脑部疾病。亨廷顿病病理学的特征是髓鞘形成不足以及神经元和白质损失(参见,例如,Osipovitch et al.,“HumanESC-Derived Chimeric Mouse Models of Huntington’s Disease Reveal Cell-Intrinsic Defects in Glial Progenitor Cell Differentiation,”Cell Stem Cell 24(1):107-122(2019),其全部内容通过引用并入本文)。
在其他实施方式中,髓磷脂缺乏与神经精神疾病例如精神分裂症相关。如本文所用,“精神分裂症”是指通常以白质相对缺乏和通常明显的髓鞘形成不足为特征的病症(参见,例如,Windrem et al.,“Human iPSC Glial Mouse Chimeras Reveal GlialContributions to Schizophrenia,”Cell Stem Cell 21(2):195-208(2017),其全部内容通过引用并入本文)。
如下文所用,术语“治疗”患有髓磷脂缺乏的受试者涵盖:(1)预防、延迟或减少受试者中发生的髓磷脂缺乏的至少一种临床或亚临床症状的发生率和/或出现的可能性,所述受试者可能患有或易患髓磷脂缺乏但尚未经历或表现出髓磷脂缺乏的临床或亚临床症状;或(2)抑制髓磷脂缺乏,即阻止、减少或延迟髓磷脂缺乏的发展或其复发或其至少一种临床或亚临床症状;或(3)缓解髓磷脂缺乏,即引起髓磷脂缺乏或其至少一种临床或亚临床症状的消退。对于待治疗的受试者的益处是统计学上显著的或者至少是患者或医生可察觉的。
如下文所用,术语“受试者”是指个体生物体,例如个体哺乳动物。在一些实施方式中,受试者是人类。在一些实施方式中,受试者是非人类哺乳动物。在一些实施方式中,受试者是非人类灵长类动物。在一些实施方式中,受试者是啮齿动物。在一些实施方式中,受试者是绵羊、山羊、猫或狗。在一些实施方式中,受试者是研究动物。在一些实施方式中,受试者是基因工程改造的,例如,基因工程改造的非人类受试者。受试者可以是成年受试者。在一些实施方式中,受试者是至少1岁、至少2岁、至少4岁、至少6岁、至少8岁、至少10岁、至少12岁、至少15岁、至少18岁,至少20岁、至少25岁、至少30岁、至少35岁、至少40岁、至少45岁、至少50岁、至少55岁、至少60岁、至少65岁、至少70岁、至少75岁、至少80岁、至少85岁、至少90岁、至少95岁、至少100岁或以上。在一些实施方式中,受试者是18至100岁、20至100岁、30至100岁、40至100岁、50至100岁、50至100岁、60至100岁、70至100岁、80至100岁、或90至100岁之间的成年受试者。
在一些实施方式中,在诱导成体GPC恢复活力的方法中或在治疗受试者中髓磷脂缺乏的方法中的表达步骤包括分别向成体GPC或受试者的GPC施用一种或多种编码选自BCL11A、HDAC2、EZH2、MYC、HMGA2、NFIB和TEAD2的一种或多种转录因子的核酸分子。
在一些实施方式中,在诱导成体GPC恢复活力的方法中或在治疗受试者中髓磷脂缺乏的方法中的表达步骤包括分别向成体GPC或受试者的GPC施用一种或多种表达选自BCL11A、HDAC2、EZH2、MYC、HMGA2、NFIB和TEAD2的一种或多种转录因子的表达载体,其中每个表达载体包含(1)编码选自BCL11A、HDAC2、EZH2、MYC、HMGA2、NFIB和TEAD2的一种或多种转录因子的核苷酸序列,和(2)与所述核苷酸序列可操作地连接的调控序列。
如本文所用,本申请中提到的转录因子,例如BCL11A、HDAC2、EZH2、MYC、HMGA2、NFIB和TEAD2,包括其所有转录变体及其功能变体。编码本文鉴定的一种或多种转录因子的核苷酸序列是本领域众所周知的并且是可得到的。下面的表1通过基因名称、基因ID号和NCBI参考转录本登录号鉴定了转录因子及其转录变体。
表1.示例性人类基因和转录变体
*每一个都通过引用全文并入本文。
在一些实施方式中,所述一种或多种表达载体包括含有编码BCL11A、其转录变体或功能变体的核苷酸序列的表达载体。在一些实施方式中,所述一种或多种表达载体包括含有编码SEQ ID NO:21的BCL11A变体的核苷酸序列的表达载体。在一些实施方式中,所述一种或多种表达载体包括含有SEQ ID NO:20的核苷酸序列的表达载体。
在一些实施方式中,所述一种或多种表达载体包括含有编码HDAC2、其转录变体或功能变体的核苷酸序列的表达载体。
在一些实施方式中,所述一种或多种表达载体包括含有编码EZH2、其转录变体或功能变体的核苷酸序列的表达载体。
在一些实施方式中,所述一种或多种表达载体包括含有编码MYC、其转录变体或功能变体的核苷酸序列的表达载体。
在一些实施方式中,所述一种或多种表达载体包括含有编码HMGA2、其转录变体或功能变体的核苷酸序列的表达载体。
在一些实施方式中,所述一种或多种表达载体包括包含编码HFIB、其转录变体或功能变体的核苷酸序列的表达载体。
在一些实施方式中,所述一种或多种表达载体包括含有编码TEAD2、其转录变体或功能变体的核苷酸序列的表达载体。
在一些实施方式中,在诱导成体GPC恢复活力的方法中或治疗受试者中髓磷脂缺乏的方法中的表达步骤包括分别向成体GPC或受试者中的GPC施用有效量的转录因子阻遏物的抑制剂。
如本文所用,术语“转录因子阻遏物”是指抑制转录因子的活性或表达的试剂。“转录因子阻遏物”可以是多肽或多核苷酸。
在一些实施方式中,转录因子阻遏物的抑制剂是小分子。
在一些实施方式中,转录因子阻遏物的抑制剂是多肽或多核苷酸。在一些实施方式中,在诱导成体GPC恢复活力的方法中或治疗受试者中髓磷脂缺乏的方法中的表达步骤包括分别向成体GPC或受试者中的GPC施用有效量的表达载体,所述表达载体包含(1)编码转录因子阻遏物的抑制剂的核苷酸序列,和(2)可操作地连接至所述核苷酸序列的调控序列。
在一些实施方式中,转录因子阻遏物是芳基20烃受体(AHR)。根据此类实施方式,转录因子阻遏物的抑制剂是AHR抑制剂。在一些实施方式中,AHR抑制剂是小分子抑制剂。
合适的AHR抑制剂是本领域已知的并且包括但不限于小分子,例如BAY-218(参见,例如,Abstract 1288:Blocking Tumor Associated Immune Suppression with BAY-218,a Novel,Selective Aryl Hydrocarbon Receptor(AhR)Inhibitor,”Proceedings of theAmerican Association for Cancer 25Research Annual Meeting 2019;2019Mar 29-Apr3;Atlanta,GA.Philadelphia(PA):AACR;Cancer Res.79(13Suppl):Abstract nr 1288(2019),其全部内容通过引用并入本文);紫苏醛(参见,例如,Fuyuno et al.,“Perillaldehyde Inhibits AHR Signaling and Activates NRF2 Antioxidant Pathwayin Human Keratinocytes,”Oxid.Med.Cell Longev.2018:9524657(2018),其全部内容通过引用并入本文);StemRegenin 1(SR1)(参见,例如,Boitano et al.,“Aryl HydrocarbonReceptor Antagonists Promote the Expansion of Human Hematopoietic StemCells,”Science 329(5997):1345-1348(2010),其全部内容通过引用并入本文);KYN-101(参见,例如,Campesato et al.,“Blockade of the AHR Restricts aTreg-MacrophageSuppressive Axis Induced by L-5Kynurenine,”Nature Comm.11:4011(2020),其全部内容通过引用并入本文);CH-223191(参见,例如,Kim et al.,“Novel Compound 2-Methyl-2H-Pyrazole-3-Carboxylic acid(2-Methyl-4-o-Tolylazo-Phenyl)-Amide(CH-223191)Prevents 2,3,7,8-TCDD-Induced Toxicity by Antagonizing the Aryl HydrocarbonReceptor,”Mol.Pharmaocl.69(6):1871-1878(2006),其全文以10篇通过引用并入本文);BAY 2416964(参见,例如,Bayer Aktiengesellschaft等人的国际专利公开号WO/2018/146010,其全部内容通过引用并入本文);PDM2(参见,例如,de Medina et al.,“Synthesisand Biological Properties of New Stilbene Derivatives of Resveratrol as NewSelective Aryl Hydrocarbon Modulators,”J.Med.Chem.48:287-291(2005),其全文以15篇通过引用并入本文),和GNF351(参见,例如,“Smith et al.,“Identification of aHigh-Affinity Ligand that Exhibits Complete Aryl Hydrocarbon ReceptorAntagonism,”J.Pharmacol.Exp.Ther.338(1):318-327(2011),其全部内容通过引用并入本文)。示例性AHR小分子抑制剂如下表2所示。
表2.示例性AHR小分子抑制剂
在一些实施方式中,转录因子阻遏物是Myc盒依赖性相互作用蛋白(BINl)。根据此类实施方式,转录因子阻遏物的抑制剂是BIN1抑制剂。
在一些实施方式中,转录因子阻遏物是miRNA分子。根据此类实施方式,转录因子阻遏物的抑制剂是miRNA的抑制剂。如本文所述,充当转录因子阻遏物的miRNA包括但不限于下表3中显示的那些。
表3.示例性的人类miRNA转录因子阻遏物
在一些实施方式中,转录因子阻遏物的抑制剂是任何一种或多种上述鉴定的miRNA(靶miRNA)的抑制剂。miRNA的抑制剂在本领域中被称为“antagomir”。antagomir是与特定miRNA具有互补性的RNA寡核苷酸或RNA寡核苷酸模拟物,并且其抑制该miRNA的活性。
在一些实施方式中,转录因子阻遏物的抑制剂是靶向表3中列出的一种或多种miRNA的antagomir。antagomir可以包含1、2、3、4、5、6、7、8、9或10个与其抑制的miRNA的互补序列不同的核苷酸。此外,antagomir可以具有与它们抑制的miRNA相同的长度、更长的长度或更短的长度。在某些实施方式中,antagomir与其抑制的miRNA的5'端的6-8个核苷酸杂交。在其他实施方式中,antagomir与miRNA互补的长度为5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49或50个核苷酸。在其他实施方式中,antagomir的长度是5-10、6-8、10-20、10-15或5-500个核苷酸。
在一些实施方式中,antagomir是靶RNA的合成反向互补物,其紧密结合靶miRNA并使靶miRNA失活。因此,在一些实施方式中,antagomir特异性抑制或阻断靶miRNA的表达或活性。
在一些实施方式中,antagomir的至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%与上表3中提供的任一miRNA序列互补。
在一些实施方式中,antagomir能够抑制表3中公开的一种或多种miRNA的表达。
具体地,本申请的antagomir可以与选自miR-193a-5p、miR-23b-3p、miR-4687-3p、miR-4651、miR-4270或miR-24-3p的miRNA特异性的核酸序列或其一部分基本互补。因此,同样也考虑表现出基本相同或改变的活性的核酸或其类似物。
在一些实施方式中,antagomir包含改善核酸酶抗性和结合亲和力的化学修饰。合适的修饰包括但不限于2'糖修饰,例如2'-O-Me、2'-O-甲氧基乙基(2'-MOE)或2'-氟(2'-F)。
在一些实施方式中,在诱导成体GPC恢复活力的方法中或治疗受试者中髓磷脂缺乏的方法中的表达步骤包括分别向成体GPC或受试者中的GPC施用有效量的(1)转录因子阻遏物的抑制剂,和/或(2)有效量的选自下组的一种或多种转录因子:B细胞淋巴瘤/白血病11A(BCL11A)、组蛋白脱乙酰酶2(HDAC2)、组蛋白赖氨酸N-甲基转移酶EZH2(EZH2)、myc原癌基因蛋白(MYC)、高15迁移率族蛋白HMGI-C(HMGA2)、核因子1B型(NFIB)和转录增强子因子TEF-4(TEAD2)。
在一些实施方式中,在诱导成体GPC恢复活力的方法中或治疗受试者中髓磷脂缺乏的方法中的表达步骤包括分别向成体GPC或受试者中的GPC施用有效量的(1)编码转录因子阻遏物的抑制剂的表达载体,和/或(2)有效量的编码选自下组的一种或多种转录因子的表达载体:B细胞淋巴瘤/白血病11A(BCL11A)、组蛋白脱乙酰酶2(HDAC2)、组蛋白赖氨酸N-甲基转移酶EZH2(EZH2)、myc原癌基因蛋白(MYC)、高15迁移率族蛋白HMGI-C(HMGA2)、核因子1B型(NFIB)和转录增强子因子TEF-4(TEAD2)。
在一些实施方式中,在诱导成体GPC恢复活力的方法中或在治疗受试者中髓磷脂缺乏的方法中的如上文描述的表达载体的调控序列包含由胶质祖细胞选择性或特异性表达的基因的启动子和/或增强子。
胶质祖细胞选择性表达的基因包括血小板25衍生生长因子α(PDGFRA)、锌指蛋白488(ZNF488)、G蛋白偶联受体(GPR17)、少突胶质细胞转录因子2(OLIG2)、硫酸软骨素蛋白聚糖4(CSPG4)和SRY盒转录因子10(SOX10)。
根据此类实施方式,适合于控制本文公开的核酸抑制剂的表达的启动子序列包括但不限于血小板衍生生长因子α(PDGFRA)启动子、锌指蛋白488(ZNF488)启动子、G蛋白偶联受体(GPR17)启动子、少突胶质细胞转录因子2(OLIG2)启动子、硫酸软骨素蛋白聚糖4(CSPG4)启动子和SRY盒转录因子10(SOX10)启动子,如下表4所示。
表4.示例性的由胶质祖细胞选择性或特异性表达的基因
*每一个都通过引用全文并入本文。
在一些实施方式中,在诱导成体GPC恢复活力的方法中或在治疗受试者中髓磷脂缺乏的方法中的上文描述的表达载体的调控序列包括诱导型启动子或启动子系统,例如四环素控制的诱导系统、cumate控制的诱导系统和雷帕霉素控制的诱导系统,在下文中对其进行更详细地描述。
在一些实施方式中,在诱导成体GPC恢复活力的方法中或在治疗受试者中髓磷脂缺乏的方法中的上文描述的表达载体是质粒载体、病毒载体或细菌载体。
在一些实施方式中,在诱导成体GPC恢复活力的方法中或在治疗受试者中髓磷脂缺乏的方法中的上文描述的表达载体是选自腺病毒、腺相关病毒(AAV)、逆转录病毒、慢病毒、牛痘病毒和疱疹病毒的病毒载体。在一些实施方式中,表达载体是慢病毒载体。在一些实施方式中,表达载体是逆转录病毒载体。在其他实施方式中,表达载体是AAV载体。下文更详细地描述了产生和分离适合用作表达载体的病毒载体的方法。
III.涉及抑制转录因子的方法
本申请的另一个方面涉及通过抑制某些转录因子来诱导成体胶质祖细胞群恢复活力的方法。该方法包括向成体胶质祖细胞群施用有效量的抑制选自下组的一种或多种转录因子的试剂:锌指蛋白274(ZNF274)、Myc相关因子X(MAX)、E2F转录因子6(E2F6)、锌指蛋白Aiolos(IKZF3)以及信号转导子和转录激活子3(STAT3)。
本申请的另一个方面涉及通过抑制某些衰老基因来诱导成体胶质祖细胞群恢复活力的方法。该方法包括向成体胶质祖细胞群施用有效量的抑制选自下组的一种或多种衰老基因表达的试剂:RUNX1、BIN1、VAMP3、DMTF1、CTNNA1、SERPINE1、CDK19、CDKN1C、RUNX2、EFEMP1、MAP3K7、AHR、OGT、PAK1、CBX7和CYLD。
本申请的另一个方面涉及通过抑制某些衰老基因来诱导成体胶质祖细胞群恢复活力的方法。该方法包括向成体胶质祖细胞群施用有效量的抑制选自下组的一种或多种胶质靶基因表达的试剂:MBP、CD9、ENPP2、PLP1、ERBIN、ZNF365、UGT8、GDNF、DUSP10、PMP22、ERBB4和MYRF。
适用于本文公开的方法的成体胶质祖细胞包括哺乳动物胶质祖细胞,例如人胶质祖细胞、啮齿动物胶质祖细胞、非人灵长类胶质祖细胞、羊胶质祖细胞、牛胶质祖细胞、猪胶质祖细胞、犬胶质祖细胞和猫胶质祖细胞。在一些实施方式中,成体胶质祖细胞是成体人类胶质祖细胞。
在一些实施方式中,所述施用是离体进行的。在根据本公开的方法的其他实施方式中,所述施用在体内进行。
本申请的另一个方面涉及通过抑制某些转录因子来治疗受试者的髓磷脂缺乏的方法。该方法包括向患有髓磷脂缺乏症的受试者施用抑制选自ZNF274、MAX、E2F6、IKZF3和STAT3的一种或多种转录因子的试剂,其中所述试剂以有效量施用以在受试者的成体胶质祖细胞中抑制一种或多种转录因子。
本申请的另一个方面涉及通过抑制某些衰老基因来治疗受试者的髓磷脂缺乏的方法。该方法包括向受试者施用抑制选自RUNX1、BIN1、VAMP3、DMTF1、CTNNA1、SERPINE1、CDK19、CDKN1C、RUNX2、EFEMP1、MAP3K7、AHR、OGT、PAK1、CBX7和CYLD的一种或多种衰老基因表达的试剂,其中所述试剂以有效量施用以在受试者的成体胶质祖细胞中抑制一种或多种衰老基因。
本申请的另一个方面涉及通过抑制某些胶质靶基因来治疗受试者的髓磷脂缺乏的方法。该方法涉及向受试者施用抑制选自MBP、CD9、ENPP2、PLP1、ERBIN、ZNF365、UGT8、GDNF、DUSP10、PMP22、ERBB4和MYRF的一种或多种衰老基因的表达的试剂,其中所述试剂以有效量施用以在受试者成体胶质祖细胞中抑制一种或多种胶质靶基因。
根据本申请的这个方面,髓磷脂缺乏可以与选自以下的病症相关:多发性硬化症、视神经脊髓炎、横贯性脊髓炎、视神经炎、皮质下中风、糖尿病性白质脑病、高血压性白质脑病、年龄相关白质疾病、脊髓损伤、放疗或化疗引起的脱髓鞘、感染后和疫苗接种后白质脑炎、脑室周围白质软化、小儿脑白质营养不良(例如佩利扎乌斯-梅茨巴赫病、泰-萨二氏病、桑德霍夫神经节苷脂病、克拉伯病、异染性脑白质营养不良、粘多糖贮积症、尼曼-匹克A病、肾上腺脑白质营养不良、卡纳万病、白质消失病和亚历山大病)、溶酶体贮积病、先天性髓鞘脱失、炎性脱髓鞘、血管性脱髓鞘和脑瘫。
在一些实施方式中,髓磷脂缺乏与神经变性疾病例如亨廷顿病相关。如本文所用,“亨廷顿氏病”是指通常在成年后表现出来的常染色体显性遗传性脑部疾病。亨廷顿病的病理学特征是髓鞘形成不足以及神经元和白质损失。
在其他实施方式中,髓磷脂缺乏与神经精神疾病例如精神分裂症相关。
在一些实施方式中,在诱导恢复活力的方法或治疗髓磷脂缺乏的方法中使用的试剂是抑制STAT3的试剂。如本公开的图4F所示,在成体胶质祖细胞的背景下,STAT3预计会激活一组衰老相关基因(例如,BIN1、DMTF1、CD47、CTNNA1、RUNX2、RUNX1、MAP3K7和OGT)、胶质细胞相关基因(例如PLP1、CNP、PMP22、SEMA4D、CLDN11、GPR37、MYRF、MAG、BCAS1、ST18、ERBB4、CERS2、LPAR1和GJB1)和下游转录因子(例如MAX、E2F6和IKZF3)。在一些实施方式中,所述试剂是抑制或沉默STAT3和/或任何上述由STAT3激活的衰老相关基因的活性的试剂。
在一些实施方式中,在诱导恢复活力的方法和治疗髓磷脂缺乏的方法中使用的试剂是抑制ZNF274、MAX、E2F6和IKZF3中的一种或多种的试剂。如本申请的图4G所示,在成体胶质祖细胞的背景下,预测ZNF274、MAX、E2F6和IKZF3抑制增殖相关基因靶标(例如,YAP1、LMNB1、PATZ1、TEAD1、FN1、TP53、CDK1、CCND2、CDKN2D、CENPH、MKI67、CDK4、CENPF、CDK5、CDKN3和CHEK1)、胶质细胞相关基因(例如CHRDL1、ST8SIA1、PTPRZ1、CA10、PDGFRA、BCAN、NXPH1、CSPG4和PCDH15)和下游转录因子(例如BLC11A、EZH2、HDAC2、NF1B、MYC、HMGA2和TEAD)的组。
在一些实施方式中,所述试剂是抑制或沉默ZNF274、MAX、E2F6、IKZF3或其任何组合的活性以允许下游增殖相关基因靶标表达的试剂。
在一些实施方式中,所述试剂是抑制ZNF274、MAX、E2F6、IKZF3和/或STAT3的试剂。适用于本文所述方法的试剂包括但不限于ZNF274抑制剂、MAX抑制剂、E2F6抑制剂、IKZF3抑制剂和STAT3抑制剂。
ZNF274抑制剂、MAX抑制剂、E2F6抑制剂、IKZF3抑制剂和/或STAT3抑制剂可以是(1)小分子抑制剂,(2)核酸分子抑制剂(例如,miRNA、shRNAi、siRNA和反义寡核苷酸),(3)基于核酸酶的基因编辑系统(例如,靶向沉默ZNF274、MAX、E2F6、IKZF3和/或STAT表达的CRISPR/Cas系统),或(4)编码(2)或(3)的核酸分子。
小分子抑制剂
在一些实施方式中,ZNF274抑制剂、MAX抑制剂、E2F6抑制剂、IKZF3抑制剂和/或STAT3抑制剂是小分子抑制剂。下表5中提供了本领域已知的并且适合根据本文描述的方法使用的这些转录因子的示例性小分子抑制剂。表5的小分子抑制剂的类似物和衍生物也预期用于本文所述的方法中。
表5.示例性小分子抑制剂
在一些实施方式中,小分子抑制剂是Myc相关因子X(MAX)的小分子抑制剂,其选自10058-F4(也称为“10058-F4(1RH)”(参见,例如,Huang et al.,“A Small-Molecule c-MycInhibitor,10058-F4,Induces Cell-Cycle Arrest,Apoptosis,and MyeloidDifferentiation of Human Acute Myeloid Leukemia,”Exp.Hematol.34(11):1480–1489(2006),其全部内容通过引用并入本文);MYCMI-6、MYCMI-11和MYCMI-14(参见,例如,Castell et al.,“ASelective High Affinity MYC-Binding Compound Inhibits MYC:MAX Interaction and MYC-Dependent Tumor Cell Proliferation,”Sci.Rep.8:10064(2018),其全部内容通过引用并入本文);12RH、22RH、27RH、28RH、1RH-S-Me、1RH-NCN-1、#015、#474、#764、12RH-NCN-1和28RH-NCN-1(参见,例如,Wang et al.,“Improved LowMolecular Weight Myc-Max inhibitors,”Mol.Cancer Ther.6(9):2399-2408(2007),其全部内容通过引用并入本文)。
在一些实施方式中,小分子抑制剂是信号转导子和转录激活子3(STAT3)的小分子抑制剂,其选自隐丹参酮(参见,例如,Shin et al.,“Cryptotanshinone InhibitsConstitutive Signal Transducer and Activator of Transcription 3Functionthrough Blocking the Dimerization in DU145 Prostate Cancer Cells,”CancerRes.69(1):193-202(2009),其全部内容通过引用并入本文);STA-21(参见,例如,Song etal.,“A Low-Molecular-Weight Compound Discovered through Virtual DatabaseScreening Inhibits Stat3 Function in Breast Cancer Cells,”PNAS 102(13):4700-4705(2005),其全部内容通过引用并入本文);NSC 7459(S3I-201)(参见,例如,Siddiqueeet al.,“Selective Chemical Probe Inhibitor of Stat3,Identified throughStructure-Based Virtual Screening,Induces Antitumor Activity,”PNAS104(18):7391-7396(2007),其全部内容通过引用并入本文);napabucasin(BBI608)(参见,例如,Liet al.,“Suppression of Cancer Relapse and Metastasis by Inhibiting CancerStemness,”PNAS 112(6):1839-1844(2015)和Hubbard et al.,“Napabucasin:An Updateon the First-in-Class Cancer Stemness Inhibitor,”Drugs 77(10):1091-1103(2017),其全部内容通过引用并入本文);Stattic、葫芦素I、葫芦素Q、Phpr-pTyr-Leu-cis-3,4-methanoPro-Gln-NHBn(参见,例如,McMurray,J.,“A New Small-Molecule Stat3Inhibitor,”Chem.Biol.13(11):1123-1124(2006),其全部内容通过引用并入本文);LLL-3(参见,例如,Fuh et al.,“LLL-3Inhibits STAT3 Activity,Suppresses GlioblastomaCell Growth and Prolongs Survival in a Mouse Glioblastoma Model,”Br.J.Cancer100(1):106-112(2009),其全部内容通过引用并入本文);LLL-12、S31-201、SF-1-066、S31-1757、STX-0119、Cpd30-12、LY5、Cpd9和Cpd1(参见,例如,Orlova et al.,“DirectTargeting Options for STAT3 and STAT5 in Cancer,”Cancers11(12):1930(2019),其全部内容通过引用并入本文);SF-1-087、SF-1-121、S3I-M2001、S3I-201.1066和BP-1-102(参见,例如,Wu et al.,“Negative Regulators of STAT Signaling Pathway inCancers,”Cancer Manag.Res.11:4957-4969(2019),其全部内容通过引用并入本文);HO-3867(参见,例如,Tierney et al.,“HO-3867,a STAT3 Inhibitor Induces Apoptosis byInactivation of STAT3 Activity in BRCA1-Mutated Ovarian Cancer Cells,”CancerBiol.Ther.13(9):766-775(2012);次苷酸查尔酮(参见,例如,Lee et al.,“PhenolicCompounds Isolated from Psoralea corylifolia Inhibit IL-6-Induced STAT3Activation,”Planta.Med.78(9):903-906(2012),其全部内容通过引用并入本文);和SD1008(参见,例如,Liu et al.,“SOCS3 Promotes Inflammation and Apoptosis viaInhibiting JAK2/STAT3 Signaling Pathway in 3T3-L1 Adipocyte,”Immunobiology220(8):947-953(2015),其全部内容通过引用并入本文)。
核酸抑制剂
在一些实施方式中,ZNF274抑制剂、MAX抑制剂、E2F6抑制剂、IKZF3抑制剂和/或STAT3抑制剂是核酸分子抑制剂。
如本文所用,术语“核酸分子抑制剂”是指减少或消除靶基因的表达的核酸分子。核酸分子抑制剂通常含有特异性靶向靶基因或靶基因mRNA中的序列的区域,以实现靶标特异性抑制。通常,核酸抑制剂分子的靶向区域包含与靶基因或靶基因mRNA上的序列充分互补的序列,以将核酸抑制剂分子的作用引导至特定的靶基因或靶基因mRNA。例如,“ZNF274的核酸分子抑制剂”减少或消除ZNF274基因的表达。核酸抑制剂分子可以包括天然核糖核苷酸、天然脱氧核糖核苷酸和/或修饰的核苷酸。修饰的核苷酸包括诸如糖环上的位置上的取代、核苷酸之间的磷酸酯键的修饰、非天然碱基和非天然替代碳结构,诸如锁核酸(“LNA”)和解锁核酸(“UNA”)。
如本文所使用的,术语“减少(reduce)”是指其如本领域普遍接受的含义。关于示例性核酸抑制剂分子(例如,选自miRNA、shRNAi、siRNA和反义寡核苷酸的ZNF274、MAX、E2F6、IKZF3和/或STAT3的核酸分子抑制剂),“减少”一般是指相对于在不存在核酸抑制剂分子的情况下观察到的基因转录和/或翻译而言,基因转录和/或翻译或基因产物水平的抑制。在一些实施方式中,相对于不存在根据本公开的核酸抑制剂分子时观察到的结果,基因的转录和/或翻译或基因产物的水平的减少是至少10%、至少20%、至少30%、至少40%、至少50%,至少60%、至少70%、至少80%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、高达100%(即,没有可检测到的转录和/或翻译)或减少至少2倍、至少5倍、至少10倍、至少20倍、至少30倍、至少40倍、至少50倍、或更多。
合适的核酸抑制剂分子包括但不限于(i)选自miRNA、shRNAi、siRNA和反义寡核苷酸(ASO)的ZNF274的核酸分子抑制剂;(ii)选自miRNA、shRNAi、siRNA和反义寡核苷酸的MAX的核酸分子抑制剂;(iii)选自miRNA、shRNAi、siRNA和反义寡核苷酸的E2F6的核酸分子抑制剂;(iv)选自miRNA、shRNAi、siRNA和反义寡核苷酸的IKZF3的核酸分子抑制剂;和(v)选自miRNA、miRNA抑制剂、shRNAi、siRNA和反义寡核苷酸的STAT3的核酸分子抑制剂。
如本文所用,术语“微小RNA”或“miRNA”是指可以负调节基因表达的一类小RNA分子(参见,例如,Lam et al.,“siRNA Versus miRNA as Therapeutics for GeneSilencing,”Mol.Ther.Nucleic Acids 4(9):e252(2015),其全部内容通过引用并入本文)。miRNA基因转录是由RNA聚合酶II在细胞核中进行,产生初级miRNA(pri-miRNA),它是一种具有双链茎环结构的5'加帽、3'聚腺苷酸化RNA。然后pri-miRNA被微处理器复合物(包括Drosha和微处理器复合物亚基DCGR8)切割,形成前体miRNA(pre-miRNA),它是包含70-100个核苷酸且散布错配的双链体,并采用环结构。随后,前体miRNA通过Exportin 5从细胞核转运至细胞质,并在细胞质中被Dicer进一步加工成18-25个核苷酸的miRNA双链体。然后miRNA双链体与RISC结合,形成称为miRISC的复合体。miRNA双链体解开,释放并丢弃客链(有义链)。成熟的单链miRNA引导miRISC到达靶mRNA。成熟的miRNA可以通过部分互补碱基配对与靶mRNA结合,结果是通过翻译抑制、降解和/或切割发生靶基因沉默。在一些实施方式中,核酸抑制剂分子是miRNA分子。用于本公开的方法中的合适的miRNA抑制剂分子包括但不限于下表6中显示的那些。
表6.示例性miRNA序列
在一些实施方式中,MAX抑制剂是MAX的核酸分子抑制剂,并且合适的MAX核酸分子抑制剂是miRNA。根据此类实施方式,示例性MAX抑制剂miRNA具有对应于miR-485-5p、前体miR-485-5p或成熟miR-485-5p的核苷酸序列。例如,miRNA可以具有SEQ ID NO:7的核苷酸序列。
在一些实施方式中,E2F6抑制剂是E2F6的核酸分子抑制剂,并且合适的E2F6核酸分子抑制剂是miRNA。根据此类实施方式,示例性E2F6抑制剂miRNA具有对应于miR-379-5p、前体miR-379-5p或成熟miR-379-5p的核苷酸序列。例如,miRNA可以具有SEQ ID NO:8的核苷酸序列。
在一些实施方式中,STAT3抑制剂是STAT3的核酸分子抑制剂,并且合适的STAT3抑制剂是miRNA。根据此类实施方式,示例性STAT3抑制性miRNA具有对应于miR-125b-5p、前体miR-125b-5p、成熟miR-125b-5p、miR-106a-5p、前体miR-106a-5p、成熟miR-106a-5p、miR-17-5p、前体miR-17-5p、成熟miR-17-5p、miR-130a-3p、前体miR-130a-3p、成熟miR-130a-3p、miR-130b-3p、前体miR-130b-3p或成熟miR-130b-3p的核苷酸序列。例如,miRNA可具有SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:11、SEQ ID NO:12或SEQ ID NO:13的核苷酸序列。
在一些实施方式中,在诱导恢复活力的方法和治疗髓磷脂缺乏的方法中使用的试剂包括一种或多种表达载体,其编码(i)选自miR-125b-5p、miR-106a-5p、miR-17-5p、miR-130a-3p和miR-130b-3p的一种或多种微小RNA,其中所述施用抑制信号转导子和转录激活子3(STAT3)信号传导途径;(ii)miR-379-5p,其中所述施用抑制E2F转录因子6(E2F6)信号传导途径;和/或(iii)miR-485-5p,其中所述施用抑制Myc相关因子X(MAX)信号传导途径。
在一些实施方式中,在诱导恢复活力的方法和治疗髓磷脂缺乏的方法中使用的试剂包括编码MAX抑制剂的表达载体。在一些实施方式中,MAX抑制剂是核酸分子抑制剂。在一些实施方式中,MAX核酸分子抑制剂是miRNA。根据这样的实施方式,示例性MAX抑制剂miRNA具有对应于miR-485-5p、前体miR-485-5p或成熟miR-485-5p的核苷酸序列。例如,miRNA可以具有SEQ ID NO:7的核苷酸序列。
在一些实施方式中,在诱导恢复活力的方法和治疗髓磷脂缺乏的方法中使用的试剂包括编码E2F6抑制剂的表达载体。在一些实施方式中,E2F6抑制剂是核酸分子抑制剂。在一些实施方式中,E2F6核酸分子抑制剂是miRNA。根据此类实施方式,示例性E2F6抑制剂miRNA具有对应于miR-379-5p、前体miR-379-5p或成熟miR-379-5p的核苷酸序列。例如,miRNA可以具有SEQ ID NO:8的核苷酸序列。
在一些实施方式中,在诱导恢复活力的方法和治疗髓磷脂缺乏的方法中使用的试剂包括编码STAT3抑制剂的表达载体。在一些实施方式中,STAT3抑制剂是核酸分子抑制剂。在一些实施方式中,STAT3核酸分子抑制剂是miRNA。根据此类实施方式,示例性STAT3抑制性miRNA具有对应于miR-125b-5p、前体miR-125b-5p、成熟miR-125b-5p、miR-106a-5p、前体miR-106a-5p、成熟miR-106a-5p、miR-17-5p、前体miR-17-5p、成熟miR-17-5p、miR-130a-3p、前体miR-130a-3p、成熟miR-130a-3p、miR-130b-3p、前体miR-130b-3p或成熟miR-130b-3p的核苷酸序列。例如,miRNA可具有SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:11、SEQ IDNO:12或SEQ ID NO:13的核苷酸序列。
在一些实施方式中,在诱导恢复活力的方法和治疗髓磷脂缺乏的方法中使用的试剂包括表达载体,其编码(1)选自miR-485-5p、miR-379-5p、miR-125b-5p、miR-106a-5p、miR-17-5p、miR-130a-3p和miR-130b-3p的一种或多种微小RNA,和(2)选自miR-93-3p、miR-1260b、miR-767-5p、miR-30b-5p、miR-9-3p和miR-9-5p的一种或多种微小RNA,如下表7所示。
表7.miRNA序列
在一些实施方式中,ZNF274、MAX、E2F6、IKZF3和/或STAT3的核酸抑制剂分子是shRNA分子。短发夹RNA(shRNA)分子包含由环连接的靶基因的有义序列和反义序列。转录后,shRNA分子从细胞核被转运到细胞质,在细胞质中,Dicer酶在短发夹RNA干扰过程中将它们加工成小/短干扰RNA(siRNA)。如本文所用,术语“短发夹RNA干扰”或“shRNAi”是由一类负调节基因表达的小RNA分子介导的过程。
在一些实施方式中,ZNF274抑制剂是ZNF274的核酸分子抑制剂,并且合适的ZNF274抑制剂是ZNF274 shRNA。在一些实施方式中,MAX抑制剂是MAX的核酸分子抑制剂,并且合适的MAX抑制剂是MAX shRNA。在一些实施方式中,E2F6抑制剂是E2F6的核酸分子抑制剂,并且合适的E2F6抑制剂是E2F6 shRNA。在一些实施方式中,IKZF3抑制剂是IKZF3的核酸分子抑制剂,并且合适的IKZF3抑制剂是IKZF3 shRNA。在一些实施方式中,STAT3抑制剂是STAT3的核酸分子抑制剂,并且合适的STAT3抑制剂是STAT3 shRNA。
在一些实施方式中,ZNF274、MAX、E2F6、IKZF3和/或STAT3的核酸抑制剂分子是siRNA。如本文所用,术语“短干扰RNA”或“siRNA”是指长度通常为21-23个核苷酸且具有3'-两个核苷酸悬垂的短核酸分子(参见,例如,McManus&Sharp,“Gene Silencing in Mammalsby Small Interfering RNAs,”Nat.Rev.Genet.3(10):737-747(2002),其全部内容通过引用并入本文)。siRNA与RNA诱导的沉默复合物(“RISC”)相互作用并激活该复合物。RISC的核酸内切酶argonaute 2(AGO2)组分会切割siRNA的客链(有义链),而引导链(反义链)仍与RISC相联。
随后,引导链将活性RISC引导至其靶mRNA以供AGO2切割。由于引导链仅结合与其完全互补的mRNA,因此siRNA会导致特定的基因沉默(参见,例如,Lam et al.,“siRNAVersus miRNA as Therapeutics for Gene Silencing,”Mol.Ther.Nucleic Acids4(9):e252(2015),其全部内容通过引用并入本文)。
在一些实施方式中,ZNF274抑制剂是ZNF274 siRNA。在一些实施方式中,MAX抑制剂是MAX siRNA。在一些实施方式中,E2F6抑制剂是E2F6 siRNA。在一些实施方式中,IKZF3抑制剂是IKZF3 siRNA。在一些实施方式中,STAT3抑制剂是STAT3 siRNA。
在一些实施方式中,ZNF274、MAX、E2F6、IKZF3和/或STAT3的核酸抑制剂分子是反义寡核苷酸。如本文所用,术语“反义寡核苷酸”或“ASO”是指具有不同化学性质的小(约18-30个核苷酸)、合成的单链核酸聚合物,其可用于通过各种机制调节基因表达(参见,例如,Roberts et al.,“Advances in Oligonucleotide Drug Delivery,”Nature ReviewsDrug Discovery 19:673-694(2020),其全部内容通过引用并入本文)。ASO可分为两大类:RNase H感受态(RNase H competent)和空间阻断。内源性RNaseH酶RNASEH1识别RNA-DNA异源双链体底物,其是当基于DNA的寡核苷酸与其同源mRNA转录本结合并催化RNA降解时形成的。ASO结合位点的切割导致靶RNA的破坏,从而沉默靶基因的表达。空间阻断寡核苷酸是ASO,其被设计成以高亲和力与目标转录本结合,但不会诱导目标转录本降解,因为它们缺乏RNase H能力。因此,此类寡核苷酸包含与RNA配对时不形成RNase H底物的核苷酸或核苷酸化学混合物(即“混合体”),从而避免连续DNA样碱基的运行。
在一些实施方式中,ZNF274抑制剂是ZNF274 ASO。在一些实施方式中,MAX抑制剂是MAX ASO。在一些实施方式中,E2F6抑制剂是E2F6 ASO。在一些实施方式中,IKZF3抑制剂是IKZF3 ASO。在一些实施方式中,STAT3抑制剂是STAT3 ASO,例如danvatirsen(参见,例如Xu et al.,“Population Pharmacokinetic Analysis of Danvatirsen Supporting FlatDosing Switch,”J.Pharmacokinet.Pharmacodyn.46(1):65-74(2019),其全部内容通过引用并入本文)。
设计核酸抑制剂的方法是本领域众所周知的并且适合于设计用于本文描述的方法中的核酸抑制剂(参见,例如,Lam et al.,“siRNA Versus miRNA as Therapeutics forGene Silencing,”Mol.Ther.Nucleic Acids 4(9):e252(2015)以及Kulkarni et al.,“The Current Landscape of Nucleic Acid Therapeutics,”Nature Nanotechnology16:630-643(2021),其全部内容通过引用并入本文)。
将核酸抑制剂分子设计为以序列特异性方式靶向ZNF274、MAX、E2F6、IKZF3和/或STAT3及其转录变体。ZNF274、MAX、E2F6、IKZF3和/或STAT3及其转录变体的序列是本领域众所周知的并且可通过各种精选数据库(例如NCBI核苷酸或基因数据库)获得。在一些实施方式中,使用通过所提供的NCBI登录号可获得的序列将核酸抑制剂分子设计为靶向下表8中显示的一种或多种转录因子。
表8.示例性人类转录因子基因和转录变体
*每一个都通过引用全文并入本文。
在一些实施方式中,ZNF274抑制剂、MAX抑制剂、E2F6抑制剂、IKZF3抑制剂和/或STAT3抑制剂是能够沉默ZNF274、MAX、E2F6、IKZF3和/或STAT3的表达的基于核酸酶的基因编辑系统。如本文所用,术语“基于核酸酶的基因编辑系统”是指包含可以被招募至基因组中的靶序列的核酸酶或其衍生物的系统。该系统可包含成簇规则间隔短回文重复相关(“Cas”)蛋白(例如,Cas9、Cas12a和Cas12b)、锌指核酸酶(“ZFN”)或转录激活子样效应物核酸酶(“TALEN”)。
在一些实施方式中,基于核酸酶的基因编辑系统是靶向沉默ZNF274表达、MAX表达、E2F6表达、IKZF3表达和/或STAT3表达的CRISPR/Cas系统。CRISPR/Cas系统可包含Cas蛋白或编码Cas蛋白的核酸分子和引导RNA,所述引导RNA包含与靶DNA序列的一部分互补的核苷酸序列。
如本文所述,Cas蛋白与引导RNA形成核糖核蛋白复合物,所述引导RNA引导Cas蛋白至靶DNA序列。合适的Cas蛋白包括Cas核酸酶(即,能够在靶核酸序列处引入双链断裂的Cas蛋白)、Cas切口酶(即,能够在靶核酸序列处引入单链断裂的Cas蛋白衍生物),和无核酸酶活性的Cas(dCas)蛋白(即,不具有任何核酸酶活性的Cas蛋白衍生物)。
在一些实施方式中,Cas蛋白是Cas9蛋白。如本文所用,术语“Cas9蛋白”或“Cas9”包括任何重组形式或天然存在形式的CRISPR相关蛋白9(Cas9)或其变体或同系物。在一些实施方式中,与天然存在的Cas9蛋白相比,变体或同系物在整个序列或序列的一部分(例如,50、100、150或200个连续氨基酸部分)上具有至少90%、95%、96%、97%、98%、99%或100%的氨基酸序列同一性。在一些实施方式中,Cas9蛋白与由UniProt参考号Q99ZW2、G3ECR1、J7RUA5、A0Q5Y3或J3F2B0(其通过引用整体并入本文)鉴定的蛋白或与其具有基本同一性的变体或同系物基本上相同。在一些实施方式中,Cas9蛋白选自Cas9核酸酶、Cas9切口酶和无核酸酶活性的Cas9(“dCas9”)。
在一些实施方式中,Cas蛋白是Cas12a蛋白。如本文所用,术语“Cas12a蛋白”或“Cas12a”包括任何重组或天然存在形式的CRISPR相关蛋白12(Cas12a)或其变体或同系物。在一些实施方式中,与天然存在的Cas12a蛋白相比,变体或同系物在整个序列或序列的一部分(例如,50、100、150或200个连续氨基酸部分)上具有至少90%、95%、96%、97%、98%、99%或100%的氨基酸序列同一性。在一些实施方式中,Cas12a蛋白与由UniProt参考号A0Q7Q2、U2UMQ6、A0A7C6JPC1、A0A7C9H0Z9或A0A7J0AY55(其通过引用整体并入本文)鉴定的蛋白或与其具有基本同一性的变体或同系物基本上相同。在一些实施方式中,Cas12a蛋白选自Cas12a核酸酶、Cas12a切口酶和无核酸酶活性的Cas12a(“dCas12a”)。
在一些实施方式中,Cas蛋白是Cas12b蛋白。如本文所用,术语“Cas12b蛋白”或“Cas12b”包括任何重组形式或天然存在形式的CRISPR相关蛋白12(Cas12b)或其变体或同系物。在一些实施方式中,与天然存在的Cas12b蛋白相比,变体或同系物在整个序列或序列的一部分(例如,50、100、150或200个连续氨基酸部分)上具有至少90%、95%、96%、97%、98%、99%或100%的氨基酸序列同一性。在一些实施方式中,Cas12b蛋白与由UniProt参考号T0D7A2、A0A6I3SPI6、A0A6I7FUC4、A0A6N9TP17、A0A6M1UF64、A0A7Y8V748、A0A7X7KIS4、A0A7X8X2U5或A0A7X8UMW7(其通过引用整体并入本文)鉴定的蛋白或与其具有基本同一性的变体或同系物基本上相同。在一些实施方式中,Cas12b蛋白选自Cas12b核酸酶、Cas12b切口酶和无核酸酶活性的Cas12b(“dCas12b”)。
如本文所用,术语“引导RNA”或“gRNA”是指能够结合核蛋白从而形成核糖核蛋白复合物的核糖核苷酸序列。根据本公开的方法和系统,引导RNA包含(i)与ZNF274、MAX、E2F6、IKZF3或STAT3序列的靶核酸序列互补的DNA靶向序列和(ii)Cas蛋白(例如,Cas9核酸酶、Cas9切口酶、dCas9、Cas12a核酸酶、Cas12a切口酶或dCas12a)的结合序列。
在一些实施方式中,引导RNA是单个引导RNA分子(单个RNA核酸),其可以包括“单引导RNA”或“sgRNA”。在其他实施方式中,本公开的核酸包括两个RNA分子(例如,通过在结合序列处的杂交连接在一起)。因此,术语引导RNA是囊括性的,指的是双分子核酸和单分子核酸(例如,sgRNA)。
在一些实施方式中,gRNA的长度为10、20、30、40、50、60、70、80、90、100或更多个核酸残基。在一些实施方式中,gRNA的长度为10至30个核酸残基。在一些实施方式中,gRNA的长度是20个核酸残基。在一些实施方式中,gRNA的长度是至少5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100或更多个核酸残基或糖残基。在一些实施方式中,gRNA的长度为5至50、10至50、15至50、20至50、25至50、30至50、35至50、40至50、45至50、5至75、10至75、15至75、20至75、25至75、30至75、35至75、40至75、45至75、50至75、55至75、60至75、65至75、70至75、5至100、10至100、15至100、20至100、25至100、30至100、35至100、40至100、45至100、50至100、55至100、60至100、65至100、70至100、75至100、80至100、85至100、90至100、95至100,或更多个残基。在一些实施方式中,gRNA的长度为10至15、10至20、10至30、10至40,或10至50个残基。
在一些实施方式中,CRISPR/Cas系统靶向沉默ZNF274基因表达,并且引导RNA包含与ZNF274基因序列的一部分互补的核苷酸序列。
在一些实施方式中,CRISPR/Cas系统靶向沉默MAX基因表达,并且引导RNA包含与MAX基因序列的一部分互补的核苷酸序列。
在一些实施方式中,CRISPR/Cas系统靶向沉默E2F6基因表达,并且引导RNA包含与E2F6基因序列的一部分互补的核苷酸序列。
在一些实施方式中,CRISPR/Cas系统靶向沉默IKZF3基因表达,并且引导RNA包含与IKZF3基因序列的一部分互补的核苷酸序列。
在一些实施方式中,CRISPR/Cas系统靶向沉默STAT3 DNA表达,并且引导RNA包含与STAT3基因序列的一部分互补的核苷酸序列。
在一些实施方式中,靶向沉默ZNF274表达、MAX表达、E2F6表达、IKZF3表达和/或STAT3表达的CRISPR/Cas系统是CRISPRi系统。如本文所用,术语“CRISPR干扰”或“CRISPRi”是指允许序列特异性抑制基因表达的系统。CRISPRi系统包含无核酸酶活性的Cas(“dCas”)蛋白(即,核酸酶失活的Cas蛋白),以阻断靶基因的转录,而不切割靶DNA序列。核酸酶失活的Cas蛋白和产生核酸酶失活的Cas蛋白的方法是本领域熟知的(参见,例如,Qi et al.,“Repurposing CRISPR as an RNA-Guided Platform for Sequence-Specific Controlof Gene Expression,”Cell 152(5):1173-1183(2013),其全部内容通过引用并入本文)。
适合如本文所述使用的CRISPRi系统可以包含(i)无核酸酶活性的Cas(dCas)蛋白(即,核酸酶失活的Cas蛋白)或编码dCas蛋白的核酸分子和(ii)包含与ZNF274、MAX、E2F6、IKZF3和STAT3的一部分互补的核苷酸序列的引导RNA。
在一些实施方式中,无核酸酶活性的Cas(dCas)蛋白选自dCas9、dCas12a和dCas12b。
在一些实施方式中,无核酸酶活性的Cas(dCas)蛋白是融合蛋白,其包含Cas蛋白和一种或多种抑制或沉默靶基因(即,ZNF274、MAX、E2F6、IKZF3和STAT3)表达的表观遗传调节物。
合适的表观遗传调节物包括但不限于DNA甲基转移酶(例如DNA甲基转移酶3α(“DNMT3A”)和DNA甲基转移酶3样(“DNMT3L”))、组蛋白去甲基化酶(例如赖氨酸特异性组蛋白去甲基化酶1(“LSD1”))、组蛋白甲基转移酶(例如G9A和SuV39h1)、转录因子募集结构域(例如Krüppel相关框结构域(“KRAB”)、KRAB-甲基-CpG结合蛋白2结构域(“KRAB-MeCP2”)、Zeste增强子2(“EZH2”))、锌指转录抑制域(例如spalt样转录因子1(“SALL1”)和缺陷沉默蛋白抑制因子3(“SDS3”))(参见,例如,Brezgin et al.,“Dead Cas Systems:Types,Principles,and Applications,”Int.J.Mol.Sci.20:6041(2019),其全部内容通过引用并入本文)。
在一些实施方式中,表观遗传调节物选自以下各项:DNMT3A、DNMT2L、LSDl、KRAB、KRAB-MeCP2、EZH2、SALLl、SDS3、G9A和Suv39h1(参见,例如,Yeo etal.,“An EnhancedCRISPR Repressor for Targeted Mammalian Gene Regulation,”15(8):611-616(2018);Alerasool et al.,“An Efficient KRAB Domain for CRISPRi Applications in HumanCells,”Nature Methods 17:1093-1096(2020);以及Duke et al.,“An Improved CRISPR/dCas9 Interference Tool for Neuronal Gene Suppression,”Frontiers in GenomeEditing 2:9(2020),其全部内容通过引用并入本文)。
在一些实施方式中,ZNF274抑制剂是靶向沉默ZNF274 DNA表达的CRISPRi系统,并且引导RNA包含与ZNF274基因序列的一部分互补的核苷酸序列。
在一些实施方式中,MAX抑制剂是靶向沉默MAX DNA表达的CRISPRi系统,并且引导RNA包含与MAX基因序列的一部分互补的核苷酸序列。
在一些实施方式中,E2F6抑制剂是靶向沉默E2F6 DNA表达的CRISPRi系统,并且引导RNA包含与E2F6基因序列的一部分互补的核苷酸序列。
在一些实施方式中,IKZF3抑制剂是靶向沉默IKZF3 DNA表达的CRISPRi系统,并且引导RNA包含与IKZF3基因序列的一部分互补的核苷酸序列。
在一些实施方式中,STAT3抑制剂是靶向沉默STAT3 DNA表达的CRISPRi系统,并且引导RNA包含与STAT3基因序列的一部分互补的核苷酸序列。
在一些实施方式中,抑制ZNF274、MAX、E2F6、IKZF3和/或STAT3的试剂包括一种或多种表达载体,所述表达载体表达选自ZNF274抑制剂、MAX抑制剂、E2F6抑制剂、IKZF3抑制剂和IKZF3抑制剂的一种或多种转录因子抑制剂。每种表达载体包含(1)编码ZNF274、MAX、E2F6、IKZF3和/或IKZF3的一种或多种核酸抑制剂的核苷酸序列,和(2)可操作地连接至所述核苷酸序列的调控序列。在一些实施方式中,调控序列包括选自PDGFRA启动子、ZNF488启动子、GPR17启动子、OLIG2启动子、CSPG4启动子和SOX10启动子的胶质细胞特异性启动子。在一些实施方式中,调控序列包括诱导型启动子或启动子系统,例如四环素控制的诱导系统、cumate控制的诱导系统和雷帕霉素控制的诱导系统,其在下文中更详细地描述。
在一些实施方式中,所述一种或多种表达载体包括质粒载体、病毒载体或细菌载体。在一些实施方式中,一种或多种表达载体包括选自腺病毒、AAV、逆转录病毒、慢病毒、牛痘病毒和疱疹病毒的病毒载体。在一些实施方式中,一种或多种表达载体包括慢病毒载体。在一些实施方式中,一种或多种表达载体包括逆转录病毒载体。在其他实施方式中,一种或多种表达载体包括AAV载体。下文更详细地描述了产生和分离适合用作表达载体的病毒载体的方法。
IV.表达载体
本公开的另一方面涉及本申请中描述的表达载体。在一些实施方式中,表达载体表达选自BCL11A、HDAC2、EZH2、MYC、HMGA2、NFIB和TEAD2的一种或多种转录因子,其中所述表达载体包含(1)编码选自BCL11A、HDAC2、EZH2、MYC、HMGA2、NFIB和TEAD2的一种或多种转录因子的核苷酸序列,和(2)与所述核苷酸序列可操作地连接的调控序列。
在一些实施方式中,表达载体包含(1)编码ZNF274、MAX、E2F6、IKZF3和/或IKZF3的一种或多种核酸抑制剂的核苷酸序列,和(2)与所述核苷酸序列可操作地连接的调控序列。
在一些实施方式中,调控序列包括选自PDGFRA启动子、ZNF488启动子、GPR17启动子、OLIG2启动子、CSPG4启动子和SOX10启动子的胶质细胞特异性启动子。
在一些实施方式中,调控序列包括诱导型启动子和/或操纵子系统序列。可用于实施本发明的方法或包括在本公开的系统中的诱导型启动子和/或操纵子系统包括受激素和激素类似物(例如黄体酮、蜕皮激素和糖皮质激素)调节的启动子和/或操纵子系统,以及受四环素、热休克、重金属离子、干扰素和乳糖操纵子激活化合物调节的启动子。诱导型启动子和/操纵子系统能够直接或间接激活其可操作地偶联的核酸分子的转录,以响应“调节剂”(例如,化学剂或生物分子,如代谢物、小分子)或刺激物。在不存在“调节剂”或刺激物的情况下,可操作地连接至诱导型启动子和/或操纵子系统的核苷酸序列将不转录或基本上不表达。
术语“不转录”或“基本上不表达”是指转录水平比在适当的刺激物或调节剂存在下观察到的转录水平低至少50倍;优选地,比在适当的刺激物或调节剂存在下观察到的转录水平低至少100倍、250倍、或500倍或更低。有关这些系统的综述,请参阅Gingrich&Roder,“Inducible Gene Expression in the Nervous System of Transgenic Mice,”Annu.Rev.Neurosci.21:377-405(1998),其全部内容通过引用并入本文。
用于包含在本公开内容的表达载体中的合适的诱导型启动子和/或操纵子系统是本领域众所周知的,并且包括但不限于四环素控制的操纵子系统、cumate控制的操纵子系统、雷帕霉素诱导系统、FKCsA诱导系统和ABA诱导系统(参见,例如,Kallunki et al.,“Howto Choose the Right Inducible Gene Expression System for Mammalian Studies?”Cells8(8):796(2019);美国专利号8728759;以及美国专利号7745592,其全部内容通过引用并入本文)。
在一些实施方式中,四环素控制的操纵子系统包含基于阻抑的配置,其中Tet操纵子(“TetO”)插入到组成型启动子和目的基因之间,并且其中Tet阻遏物(“TetR”)结合到操纵子会抑制目的核酸序列的下游转录(参见,例如,Kallunki et al.,“How to Choose theRight Inducible Gene Expression System for Mammalian Studies?”Cells 8(8):796(2019),其全部内容通过引用并入本文)。根据此类实施方式,四环素(或合成的四环素衍生物多西环素)的添加导致TetR和TetO之间缔合的破坏,从而触发目的核酸序列的TetO依赖性转录。
在一些实施方式中,四环素控制的操纵子系统包含Tet-off配置,其中串联TetO序列位于最小启动子的上游,随后是目的核酸序列(参见,例如,Kallunki et al.,“How toChoose the Right Inducible Gene Expression System for Mammalian Studies?”Cells 8(8):796(2019),其全部内容通过引用并入本文)。根据此类实施方式,由TetR和VP16组成的嵌合蛋白(“tTA”)(源自1型单纯疱疹病毒的真核反式激活子)转化为转录激活子,并且表达质粒与操纵子质粒一起转染。因此,四环素(或合成的四环素衍生物多西环素)的存在会关闭系统或其组件的表达,而去除四环素则将开启其表达。
在一些实施方式中,四环素控制的操纵子系统包含Tet-on配置,其中当四环素存在时系统或其组件转录(参见,例如,Kallunki et al.,“How to Choose the RightInducible Gene Expression System for Mammalian Studies?”Cells 8(8):796(2019),其全部内容通过引用并入本文)。根据此类实施方式,串联TetO序列位于最小启动子的上游,随后是目的核酸序列。在四环素(或5种合成四环素衍生物强力霉素)存在的情况下,突变体rTa(“rtTa”)与TetO序列结合,从而激活最小启动子。
在一些实施方式中,诱导型启动子和/或操纵子系统是cumate控制的操纵子系统。类似于四环素控制的操纵子系统,cumate控制的操纵子系统,cumate操纵子(“CuO”)及其阻遏物(“CymR”)可以被设计成阻遏物配置、激活子配置和反向激活子配置(参见,例如,Kallunki et al.,“How to Choose the Right Inducible Gene Expression System forMammalian Studies?”Cells 8(8):796(2019),其全部内容通过引用并入本文)。
在一些实施方式中,如本文所述,cumate控制操纵子系统包含基于阻抑的配置,其中cumate操纵子(“CuO”)插入到组成型启动子和目的基因之间,并且其中cumate阻遏物(“CymR”)结合到操纵子会抑制系统(或系统组件)的下游转录。根据此类实施方式,添加cumate释放CymR,从而触发系统或系统组分的CuO依赖性表达。
在一些实施方式中,cumate控制的操纵子系统包括激活子配置,其中嵌合分子(“cTA”)通过CymR和VP16的融合形成。在此配置中,最小启动子位于多聚化操纵子结合位点(例如6xCuO)的下游。目的核酸序列的转录由最小启动子控制,该启动子在没有cumate的情况下被激活。
在一些实施方式中,cumate控制的操纵子系统包括反向激活子配置,其中当cumate存在时核酸序列被转录。根据此类实施方式,串联CuO序列位于最小启动子的上游,随后是目的核酸序列。在cumate存在的情况下,cTA突变体(“rcTA”)与CuO序列结合,从而激活最小启动子。
在一些实施方式中,诱导型启动子和/或操纵子系统是雷帕霉素诱导系统。根据此类实施方式,启动子是雷帕霉素诱导启动子(例如,最小IL-2启动子)。在该系统中,DNA 25结合结构域(ZFHD1)和转录因子激活结构域(NF-KB p65)分别表达为分别与FKBP12和FRAP(mTOR)的雷帕霉素结合结构域的融合蛋白(参见,例如,Koh et al.,“Use of aStringentDimerizer-Regulated Gene Expression System for Controlled BMP2 Delivery,”Mol.Ther.14(5):P684-691(2006),其全部内容通过引用并入本文)。添加雷帕霉素(或雷帕霉素类似物FK506)后,融合蛋白可逆地交联以驱动目的核酸序列的转录。mTOR激活结构域融合蛋白的雷帕霉素结合区的突变导致系统对雷帕霉素样化合物(rapalogs)反应,与雷帕霉素不同,雷帕霉素样化合物不与内源性mTOR蛋白结合,因此几乎没有免疫抑制或抗增殖活性。
在一些实施方式中,调控序列包括人延伸因子1α启动子(“EF1A”)、5巨细胞病毒(“CMV”)启动子、人泛素C启动子(“UBC”)、鸡β-肌动蛋白启动子、杂交鸡β-肌动蛋白启动子(CBh)和磷酸甘油激酶(“PGK”)启动子。根据此类实施方式,启动子可被修饰以包含1、2、3或更多个Tet操纵子(TetO)位点或1、2、3、4、5、6或更多个CuO位点。
用于包含在本申请的表达载体中的另外的合适的启动子包括但不限于H1启动子和U6启动子。在一些实施方式中,当诱导型启动子和/或操纵子系统可操作地连接至编码Cas系统中的一种或多种引导RNA的核苷酸序列时,启动子是H1启动子或U6启动子。H1启动子可以是包含1、2、3或更多个Tet操纵子(TetO)位点的修饰的H1启动子。U6启动子可以是包含1、2或3个Tet操纵子(TetO)位点或1、2、3、4、5、6或更多个CuO位点的修饰的U6启动子(参见,例如,Sun et al.,“Development of Drug-20 Inducible CRISPR-Cas9 Systems forLarge-Scale Functional Screening,”BMC Genomics 20:225(2019),其全部内容通过引用并入本文)。
在一些实施方式中,调控序列还可以包含转录增强子结合位点、RNA聚合酶起始位点、核糖体结合位点和/或促进与表达载体中的调控序列可操作地连接的核苷酸序列表达的其他位点。
在一些实施方式中,表达载体编码用于诱导成体胶质祖细胞群恢复活力或治疗受试者中的髓磷脂缺乏的系统。
在一些实施方式中,用于诱导成体胶质祖细胞群恢复活力或治疗受试者中的髓磷脂缺乏的系统是无核酸酶活性的Cas(dCas)系统。该系统包含编码融合蛋白的第一核酸分子,该融合蛋白包含与表观遗传调节物融合的无核酸酶活性的Cas(dCas)蛋白;编码一种或多种引导RNA的第二核酸分子,其中所述一种或多种引导RNA各自包含与ZNF274、MAX、E2F6、IKZF3和/或STAT3的DNA序列的一部分杂交的RNA序列;和可操作地连接至第一核酸分子、第二核酸分子或两者的诱导型启动子和/或操纵子系统。在一些实施方式中,失活的Cas蛋白(dCas)选自dCas9、dCas12a和dCas12b(参见,例如,Brezgin et al.,“Dead Cas Systems:Types,Principles,and Applications,”Int.J.Mol.Sci.20:6041(2019),其全部内容通过引用并入本文)。
合适的表观遗传调节物在上文详细描述。在一些实施方式中,表观遗传调节物选自以下各项:DNMT3A、DNMT2L、LSD1、KRAB、KRAB-MeCP2、EZH2、SALL1、SDS3、G9A、Suv39h1、Cs和WRPW(参见,例如,Yeo et al.,“An Enhanced CRISPR Repressor for TargetedMammalian Gene Regulation,”15(8):611-616(2018);Alerasool et al.,“An EfficientKRAB Domain for CRISPRi Applications in Human Cells,”Nature Methods 17:1093-1096(2020);以及Duke et al.,“An Improved CRISPR/dCas9 Interference Tool forNeuronal Gene Suppression,”Frontiers in Genome Editing 2:9(2020),其全部内容通过引用并入本文)。在一些实施方式中,当基因或基因启动子的甲基化有效抑制其转录时,表观遗传调节物是甲基转移酶。
在一些实施方式中,表观遗传调节物选自Tet甲基胞嘧啶双加氧酶1(“TET1”)、SunTag-TET1、MS2/MCP-TET1、p300Core、单纯疱疹病毒蛋白16的四个串联拷贝(“VP64”)、VP160、NF-κB p65激活结构域(“p65”)、Epstein-Barr病毒衍生的R反式激活蛋白(“Rta”)、SunTag-VP64、VP64-p65-Rta(“VPR”)、SunTag-p65-HSF1、TV、协同激活介体(“SAM”)、增强表达的三组分再利用技术(“TREE”)、Casilio、Scaffold和CMV(参见,例如,Brezgin et al.,“Dead Cas Systems:Types,Principles,and Applications,”Int.J.Mol.Sci.20(23):6041(2019),其全部内容通过引用并入本文)。在一些实施方式中,当基因或基因蛋白的去甲基化有效抑制其转录时,表观遗传调节物是去甲基酶(例如,TET1)。
在一些实施方式中,用于诱导成体胶质祖细胞群恢复活力或治疗受试者的髓磷脂缺乏的系统包含dCas融合蛋白,其中dCas与甲基转移酶融合。在任何实施方式中,用于诱导成体胶质祖细胞群恢复活力或治疗受试者中的髓磷脂缺乏的系统包含dCas融合蛋白,其中dCas与去甲基酶融合。
根据本公开的方法使用的示例性dCas融合蛋白和dCas融合蛋白系统在下表9中显示。
表9.示例性Cas融合蛋白
*每一个都通过引用全文并入本文。
在一些实施方式中,dCas蛋白是dCas9或dCas12蛋白。
在一些实施方式中,该dCas系统的第一和第二核酸分子包含在单个表达载体中。在一些实施方式中,该系统的第一和第二核酸分子包含在不同的表达载体中。
在一些实施方式中,用于诱导成体胶质祖细胞群恢复活力或治疗受试者中的髓磷脂缺乏的系统是Cas系统。该系统包含编码Cas蛋白的第一核酸分子;编码一种或多种引导RNA的第二核酸分子,其中所述一种或多种引导RNA各自包含与ZNF274、MAX、E2F6、IKZF3和/或STAT3的DNA序列的一部分杂交的RNA序列;和可操作地连接至第一核酸分子、第二核酸分子或两者的诱导型启动子和/或操纵子系统。
在一些实施方式中,该Cas核酸酶系统包含Cas9蛋白或Casl2蛋白(例如,Casl2a或Casl2b)。包含在根据本公开的系统中的合适的Cas蛋白及其衍生物是本领域众所周知的并且在上文进行了更详细的描述。
在一些实施方式中,该Cas核酸酶系统的第一和第二核酸分子包含在单个表达载体中。在一些实施方式中,第一和第二核酸分子包含在不同的表达载体中。
在一些实施方式中,用于诱导成体胶质祖细胞群恢复活力或治疗受试者中的髓磷脂缺乏的系统是基因编辑核酸酶系统。该系统包含:编码包含第一DNA结合基序的第一序列特异性基因编辑核酸酶的第一核酸分子,其中第一DNA结合基序分别结合ZNF274、MAX、E2F6、IKZF3和/或STAT3的第一DNA序列;编码包含第二DNA结合基序的第二序列特异性基因编辑核酸酶的第二核酸分子,其中所述第二DNA结合基序分别结合ZNF274、MAX、E2F6、IKZF3和/或STAT3的第二DNA序列;以及可操作地偶联至第一核酸分子、第二核酸分子或第一和第二核酸分子两者的诱导型启动子和/或操纵子系统序列。
用于纳入根据本公开的系统的合适的序列特异性基因编辑核酸酶是本领域众所周知的,并且包括但不限于锌指核酸酶(“ZFN”)和转录激活子样效应物核酸酶(“TALEN”)。
在一个实施方式中,本文所述系统的序列特异性基因编辑核酸酶是ZFN。ZFN是包含与核酸酶结构域(例如,FokI限制酶的切割结构域)融合的至少1个锌指基序(例如,至少2、3、4或5个锌指基序)的人工核酸内切酶。两个单独的ZFN在靶核酸序列上的异二聚化可导致靶序列的裂解。例如,两个单独的ZFN可以结合靶DNA序列的相反链以诱导靶核酸序列中的双链断裂。设计包含在本发明所要求保护的公开内容的系统中的合适ZFN的方法是本领域众所周知的(参见,例如,Urnov et al.,“Genome Editing with Engineered ZincFinger Nucleases,”Nat.Rev.Genet.11(9):636-646(2010);Gaj et al.,“Targeted GeneKnockout by Direct Delivery of Zinc-Finger Nuclease Proteins,”Nat.Methods9(8):805-807(2012);美国专利号6,534,261;美国专利号6,607,882;美国专利号6,746,838;美国专利号6,794,136;美国专利号6,824,978;美国专利号6,866,997;美国专利号6,933,113;美国专利号6,979,539;美国专利号7,013,219;美国专利号7,030,215;美国专利号7,220,719;美国专利号7,241,573;美国专利号7,241,574;美国专利号7,585,849;美国专利号7,595,376;美国专利号6,903,185;以及美国专利号6,479,626,其通过引用全部并入本文)。在一些实施方式中,第一和第二基因编辑核酸酶是FokI核酸酶。根据此类实施方式,第一和第二DNA结合基序是锌指基序。
在一些实施方式中,本文描述的系统的序列特异性基因编辑核酸酶是TALEN。TALEN是一种工程化的转录激活子样效应物核酸酶,其包含DNA结合结构域和核酸酶结构域(例如FokI限制性酶的切割结构域)。DNA结合结构域包含一系列33-35个氨基酸重复结构域,每个重复结构域识别单个碱基对。两个单独的TALEN在靶核酸序列上的异二聚化可导致靶序列的裂解。例如,两个单独的TALEN可以结合靶DNA序列的相反链以诱导靶核酸序列中的双链断裂。设计包含在本公开内容的系统中的合适ZFN的方法是本领域众所周知的(参见,例如,Scharenberg et al.,“Genome Engineering with TAL-Effector Nucleasesand Alternative Modular Nuclease Technologies,”Curr.Gene Ther.13(4):291-303(2013);Gaj et al.,“Targeted Gene Knockout by Direct Delivery of Zinc-FingerNuclease Proteins,”Nat.Methods 9(8):805-807(2012);Beurdeley et al.,“CompactDesigner TALENs for Efficient Genome Engineering,”Nat.Commun.4:1762(2013);美国专利号8,440,431;美国专利号8,440,432;美国专利号8,450,471;美国专利号8,586,363;以及美国专利号8,697,853,其全部内容通过引用并入本文)。在一些实施方式中,第一和第二基因编辑核酸酶是FokI核酸酶。根据此类实施方式,第一和第二DNA结合基序是TALE基序。
在一些实施方式中,本文所述的序列特异性基因编辑核酸酶系统的第一和第二核酸分子包含在单个表达载体中。在一些实施方式中,第一和第二核酸分子包含在不同的表达载体中。
如上文中更详细地描述的,在本文描述的用于使胶质祖细胞恢复活力或治疗受试者中的髓磷脂缺乏的所有系统中,系统的第一和/或第二核酸分子可操作地偶联至诱导型启动子和/或操纵子系统。
在一些实施方式中,本申请的表达载体是质粒载体、病毒载体或细菌载体。
在一些实施方式中,本申请的表达载体是慢病毒载体(参见,例如,Fang等人的美国专利号748,529;Ura et al.,“Developments in Viral Vector-Based Vaccines,”Vaccines 2:624-641(2014);和Hu et al.,“Immunization Delivered by LentiviralVectors for Cancer and Infection Diseases,”Immunol.Rev.239:45-61(2011),15,其全部内容通过引用并入本文)。
在一些实施方式中,本申请的表达载体是逆转录病毒载体(参见,例如,Fang等人的美国专利号748,529和Ura et al.,“Developments in Viral Vector-BasedVaccines,”Vaccines2:624-641(2014),其全部内容通过引用并入本文)、牛痘病毒、复制缺陷型腺病毒载体和无肠腺病毒载体(参见,例如,美国专利号5,872,005,其全部内容通过引用并入本文)。
在其他实施方式中,本申请的表达载体是腺相关病毒(AAV)载体(参见,例如,Krause et al.,“Delivery of Antigens by Viral Vectors for Vaccination,”Ther.Deliv.2(1):51-70(2011);Ura et al.,“Developments in Viral Vector-BasedVaccines,”Vaccines 2:624-641(2014);Buning et al,"Recent Developments inAdeno-associated Virus Vector Technology,"J.Gene Med.10:717-733(2008),每一篇均通过引用全文并入本文)。
用于产生和分离适合用作载体的病毒表达载体的方法是本领域已知的(参见,例如,Bulcha et al.,“Viral Vector Platforms within the Gene Therapy Landscape,”Nature 6:53(2021);Bouard et al.,“Viral Vectors:From Virology to TransgeneExpression,”Br.J.Pharmacol.157(2):153-165(2009);Grieger&Samulski,"Adeno-associated Virus as a Gene Therapy Vector:Vector Development,Production andClinical Applications,"Adv.Biochem.Engin/Biotechnol.99:119-145(2005);Buninget al,"Recent Developments in Adeno-associated Virus Vector Technology,"J.Gene Med.10:717-733(2008),其每一篇都通过引用全文并入本文)。
V.遗传修饰的胶质祖细胞
本公开的方面还涉及用本申请的表达载体或核酸分子进行遗传修饰的胶质祖细胞。在一些实施方式中,表达载体或核酸分子整合至遗传修饰的胶质祖细胞的基因组中。在一些实施方式中,表达载体或核酸分子以表观染色体形式存在于遗传修饰的胶质祖细胞中。
在一些实施方式中,胶质祖细胞用根据本申请的无核酸酶活性的Cas(dCas)系统、Cas核酸酶系统或基因编辑核酸酶系统进行遗传修饰。
在一些实施方式中,遗传修饰的胶质祖细胞是哺乳动物胶质祖细胞。在任何实施方式中,遗传修饰的胶质祖细胞是人胶质祖细胞。
适合本文所述的遗传修饰的胶质祖细胞可以使用本领域已知的或本文所述的方法衍生自专能干细胞(multipotent)(例如,神经干细胞)或多能细胞(pluripotent cell)(例如,胚胎干细胞和诱导多能干细胞)。在另一个实施方式中,可以通过使用启动子特异性分离技术直接从含有混合细胞群的胚胎组织、胎儿组织或成体脑组织中提取胶质祖细胞,如Goldman的美国专利申请公开号20040029269和20030223972中所述,其全部内容通过引用并入本文。根据该实施方式,胶质祖细胞从脑室或脑室下区或从皮层下白质分离。
在一些实施方式中,遗传修饰的胶质祖细胞是遗传修饰的双能胶质祖细胞。在一些实施方式中,遗传修饰的胶质祖细胞是遗传修饰的偏向少突胶质细胞的胶质祖细胞。在一些实施方式中,遗传修饰的胶质祖细胞是遗传修饰的偏向星形胶质细胞的胶质祖细胞。
在一些实施方式中,可以优选在遗传修饰之前或之后富集包含胶质祖细胞的细胞制品,以增加经修饰以含有本文描述的表达载体或系统的胶质祖细胞的浓度和/或纯度。因此,在一个实施方式中,利用在发育或分化过程早期识别并结合存在于胶质祖细胞上的神经节苷脂的A2B5单克隆抗体(mAb)来从混合细胞群中分离胶质祖细胞(Nunes et al.,“Identification and Isolation of Multipotential Neural Progenitor Cells Fromthe Subcortical White Matter of the Adult Human Brain.,”Nat Med.9(4):439-47(2003),其全部内容通过引用并入本文)。使用A2B5 mAb,可以从混合的细胞类型群体中分离、富集或纯化胶质祖细胞。在另一个实施方式中,采用CD140α/PDGFRα阳性细胞的选择来产生双能胶质祖细胞的纯化或富集制品。在另一个实施方式中,采用CD9阳性细胞的选择来产生偏向少突胶质细胞的胶质祖细胞的纯化或富集制品。在又一个实施方式中,采用CD140α/PDGFRα和CD9两者阳性细胞选择来产生偏向少突胶质细胞的胶质祖细胞的纯化或富集制品。在另一个实施方式中,采用CD44阳性细胞选择来产生偏向星形胶质细胞的胶质祖细胞的纯化或富集制品(Liu et al.,“CD44 Expression Identifies Astrocyte-RestrictedPrecursor Cells,”Dev.Biol.276(1):31-46(2004),其全部内容通过引用并入本文)。在另一个实施方式中,采用CD140α/PDGFRα和CD44两者阳性细胞选择来产生偏向少突胶质细胞的胶质祖细胞的纯化或富集制品。在另一个实施方式中,采用CD140α/PDGFRα、CD9和CD44阳性细胞选择来产生偏向少突胶质细胞的胶质祖细胞的纯化或富集制品。
本公开的另一方面涉及表达根据本公开的遗传构建体的胶质祖细胞的制品。
下面的实施例旨在举例说明本公开的实施方式的实践,但决不旨在限制其范围。
实施例
材料和方法
细胞系
人iPSC细胞系C27用于生成hGPC,其中预测的感兴趣转录物得到了验证。C27细胞系为男性的。细胞分化为GPC,详见人iPSC衍生的GPC产生(Chambers et al.,“HighlyEfficient Neural Conversion of Human ES and iPS Cells by Dual Inhibition ofSMAD Signaling,”Nat Biotechnol 27:275-280(2009),其全文通过引用并入本文)。
用于细胞分离的成体和胎儿大脑处理
人脑样本是根据经批准的机构审查委员会协议从罗切斯特大学史壮纪念医院的同意患者中获得的。从正常的GW 18-24皮质和/或VZ/SVZ解剖或成人白质/皮质癫痫切除术获得脑组织(18岁(女性)、19岁(男性)和27岁(女性)获得mRNA,8岁(男性)、20岁(女性)、43岁(男性)和54岁(女性)获得miRNA)。胎儿GPC的采集、分离和A2B5+/PSA-NCAM-细胞的免疫磁性分选已被描述(Windrem et al.,“Fetal and Adult Human OligodendrocyteProgenitor Cell Isolates Myelinate the Congenitally Dysmyelinated Brain,”Nat.Med.10:93-97(2004),其全文通过引用并入本文)。如其所述,采用双重免疫磁分选策略从游离组织中分离GPC:消耗小鼠抗-PSA-NCAM+(Millipore,DSHB)细胞,使用微珠标记的大鼠抗小鼠IgM(Miltenyi Biotech),然后从PSA-NCAM-池选择A2B5+(克隆105;ATCC,Manassas,VA)细胞(Windrem et al.,“Fetal and Adult Human OligodendrocyteProgenitor Cell Isolates Myelinate the Congenitally Dysmyelinated Brain,”Nat.Med.10:93-97(2004)以及Windrem et al.,“Neonatal Chimerization with HumanGlial Progenitor Cells can both Remyelinate and Rescue the Otherwise LethallyHypomyelinated Shiverer Mouse,”Cell Stem Cell 2:553-565(2008),其全文通过引用并入本文)。分选后,细胞在含有10ng/ml bFGF和20ng/ml PDGF-AA的DMEM-F12/N1中保持1-14天。或者,如前所述,使用MACS分离和分选CD140a/PDGFR定义的GPC(Sim et al.,“CD140aIdentifies aPopulation of Highly Myelinogenic,Migration-Competent andEfficiently Engrafting Human Oligodendrocyte Progenitor Cells,”Nat.Biotechnol.29:934-941(2011b),其全文通过引用并入本文),产生富集的CD140+胶质祖细胞群。
批量RNA测序
通过Qiagen-RNeasy试剂盒从分离物中纯化RNA,并构建批量RNA测序文库。样本在罗切斯特大学基因组学研究中心的Illumina HiSeq 2500上进行深度测序。使用fastp修剪原始FASTQ文件并移除适配子(Chen et al.,“fastp:An Ultra-fast All-in-one FASTQPreprocessor,”Bioinformatics 34:i884-i890(2018),其全文通过引用并入本文),并通过在所有样本中以2-pass模式的STAR使用Ensembl 95基因注释与GRCh38比对(Dobin etal.,“STAR:Ultrafast Universal RNA-seq Aligner,”Bioinformatics 29:15-21(2013),其全文通过引用并入本文),并使用RSEM版本进行量化(Li and Dewey,“RSEM:AccurateTranscript Quantification From RNA-Seq Data With or Without a ReferenceGenome,”BMC Bioinformatics 12:323(2011),其全文通过引用并入本文)。随后的分析在R(R Core Team R:A Language and Environment for Statistical Computing.(Vienna,Austria:R Foundation for Statistical Computing)(2017),其全文通过引用并入本文)中进行,其中RSEM基因水平结果通过tximport输入(Soneson et al.,“DifferentialAnalyses for RNA-seq:Transcript-Level Estimates Improve Gene-LevelInferences,”F1000Research 4:1521(2015),其全文通过引用并入本文)。DE分析在DESeq2(Love et al.,“Moderated Estimation of Fold Change and Dispersion for RNA-seqData With DESeq2,”Genome Biology 15:550(2014),其全文通过引用并入本文)中进行,其中配对分析(胎儿A2B5+vs CD140a+,胎儿CD140a+vs CD140a-)将配对信息添加到其模型中。对于成人vs胎儿DE分析,年龄与分类标记物(不包括CD140a-样本)相连,以定义组变量,其中测序批次也被添加到模型中,以说明技术变异性。调整后p值<0.01和绝对log2倍数变化>1的基因被认为是显著的。然后,通过有意义的丰度进一步过滤这些数据,定义为至少1组中的中值TPM(通过RSEM计算)为1(20663个基因在DE之前符合该标准)。
scRNA-Seq分析
如上所述对胎儿脑样本进行批量rna-seq处理,直到通过FACS对单个细胞进行CD140a+或PSA-NCAM-/A2B5+表面表达的分选。然后利用V2化学和根据制造商说明生成的文库,在10X基因组学铬控制器(10X genomics chromium controller)上捕获单细胞。
在Illumina HISeq 2500系统上对样本进行测序。然后使用Cell Ranger将分离的样本与仅使用蛋白质编码、lncRNA或miRNA生物型的GRCh38和Ensembl 95基因注释生成的指数进行比对和定量。scRNA-Seq样本通过Seurat(Butler et al.,“Integrating Single-cell Transcriptomic Data Across Different Conditions,Technologies,andSpecies,”Nat Biotechnol36:411-420(2018),其全文通过引用并入本文)在R内进行分析。合并两个样本并过滤掉定义为线粒体基因表达大于15%或少于500个独特基因的低质量细胞。然后使用SCTransform对样本进行归一化,并注意回归出由于UMI总数、线粒体基因含量百分比或每个细胞S期和G2M期评分差异而产生的贡献。然后计算PCA,使用前30个维度运行UMAP,其中n.neighbors=60以及repulsion.strength=0.8。然后运行FindNeighbors,之后运行分辨率设置为.35的FindClusters。根据每个聚类的表达谱,将一些相似的聚类合并为更广泛的细胞类型聚类。使用MAST检验(Finak et al.,“MAST:A Flexible StatisticalFramework for Assessing Transcriptional Changes and CharacterizingHeterogeneity in Single-cell RNA Sequencing Data,”Genome Biology 16:278(2015),其全文通过引用并入本文)计算聚类的静态差异表达,其中调整后p值<0.01且绝对log2倍数变化>0.5被认为是显著的。利用R中的SCENIC软件包(Aibar et al.,“SCENIC:Single-cell Regulatory Network Inference and Clustering,”Nat.Methods 14:1083-1086(2017),其全文通过引用并入本文),利用位于https://resources.aertslab.org/cistarget/的hg38数据库,对活性转录因子调节子进行预测。如果基因在至少1%的细胞中表达,则将其包括在共表达分析中。
Ingenuity通路分析(Ingenuity Pathway Analysis)和网络构建
将差异表达的基因输入到Ingenuity通路分析(Qiagen)中,以确定重要的标准、功能和上游信号转导项。对于IPA网络的构建,对调整后的p值低于0.001的项进行了过滤。删除了不相关的IPA项以及使用iGraph软件包通过jaccard相似性指数评估的高度冗余的功能项(Csardi,G.N.,Tamas“The Igraph Software Package for Complex NetworkResearch,”InterJournal Complex Systems 1695(2006),其全文通过引用并入本文)。在Gephi中建立模块化(Bastian et al.,“Gephi:An Open Source Software for Exploringand Manipulating Networks,”(2009),其全文通过引用并入本文),并使用Cytoscape对最终网络进行可视化(Shannon P.,“Cytoscape:A Software Environment for IntegratedModels of Biomolecular Interaction Networks,”Genome Res 13:2498-2504(2003),其全文通过引用并入本文)。出于可视化目的,保留了感兴趣的基因和项目。模块彼此分离,并使用yFiles有机布局进行组织。
转录因子活性的推断
将成人和胎儿富集的基因列表分别输入到RcisTarget中(Aibar et al.,“SCENIC:Single-cell Regulatory Network Inference and Clustering,”Nat.Methods14:1083-1086(2017),其全文通过引用并入本文),以鉴定基因启动子周围窗口中基序的过度表现(500bp向上/100bp向下,10kb向上和10kb向下)。然后,通过输入基因列表中的显著差异表达过滤与显著富集基序(NES>3)相关的转录因子。在每个窗口和基因列表中,仅保留适当的TF基因相互作用(阻遏物下调基因和激活子上调基因)。然后合并扫描窗口以产生预测的胎儿/成人阻遏物/激活子的TF基因边缘列表。感兴趣TF被缩小到文献中主要报道为单独激活子或阻遏物的转录因子。
miRNA微阵列分析
如上所述,通过MACS分离A2B5+成体(n=3)和CD140a+胎儿(n=4)细胞悬液,并根据制造商说明(QIAGEN)使用miRNeasy试剂盒分离其miRNA。然后制备纯化的miRNA,并按照其标准方案的指示在Affymetrix GeneChip miRNA 3.0Arrays上进行分析。然后通过oligo(Carvalho and Irizarry,“A Framework for Oligonucleotide MicroarrayPreprocessing,”Bioinformatics 26:2363-2367(2010),其全文通过引用并入本文)软件包将原始CEL文件读取到R中,并通过robust multi-array averaging(RMA)对样本进行归一化。然后根据Affymetrix的注释仅对人miRNA的探针进行过滤,并在limma中进行差异表达(Ritchie et al.,“Limma Powers Differential Expression Analyses for RNA-Sequencing and Microarray Studies,”Nucleic Acids Res 43:e47(2015),其全文通过引用并入本文),其中在调整后p值<0.01时确定具有显著性。最后,使用miRNAtap在五个独立的miRNA预测数据库中调查差异表达的miRNA(Pajak M.,“miRNAtap:miRNAtap:microRNATargets-Aggregated Predictions,”R Package Version 1.22.0(2020),其全文通过引用并入本文),min_src设置为2,方法设置为“geom”。通过查询TrasmiR V2.0数据库进行miRNA的转录因子调控(Tong et al.,“TransmiR v2.0:An Updated Transcription Factor-microRNA Regulation Database,”Nucleic Acids Res 47:D253-D258(2019),其全文通过引用并入本文)。
探索性分析和可视化
批量RNA-Seq或微阵列样本的PCA通过prcomp计算,默认设置DESeq2对象的方差稳定值。通过ggfortify软件包中的自动绘图绘制PCA。使用EnhancedVolcano生成火山图。使用ggplot2进一步编辑或重新生成图形,并使用patchwork对齐。
人iPSC衍生的GPC产生
使用我们先前描述的方案(Osipovitch et al.,“Human ESC-Derived ChimericMouse Models of Huntington's Disease Reveal Cell-Intrinsic Defects in GlialProgenitor Cell Differentiation,”Cell Stem Cell 24:107-122e107(2019);Wang etal.,“Human iPSC-Derived Oligodendrocyte Progenitor Cells Can Myelinate andRescue a Mouse Model of Congenital Hypomyelination,”Cell Stem Cell 12:252-264(2013);以及Windrem et al.,“Human iPSC Glial Mouse Chimeras Reveal GlialContributions to Schizophrenia,”Cell Stem Cell21:195-208.e196(2017),其全文通过引用并入本文),将人诱导多能干细胞(C27(Chambers et al.,“Highly EfficientNeural Conversion of Human ES and iPS Cells by Dual Inhibition of SMADSignaling,”Nat Biotechnol 27:275-280(2009),其全文通过引用并入本文))分化为GPC。简言之,细胞首先分化为神经上皮细胞,然后分化为pre-GPC,最后分化为GPC。GPC维持在补充有T3、NT3、IGF1和PDGF-AA的胶质细胞培养基中。
慢病毒过表达
对于E2F6、ZNF274、IKZF3或MAX的过表达,我们首先从成人hGPC数据集中鉴定出这些基因中每个基因最丰富的蛋白质编码转录本。将每个转录物的cDNA克隆到pTANK-TRE-EGFP-CG-rtTA3G-WPRE载体中四环素响应元件启动子的下游。水泡性口炎病毒的G糖蛋白假型病毒颗粒通过HEK293FT细胞的瞬时转染产生,并通过超速离心浓缩,并通过QPCR(QPCR慢病毒滴定试剂盒,ABM-Applied Biological Materials Inc)滴定。iPSC(C27)衍生的GPC培养物(体外160-180天)在胶质细胞培养基中以1.0MOI感染24小时。用HBSS洗涤细胞,并在补充有1μg/ml多西环素(Millipore Sigma St.Louis,MO)的胶质细胞培养基中维持实验的其余部分。在首次加入多西环素后3、7和10天,通过FACS在DAPI-/EGFP+表达上分离转导的hGPC。多西环素对照细胞在单独的DAPI-上进行分选。
定量PCR
使用RNeasy micro kits(Qiagen,Germany)提取过表达实验中的RNA。使用TaqMan逆转录试剂(Applied Biosystems,USA)合成第一链cDNA。qPCR反应一式三份,每次反应加与FastStart Universal SybrGreen Mastermix(Roche Diagnostics,德国)混合的1ngRNA,并在实时PCR仪(CFX Connect Real-Time System thermocycler;Bio-Rad)进行分析。将结果归一化为每个样本中18S的表达。
定量和统计学分析
对于qPCR实验,在线性模型中分析了每个基因的ΔCT的显著差异,该模型是通过过表达条件和时间点与添加细胞批次协变量的相互作用构建的。在使用lsmeans软件包的时间点内,通过最小二乘均值测试对Dox对照进行事后配对比较(Lenth,R.V.,“Least-Squares Means:The R Package lsmeans,”Journal of Statistical Software,Foundation for Open Access Statistics 69(i01)(2016),其全文通过引用并入本文)。使用错误发现率方法对多个比较的P值进行调整,其中P值<0.05被认为是显著的。
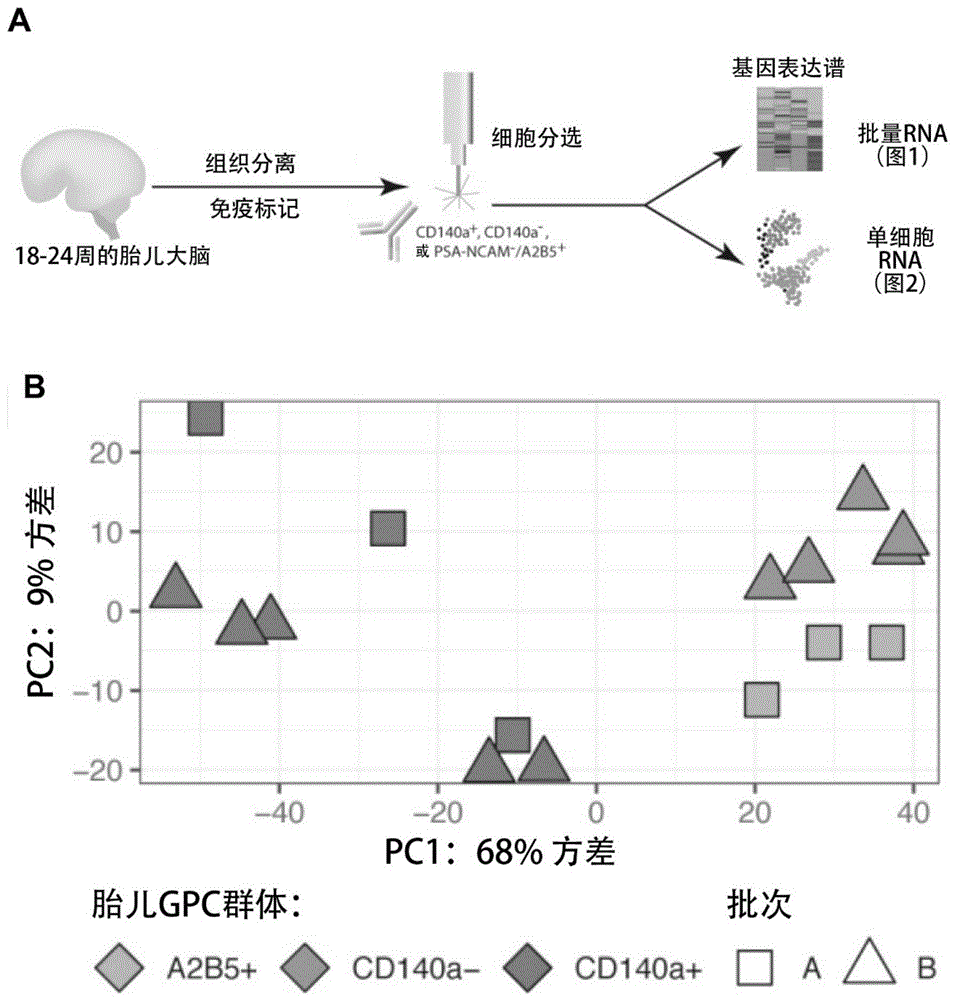
实施例1:CD140a选择富集人胎儿胶质祖细胞比A2B5更有效
为了识别GPC老化的转录伴随物,首先使用批量和单细胞RNA-Seq来表征源自妊娠中期胎儿人组织的hGPC,无论其是否通过靶向PDGFRα的CD140a表位(Sim et al.,“CD140aIdentifies a Population of Highly Myelinogenic,Migration-Competent andEfficiently Engrafting Human Oligodendrocyte Progenitor Cells,”NatureBiotechnology 29:934-941(2011a),其全文通过引用并入本文),或由单克隆抗体A2B5识别的胶质神经节苷脂(Dietrich et al.,“Characterization of A2B5+Glial PrecursorCells From Cryopreserved Human Fetal Brain Progenitor Cells,”Glia 40:65-77(2002);Sim et al.,“CD140a Identifies aPopulation of Highly Myelinogenic,Migration-Competent and Efficiently Engrafting Human OligodendrocyteProgenitor Cells,”Nature Biotechnology 29:934-941(2011a);以及Windrem et al.,“Fetal and Adult Human Oligodendrocyte Progenitor Cell Isolates Myelinate theCongenitally Dysmyelinated Brain,”Nat.Med.10:93-97(2004),其全文通过引用并入本文)。为此,进行了两个样本匹配实验,其中对于自同一胎儿大脑分离的CD140a+和A2B5+/PSA-NCAM-(A2B5+)GPC(n=3),或对于CD140a+GPC以及CD140a耗尽的剩余部分(n=5;图1,A图),将18-22周胎龄(g.a.)胎儿大脑的脑室/脑室下区(VZ/SVZ)分离并通过荧光激活细胞分选(FACS)进行分选。然后生成批量RNA-Seq文库,并对两个实验进行深度测序。主成分分析(PCA)显示CD140a+和A2B5+细胞的分离,以及两者与CD140a耗尽的样本的进一步分离(图1,B图)。两个配对队列中的差异表达(p<0.01,绝对log2倍数变化>1)鉴定出723个基因在CD140a+和A2B5+GPC之间差异表达(CD140a中435个,A2B5中288个,表S1)。相比之下,2,629个基因将CD140a+GPC与CD140a-细胞区分开来(图1,C图)。当比较CD140+与A2B5+或CD140-细胞时,差异基因表达方向性高度一致,除了4个基因外,所有基因都是一致的。
利用Ingenuity通路分析(IPA)对这两个基因集进行通路富集分析,鉴定出在CD140+GPC中相对活跃的类似通路;这些通路包括细胞运动、少突胶质细胞分化、脂质合成以及下游PDGF、SOX10和TCF7L2信号传导(图1,D图)。正如预期的那样,当将CD140a+GPC与CD140a-细胞而不是与A2B5+GPC进行比较时,通常会观察到更强的激活Z评分。有趣的是,CD140a+细胞还差异表达了许多与免疫系统相关的通路,这可能是由于小胶质细胞表面上PDGF R表位的重新表达导致的少量小胶质细胞污染。A2B5+样本还显示出上调的ST8SIA1(负责A2B5合成的酶)((Sim et al.,“Fate Determination of Adult Human GlialProgenitor Cells,”Neuron Glia Biol 5:45-55(2009),其全文通过引用并入本文)以及促神经通路。
CD140a+分离物中差异上调的基因包括PDGFRA本身,以及许多早期少突胶质细胞基因,包括OLIGl、OLIG2、NKX2-2、SOX10和GPR17(图1,E-1图,F图)。此外,CD140a+部分还表现出后期髓鞘形成相关基因(包括MBP、GAL3ST1和UGT8)的表达增加。除了少突胶质细胞谱系的富集之外,许多通常与小胶质细胞相关的基因也在CD140a分离物中富集,包括CD68、C2、C3、C4和TREM2。相比之下,A2B5+分离物表现出星形胶质细胞(AQ4、CLU)和早期神经元(NEUROD1、NEUROD2、GABRG1、GABRA4、EOMES、HTR2A)基因的富集,表明未成熟星形胶质细胞和神经元以及GPC和少突胶质细胞谱系细胞表达A2B5。总体而言,当各自与耗尽部分进行比较时,CD140a+GPC中的少突胶质细胞富集显著高于A2B5定义的GPC,这表明CD140a分离物在hGPC中更多富集,因此CD140a作为更合适的表型用于与成体hGPC进行头对头比较(head-to-head comparison)。
实施例2:单细胞RNA测序揭示人胎儿GPC分离物内的细胞异质性
为了进一步以单细胞分辨率描述胎儿hGPC分离物的组成,通过FACS从20周g.a.胎儿VZ/SVZ中分离了CD140a+和A2B5+hGPC,然后通过单细胞RNA-Seq测定各自的转录组(图1,A图,10X Genomics,V2)。试图每种捕获>1,000个细胞;过滤低质量细胞(独特基因<500,线粒体基因百分比>15%)后,1,053个PSA-NCAM-/A2B5+和957个CD140a+高质量细胞(每个细胞中位数有6,845个独特分子标识符和2,336个独特基因)被留下。通过统一流形逼近和投影(UMAP)进行的降维,然后使用Seurat(Butler et al.(2018).Nat Biotechnol 36,411-420)进行的所有细胞的基于共享最近邻模块化聚类分析(Butler et al.,“IntegratingSingle-cell Transcriptomic Data Across Different Conditions,Technologies,andSpecies,”Nat Biotechnol 36:411-420(2018),其全文通过引用并入本文),揭示了具有8种主要细胞类型的11个簇,如由标记基因的差异富集所定义的。这些主要细胞类型包括:GPC、pre-GPC、神经祖细胞(NPC)、未成熟神经元、神经元、小胶质细胞以及由内皮细胞和周细胞组成的细胞簇。我们发现,CD140a+FACS分离物比胎儿A2B5+/PSA-NCAM-细胞更多富集GPC和pre-GPC群体(图2,A-2图,D图)。此外,虽然CD140a分选的细胞主要限于GPC和pre-GPC,仅具有分散的小胶质细胞污染,但A2B5+/PSA-NCAM-分离物还包括星形胶质细胞和神经元谱系细胞,尽管后者先期耗尽了神经元PSA-NCAM。这些数据支持CD140a的选择性和表型限制性比基于A2B5的GPC分离更强。
在此基础上,接下来探讨了CD140a+胎儿分离物中主要细胞群,GPC和pre-GPC的基因表达谱。这两个库之间的差异表达产生了269个(143个上调,126个下调;p<0.01,log2倍数变化>0.5;图2,E图)。在pre-GPC到GPC的转变过程中,早期少突胶质细胞谱系基因迅速上调(OLIG2、SOX10、NKX2-2、PLLP、APOD),而在pre-GPC中表达的基因有效地消失了(VIM、HOPX、TAGLN2、TNC)。有趣的是,当细胞过渡到GPC阶段时,参与人白细胞抗原系统的基因,包括HLA-A、HLA-B、HLA-C和B2M,均被下调(图2,F图)。IPA分析表明,pre-GPC相对富集了与迁移、增殖和预示星形胶质细胞身份(BMP4、AGT和VEGF信号传导)相关的项,而GPC则富集了与获得少突胶质细胞身份(PDGF-AA、FGFR2、CCND1)相关的项,此外还有MYC和MYCN通路的激活(图2,G图)。通过使用单细胞共表达数据以及使用SCENIC软件包(Aibar et al.,“SCENIC:Single-cell Regulatory Network Inference and Clustering,”Nat Methods 14:1083-1086(2017),其全文通过引用并入本文)的启动子基序富集,本研究随后鉴定了262个预计在GPC中相对于pre-GPC相对激活的转录因子(Wilcoxon秩和检验,p<0.01)。这些包括SATB1,以及早期GPC规格因子OLIG2、SOX10和NKX2-2(图2,H图)。
实施例3:人成体和胎儿GPC在转录上是不同的
接下来要问成体hGPC在其转录方面与胎儿hGPC有何不同。为此,从手术切除的成人颞叶新皮质(19-21岁,n=3)中分离出A2B5+hGPC,并评估它们的批量RNA表达,并与另外四个胎儿CD140a+样本配对。之前已经注意到,考虑到成体hGPC中成熟相关的PDGFRA 表达下调,A2B5选择足以从成人大脑中分离GPC,并且在这方面比CD140a更灵敏(Sim et al.,“Complementary Patterns of Gene Expression by Human OligodendrocyteProgenitors and their Environment Predict Determinants of ProgenitorMaintenance and Differentiation,”Ann Neurol 59:763-779(2006)以及Windrem etal.,“Fetal and Adult Human Oligodendrocyte Progenitor Cell Isolates Myelinatethe Congenitally Dysmyelinated Brain,”Nat.Med.10:93-97(2004),其全文通过引用并入本文)。
为证实了之前的观察,发现A2B5+成体GPC中PDGFRA的中位数TPM表达为0.55,而胎儿A2B5+细胞的中位数TPM为47.56。通过将该测序和分析与胎儿CD140a选择的细胞配对,实现了测序批次效应的回归,同时提高了功效(图3,A图)。对于成体hGPC样本来说,不需要耗尽PSA-NCAM+细胞,因为PSA-NCAM在成人皮质和白质中停止表达(Seki et al.,“Distribution and Possible Roles of the Highly Polysialylated Neural CellAdhesion Molecule(NCAM-H)in the Developing and Adult Central Nervous System,”Neurosci.Res.1:265-290(1993),其全文通过引用并入本文)。结果,人成体和胎儿GPC的PCA表明成体GPC紧密聚集,与两个分选的胎儿hGPC池明显分离(图3,B图)。与A2B5+或CD140a+胎儿GPC群体相比,成体GPC的差异表达分别产生3,142和5,282个显著基因(p<0.01;绝对log2倍数变化>1)(图3,C图)。为了提高定义差异表达的准确性,对交叉的2,720个基因进行了下游分析(图3,D图,与胎儿hGPC相比,成体GPC中有1,060个上调和1,660个下调)。值得注意的是,在这两个差异表达的基因集中,100%的基因在方向上是一致的。
为了更好地理解成体GPC和胎儿GPC之间的差异,接下来构建了非冗余显著IPA项及其贡献差异表达基因的基因本体网络(图3,D-3图,E图)。该网络的自旋玻璃社区检测(Reichardt et al.,“Statistical Mechanics of Community Detection,”Phys.Rev.EStat.Nonlin.Soft Matter Phys.74:016110(2006),其全文通过引用并入本文)发现了高度连接的功能项(图3E)和基因(图3F,表S3)的三个模块(模块M1-M3)。M1包括与胶质细胞发育、增殖和运动相关的项和基因。值得注意的是,许多与GPC个体发育相关的基因在成体GPC中下调。这些包括CSPG4/NG2、PCDH15、CHRDL1、LMNB1、PTPRZ1和ST8SIA1(Huang et al.,“Origins and Proliferative States of Human Oligodendrocyte Precursor Cells,”Cell182:594-608e511(2020);McClain et al.,“Pleiotrophin Suppression ofReceptor Protein Tyrosine Phosphatase-β/ζMaintains the Self-renewalCompetence of Fetal Human Oligodendrocyte Progenitor Cells,”J Neurosci 32:15066-15075(2012);Nishiyama et al.,“Co-Localization of NG2 Proteoglycan andPDGFα-Receptor on O2A Progenitor Cells in the Developing Rat Brain,”Journalof Neuroscience Research 43:299-314(1996);Sim et al.,“Fate Determination ofAdult Human Glial Progenitor Cells,”Neuron Glia Biol 5:45-55(2009);以及Yattahet al.,“Dynamic Lamin B1-Gene Association During Oligodendrocyte ProgenitorDifferentiation,”Neurochem Res 45:606-619(2020),其全文通过引用并入本文)。相比之下,许多在少突胶质细胞分化和髓鞘形成之前出现并持续出现的基因在成体GPC中上调,包括MAG、MOG、MYRF、PLP1、CD9、CLDN11、CNP、ERBB4、GJB1、PMP22和SEMA4D。
模块2包含许多与细胞老化以及增殖和衰老的调节相关的项。由于增殖因子(包括MKI67、TOP2A、CENPF、CENPH、CHEK1、EZH2)和多种细胞周期蛋白(包括CDK1和CDK4)的强烈富集,胎儿GPC中细胞周期进程和有丝分裂预计会被激活。此外,还推断诱导增殖的通路被激活;这些包括MYC、CCND1和YAP1信号传导,其中YAP1和MYC转录本均类似地上调(Bretoneset al.,“Myc and Cell Cycle Control,”Biochim.Biophys Acta 1849:506-516(2015);Bunt et al.,“Regulation of Cell Cycle Genes and Induction of Senescence byOverexpression of OTX2 in Medulloblastoma Cell Lines,”Mol.Cancer Res.8:1344-1357(2010);以及Xie et al.,“YAP/TEAD-Mediated Transcription Controls CellularSenescence,”Cancer Res 73:3615-3624(2013),其全文通过引用并入本文)。在这方面,最近已证明衰老啮齿动物GPC中MYC的短暂过表达可以恢复其增殖和分化的能力(Neumann etal.,“Myc Determines the Functional Age State of Oligodendrocyte ProgenitorCells,”Nature Aging 1:826-837(2021),其全文通过引用并入本文)。相反,成体GPC表现出衰老相关转录本(包括E2F6、MAP3K7、DMTF1/DMP1、OGT、AHR、RUNX1和RUNX2)的上调(Ferrand et al.,“Screening of a Kinase Library Reveals Novel Pro-senescenceKinases and Their Common NF-κB-dependent Transcriptional Program,”Aging(Albany NY)7:986-1003(2015);Inoue et al.,“Disruption of the ARFTranscriptional Activator DMP1Facilitates Cell Immortalization,RasTransformation,and Tumorigenesis,”Genes Dev14:1797-1809(2000);Lee and Zhang,“O-Linked N-Acetylglucosamine Transferase(OGT)Interacts With the HistoneChaperone HIRA Complex and Regulates Nucleosome Assembly and CellularSenescence,”Proceedings of the National Academy of Sciences 113:E3213-E3220(2016);Wotton et al.,“RUNX1 Transformation of Primary Embryonic Fibroblastsis Revealed in the Absence of p53,”Oncogene 23:5476-5486(2004);以及Kilbey etal.,“Runx2Disruption Promotes Immortalization and Confers Resistance toOncogene-induced Senescence in Primary Murine Fibroblasts,”Cancer Res 67:11263-11271(2007),其全文通过引用并入本文)。与此同时,成体hGPC表现出包括LMNB1、PATZ1、BCL11A、HDAC2、FN1、EZH2和YAP1及其辅因子TEAD1的胎儿转录本的下调(Cho etal.,“POZ/BTB and AT-hook-containing Zinc Finger Protein 1(PATZ1)InhibitsEndothelial Cell Senescence Through a p53 Dependent Pathway,”Cell DeathDiffer 19:703-712(2012);Fan et al.,“EZH2-dependent Suppression of a CellularSenescence Phenotype in Melanoma Cells by Inhibition of p21/CDKN1AExpression,”Mol.Cancer Res.9:418-429(2011);Freund et al.,“Lamin B1 Loss is aSenescence-associated Biomarker,”Mol.Biol.Cell 23:2066-2075(2012);Luc et al.,“Bcl11a Deficiency Leads to Hematopoietic Stem Cell Defects with an Aging-like Phenotype,”Cell Rep.16:3181-3194(2016);Lukjanenko et al.,“Loss ofFibronectin From the Aged Stem Cell Niche Affects the Regenerative Capacityof Skeletal Muscle in Mice,”Nat Med22:897-905(2016);Sundar et al.,“GeneticAblation of Histone Deacetylase 2Leads to Lung Cellular Senescence andLymphoid Follicle Formation in COPD/Emphysema,”FASEB Journal:OfficialPublication of the Federation of American Societies for Experimental Biology32:4955-4971(2018);以及Xie et al.,“YAP/TEAD-Mediated Transcription ControlsCellular Senescence,”Cancer Res 73:3615-3624(2013),其全文通过引用并入本文)。因此,预测在成体hGPC中活跃的功能项包括衰老、在Hutchinson-Gilford早衰症中观察到的快速衰老以及CDKN1A/p21和CDKN2A/p16下游的细胞周期蛋白依赖性激酶抑制通路。此外,AHR及其信号通路涉及通过抑制MYC驱动衰老(Yang et al.,“The Aryl HydrocarbonReceptor Constitutively Represses C-Myc Transcription in Human Mammary TumorCells,”Oncogene24:7869-7881(2005),其全文通过引用并入本文),在成体GPC中同样上调。
模块3主要由也与衰老相关的发育和疾病相关信号传导通路组成。这包括胎儿hGPC中ASCL1和BDNF信号传导的预测激活以及成体GPC中MAPT/Tau、APP和REST信号传导的预测激活(Ahlin et al.,“High Expression of Cyclin D1 is Associated to HighProliferation Rate and Increased Risk of Mortality in Women With ER-positiveBut Not in ER-negative Breast Cancers,”Breast Cancer Res.Treat 164:667-678(2017);Erickson et al.,“Brain-derived Neurotrophic Factor is Associated WithAge-related Decline in Hippocampal Volume,”J.Neurosci.30:5368-5375(2010);以及Harris et al.,“Coordinated Changes in Cellular Behavior Ensure the LifelongMaintenance of the Hippocampal Stem Cell Population,”Cell Stem Cell(2021),其全文通过引用并入本文)。总体而言,成体GPC的转录和功能分析揭示了与增殖能力相关的转录本的减少,以及向衰老和更成熟表型的转变。
实施例4:转录因子活性的推断暗示成体GPC转录阻遏物
鉴于成体和胎儿GPC之间显著的转录差异,本研究接下来要问是否可以推断哪些转录因子指导它们的身份。为了实现这一目标,首先扫描了成体或胎儿富集GPC基因集的两个启动子窗口(500bp向上/100bp向下,10kb向上/10kb向下),以推断显著富集的TF基序(Aibar et al.,“SCENIC:Single-cell Regulatory Network Inference andClustering,”Nat.Methods 14:1083-1086(2017),其全文通过引用并入本文)。这鉴定了48个TF,它们在扫描的相交数据集中也有差异表达。其中,首先研究了那些与DNA相互作用的主要方式完全是抑制性或刺激性的转录因子,同时还考虑了其已知辅助因子的富集。该分析产生了12个潜在的上游调节子可供探索(图4,A-4图,C图):4个成体阻遏物,E2F6、ZNF274、MAX和IKZF3;1个成体激活子,STAT3;3个胎儿阻遏物:BCL11A HDAC2和EZH2;和4个胎儿激活子:MYC、HMGA2、NFIB和TEAD2。有趣的是,在这些预测的TF中,3个组在其目标启动子内具有高度一致性的基序相似性:1)E2F6、ZNF274、MAX和MYC;2)STAT3和BCL11A;3)EZH2和HDAC2,表明它们可能在共享位点合作或竞争DNA结合(图4,A图)。
接下来,构建了基于策划的转录相互作用四种潜在的信号传导通路,以预测该TF集靶向的那些基因(图4,D-4图,G图)。在胎儿GPC中富集的激活子(图4,D图)中,MYC(一种增殖因子)(Dang,C.V.,“c-Myc Target Genes Involved in Cell Growth,Apoptosis,andMetabolism,”Molecular and Cellular Biology 19:1(1999),其全文通过引用并入本文)、NFIB(一种胶质细胞生成的关键决定子)(Deneen et al.,“The TranscriptionFactor NFIA Controls the Onset of Gliogenesis in the Developing Spinal Cord,”Neuron 52:953-968(2006),其全文通过引用并入本文)、TEAD2(一种YAP/TAZ效应子)和HMGA2(另一种增殖因子)均被预测会激活祖细胞阶段基因群,包括有丝分裂相关转录本和被证明可抑制衰老发生的转录本(Dang,C.V.,“c-Myc Target Genes Involved in CellGrowth,Apoptosis,and Metabolism,”Molecular and Cellular Biology 19:1(1999);Deneen et al.,“The Transcription Factor NFIA Controls the Onset ofGliogenesis in the Developing Spinal Cord,”Neuron52:953-968(2006);Diepenbrucket al.,“Tead2 Expression Levels Control the Subcellular Distribution of Yapand Taz,Zyxin Expression and Epithelial-mesenchymal Transition,”Journal ofCell Science 127:1523-1536(2014);以及Yu et al.,“HMGA2 Regulates the in VitroAging and Proliferation of Human Umbilical Cord Blood-Derived Stromal CellsThrough the mTOR/p70S6K Signaling Pathway,”Stem Cell Res 10:156-165(2013),其全文通过引用并入本文)。还预测这四种胎儿激活子之间存在直接正向调节,其中NFIB由HMGA2和TEAD2驱动,MYC由TEAD2和NFIB驱动,HMGA2由MYC和TEAD2驱动,TEAD2由MYC相互驱动(图4,D图)。与这些胎儿激活子相反,胎儿阶段阻遏物,包括C2H2型锌指BCL11A、多梳抑制复合物亚单位EZH2和组蛋白脱乙酰酶HDAC2,均被预测在该阶段抑制更成熟的少突胶质细胞基因表达(图4,E图)(Laherty et al.,“Histone Deacetylases Associated With themSin3 Corepressor Mediate Mad Transcriptional Repression,”Cell 89:349-356(1997);Laible et al.,“Mammalian Homologues of the Polycomb-group GeneEnhancer of Zeste Mediate Gene Silencing in Drosophila Heterochromatin and atS.cerevisiae Telomeres,”EMBO J 16:3219-3232(1997);以及Nakamura et al.,“Evi9Encodes a Novel Zinc Finger Protein that Physically Interacts with BCL6,aknown Human B-Cell Proto-Oncogene Product,”Mol Cell Biol 20:3178-3186(2000),其全文通过引用并入本文)。此外,所有这三种转录因子都被预测会抑制与衰老有关的靶标。因此,这些因子似乎直接协调下游转录事件,从而维持循环祖细胞状态。
接下来,评估了这些预测的成体GPC信号网络,以寻找负责其年龄相关基因表达变化的潜在机制。预计STAT3通过上调一大群早期分化和髓鞘形成相关少突胶质细胞基因将GPC身份转向神经胶质成熟(图4,F图)。此外,STAT3还被推断激活一组衰老相关基因,包括BIN1、RUNX1、RUNX2、DMTF1、CD47、MAP3K7、CTNNA1和OGT。同时,预计成体GPC中的抑制是通过Ikaros家族锌指IKZF3/Aiolos、KRAB(kruppel相关盒)锌指ZNF274、MYC相关因子MAX和细胞周期调节子E2F6来实现的(图4,G图)(Blackwood and Eisenman,“Max:A Helix-loop-helix Zipper Protein That Forms aSequence-specific DNA-binding Complex WithMyc,”Science 251:1211-1217(1991);Frietze et al.,“ZNF274 Recruits the HistoneMethyltransferase SETDB1 to the 3'Ends of ZNF Genes,”PLoS One 5:e15082(2010);Ma et al.,“Ikaros and Aiolos Inhibit Pre-B-cell Proliferation by DirectlySuppressing c-Myc Expression,”Mol Cell Biol 30:4149-4158(2010b);以及Ogawa etal.,“A Complex with Chromatin Modifiers that Occupies E2F-and Myc-ResponsiveGenes in G0 Cells,”Science 296:1132-1136(2002),其全文通过引用并入本文)。该转录因子集的靶向预测了那些有助于胎儿GPC特征的基因集的抑制,这确实在早期祖基因PDGFRA和CSPG4以及细胞周期性基因CDK1、CDK4和MKI67的下调中观察到。还预测了YAP1、LMNB1和TEAD1(这些基因的表达可以减缓或阻止衰老的发生)的抑制。有趣的是,除了胎儿富集的阻遏物BCL11A、EZH2和HDAC2之外,这组四种成体阻遏物还预测胎儿富集的激活子NFIB、MYC、TEAD2和HMGA2中的每一种的表达下调。
实施例5:成体富集阻遏物的表达诱导GPC中年龄相关性转录变化
接下来要问图4,G图中所鉴定的四种成体富集的转录阻遏物,E2F6、IKZF3、MAX和ZNF274,是否单独足以在其他年轻GPC的基因表达中诱导年龄相关性变化的方面。为了实现这一目标,为每个转录因子设计了多西环素(Dox)诱导型过表达慢病毒(图5,A图)。简而言之,首先确定了每种阻遏物在成体GPC中最丰富的蛋白质编码亚型,以便最好地模拟内源性年龄相关上调;这些候选者是E2F6-202、IKZF3-217、MAX-201和ZNF274-201。这些cDNA被克隆到四环素响应元件启动子的下游和T2A自切割EGFP报告基因的上游(图5,A图)。由人诱导多能干细胞(iPSC)衍生得到的hGPC培养物,如先前所述由C27细胞系制备(Wang et al.,“Human iPSC-Derived Oligodendrocyte Progenitor Cells Can Myelinate and Rescuea Mouse Model of Congenital Hypomyelination,”Cell Stem Cell 12:252-264(2013),其全文通过引用并入本文),然后感染24小时,然后用Dox处理以诱导转基因过表达。选择由C27 iPSC衍生得到的GPC是因为它们的转录组与胎儿的转录组相似,并且它们在移植后同样能够植入髓鞘发育不良小鼠进行并形成髓鞘(Wang et al.,“Human iPSC-DerivedOligodendrocyte Progenitor Cells Can Myelinate and Rescue a Mouse Model ofCongenital Hypomyelination,”Cell Stem Cell 12:252-264(2013)以及Windrem etal.,“Human iPSC Glial Mouse Chimeras Reveal Glial Contributions toSchizophrenia,”Cell Stem Cell 21:195-208.e196(2017),其全文通过引用并入本文)。添加Dox后第3、7和10天通过FACS选择过表达细胞用于EGFP表达(图5,B图,n=3-5)。给予Dox的未感染培养物用作对照。
提取RNA并通过qPCR分析感兴趣的衰老相关基因。在补充Dox后的每个时间点观察到每种成体富集阻遏物的显著诱导(图5,C图)。MKI67和CDK1(其上调与活跃的细胞分裂相关的基因)在每个过表达范例中的两个或更多个时间点被显著抑制(图5,D图)。这与它们在成体GPC中的表达减少一致(图3,F图),并表明它们受到E2F6、MAX和ZNF274(MKI67)或全部四种(CDK1)的直接抑制。GPC阶段标记物PDGFRA(PDGF-AA的同源受体)在IKZF3转导的GPC中的两个时间点以及在第3天在E2F6转导的GPC中也受到显著抑制,这与其在正常成体GPC中的抑制一致。有趣的是,衰老相关的细胞周期蛋白依赖性激酶抑制剂CDKN1A/p21在所有时间点响应于每个测试的阻遏物都上调,而CDKN2A/p16同样在ZNF274转导的hGPC中在所有时间点以及在第7天在E2F6过表达的GPC中都上调(图5,D图)。此外,相对于胎儿hGPC,MBP和IL1A在成体hGPC中均显著上调,尽管时间点相关变异性阻止了它们的增量达到统计学显著性,但它们都表现出响应阻遏物转导而表达上调的急剧趋势。总之,这些数据支持我们的预测:成体富集的GPC阻遏物E2F6、IKZF3、MAX和ZNF274的强制过早表达足以在年轻的iPSC衍生的GPC中诱导衰老GPC转录组的多种特征。
实施例6:胎儿hGPC的miRNA表达模式预测它们对衰老的抑制
为了鉴定基因表达的潜在转录后调节子,我们利用Affymetrix GeneChip miRNA3.0阵列评估了成体和胎儿GPC(n=4)之间miRNA表达的差异。PCA显示了由miRNA表达谱定义的两个GPC群体的分离(图6,A图)。两个年龄之间的差异表达(调整后p值<0.01)产生了56个基因(23个在成体GPC中富集,33个在胎儿GPC中富集,图6,B-C图)。这些差异表达的miRNA中,除了胎儿祖细胞阶段miRNA miR-9-3p、miR-9-5p(Lau,P.,Verrier,J.D.,Nielsen,J.A.,Johnson,K.R.,Notterpek,L.,and Hudson,L.D.(2008).Identification ofdynamically regulated microRNA and mRNA networks in developingoligodendrocytes.J Neurosci 28,11720-11730)以及miR-17-5p(Budde,H.,Schmitt,S.,Fitzner,D.,Opitz,L.,Salinas-Riester,G.,and Simons,M.(2010).Control ofoligodendroglial cell number by the miR-17-92cluster.Development 137,2127)外,值得注意的是成体少突胶质细胞调节子miR-219a-3p和miR-338-5p(Dugas,J.C.,Cuellar,T.L.,Scholze,A.,Ason,B.,Ibrahim,A.,Emery,B.,Zamanian,J.L.,Foo,L.C.,McManus,M.T.,and Barres,B.A.(2010).Dicer1 and miR-219Are required for normaloligodendrocyte differentiation and myelination.Neuron 65,597-611)。
本研究接下来利用这组miRNA来预测其表达可能通过miRNA上调而受到抑制的基因,分别分析成体和胎儿GPC池。为了实现这一目标,使用miRNAtap查询了五个miRNA基因靶标数据库:DIANA (Maragkakis,M.,Vergoulis,T.,Alexiou,P.,Reczko,M.,Plomaritou,K.,Gousis,M.,Kourtis,K.,Koziris,N.,Dalamagas,T.,and Hatzigeorgiou,A.G.(2011).DIANA-microT Web server upgrade supports Fly and Worm miRNA targetprediction and bibliographic miRNA to disease association.Nucleic Acids Res39,W145-148)、Miranda(Enright,A.J.,John,B.,Gaul,U.,Tuschl,T.,Sander,C.,andMarks,D.S.(2003).MicroRNA targets in Drosophila.Genome biology 5,R1)、PicTar(Lall,S.,Grun,D.,Krek,A.,Chen,K.,Wang,Y.L.,Dewey,C.N.,Sood,P.,Colombo,T.,Bray,N.,Macmenamin,P.,et al.(2006).Agenome-wide map of conserved microRNAtargets in C.elegans.Current biology:CB 16,460-471)、TargetScan(Friedman,R.C.,Farh,K.K.,Burge,C.B.,and Bartel,D.P.(2009).Most mammalian mRNAs are conservedtargets of microRNAs.Genome Res 19,92-105)和miRDB(Wong,N.,and Wang,X.(2015).miRDB:an online resource for microRNA target prediction and functionalannotations.Nucleic Acids Res 43,D146-152)。
为了最大限度地提高精度,只有出现在至少两个数据库中的基因才被视为靶标。在胎儿富集的miRNA中,这种方法预测每个miRNA平均有36.3(SD=24.5)个被抑制的基因。相比之下,在成体hGPC富集的miRNA中,每个miRNA平均有46.4(SD=37.8)个基因被预测为靶标(图6,C图)。总而言之,这确定了通过胎儿miRNA可能抑制48.8%的成体GPC富集基因,以及通过成体miRNA抑制39.9%的胎儿GPC富集基因。
为了评估这些miRNA依赖性转录后调节机制的功能重要性,本研究根据功能相关的差异表达基因的miRNA靶向来策划胎儿和成体网络(图6,D-E图)。提出的上游成体转录调节子STAT3、E2F6和MAX预计会通过胎儿GPC中的7个miRNA受到抑制(图24,D图);其中包括已经验证的其他细胞类型中miR-126b-5p、miR-106a-5p、miR-17-5p、miR-130a-3p和miR-130b-3p对STAT3的抑制(Du,W.,Pan,Z.,Chen,X.,Wang,L.,Zhang,Y.,Li,S.,Liang,H.,Xu,C.,Zhang,Y.,Wu,Y.,et al.(2014a).By Targeting Stat3 microRNA-17-5pPromotesCardiomyocyte Apoptosis in Response to Ischemia Followed byReperfusion.Cellular Physiology and Biochemistry 34,955-965)。与此同时,许多早期和成熟的少突胶质细胞基因同时被靶向抑制,所有这些都与祖细胞状态的维持一致;这些基因包括MBP、UGT8、CD9、PLP1、MYRF和PMP22(Goldman,S.A.,and Kuypers,N.J.(2015).How to make an oligodendrocyte.Development 142,3983-3995)。重要的是,一组与诱导衰老或抑制增殖或两者相关的基因也被预测在胎儿GPC中受到积极抑制。这些基因包括RUNX1、RUNX2、BIN1、DMTF1/DMP1、CTNNA1、SERPINE1、CDKN1C、PAK1、IFI16、EFEMP1、MAP3K7、AHR、OGT、CBX7和CYLD(Eckers,A.,Jakob,S.,Heiss,C.,Haarmann-Stemmann,T.,Goy,C.,Brinkmann,V.,Cortese-Krott,M.M.,Sansone,R.,Esser,C.,Ale-Agha,N.,et al.(2016).The aryl hydrocarbon receptor promotes aging phenotypes across species.SciRep 6,19618)。这里鉴定的几种miRNA,包括miR-17-5p、miR-93-3p、miR-1260b、miR-106a-5p、miR-767-5p、miR-130a-3p、miR-9-3p、miR-9-5p和miR-130b-3p,也注意到了对衰老或增殖激活的抑制(Borgdorff,V.,Lleonart,M.E.,Bishop,C.L.,Fessart,D.,Bergin,A.H.,Overhoff,M.G.,and Beach,D.H.(2010).Multiple microRNAs rescue from Ras-inducedsenescence by inhibiting p21(Waf1/Cip1).Oncogene 29,2262-2271)。总之,这些数据提供了一种补充机制,胎儿hGPC可以通过该机制维持其特征性祖细胞转录状态和特征。
实施例7:成体miRNA信号传导可以抑制增殖祖细胞状态并预示衰老
本研究接下来检查了成体hGPC内潜在的miRNA调控网络(图6,E图)。这涉及5个miRNA,控制着5个已识别的活性胎儿转录调节子(包括HDAC2、NFIB、BCLL1A、TEAD2和HMGA2),这些调节子通过miR-4651的沉默已在先前被证明可以抑制增殖(Han,X.,Yang,R.,Yang,H.,Cao,Y.,Han,N.,Zhang,C.,Shi,R.,Zhang,Z,Fan,Z.(2020).miR-4651inhibitsproliferation of gingival mesenchymal stem cells by inhibiting HMGA2undernifedipine treatment.Int J Oral Sci 12,10)。预计这组miRNA会与成体转录阻遏物同时发挥作用,抑制参与维持GPC祖细胞状态的基因的表达,包括PDGFRA、PTPRZ1、ZBTB18、SOX6、EGFR和NRXN1。此外,预计成体miRNA环境会抑制许多已知可诱导增殖状态或延迟衰老的基因,包括LMNB1(Freund,A.,Laberge,R.M.,Demaria,M.,and Campisi,J.(2012).LaminB1 loss is a senescence-associated biomarker.Mol Biol Cell 23,2066-2075)、PATZ1(Cho,J.H.,Kim,M.J.,Kim,K.J.,and Kim,J.R.(2012).POZ/BTB and AT-hook-containing zinc finger protein 1(PATZ1)inhibits endothelial cell senescencethrough ap53 dependent pathway.Cell Death Differ 19,703-712)、GADD45A(Hollander,M.C.,Sheikh,M.S.,Bulavin,D.V.,Lundgren,K.,Augeri-Henmueller,L.,Shehee,R.,Molinaro,T.A.,Kim,K.E.,Tolosa,E.,Ashwell,J.D.,et al.(1999).Genomicinstability in Gadd45a-deficient mice.Nat Genet 23,176-184)、YAP1和TEAD1(Xie,Q.,Chen,J.,Feng,H.,Peng,S.,Adams,U.,Bai,Y.,Huang,L.,Li,J.,Huang,J.,Meng,S.,etal.(2013).YAP/TEAD-mediated transcription controls cellular senescence.CancerRes 73,3615-3624.)、CDK1(Diril,M.K.,Ratnacaram,C.K.,Padmakumar,V.C.,Du,T.,Wasser,M.,Coppola,V.,Tessarollo,L.,and Kaldis,P.(2012).Cyclin-dependentkinase 1(Cdk1)is essential for cell division and suppression of DNA re-replication but not for liver regeneration.Proc Natl Acad Sci U S A 109,3826-3831)、TPX2(Rohrberg,J.,Van de Mark,D.,Amouzgar,M.,Lee,J.V.,Taileb,M.,Corella,A.,Kilinc,S.,Williams,J.,Jokisch,M.L.,Camarda,R.,et al.(2020).MYCDysregulates Mitosis,Revealing Cancer Vulnerabilities.Cell Rep 30,3368-3382)、S1PR1(Liu,Y.,Zhi,Y.,Song,H.,Zong,M.,Yi,J.,Mao,G.,Chen,L.,and Huang,G.(2019).S1PR1 promotes proliferation and inhibits apoptosis of esophageal squamouscell carcinoma through activating STAT3 pathway.Journal of Experimental&Clinical Cancer Research 38,369)、RRM2(Aird,K.M.,Zhang,G.,Li,H.,Tu,Z.,Bitler,B.G.,Garipov,A.,Wu,H.,Wei,Z.,Wagner,S.N.,Herlyn,M.,et al.(2013).Suppressionof nucleotide metabolism underlies the establishment and maintenance ofoncogene-induced senescence.Cell Rep 3,1252-1265)、CCND2(Bunt,J.,de Haas,T.G.,Hasselt,N.E.,Zwijnenburg,D.A.,Koster,J.,Versteeg,R.,and Kool,M.(2010).Regulation of cell cycle genes and induction of senescence by overexpressionof OTX2 in medulloblastoma cell lines.Mol Cancer Res 8,1344-1357)、SGO1(Murakami-Tonami,Y.,Ikeda,H.,Yamagishi,R.,Inayoshi,M.,Inagaki,S.,Kishida,S.,Komata,Y.,Jan,K.,Takeuchi,I.,Kondo,Y.,et al.(2016).SGO1 is involved in theDNA damage response in MYCN-amplified neuroblastoma cells.Scientific Reports6,31615)、MCM4和MCM6(Mason,D.X.,Jackson,T.J.,and Lin,A.W.(2004).Molecularsignature of oncogenic ras-induced senescence.Oncogene 23,9238-9246.)、ZNF423(Hernandez-Segura,A.,de Jong,T.V.,Melov,S.,Guryev,V.,Campisi,J.,and Demaria,M.(2017).Unmasking Transcriptional Heterogeneity in Senescent Cells.Currentbiology:CB 27,2652-2660)、PHB(Piper,P.W.,Jones,G.W.,Bringloe,D.,Harris,N.,MacLean,M.,and Mollapour,M.(2002).The shortened replicative life span ofprohibitin mutants of yeast appears to be due to defective mitochondrialsegregation in old mother cells.Aging cell 1,149-157)、WLS(Poudel,S.B.,So,H.S.,Sim,H.J.,Cho,J.S.,Cho,E.S.,Jeon,Y.M.,Kook,S.H.,and Lee,J.C.(2020).Osteoblastic Wntless deletion differentially regulates the fate andfunctions of bone marrow-derived stem cells in relation to age.Stem Cells.)和ZMAT3(Kim,B.C.,Lee,H.C.,Lee,J.J.,Choi,C.M.,Kim,D.K.,Lee,J.C.,Ko,Y.G.,and Lee,J.S.(2012).Wig1 prevents cellular senescence by regulating p21 mRNA decaythrough control of RISC recruitment.EMBO J 31,4289-4303)。更直接地,衰老的诱导或增殖的抑制与miR-584-5p(Li,Q.,Li,Z.,Wei,S.,Wang,W.,Chen,Z.,Zhang,L.,Chen,L.,Li,B.,Sun,G.,Xu,J.,et al.(2017).Overexpression of miR-584-5p inhibitsproliferation and induces apoptosis by targeting WW domain-containing E3ubiquitin protein ligase 1in gastric cancer.J Exp Clin Cancer Res36,59)、miR-193a-5p(Chen,J.,Gao,S.,Wang,C.,Wang,Z.,Zhang,H.,Huang,K.,Zhou,B.,Li,H.,Yu,Z.,Wu,J.,et al.(2016).Pathologically decreased expression of miR-193acontributesto metastasis by targeting WT1-E-cadherin axis in non-small cell lungcancers.JExp Clin Cancer Res 35,173)、miR-548ac(Song,F.,Yang,Y.,and Liu,J.(2020).MicroRNA-548ac induces apoptosis in laryngeal squamous cell carcinomacells by targeting transmembrane protein 158.Oncol Lett 20,69)、miR-23b-3p(Campos-Viguri,G.E.,Peralta-Zaragoza,O.,Jimenez-Wences,H.,Longinos-Gonzalez,A.E.,Castanon-Sanchez,C.A.,Ramirez-Carrillo,M.,Camarillo,C.L.,Castaneda-Saucedo,E.,Jimenez-Lopez,M.A.,Martinez-Carrillo,D.N.,et al.(2020).MiR-23b-3preduces the proliferation,migration and invasion of cervical cancer celllines via the reduction of c-Met expression.Sci Rep 10,3256)、miR-140-3p(Wang,M.,Wang,X.,and Liu,W.(2020a).MicroRNA-130a-3p promotes the proliferation andinhibits the apoptosis of cervical cancer cells via negative regulation ofRUNX3.Mol Med Rep 22,2990-3000)和miR-330-3p(Wang,Y.,Chen,J.,Wang,X.,and Wang,K.(2020b).miR-140-3p inhibits bladder cancer cell proliferation and invasionby targeting FOXQ1.Aging 12,20366-20379)的上调相关。总而言之,这些数据表明这些miR作为胎儿hGPC祖细胞状态维持的积极参与者,并且它们的调节是成体hGPC呈现其特征基因表达谱的可能机制。
实施例8:miRNA的转录因子调节建立并巩固了GPC身份
本研究接下来试图通过查询TransmiR转录因子miRNA调控数据库(Tong,et al.(2019).TransmiR v2.0:an updated transcription factor-microRNA regulationdatabase.Nucleic Acids Res 47,D253-D258)来预测胎儿和成体GPC中差异表达的miRNA的上游调控。该方法预测通过66个类似的被确定为在胎儿和成体GPC之间显著差异表达的转录因子对56个年龄特异性GPC miRNA中的54个进行调节。有趣的是,前四个预测的miRNA调节TF都是MYC相关因子,包括MAX、MYC本身、E2F6和胎儿富集的MYC相关锌指蛋白MAZ,分别靶向36、33、30和28个独特的差异表达miRNA。
在12个TF候选物的背景下检查所提出的关系表明大量胎儿hGPC富集的miRNA,其被预测为胎儿激活子和成体阻遏物两者的靶标,而在成体GPC中富集的那些miRNA是被更独特地靶向的。预计MYC会驱动胎儿GPC中大量miRNA的表达,其中许多miRNA预计在成年后会通过E2F6、MAX或两者受到抑制。除了通过TEAD2激活之外,预计miR-130a-3p特别会成为MYC、MAX和E2F6的靶标。值得注意的是,在其他细胞类型中经过验证的TF-miRNA相互作用中,已经报道了通过MYC上调miR-17-5p恢复活力,以及通过MAX对其的抑制(Du,et al.(2014b).miR-17extends mouse lifespan by inhibiting senescence signalingmediated by MKP7.Cell Death Dis 5,e1355)。类似地,已报道通过MYC或TEAD2和YAP1并行激活增殖性miR-130-3p(Shen,et al.(2015).A miR-130a-YAP positive feedbackloop promotes organ size and tumorigenesis.Cell Res 25,997-1012),以及通过MYC激活miR-9的双臂(Ma,L.,et al.(2010a).miR-9,a MYC/MYCN-activated microRNA,regulates E-cadherin and cancer metastasis.Nat Cell Biol 12,247-256),miR-9随着少突胶质细胞的成熟而减少(Lau,P.,et al.(2008).Identification of dynamicallyregulated microRNA and mRNA networks in developing oligodendrocytes.JNeurosci 28,11720-11730)。
在成体GPC中,预计由我们显著富集的TF组调节的富集miRNA更有可能仅被仅具有miR-151a-5p和miR-4687-3p的胎儿阻遏物(预测的HMGA2的抑制剂,分别是STAT3相对于BCL11A和EZH2相反靶向)的成体激活子靶向。除此之外,预计miR-1268b会同时受到EZH2和HDAC2的抑制。值得注意的是,关键的少突胶质细胞microRNA miR-219a-2-3p预计将通过EZH2在胎儿GPC中保持受到抑制,而STAT3可能独立驱动7个其他miR的表达。有趣的是,STAT3的活性增加与衰老有关(Kojima,et al.(2013).IL-6-STAT3 signaling andpremature senescence.JAKSTAT 2,e25763),也被预测会驱动一组与衰老诱导独立相关的miRNA (包括miR-584-5p、miR-330-3p、miR-23b-3p和miR-140-3p)的表达。
通过转录和miRNA谱分析、通路富集分析和靶标预测的整合,我们提出了人GPC衰老的模型,其中胎儿hGPC维持祖基因表达、激活增殖程序并防止衰老,同时通过microRNA在转录和转录后上抑制少突胶质细胞和衰老基因程序。随着成体的成熟、时间的推移以及群体倍增,hGPC开始上调这些胎儿祖细胞相关网络的阻遏物,同时还激活程序以进一步进行分化并最终衰老的表型。
实施例9:嵌合动物模型大脑中BCL11A的表达导致宿主中表达BCL11A的GPC的增殖
通过分析从新鲜组织样本中分离的胎儿和成人胶质祖细胞(GPC)的RNA测序数据,本研究鉴定出几个转录因子是区分“年轻”vs“年老”GPC的基因调控网络的核心。其中,转录阻遏物BCL11A(B细胞CLL/淋巴瘤11A)是差异表达最显著的基因之一,在胎儿hGPC中高表达,在成人细胞中低表达,提示其在维持胎儿hGPC表型中起作用。此前从未发现BCL11A在中枢神经系统或在胶质祖细胞扩大、命运或衰老的调节中发挥这样的作用。
为了研究BCL11A是否能够在衰老的GPC中重新启动或加速自我更新,本研究生成了由CBh启动子驱动的表达BCL11A和GFP的慢病毒(以下简称CBh-BCL11A),以及仅表达绿色荧光蛋白(GFP)的对照病毒(CBh-GFP)(图14a)。如前所述,从人C27 iPSC细胞系中生成GPC,用表达红色荧光的转基因(RFP)标记(图14b),然后在出生后第1天将其植入到Rag1免疫缺陷小鼠的胼胝体(CC)中(P1,300,000个细胞/只)(Windrem at al.J.Neurosci 34,16153–16161(2014),Windrem et al.,Cell Stem Cell 21,195-208.e6(2017))。植入后,让嵌合小鼠衰老2年,此时它们在左半球接受CBh-BCL11A的立体定向注射,在右半球接受CBh-GFP对照病毒的立体定向注射。病毒沉积在纹状体、胼胝体和皮层中。在注射后3或6周,解剖小鼠进行单细胞分析,或用4% PFA灌注进行切片和免疫组织化学(图14c)。
本研究通过体外RNA表达(图14d)和体内蛋白质染色(图14e)证实了BCL11A的过表达。感染后三周,本研究观察到与大脑对照侧相比,CBh-BCL11A处理的半球的GPC群体有所扩大(图15a)。该研究发现,GPC谱系的RFP标记的人类细胞和OLIG2+细胞的存在显著增加(图15b,在15c中定量),以及由小鼠NG2抗原鉴定的常驻小鼠GPC增加(图15d,在15e中定量)。这种效应在感染后6周仍然存在(图16a),在CBh-BCL11A感染的半球检测到的RFP+和OLIG2+细胞比在CBh-GFP处理的对照组中更多(图16b)。在6周的时间点,供体细胞扩散既广泛又相对均匀;未发现肿瘤或异托邦(heterotopias)。这些观察结果表明,BCL11A转导激活了年老常驻人类和小鼠的GPC,以重新启动其宿主大脑的有丝分裂扩大和迁移定植。此外,BCL11A动员的人类供体细胞的(红色)膜标记允许白质中大部分细胞的形态被定义为髓鞘化少突胶质细胞,表明至少部分逆转了这些年老小鼠中典型的与年龄相关的髓鞘丢失。
虽然上面已经描述了各种实施方式,但是应当理解,这样的公开仅通过示例的方式呈现并且不是限制性的。因此,主题组合物和方法的广度和范围不应受到任何上述示例性实施方式的限制,而应仅根据所附权利要求及其等同物来定义。
上述描述的目的是教导本领域的普通技术人员如何实践本发明,并不旨在详细描述本领域技术人员在阅读说明书后将变得显而易见的所有那些明显修改和变化。然而,所有这些明显的修改和变化都旨在包括在由所附权利要求限定的本发明的范围内。权利要求旨在涵盖有效满足其预期目标的任何顺序的组成部分和步骤,除非上下文明确指出相反。
<?xml version="1.0"encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC"-//WIPO//DTD SequenceListing1.3//EN"
"ST26SequenceListing_vi_3.dtd">
- 包含间充质系干细胞的细胞群的制造方法、间充质系干细胞、细胞群、以及医药组合物
- 能够恢复由微尘引起的皮肤角质形成细胞分化抑制的物质的筛选方法以及用于恢复由微尘引起的皮肤角质形成细胞分化抑制的组合物
- 使CAR T细胞恢复活力的缀合物、组合物和方法
