诱导型启动子、基于其的载体和宿主细胞
文献发布时间:2024-07-23 01:35:12
技术领域
本发明涉及生物技术和分子生物学领域,特别涉及通用的诱导型启动子、基于其的载体和宿主细胞,以及涉及用于产生所述宿主细胞的方法。所提出的发明使得可以分析目标蛋白例如受体配体,例如细胞因子的活性。
背景技术
各种治疗活性多肽(例如单克隆抗体、融合蛋白、各种细胞因子、受体配体等)已证明其作为用于治疗许多病症和疾病的有效药物的价值。
为了开发新的治疗活性多肽,有必要进行功能测试以确定给定治疗活性多肽的生物活性。
治疗活性多肽的生物活性测试是一套技术,其用于评估候选药物,并且以使用原代细胞培养物和特化细胞系两者(在体外),或使用实验动物(在体内)来分析分子的生物活性为基础。来自功能测试的数据提供关于候选治疗活性多肽的活性的信息。
功能测试可分为以下几组:
1)比活性(细胞增殖的刺激和抑制、细胞毒性/凋亡、抗病毒活性、分化、迁移等)的测试;
2)报告基因表达的测试。
增殖/细胞毒性调节测试是大多数治疗活性多肽的最通用的测试。这些测试通过治疗活性多肽增加或降低细胞增殖的能力来测量其水平和活性。该方法以追踪细胞响应测试样品的生长或死亡为基础(Banks RE.Measurement of cytokines in clinicalsamples using immunoassays:problems and pitfalls.Crit Rev Clin Lab Sci.2000年4月;37(2):131-82.doi:10.1080/10408360091174187.PMID:10811142)。
此类测试已在抗增殖活性测定中建立了应用,例如研究人员评估了IFN-β-1a减少WISH细胞生长的能力(Renato Mastrangeli等人,In vitro biologicalcharacterization of IFN-β-1a major glycoforms,Glycobiology,第25卷,第1期,2015年1月,第21–29页,
另一个值得注意的实例是广泛用于评估细胞免疫的淋巴细胞增殖测定(Nikbakht,M.等人,Evaluation of a new lymphocyte proliferation assay based oncyclic voltammetry;an alternative method.Sci Rep 9,4503(2019).https://doi.org/10.1038/s41598-019-41171-8)。迄今为止,如下多种细胞因子的细胞增殖测定是商业可获得的:IFN-γ、IL-1α、IL-1β、IL-2、3、4、5、6、7、8、10、13、15、19、21、33。
报告基因典型地用于细胞测定,以追踪在转录和/或翻译水平上受体介导的表达变化。这些优化的基因在启动子内的敏感元件控制下表达,并且转录因子与其结合。
Phyllis A.Rees、R.Joel Lowy已经报道了使用报告细胞系来测量1型干扰素,作为耗时且费力的增殖测定的替代方法(Phyllis A.等人,Measuring type I interferonusing reporter gene assays based on readily available cell lines,Journal ofImmunological Methods,第461卷,2018,第63-72页,ISSN 0022-1759,
Jacqueline Mock等人已经开发了一个报告系(reporter line),其包括在NF-kB依赖性启动子控制下的萤光素酶基因。由常规测试(诸如CTLL-2增殖测定、检测INF-γ诱导的IL-12的ELISA、TNF的细胞毒活性的测量)产生了类似的细胞系(Mock J.等人,Auniversal reporter cell line for bioactivity evaluation of engineeredcytokine products.Sci Rep.2020;10(1):3234.2020年2月24日出版.doi:10.1038/s41598-020-60182-4)。
Zeuner MT等人已经报道了使用包括NF-kB敏感的启动子和萤光素酶基因的报告细胞系来研究神经炎症。该测定使得可以评估促炎分子和肽以及抗炎药物在神经细胞中的功效(Marie-Theres Zeuner等人,Development and Characterisation of a Novel NF-κB Reporter Cell Line for Investigation of Neuroinflammation,MediatorsInflamm,2017,doi:10.1155/2017/6209865)。
Wang等人已经开发了基于在SIE(血清应答元件)控制下表达萤光素酶的细胞系的增殖测定的类似方法(Wang L.等人,Development of reporter gene assays todetermine the bioactivity of biopharmaceuticals,Biotechnology Advances(2018),
当与常规的比活性测定相比,报告细胞的优点包括以下:
1)易于重现的结果、自动化和可缩放(scaling);
2)对目标药物的特异性;
3)高水平的敏感性、低水平的背景激活;
4)容易使用、容易检测报告信号。
当与常规的比活性测定相比,报告细胞的缺点包括为目标药物开发单独的报告细胞的漫长过程,因为它可以持续长达数月。
因此,需要可用于确定多种不同的治疗活性多肽(而不是仅一种单独的治疗活性多肽)的生物活性的报告细胞。
发明内容
本发明的作者开发了一种包含转录因子STAT3、STAT5和AP-1的结合位点和最小启动子的通用的诱导型启动子,以及基于其的载体和宿主细胞,这使得可以确定多种不同的治疗活性多肽(而不是仅一种单独的治疗活性多肽)的生物活性。
发明简述
在一个方面,本发明涉及一种诱导型启动子,其包含转录因子STAT3、STAT5和AP-1的结合位点和最小启动子。
在本发明的一些实施方案中,诱导型启动子包含转录因子STAT3的结合位点,其为选自包含SEQ ID NO:1、SEQ ID NO:2或SEQ ID NO:3的核苷酸序列的核苷酸序列。
在本发明的一些实施方案中,诱导型启动子包括转录因子STAT5的结合位点,其为选自包含SEQ ID NO:4、SEQ ID NO:5或SEQ ID NO:6的核苷酸序列的核苷酸序列。
在本发明的一些实施方案中,诱导型启动子包含AP-1家族转录因子的结合位点,其为选自包含SEQ ID NO:7、SEQ ID NO:8或SEQ ID NO:9的核苷酸序列的核苷酸序列。
在本发明的一些实施方案中,诱导型启动子包含转录因子STAT3、STAT5和AP-1的结合位点,它们从5'端至3'端依次按以下顺序排列:STAT3-STAT5-AP-1。
在本发明的一些实施方案中,诱导型启动子包含转录因子STAT3、STAT5和AP-1的结合位点,它们从5'端至3'端依次按以下顺序排列:STAT3-STAT5-AP-1,并且包含选自包含SEQ ID NO:10、SEQ ID NO:11或SEQ ID NO:12的核苷酸序列的核苷酸序列。
在本发明的一些实施方案中,诱导型启动子包含转录因子STAT3、STAT5和AP-1的结合位点,其包括SEQ ID NO:13的核苷酸序列。
在本发明的一些实施方案中,诱导型启动子包含最小启动子,该最小启动子包含TATA盒。
在本发明的一些实施方案中,诱导型启动子包含最小启动子,该最小启动子包含SEQ ID NO:14的核苷酸序列。
在一个方面,本发明涉及一种诱导型表达载体,其在5'端至3'端方向上包含上述诱导型启动子的任一种和报告基因。
在本发明的一些实施方案中,诱导型表达载体包含报告基因,该报告基因是萤火虫萤光素酶蛋白的基因。
在本发明的一些实施方案中,诱导型表达载体包含萤火虫萤光素酶蛋白的基因,该基因包含SEQ ID NO:15的核苷酸序列。
在本发明的一些实施方案中,诱导型表达载体包含SEQ ID NO:16的核苷酸序列。
在一个方面,本发明涉及一种用于产生用于分析目标蛋白活性的宿主细胞的方法,所述方法包含用上述诱导型表达载体的任一种转化细胞。
在一个方面,本发明涉及一种用于分析目标蛋白活性的宿主细胞,所述宿主细胞包含上述诱导型启动子的任一种和报告基因。
在本发明的一些实施方案中,宿主细胞包含报告基因,该报告基因是萤火虫萤光素酶蛋白的基因。
在本发明的一些实施例中,宿主细胞包含萤火虫萤光素酶蛋白的基因,该基因包含SEQ ID NO:15的核苷酸序列。
在本发明的一些实施方案中,宿主细胞包含SEQ ID NO:16的核苷酸序列。
在本发明的一些实施方案中,宿主细胞用于分析目标蛋白的活性,其中目标蛋白是受体配体。
在本发明的一些实施方案中,宿主细胞用于分析目标蛋白的活性,其中目标蛋白是细胞因子。
附图说明
图1是遗传报告构建体的示意图。该构建体包含在STAT3、STAT5、AP-1依赖性启动子控制下的报告萤火虫萤光素酶蛋白基因的核苷酸序列。如示意图中指示的,非编码区包括由TATA盒组成的最小启动子,在TATA盒的5'端放置有顺式调节元件,其由在三个重复中的交替的转录因子STAT3、STAT5、AP-1的结合位点组成。侧翼序列与目标载体内表达盒周围的区域互补,并且包含限制性核酸内切酶Acc65I和BglII的识别位点。
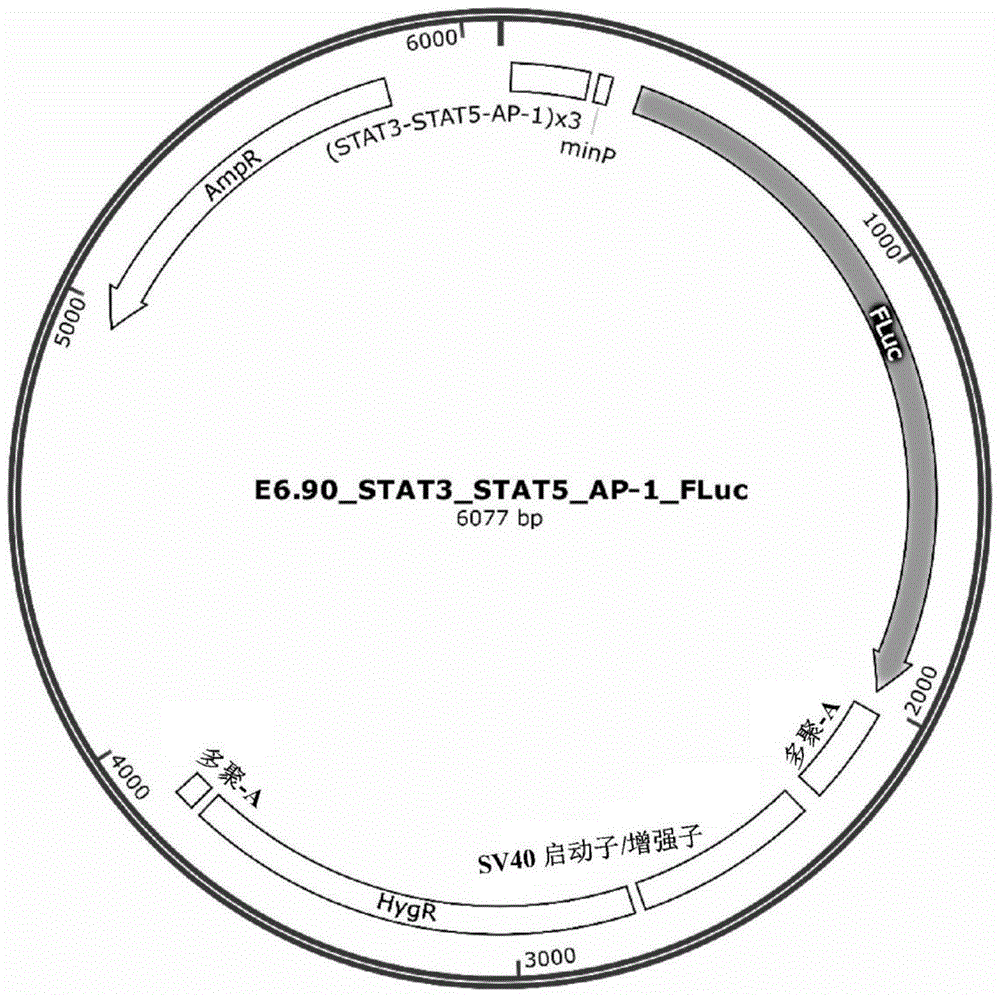
图2是报告质粒载体E6.90_STAT3_STAT5_AP-1_FLuc的图谱,所述载体编码在STAT3、STAT5、AP-1依赖性启动子控制下的萤火虫萤光素酶基因。
AmpR是β内酰胺酶基因,其传递对氨苄青霉素的抗性,并允许在大肠杆菌(E.coli)细胞中进行选择;
多聚-A是多聚腺苷酸化信号,转录终止子;
STAT3-STAT5-AP-1是调节FLuc基因表达的调节元件;
MinP是包含TATA盒的最小启动子;
FLuc是Photinus pyralis(萤火虫)萤光素酶基因;
HygR是传递对潮霉素的抗性的基因。它使得能够在真核细胞培养中进行选择;
SV40启动子/增强子是SV40病毒的真核启动子/增强子。
图3是编码人IL10RA基因的表达质粒载体E4.244_IL10RA_PR的图谱。
HS4是HS4绝缘子;
pCMVe/EF1α是CMV/EF1α的组成型杂合启动子;
Kozak是Kozak序列;
IL10RA是人IL10RA基因;
多聚-A是多聚腺苷酸化信号,转录终止子;
SV40增强子是SV40病毒的增强子;
b-珠蛋白MAR是人b-珠蛋白基因的MAR元件(M5);
Rep起点1是复制起始位点;
AmpR是β-内酰胺酶基因,其提供对氨苄青霉素的抗性。它使得能够在大肠杆菌细胞培养中进行选择;
F1起点是噬菌体f1复制起点;
SV40启动子是SV40病毒的真核启动子。
Puro R是对嘌呤霉素的真核抗性。传递对嘌呤霉素的抗性的基因。它使得能够在真核细胞培养中进行选择。
图4是编码人IL10RB基因的表达质粒载体E4.245_IL10RB_BR的图谱。
HS4是HS4绝缘子;
pCMVe/EF1α是CMV/EF1α的组成型杂合启动子;
Kozak是Kozak序列;
IL10RA是人IL10RA基因;
多聚-A是多聚腺苷酸化信号,转录终止子;
SV40增强子是SV40病毒的增强子;
b-珠蛋白MAR是人b-珠蛋白基因的MAR元件(M5);
Rep起点1是复制起始位点;
AmpR是β-内酰胺酶基因,其提供对氨苄青霉素的抗性。它使得能够在大肠杆菌细胞培养中进行选择;
F1起点是噬菌体f1复制起点;
SV40启动子是SV40病毒的真核启动子。
Blasti R是对杀稻瘟菌素的真核抗性。传递对杀稻瘟菌素的抗性的基因。它使得能够在真核细胞培养中进行选择。
图5是柱状图,其显示响应不同剂量PMA的HEK293 Nf-kB报告细胞的激活复数(multiplicity of activation)。
图6是柱状图,其显示响应33nM的PMA浓度的报告克隆系HEK293_STAT3-STAT5-AP1_FLuc的激活复数。
A2、A4、A5、B1、B3、B5、B6、C4、C6、D1、D4、C4#2、B0>、B1>、B2>、B3>是不同克隆报告系的名称;
初始-未转染的亲本细胞;
集合(pool)-转染后的细胞群体。
集合和未转染的细胞用作对照。
图7是柱状图,其显示响应100ng/ml下的IL10的表达IL10R的报告克隆系HEK293_STAT3-STAT5-AP1_FLuc的激活复数。
A1.2、A1.4、A1.5、A1.7、C1.1、C1.2、C1.6、C1.15、C1.11、C1.14、C1.16、A4_1、A4_3、A4_9、A4_10、C4_3、C4_12、C4_13、A5、A8、A9、A12、A15、A23、A31、C44、C4.4、C12、C16、C20、C27、C28、C29、C31、C33、C40、C41是IL10报告分子的不同克隆系的名称。
图8是显示HEK293-STAT3-STAT5-AP1_FLuc_IL10R细胞对IL10激活的剂量依赖性反应的图。
图9是在报告细胞系HEK293_STAT3-STAT5-AP1_FLuc的三个不同克隆(Cl.D1、cl.B3、cl.C4#2)的基础上产生的HEK293_STAT3-STAT5-AP1_FLuc_AXL集合的GAS6依赖性激活的图。GAS6是AXL依赖性细胞信号传导的激活剂。
Cl.D1、cl.B3、cl.C4#2是报告细胞系HEK293_STAT3-STAT5-AP1_FLuc的克隆。
图10是显示作为各种GAS6产物浓度的函数的报告细胞系HEK293_STAT3-STAT5-AP1_FLuc_AXL的激活的图。
GAS6产物#1、#2、#3是三种不同的Gas6产物。
图11是显示在GAS6存在的情况下,作为细胞孵育时间的函数的报告细胞系HEK293_AXL_STAT3-STAT5-AP1的激活的图。
图12是显示作为GAS6浓度的函数的DU145细胞增殖的图。
图13-15是显示DU145_STAT3-STAT5-AP1_FLuc的不同克隆(图13中为克隆C2、图14中为克隆H4、图15中为克隆E8)的GAS6依赖性激活的图。
克隆C2、H4和E8是DU145_STAT3–STAT5-AP1细胞系的克隆,该细胞系是在DU145细胞系(天然AXL表达细胞)的基础上,使用在STAT3-STAT5-AP1启动子控制下编码萤火虫萤光素酶的构建体产生的。这些克隆显示出对GAS6处理的最高反应水平。
图16是HEK293_AXL_STAT3-STAT5-AP1_FLuc的集合和个体克隆的GAS6依赖性激活的图。
cl.1、cl.8、cl.10、cl.14是HEK293_AXL_STAT3-STAT5-AP1_FLuc细胞系的克隆,它们是从HEK293_AXL_STAT3-STAT5-AP1_FLuc集合中产生的。
集合是从细胞系HEK293_AXL(AXL过表达细胞)产生的细胞系HEK293_AXL_STAT3-STAT5-AP1_FLuc,其中引入了在STAT3-STAT5-AP1依赖性启动子控制下编码萤火虫萤光素酶的基因。
图17是显示作为细胞计数的函数的报告细胞系HEK293_AXL_STAT3-STAT5-AP1的激活的图。
定义和一般方法
除非本文另有定义,所使用的与本发明有关的所有技术和科学术语将具有与本领域技术人员通常所理解的相同的含义。
此外,除非上下文另有要求,单数术语应包括复数术语,并且复数术语应包括单数术语。典型地,本文所述的细胞培养、分子生物学、免疫学、微生物学、遗传学、分析化学、有机合成化学、医学和药物化学以及蛋白和核酸的杂交和化学的现有分类和方法是技术人员所熟知并且在本领域广泛使用的。如本领域常见的,或如本文所述的,酶反应和纯化方法根据制造商的指南进行。
术语"核酸"、"核酸序列(nucleic sequence)"、"核酸序列(nucleic acidsequence)"、"多核苷酸"、"寡核苷酸"、"多核苷酸序列"和"核苷酸序列"在本描述中可交换地使用,意为修饰或未修饰的核苷酸的精确序列,其决定核酸的片段或区域、含有或不含非天然核苷酸以及为双链DNA或RNA、单链DNA或RNA或所述DNA的转录产物。
如本描述中使用的,作为非限制性实例,多核苷酸包括通过本领域可用的任何手段获得的所有核酸序列,作为非限制性实例,所述手段包括重组手段,即使用普通的克隆技术和PCR等,从重组文库或细胞基因组中克隆核酸序列,以及通过合成手段。
此处还应包括,本发明不涉及在其天然染色体环境中(即在天然状态中)的核苷酸序列。本发明的序列已经经过分离和/或纯化,即它们通过例如复制被直接或间接地取样,它们的环境已经被至少部分地修改。因此,这里还应提及通过重组遗传学,例如通过宿主细胞获得,或通过化学合成获得的分离的核酸。
除非另有指示,术语核苷酸序列包括其互补物。因此,具有特定序列的核酸应理解为包括具有其互补序列的其互补链的核酸。
如本文使用的术语"载体"意为能够转运与其连接的另一核酸的核酸分子。
如本描述中使用的,术语"表达"定义为由其启动子驱动的特定核苷酸序列的转录和/或翻译。
具体实施方式
诱导型启动子
在一个方面,本发明涉及一种诱导型启动子,其包含转录因子STAT3、STAT5和AP-1的结合位点和最小启动子。
根据本发明的诱导型启动子在报告细胞系统中的使用是通用的,以确定受体配体(例如细胞因子)的活性。
诱导型启动子是指响应特定信号而提供基因表达的启动子。
本发明的作者出乎意料地发现,在诱导型启动子中转录因子STAT3、STAT5和AP-1的结合位点的存在使得可以确定响应特定信号的报告基因表达的水平,所述信号产生自配体与其受体之间的相互作用,其中受体配体可以选自包含以下的多种细胞因子和其他受体配体:IL-2、IL-4、IL-7、IL-9、IL-13、IL-15、IL-21、GM-CSF、IL-3、IL-5、IL-6、IL-11、IL-12、IL-27、LIF、OSM、CNTF、CT-1、CLC、NP、瘦素、NNT-1/BSF-3、IFN-α、IFN-β、IFN-γ、IL-23、IL-10、IL-20、IL-22、IL-28、IL-29、IL-19、IL-24、IL-26、IL37、IL18、M-CSF、CSF1、G-CSF、CSF3、IL-31、IL-35、生长激素、催乳素、THPO、MGDF、EPO、TSLP、TNFSF18、IL-1、IL-17、TNF、TNF-α、RANKL(OPGL/TRANCE)、TRAIL、VEGI、CD153(CD30L)、CD154(CD40L)、CD70(CD27L)、TNF-C、CD70、4-1BB配体或GAS6,从而使得所述诱导型启动子在报告细胞系统中的使用是通用的,以确定配体对受体的活性,例如细胞因子。
转录因子STAT3的结合位点包含核心部分TTCnnnGAA。
在本发明的一些实施方案中,诱导型启动子包含转录因子STAT3的结合位点,其为选自包含SEQ ID NO:1、SEQ ID NO:2或SEQ IDNO:3的核苷酸序列的核苷酸序列。
转录因子STAT5的结合位点包含核心部分TTCnnnGAA。
在本发明的一些实施方案中,诱导型启动子包括转录因子STAT5的结合位点,其为选自包含SEQ ID NO:4、SEQ ID NO:5或SEQ ID NO:6的核苷酸序列的核苷酸序列。
转录因子AP-1的结合位点包括核心部分T[G/T]A[C/G]TCA。
在本发明的一些实施方案中,诱导型启动子包含AP-1家族转录因子的结合位点,其为选自包含SEQ ID NO:7、SEQ ID NO:8或SEQ ID NO:9的核苷酸序列的核苷酸序列。
在本发明的一些实施方案中,诱导型启动子包含转录因子STAT3、STAT5和AP-1的结合位点,它们从5'端至3'端依次按以下顺序排列:STAT3-STAT5-AP-1。
在本发明的一些实施方案中,诱导型启动子包括转录因子STAT3、STAT5和AP-1的结合位点,它们从5'端至3'端依次按以下顺序排列:STAT3-STAT5-AP-1,其中STAT3-STAT5-AP-1表示在1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40或更多个重复中。STAT3-STAT5-AP-1重复的最大量受限于表达载体的容量。STAT3-STAT5-AP-1重复的量不影响根据本发明的诱导型启动子的性能。
在本发明的一些实施方案中,诱导型启动子包含转录因子STAT3、STAT5和AP-1的结合位点,它们从5'端至3'端依次按以下顺序排列:STAT3-STAT5-AP-1,并且包含选自包含SEQ ID NO:10、SEQ ID NO:11或SEQ ID NO:12的核苷酸序列的核苷酸序列。
在本发明的一些实施方案中,诱导型启动子包含转录因子STAT3、STAT5和AP-1的结合位点,其包括SEQ ID NO:13的核苷酸序列。
在本发明的一些实施方案中,诱导型启动子包含最小启动子,该最小启动子包含TATA盒。
最小启动子是指具有最低调节元件含量的启动子,其包含TATA盒(霍格内斯盒(Hogness box))和转录起始位点;除非在该启动子前面添加特殊的调节元件,否则其将不起作用。
在本发明的一些实施方案中,诱导型启动子包含最小启动子,该最小启动子包含SEQ ID NO:14的核苷酸序列。
诱导型表达载体
在一个方面,本发明涉及一种诱导型表达载体,其在5'端至3'端方向上包含上述诱导型启动子的任一种和报告基因。
根据本发明的诱导型表达载体通用于产生报告细胞系统,以确定配体对其受体的活性,例如细胞因子。
诱导型表达载体是重组载体。
在本发明的一些实施方案中,诱导型表达载体包含报告基因,该报告基因是萤光素酶蛋白的基因。
在本发明的一些实施方案中,诱导型表达载体包含报告基因,该报告基因是萤火虫萤光素酶蛋白的基因。
在本发明的一些实施方案中,诱导型表达载体包含萤火虫萤光素酶蛋白的基因,该基因包含SEQ ID NO:15的核苷酸序列。
在本发明的一些实施方案中,诱导型表达载体包含SEQ ID NO:16的核苷酸序列。
在本发明的一些实施方案中,诱导型表达载体包含报告基因,该报告基因是编码绿色荧光蛋白(GFP)的基因,或红色荧光蛋白基因(DsRed),或编码酶β-半乳糖苷酶的LacZ基因,或可用作报告基因的编码荧光或发光蛋白的任何其他基因。
在本发明的一些实施方案中,诱导型表达载体包含异源核酸序列,该异源核酸序列包含提供报告多肽基因的表达的调节序列。
如本发明使用的,“在靶细胞中提供由异源核酸序列编码的产物表达的调节序列”意为影响克隆有它们的编码序列的表达和加工所必需的多核苷酸序列。表达控制序列包括:适当的转录起始、终止、诱导型启动子和增强子序列;有效的RNA加工信号(诸如剪接)和多聚腺苷酸化信号;稳定细胞质mRNA的序列;增强翻译效率的序列(即Kozak共有序列);增强蛋白稳定性的序列;以及当期望时,增强蛋白分泌的序列。此类控制序列的性质取决于宿主生物体而不同,在原核生物中,此类控制序列一般包括核糖体结合位点的启动子和转录终止序列,在真核生物中,此类控制序列典型地包括启动子和转录终止序列。术语"调节序列"至少包括其存在对于表达和加工是重要的所有组分。
如本文使用的术语"增强子(enhancers)"或"增强子(enhancer)"可以指与编码重组产物的DNA序列相邻定位的DNA序列。增强子元件典型地位于启动子元件的5'方向,或者可以在编码DNA序列(例如转录或翻译为重组产物的DNA序列)的下游或内部定位。因此,增强子元件可以在编码重组产物的DNA序列的上游或所述序列的下游的100个碱基对、200个碱基对或300个或更多碱基对处定位。增强子元件可以增加表达自DNA序列的重组产物的量至高于与单个启动子元件相关的表达水平。本领域的普通技术人员容易得到多种增强子元件。
在本发明的一些实施方案中,通用的诱导型表达载体可用于生成宿主细胞,该宿主细胞用作通用的报告细胞系,以分析多种不同受体配体的活性,所述受体配体为,例如IL-2、IL-4、IL-7、IL-9、IL-13、IL-15、IL-21、GM-CSF、IL-3、IL-5、IL-6、IL-11、IL-12、IL-27、LIF、OSM、CNTF、CT-1、CLC、NP、瘦素、NNT-1/BSF-3、IFN-α、IFN-β、IFN-γ、IL-23、IL-10、IL-20、IL-22、IL-28、IL-29、IL-19、IL-24、IL-26、IL37、IL18、M-CSF、CSF1、G-CSF、CSF 3、IL-31、IL-35、生长激素、催乳素、THPO、MGDF、EPO、TSLP、TNFSF18、IL-1、IL-17、TNF、TNF-α、RANKL(OPGL/TRANCE)、TRAIL、VEGI、CD153(CD30L)、CD154(CD40L)、CD70(CD27L)、TNF-C、CD70、4-1BB配体或GAS6。
宿主细胞及用于产生其的方法
在一个方面,本发明涉及一种用于产生用于分析目标蛋白活性的宿主细胞的方法,所述方法包含用上述诱导型表达载体的任一种转化细胞。
在一个方面,本发明涉及一种用于分析目标蛋白活性的宿主细胞,所述宿主细胞包含上述诱导型启动子的任一种和报告基因。
由于上述根据本发明的诱导型启动子的特征,因此根据本发明的宿主细胞可用于分析多种不同受体配体的活性,所述受体配体为,例如IL-2、IL-4、IL-7、IL-9、IL-13、IL-15、IL-21、GM-CSF、IL-3、IL-5、IL-6、IL-11、IL-12、IL-27、LIF、OSM、CNTF、CT-1、CLC、NP、瘦素、NNT-1/BSF-3、IFN-α、IFN-β、IFN-γ、IL-23、IL-10、IL-20、IL-22、IL-28、IL-29、IL-19、IL-24、IL-26、IL37、IL18、M-CSF、CSF1、G-CSF、CSF 3、IL-31、IL-35、生长激素、催乳素、THPO、MGDF、EPO、TSLP、TNFSF18、IL-1、IL-17、TNF、TNF-α、RANKL(OPGL/TRANCE)、TRAIL、VEGI、CD153(CD30L)、CD154(CD40L)、CD70(CD27L)、TNF-C、CD70、4-1BB配体或GAS6。
根据本发明的宿主细胞是重组宿主细胞。
在本发明的一些实施方案中,宿主细胞包含报告基因,该报告基因是萤光素酶蛋白的基因。
在本发明的一些实施方案中,宿主细胞包含报告基因,该报告基因是萤火虫萤光素酶蛋白的基因。
在本发明的一些实施方案中,宿主细胞包含萤火虫萤光素酶蛋白的基因,该基因包含SEQ ID NO:15的核苷酸序列。
在本发明的一些实施方案中,宿主细胞包含SEQ ID NO:16的核苷酸序列。
在本发明的一些实施方案中,宿主细胞包含报告基因,该报告基因是编码绿色荧光蛋白(GFP)的基因,或红色荧光蛋白基因(DsRed),或编码酶β-半乳糖苷酶的LacZ基因,或可用作报告基因的编码荧光或发光蛋白的任何其他基因。
在本发明的一些实施方案中,宿主细胞用于分析目标蛋白的活性,其中目标蛋白是受体配体。
在本发明的一些实施方案中,宿主细胞用于分析目标蛋白的活性,其中目标蛋白是细胞因子。
在本发明的一些实施方案中,宿主细胞是真核细胞。
在本发明的一些实施方案中,宿主细胞是哺乳动物细胞。
用作转化宿主的哺乳动物细胞系在本领域中是众所周知的并且包括多种可用的永生化细胞系。这些包括,例如中国仓鼠卵巢(CHO)细胞、NS0细胞、SP2细胞、HEK-293T细胞、FreeStyle 293细胞(Invitrogen)、NIH-3T3细胞、HeLa细胞、幼仓鼠肾(BHK)细胞、非洲绿猴肾细胞(COS)、人肝细胞癌细胞(例如Hep G2)、A549细胞和许多其他细胞系。通过确定哪些细胞系具有高表达水平并提供所产生蛋白的必要特征来选择细胞系。可以使用的其他细胞系是昆虫细胞系,诸如Sf9或Sf21细胞。植物宿主细胞包括例如烟草(Nicotiana)、拟南芥(Arabidopsis)、浮萍、玉米、小麦、马铃薯等。细菌宿主细胞包括埃希氏菌属(Escherichia)和链霉菌属(Streptomyces)物种。酵母宿主细胞包括粟酒裂殖酵母(Schizosaccharomycespombe)、酿酒酵母(Saccharomyces cerevisiae)和巴斯德毕赤酵母(Pichia pastoris)。
本发明的上述宿主细胞不是指使用人胚胎产生的宿主细胞。
本发明的上述宿主细胞不是指通过修饰人生殖系细胞的遗传完整性而产生的宿主细胞。
实施例
为了更好地理解本发明,提供以下实施例。这些实施例仅用于说明的目的,并且不应解释为以任何方式限制本发明的范围。
本说明书中引用的所有出版物、专利和专利申请均通过引用并入本文。尽管为了清楚理解的目的已经通过说明和实例的方式详细描述了前述发明,但是根据本发明的教导,对于本领域的普通技术人员来说显而易见的是,可以在不背离所附实施方案的精神或范围的情况下对其进行某些改变和修改。
材料和一般方法
重组DNA技术
如在Sambrook,J等人,Molecular cloning:A laboratory manual;Cold SpringHarbor Laboratory Press,Cold Spring Harbor,New York,1989中所述,使用标准方法操作DNA。根据制造商方案使用分子生物学试剂。
基因合成
期望的基因段制备自通过化学合成制成的寡核苷酸。侧翼是单个限制性位点的300-1400bp长的基因段通过寡核苷酸的退火和连接(包括PCR扩增)进行组装,并随后通过限制性位点进行克隆。通过DNA测序确认所亚克隆的基因片段的DNA序列。
DNA序列确定
DNA序列通过Sanger测序确定。
DNA序列分析和序列数据处理
Unipro的UGENE套件1.29版和SnapGene Viewer用于序列创建、作图(mapping)、分析、注释和说明。
表达载体
如申请材料中所述,包含报告基因的载体除了报告构建体之外,还包含:在大肠杆菌中提供所述质粒的复制的复制起始位点、传递对选择性抗生素(氨苄青霉素)的大肠杆菌抗性的基因。
如下所述的载体的遗传构建体通过PCR和/或基因合成以及使用已知的重组方法和技术通过连接相应的核酸段(例如使用相应载体中独特的限制性位点)的组装来组装。通过DNA测序验证所亚克隆的核酸序列。对于瞬时转染,通过从转化的大肠杆菌培养物中制备质粒来制备更大量的质粒。
实施例1.产生编码在STAT3-STAT5-AP-1敏感的启动子控制下的萤火虫萤光素酶基因的报告质粒载体
为了生成通用的报告构建体,我们选择了转录因子STAT3、STAT5、AP-1,它们介导许多不同信号传导分子的活性。
我们创建了调节元件,其包括由TATA盒组成的最小启动子,并且在启动子的5'端放置有在三个重复中的转录因子STAT3、STAT5、AP-1的结合位点(doi:10.1128/JVI.01713-10;doi:10.1074/jbc.M001748200)(图1)。这种转录因子结合位点的组合使得可以产生具有广泛应用范围的诱导型启动子。
为了组装阵列,我们合成了六个具有20bp重叠的60bp长的部分互补寡核苷酸。通过从寡核苷酸的合成进行组装,产生侧翼是与质粒载体互补的区域的249bp长的片段。通过不依赖连接的克隆将所得序列克隆在载体E6.90内(图2)。通过DNA测序验证所克隆的核酸序列。
实施例2.产生编码IL-10受体亚基的质粒载体以创建稳定的表达细胞系
为了在特定细胞测试中评估报告系,我们将IL-10受体表达到报告细胞的表面上。
为了生成人IL-10Ra基因(https://www.uniprot.org/uniprot/Q13651)和人IL-10Rb基因(https://www.uniprot.org/uniprot/Q08334)的天然序列,我们从供体的外周血单核细胞中分离了总RNA,并在总RNA的基础上合成了cDNA。所得cDNA文库用作模板,用于侧翼是限制性位点的目标序列的PCR扩增。表达载体内的目标基因通过限制性连接方法进行克隆(图3,图4)。通过DNA测序验证所克隆的核酸序列。
实施例3.HEK293 Nf-kB的激活
我们使用PMA激活剂来筛选克隆报告系。该试剂直接影响蛋白激酶C,从而触发激活报告基因表达的信号传导级联反应(https://doi.org/10.1007/s11373-005-1210-5;doi:10.1093/carcin/bgm261)。为了确定PMA的最佳剂量,我们进行了涉及HEK293 Nf-kB报告系的激活的实验。将细胞以每孔3*10
因此,选择了33nM的PMA激活剂最佳浓度(图5)。
实施例4.产生稳定的报告细胞系
报告细胞系的重要指标是响应测试分子的激活复数,以及背景激活的水平。
使用HEK293细胞系(ATCC CRL-1573,美国)产生稳定的报告细胞系,所述HEK293细胞系用来自实施例1的包含报告构建体的质粒载体转染。通过有限稀释克隆来克隆所得的稳定集合。为了筛选克隆系HEK293_STAT3-STAT5-AP1_FLuc,我们进行了萤光素酶表达激活测试。将细胞以每孔1*10
因此产生了一个报告细胞系,其显示出高激活复数和低水平的背景激活(图6)。
实施例5.产生对IL10特异的报告系
为了在特定细胞测试中评估报告系,我们将IL-10受体表达到报告细胞的表面上。为此,用实施例2中产生的编码IL-10受体亚基的质粒载体转染实施例4中产生的HEK293_STAT3-STAT5-AP1_FLuc报告细胞系。为了筛选表达IL10受体的克隆报告系,我们进行了实施例3中所述的萤光素酶表达激活测试。100ng/ml浓度下的重组人IL10用作激活剂。
基于激活复数的克隆的筛选和选择产生了基于通用系的IL10特异性报告系(图7)。
实施例6.IL10活性确定测试
报告系用于评估候选药物的活性。我们进行了响应图中显示的IL10激活剂的各种浓度的萤光素酶表达激活测试。测试设计已在实施例3中描述。
我们最终观察到报告细胞系对特定激活剂的剂量依赖性反应(图8)。
实施例7.在通用报告细胞系HEK293_STAT3-STAT5-AP1_FLuc的基础上,创建报告细胞系HEK293_STAT3-STAT5-AP1_FLuc_AXL以评估Gas6STAT3-STAT5-AP1产物的AXL介导的细胞内信号传导激活
为了生成报告细胞系HEK293_STAT3-STAT5-AP1_FLuc_AXL,我们使用了通用报告细胞系HEK293_STAT3-STAT5-AP1_FLuc的三个克隆:cl.D1、cl.B3和cl.C4#2,在它们的基础上,我们分别产生了3个具有嵌入的组成型表达的AXL受体基因的细胞集合。测试了这些集合的AXL介导的激活。该测试在设计用于发光测定的96孔培养板中进行。每个孔中的悬浮液含有30,000个HEK293_STAT3-STAT5-AP1_FLuc_AXL细胞以及在图9中显示的浓度下的AXL配体GAS6。孔中的细胞悬浮液的最终体积为100μl,悬浮液的所有组分均在不含胎牛血清的DMEM培养基中制备。在添加所有组分后,将板在37℃、5%CO
实施例8.在报告细胞系HEK293_STAT3-STAT5-AP1_FLuc_AXL上测试各种GAS6产物的AXL介导的STAT3-STAT5-AP1激活
与实施例7中描述的程序类似地进行了测试(在2μg/ml浓度的GAS6存在的情况下);为了激活,我们使用了HEK293_STAT3-STAT5-AP1_FLuc_AXL(在细胞系HEK293_STAT3-STAT5-AP1_FLuc的基础上产生的集合:cl.D1,参见实施例7)和在图中显示的浓度的各种GAS6制剂(图10)。
实施例9.分析AXL介导的HEK293_STAT3-STAT5-AP1_FLuc_AXL克隆的激活
从在细胞系HEK293_STAT3-STAT5-AP1_FLuc的基础上产生的集合:cl.D1、cl.B3和cl.C4#2(参见实施例7)中,我们选择了在测试(在2μg/ml浓度的GAS6存在的情况下与实施例7中类似地进行)中显示出GAS6依赖性激活的个体克隆。显示出最高水平激活的克隆是从在cl.D1的基础上产生的细胞集合中选择的。含有给定集合的不同克隆以及初始集合本身的96孔板的一个中的激活水平显示在表1中;它显示了相对于未激活细胞的激活,H11孔对应于集合。灰色指示对应于用于进一步研究的克隆HEK293_STAT3-STAT5-AP1_FLuc_AXL(cl.13)的孔。
表1.集合和个体克隆HEK293_STAT3-STAT5-AP1_FLuc_AXL的GAS6依赖性激活水平
实施例10.研究在GAS6存在的情况下作为孵育时间的函数的报告细胞系HEK293_STAT3-STAT5-AP1_FLuc_AXL的激活
与实施例7中描述的程序类似地进行测试,我们使用了报告系HEK293_STAT3-STAT5-AP1_FLuc_AXL(cl.13)的细胞和2μg/ml浓度下的GAS6(图11)用于活化;添加所有组分后,将板孵育图中显示的时间,然后确定孔中的发光强度。将激活水平计算为在所述浓度的GAS6存在的情况下的发光值与在GAS6变体不存在的情况下具有相同的孵育时间的发光值的比率。在24小时孵育期间观察到最高水平的激活。
实施例11.生成基于天然存在的Du145细胞系的报告细胞系,以评估AXL介导的STAT3-STAT5-AP1细胞内信号传导的激活
为了用AXL配体GAS6测试Du145细胞增殖的激活(图12),我们使用了Du145细胞系(天然AXL表达细胞)。该测定在用于黏附培养的96孔培养板中进行。每个孔中的悬浮液含有5,000个Du145细胞和图中显示的浓度下的AXL配体GAS6。孔中的细胞悬浮液的最终体积为100μl,悬浮液的所有成分均在包含0.3%胎牛血清的DMEM培养基中制备。添加所有组分后,将板在37℃、5%CO
我们生产了稳定的Du145细胞的克隆,以生成基于天然AXL表达细胞系的、对GAS6依赖性AXL信号传导激活敏感的报告细胞系,所述Du145细胞的克隆包含在STAT3-STAT5-AP1启动子控制下编码萤火虫萤光素酶的STAT3-STAT5-AP1_FLuc基因。
选择了在测试中显示出激活的克隆(图13-15)。该测试在96孔ELISA板中进行。实验前一天,将AXL配体GAS6固定化到塑料上:我们在DPBS中制备了浓度为5μg/ml的GAS6溶液,并且将100μl添加到每个板孔中。将板在37℃、5% CO
实施例12.创建基于AXL过表达细胞系HEK-293-AXL的报告细胞系HEK293_AXL_STAT3-STAT5-AP1_FLuc,以评估AXL介导的STAT3-STAT5-AP1细胞内信号传导的激活
为了创建报告细胞系HEK293_AXL_STAT3-STAT5-AP1_FLuc,我们使用了细胞系HEK293_AXL(AXL过表达细胞),在其基础上,我们生产了包含在STAT3-STAT5-AP1启动子控制下编码萤火虫萤光素酶的基因的细胞集合。接下来,我们从该集合中选择了在测试中显示出激活的个体克隆(图16)。以与实施例7中描述的程序类似的方法,在2μg/ml的GAS6浓度下进行测试。将激活水平计算为在GAS6存在的情况下给定克隆的发光值与在GAS6不存在的情况下的发光值的比率。
实施例13.研究作为细胞计数的函数的报告细胞系HEK293_AXL_STAT3-STAT5-AP1的激活
以与实施例7中描述的程序类似的方法,在2μg/ml的GAS6浓度下进行测试,报告系HEK293_AXL_STAT3-STAT5-AP1的细胞用于激活,其中每个96孔板的孔的细胞计数如图中显示的(图17)。当孔含有25,000-50,000个报告系的细胞时,观察到最高水平的激活。
- 盐胁迫诱导型启动子及其引物、表达载体和应用
- 源自谷氨酸棒杆菌的新型启动子核酸分子、包括所述启动子的重组载体、包括所述重组载体的宿主细胞和利用所述宿主细胞表达基因的方法
- 源自谷氨酸棒杆菌的新型启动子核酸分子、包括所述启动子的重组载体、包括所述重组载体的宿主细胞和利用所述宿主细胞表达基因的方法
