白色念球菌蛋白酶K突变体及其酶原、表达质粒、重组巴斯德毕赤酵母菌株以及产生蛋白酶K突变体成熟形式的方法
文献发布时间:2024-07-23 01:35:12
本发明涉及白色念球菌(Tritirachium album)蛋白酶K突变体及其酶原、表达质粒、重组巴斯德毕赤酵母菌株以及产生蛋白酶K突变体成熟形式的方法。
蛋白酶K(E.C.3.4.21.64)是一种丝氨酸蛋白酶,是由白色念球菌(白色侧齿霉菌(Engyodontium album))ATCC 22625的霉菌细胞合成的蛋白水解酶。它的类似物也可见于细菌细胞中,例如沙雷氏菌属(Serratia sp.)、假交替单胞菌属(Pseudoalteromonassp.)、交替单胞菌属(Alteromonas sp.)、栖热菌属(Thermus sp.)、弧菌属(Vibrio sp.)等。
取决于来源,这些酶的分子量、C末端结构域长度、最佳温度和pH值以及酶活性和/或其结构稳定所需的金属离子需求也有所不同。当反应缓冲液中存在变性剂(诸如SDS或尿素)时,蛋白酶K家族的酶活性通常会增加。另一方面,钙离子保护蛋白酶K免遭自水解。
这些酶具有催化肽键水解的能力,同时表现出广泛的底物谱,因此它们主要用于DNA分离过程和分子生物学的其他应用,以及从非蛋白质物质中去除蛋白质污染物。
蛋白酶K是一种从白色念球菌霉菌培养后液体中分离出来的酶,早已为人所知。但其生产流程长,且其特征在于每1升培养后液体的生产效率低。还尝试构建能够以包涵体形式产生蛋白酶K的细菌表达系统,但蛋白质复性问题阻止了大量酶的产生(Gunkel,F.A.和Gassen,H.G.(1989)Eur.J.Biochem.卷179(1),185-194;Samal,B.B.等.(1996)Adv.Exp.Med.Biol.卷379,95-104)。
此外,在专利EP1360283中描述了一种在酵母系统中以酶原与酿酒酵母(Saccharomyces cerevisiae)α-因子的信号肽的翻译融合形式产生蛋白酶K的方法。在这种情况下,酶原自催化活化为蛋白质的活性形式发生在分泌期间或培养后液体中,但它也可能过早发生,因此不是严格控制的过程。
专利PL 213045描述了白色念球菌蛋白酶K酶原的突变体,其含有能被Kex2蛋白酶识别的氨基酸序列,所述氨基酸序列位于前肽和具有成熟蛋白酶K活性的蛋白质序列之间。酶原(或蛋白质的酶促无活性形式)的这种修饰导致在酵母细胞中的前肽(或充当内部伴侣的蛋白质部分)的受控裂解,并产生蛋白酶K的成熟形式或其突变体(即,具有成熟蛋白酶K活性的蛋白质),从而在酵母宿主中,尤其是在重组巴斯德毕赤酵母菌株的细胞中有效生产该酶。
尽管有已知的解决方案,但仍在继续寻找新的、有效的系统,以便有效且廉价地生物合成K蛋白酶家族的酶。多年来,人们一直致力于构建能够进行生物合成并轻松分离具有蛋白酶K活性的酶的系统。本发明的目的是提供此类系统,其允许有效生产具有蛋白酶K活性的蛋白质以及可用于获得此类所需系统的新的蛋白酶K突变体。
本发明的另一个目的是获得具有与蛋白酶K类似的蛋白水解活性的新蛋白,然而,该蛋白可以容易地被灭活,以避免蛋白水解反应结束后获得的反应混合物的不期望的蛋白水解活性。若将蛋白酶K用作去除所有蛋白质的试剂,例如在核酸纯化过程中,则不希望在最终产物中留下具有蛋白酶活性的酶污染。因此,迫切需要生产一种比野生型蛋白酶K更容易失活的蛋白质。
出乎意料的是,本发明实现了上述复杂的技术效果。
出乎意料的是,本发明实现了上述目的。
本发明涉及白色念球菌蛋白酶K酶原的突变体,其在C末端处含有的突变能提高在酵母细胞中的表达效率并促进成熟蛋白酶K在应激下失活,所述突变是在C末端处附加的Gly残基。
优选地,本发明的白色念球菌蛋白酶K酶原突变体具有如序列号9所示的序列。
出乎意料的是,根据所述实施例9,本发明提出的酶原的修饰提高了在酵母细胞中,尤其是在巴斯德毕赤酵母细胞中的酶生产效率。
本发明还涉及白色念球菌成熟蛋白酶K的突变体,其在C末端处含有的突变能提高在酵母细胞中的表达效率并促进成熟蛋白酶K在应激下失活,所述突变是在C末端处附加的Gly残基。优选地,其具有如序列号22所示的序列。
本发明还涉及DNA序列,其含有如上定义的如本发明所述的蛋白酶K酶原突变体的编码序列或其片段。优选地,其具有序列号8。
本发明还涉及具有符号ProtK-G-F和ProtK-G-R的寡核苷酸序列,其用于产生DNA序列,所述DNA序列编码如上所定义的如本发明所述的突变体蛋白酶K酶原,或选自序列号6和7的其片段。
本发明还涉及表达质粒,其含有编码如上定义的如本发明所述的突变体蛋白酶K酶原的DNA序列,如实施例4中所述。优选地,如本发明所述的质粒具有选自以下序列的序列:序列号16。
本发明还涉及用如上定义的如本发明所述的任何质粒转化的重组酵母菌株,如实施例6中所述。优选地,如本发明所述的酵母菌株可获得自选自以下已知酵母菌株之一:毕赤酵母属(Pichia sp.)、汉逊酵母属(Hansenula sp.)、酵母属(Saccharomyces sp.)、裂殖酵母属(Schizosaccharomyces sp.)、耶式酵母属(Yarrovia sp.)或克鲁维酵母属(Kluyveromyces sp.),优选选自巴斯德毕赤酵母(Pichia pastoris)菌株。
本发明涉及一种获得具有白色念球菌蛋白酶K活性的蛋白质的方法,其特征在于用编码白色念球菌蛋白酶K酶原突变体的表达质粒转化酵母细胞,所述突变体在C末端含有能提高在酵母细胞中的表达效率并促进成熟蛋白酶K在应激下失活的突变,其中所述突变是位于C末端处附加的Gly残基,然后从培养后液体中分离纯化获得的蛋白质。
优选地,在约28至30℃的温度,优选地在含有甘油或甲醇作为碳源的培养基上培养如上文所定义的本发明所述的酵母细胞,用甲醇诱导修饰的蛋白酶K基因的表达。同等优选地,通过疏水相互作用色谱或羟基磷灰石床色谱从培养后液体中分离出具有白色念球菌蛋白酶K活性的蛋白质,然后用碳酸铵溶液透析纯化,随后冷冻干燥,如实施例9所述。
构建了一个表达系统,其允许在巴斯德毕赤酵母细胞中有效生物合成成熟形式的经修饰白色念球菌ATCC 22625蛋白酶K。如实施例2中所述,在编码如序列号5所示的野生型蛋白质的基因的模板序列上,通过PCR扩增编码如序列号8所示的修饰的蛋白质酶原的基因并测序。从扩增的序列中,去除如序列2所示的编码信号肽的核苷酸序列,并留下如序列号3所示的编码野生型蛋白质前肽的DNA序列,稳定蛋白酶K酶原防止其过早活化为具有酶促活性的成熟蛋白形式(Wolfgang Ebeling等,来自林伯氏白色念球菌的蛋白酶K(ProteinaseK from Tritirachium album Limber),Eur.J Biochem.47,91-97,1974)。此外,在成熟蛋白质的C末端添加了甘氨酸残基,这出乎意料地增加了成熟形式的突变蛋白质在应激条件下、在表面活性剂浓度增加的情况下的自溶效率。如实施例10中所述,野生型蛋白质的这种修饰允许酶在适当的缓冲液条件下有效失活,这是尤其有利的特征,可使酶在核酸纯化过程中轻松失活,所述过程需要高质量、高纯度、不含蛋白质杂质的DNA和RNA产品,而不需要使用会损坏核酸分离制备物的其它化学或物理因子。
如实施例6中所述,本发明中获得的巴斯德毕赤酵母/pD912-ProtK-G表达菌株允许产生显著量的功能性修饰的白色念球菌蛋白酶K,并且还允许产生修饰的酶,其与从野生型菌株中分离的酶的活性没有不同。尽管在成熟蛋白的C末端存在附加的甘氨酸氨基酸残基,但所获得的成熟蛋白酶K突变蛋白(如序列22所示)在活性上与从白色念球菌中分离的蛋白质没有显著差异。
本发明的一个实施方式是如实施例7所述,使用序列18和符号ProtK-G-out-F及序列19和符号ProtK-G-out-R的引物进行DNA扩增后得到的具有符号pD912-ProtK和序列21的表达质粒的DNA序列,其中包含如序列20所示的DNA片段,该DNA片段编码与蛋白酶K突变体相同的氨基酸序列,但如序列17所示,在成熟蛋白的C末端缺少附加的甘氨酸氨基酸残基。
本发明的一个实施方式是实施例8中所述带有符号巴斯德毕赤酵母/pD912-ProtK的重组巴斯德毕赤酵母菌株,其由巴斯德毕赤酵母BG10酵母菌细胞构成,其中含有如序列20所示的编码经修饰白色念球菌蛋白酶K的基因。
本发明的一个实施方式还包括通过从头DNA合成,并将其克隆到具有符号pPink_HC和序列10的载体中,获得具有符号pPink_HC-ProtK-WT和序列11的表达质粒的DNA序列,如实施例1中所述。获得的pPink_HC-ProtK-WT表达质粒含有DNA片段,其带有序列5和符号ProtK-WT,能编码野生型白色念球菌蛋白酶K的氨基酸序列。它含有天然蛋白酶K信号肽(序列2)与天然前肽(序列3)。
本发明的一个实施方式是实施例5中所述带有符号Pichia Pink/pPink_HC-ProtK-WT的重组巴斯德毕赤酵母菌株,其由含有如序列1中所示的编码野生型白色念球菌蛋白酶K的基因的Pichia Pink酵母细胞构成(赛默飞世尔(ThermoFisher),目录号A11150)。
本发明的一个实施方式还包括如实施例9中所述的用于产生经修饰白色念球菌蛋白酶K的方法,其包括由重组酵母菌株的细胞在富含钙离子(Ca
通过使用本发明,获得了能够在重组巴斯德毕赤酵母/pD912-ProtK-G酵母细胞中高效产生经修饰白色念球菌蛋白酶K(ProtK-G)的表达系统,与重组巴斯德毕赤酵母/pD912-ProtK菌株中相同条件下相同表达系统中进行的天然蛋白酶(ProtK)的表达水平相比,其效率高出约10%,并且与在Pichia Pink/pPink_HC-ProtK-WT菌株中野生型蛋白酶K的表达相比,其效率高出约30%。Pichia Pink
作为本发明的结果,获得了巴斯德毕赤酵母/pD912-ProtK-G表达菌株,该菌株在本发明实施过程中测试的所有系统中,在重组系统中产生白色念球菌蛋白酶K的效率最高。产量差异为10%,并且如果工艺扩大到1000L生产规模,则每个工艺可以产生超过260g的蛋白质。
附图简要说明以及序列说明:
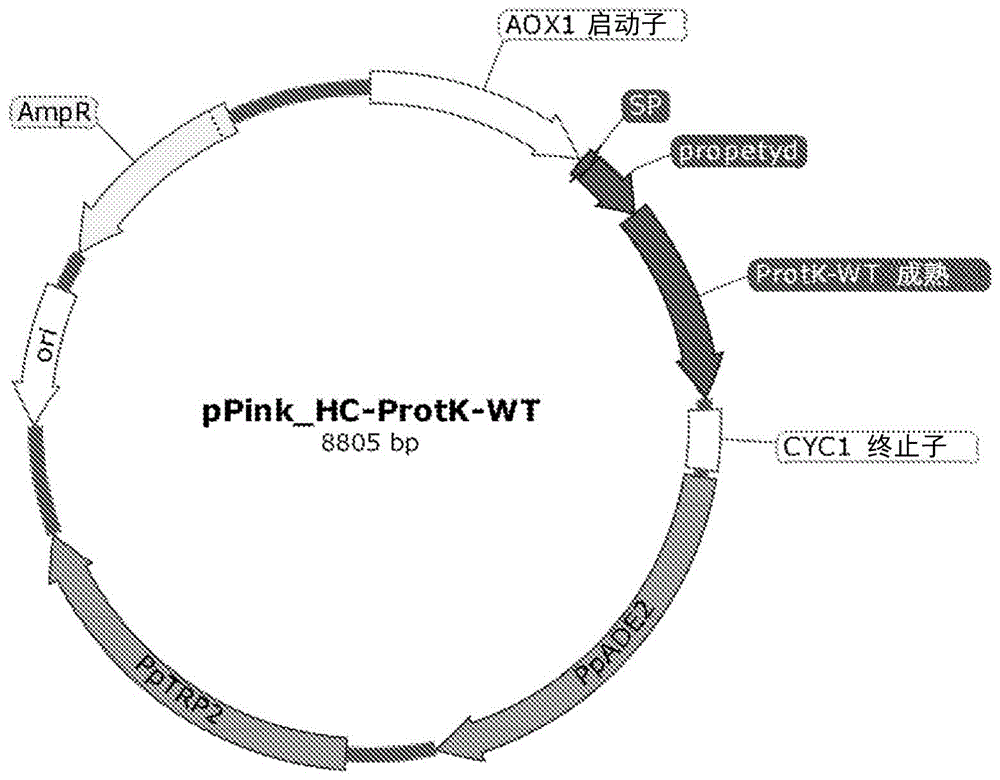
图1——显示了具有序列11和符号pPink_HC-ProtK-WT的表达质粒的结构,其编码野生型蛋白酶K。
图2——显示了具有序列16(或21)和符号pD912-ProtK-G(或pD912-ProtK)的表达质粒的结构,其编码具有突变C末端的蛋白酶K的重组形式(或成熟蛋白质的野生型)。
图3——三种表达菌株Pichia Pink/pPink_HC-ProtK-WT、巴斯德毕赤酵母/pD912-ProtK-G和巴斯德毕赤酵母/pD912-ProtK中白色念球菌蛋白酶K表达效率的比较。
图4——在典型的核酸纯化和应激条件下,比较重组形式的ProtK-G和天然ProtK_WT的蛋白质稳定性,其中表面活性剂的量增加至1%。在典型的DNA和/或RNA分离条件下(左图)或在表面活性剂浓度增加的应激条件下(中图)孵育30分钟后,ProtK-G的重组形式和天然ProtK_WT的稳定性显示在SDS-PAGE凝胶上。右图显示了在应激条件下再孵育30分钟后的两种蛋白质。ProtK-G和ProtK-WT这两种蛋白在核酸分离的典型条件下不会发生自溶,并保持相似的水平,而在应激条件下,重组ProtK-G蛋白比野生型蛋白ProtK-WT降解更快且更有效。
图5——三种表达菌株Pichia Pink/pPink_HC-ProtK-WT、巴斯德毕赤酵母/pD912-ProtK-G和巴斯德毕赤酵母/pD912-ProtK中白色念球菌蛋白酶K表达效率的比较。对于所有表达系统,在相同条件下使用相同方案进行酵母发酵。培养结束后,测量通过离心分离发酵培养基后发酵后培养物中的细胞生物量,以每1升培养物中沉淀物的克数表示。通过密度测定法和高效液相色谱测量了细胞分离后发酵培养基中蛋白酶K的含量。将三种表达系统的相对性能与最有效的系统,假设效率为100%的巴斯德毕赤酵母/pD912-ProtK-G进行比较。
序列1——显示白色念球菌蛋白酶K野生型蛋白质的氨基酸序列,符号为ProtK-WT
序列2——显示白色念球菌蛋白酶K野生型蛋白质信号肽的氨基酸序列,符号为ProtK-WT SP
序列3——显示白色念球菌蛋白酶K野生型蛋白质前肽的氨基酸序列,符号为ProtK-WT前肽
序列4——显示成熟的白色念球菌蛋白酶K酶促活性蛋白片段的氨基酸序列,符号为ProtK-WT成熟
序列5——显示编码野生型蛋白酶K蛋白,长1173个核苷酸的基因的核苷酸序列,符号为ProtK-WT
序列6——显示了用于PCR反应以扩增序列8的41个核苷酸长的寡核苷酸的序列,符号为ProtK-G-F
序列7——显示了用于PCR反应以扩增序列8的长41个核苷酸的寡核苷酸的序列,符号为ProtK-G-R
序列8——显示长1139个核苷酸的基因的核苷酸序列,该基因编码重组型白色念球菌蛋白酶K的前肽片段和成熟蛋白的肽段,符号为pro-ProtK-G
序列9——显示K白色念球菌成熟重组蛋白酶K蛋白长370个氨基酸序列的酶促活性蛋白片段的前肽和多肽,符号为pro-ProtK-G
序列10——显示长7667个核苷酸的表达载体pPink_HC的核苷酸序列(购自赛默飞世尔,美国,目录号A11152),含有甲醇诱导型酿酒酵母AOX1启动子
序列11——显示长8805核苷酸的pPink_HC-ProtK-WT表达载体的核苷酸序列,符号为pPink_HC-ProtK-WT,其含有受甲醇诱导型酿酒酵母AOX1启动子控制的序列5
序列12——显示白色念球菌蛋白酶K重组型蛋白质的氨基酸序列,符号为ProtK-G,长度为460个氨基酸,且蛋白质带有经修饰的C末端
序列13——显示长90个氨基酸的酿酒酵母蛋白酶α因子蛋白质信号肽序列,符号为ProtK-G SP
序列14——显示了编码白色念球菌蛋白酶K重组型蛋白,长1324个核苷酸的基因的核苷酸序列,符号为ProtK-G
序列15——显示长3837个核苷酸的表达载体pD912的核苷酸序列(购自ATUM,美国,目录号867858d1),其含有甲醇诱导型酿酒酵母AOX1启动子
序列16——显示长4928核苷酸的pD912-ProtK-G表达载体的核苷酸序列,符号为pD912-ProtK-G,其含有受甲醇诱导型酿酒酵母AOX1启动子控制的序列14
序列17——显示白色念球菌蛋白酶K重组型蛋白质的氨基酸序列,符号为ProtK,长度为459个氨基酸,且蛋白质带有天然C末端(在第460位处没有添加甘氨酸的氨基酸)
序列18——显示了用于PCR反应以扩增序列20的长59个核苷酸的寡核苷酸的序列,符号为ProtK-G-out-F
序列19——显示了用于PCR反应以扩增序列20的长36个核苷酸的寡核苷酸的序列,符号为ProtK-out-G-
序列20——显示了编码白色念球菌蛋白酶K重组型蛋白,长1324个核苷酸的基因的核苷酸序列,符号为ProtK(G460stop)
序列21——显示长4928核苷酸的pD912-ProtK表达载体的核苷酸序列,符号为pD912-ProtK,其含有受甲醇诱导型酿酒酵母AOX1启动子控制的序列20
序列22——显示了白色念球菌成熟蛋白酶K的酶促活性蛋白片段的氨基酸序列,符号为ProtK-WT成熟
实施例1.获得具有序列1的编码白色念球菌野生型蛋白酶K的基因DNA序列,符号为ProtK-WT。
为了获得编码以下的基因的DNA:具有序列1的野生型蛋白酶K蛋白、含有序列2的信号肽和符号ProtK-WT SP的符号ProtK-WT、具有序列3和符号ProtK-WT的前肽以及具有序列4和符号ProtK-WT成熟的具有酶促活性的蛋白酶K多肽,设计了基于UniProtKB数据库编号P06873的蛋白酶K蛋白质序列的DNA序列(
实施例2.获得编码白色念球菌重组蛋白酶K片段的基因的DNA序列,其中甘氨酸氨基酸连接至序列8的蛋白质的C末端,符号为pro-ProtK-G。
为了获得序列8和符号pro-ProtK-G的基因DNA片段,该DNA片段编码重组白色念球菌蛋白酶K的片段,该片段的序列9和符号pro-ProtK-G蛋白的C-末端连接有甘氨酸氨基酸,使用从新英格兰生物实验室公司(New England Biolabs,Inc.)购买,目录号为50-995-156的扩增试剂盒,用序列6和符号ProtK-GF以及序列7和符号ProtK-GR的两个寡核苷酸引物,通过PCR扩增在实施例1中获得的序列5和符号ProtK-WT的DNA片段。此外,为了将序列8的DNA片段和pro-ProtK-G符号克隆到表达载体中,PCR反应中使用的寡核苷酸含有限制性酶SapI识别位点。获得的DNA片段具有序列8,符号为pro-ProtK-G,用乙醇沉淀后用于克隆到表达载体中。
实施例3.获得具有序列11,符号为pPink_HC-ProtK-WT的表达质粒,其含有具有序列1的编码白色念球菌野生型蛋白酶K多肽序列的基因,符号为ProtK-WT。
为了获得具有序列11和符号pPink_HC-ProtK-WT的表达质粒,将实施例1中获得的通过乙醇沉淀纯化的具有序列1且符号ProtK-WT的DNA片段用EcoRI和KpnI限制性内切酶消化,然后与序列10且符号为pPink_HC(购自赛默飞世尔,美国,目录号A11152)的质粒载体DNA连接,用相同的限制性内切酶消化。
将连接混合物转化到大肠杆菌(Escherichia coli)TOP10F感受态细胞中,并铺板在含有100μg/ml氨苄青霉素的LA培养基(1% K-蛋白胨;0.5%酵母提取物;1%NaCl;1.5%琼脂)的培养皿中。从所得细菌菌落中分离质粒DNA后,获得了具有序列11且符号为pPink_HC-ProtK-WT的表达质粒,其含有具有序列5且符号为ProtK-WT的基因,其编码序列1且符号为ProtK-WT的白色念球菌蛋白酶K野生型形式。序列11且符号为pPink_HC-ProtK-WT的质粒结构如图1所示。
实施例4.获得序列16且符号为pD912-ProtK-G的表达质粒,该质粒含有序列14且符号为ProtK-G的基因,该基因编码序列12且符号为ProtK-G的白色念球菌重组蛋白酶K的多肽序列。
用SapI限制性酶消化在实施例2中得到的序列8且符号为pro-ProtK-G的DNA片段,然后与序列15且符号为pD912(购自ATUM,纽瓦克,美国,目录号867858d1)的质粒载体DNA连接,用相同的限制性酶消化。作为具有序列8且符号为pro-ProtK-G的DNA片段与具有序列15的pD912载体DNA连接的结果,具有符号pro-ProtK-G的序列8与具有序列13且符号为ProtK-G SP的pD912载体上的信号肽连接到正确的阅读框中(翻译融合)。
将连接混合物转化到大肠杆菌TOP10F感受态细胞中,并铺板在含有25μg/ml博来霉素的LA培养基(1% K-蛋白胨;0.5%酵母提取物;1% NaCl;1.5%琼脂)的培养皿中。从所得细菌菌落中分离出质粒DNA后,得到了序列16且符号为pD912-ProtK-G的表达质粒,其中含有序列14且符号为ProtK-G的基因,其编码如图2所示的序列16且符号为pD912-ProtK-G的白色念球菌重组蛋白酶K。
实施例5.获得符号为Pichia Pink/pink_HC-ProtK-WT的重组巴斯德毕赤酵母菌株
为了获得重组Pichia Pink/pink_HC-ProtK-WT菌株,将Pichia Pink酵母菌细胞以具有序列11且符号为pPink_HC-ProtK-WT的表达质粒DNA的线性形式进行转化,该质粒DNA是先前使用SpeI限制酶(赛默飞世尔,目录号ER1251)对序列11且符号为pPink_HC-ProtK-WT的质粒DNA进行消化获得的。按照Pichia Pink细胞供应商(赛默飞世尔,目录号A11150,手册版MAN0000717)的推荐,在PAD选择培养基上进行阳性毕赤酵母细胞克隆的选择。在从酵母细胞中分离出的基因组DNA模板上,使用实施例2中的寡核苷酸进行PCR扩增,以确认酵母基因组中是否存在重组的ProtK-WT基因,其符号为Pichia Pink/pink_HC-ProtK-WT。
实施例6.获得符号为巴斯德毕赤酵母/pD912-ProtK-G的重组巴斯德毕赤酵母菌株
为了获得重组的巴斯德毕赤酵母/pD912-ProtK-G菌株,用序列16且符号为pD912-ProtK-G的表达质粒DNA的线性形式转化酵母巴斯德毕赤酵母菌株BG10(ATUM,美国目录号PPS-9010),该质粒DNA是用PmeI限制酶(赛默飞世尔,目录号ER1342)消化序列16且符号为pD912-ProtK-G的质粒DNA而获得的。根据巴斯德毕赤酵母菌株BG10细胞供应商(ATUM,美国)的建议,在添加了200pg/ml博来霉素的YPDS选择培养基上对巴斯德毕赤酵母/pD912-ProtK-G酵母菌细胞的阳性克隆进行选择,然后将其转移到添加了200pg/ml博来霉素的YPD培养基上。在从酵母细胞中分离出的基因组DNA模板上,使用实施例2中的寡核苷酸进行PCR扩增,以确认酵母基因组中是否存在重组的ProtK-G基因,其符号为巴斯德毕赤酵母/pD912-ProtK-G。
实施例7.获得序列21且符号为pD912-ProtK的表达质粒,该质粒含有序列20且符号为ProtK的基因,该基因编码序列17且符号为ProtK的白色念球菌重组蛋白酶K的多肽序列。
将如实施例4所述获得的序列16且符号为pD912-ProtK-G的表达质粒用作PCR过程中的模板,该表达质粒含有序列14且符号为ProtK-G的基因,该基因编码带有序列12且符号为ProtK-G的重组白色念球菌蛋白酶K的多肽序列,所述PCR过程获得序列21且符号为pD912-ProtK的表达载体,该表达载体含有序列20且符号为ProtK的基因,该基因编码带有序列17且符号为ProtK的白色念球菌重组蛋白酶K的多肽序列。在PCR过程中,使用两种寡核苷酸作为引物,其一是具有序列18和符号ProtK-G-out-F的引物,另一是具有序列19和符号ProtK-G-out-R的引物,使用从新英格兰生物实验室公司(New England Biolabs,Inc.)购买的扩增试剂盒(目录号50-995-156),按照制造商推荐的条件进行。
将PCR混合物与DpnI限制酶(赛默飞世尔,目录号ER1701)孵育,转化到大肠杆菌DH5(α)感受态细胞中,并铺板在含有25μg/ml博来霉素的LA培养基(1%K-蛋白胨;0.5%酵母提取物;1% NaCl;1.5%琼脂)的培养皿中。作为从所得细菌菌落中分离质粒DNA的结果,获得了具有序列21且符号为pD912-ProtK的表达质粒,其含有具有序列20且符号为ProtK的基因,其编码序列17且符号为ProtK的重组白色念球菌蛋白酶K。序列21且符号为pD912-ProtK的质粒结构如图2所示。
实施例8.获得符号为巴斯德毕赤酵母/pD912-ProtK的重组巴斯德毕赤酵母菌株
为了获得重组的巴斯德毕赤酵母/pD912-ProtK菌株,用序列21且符号为pD912-ProtK的表达质粒DNA的线性形式转化酵母巴斯德毕赤酵母菌株BG10(ATUM,美国目录号PPS-9010),该质粒DNA是用PmeI限制酶(赛默飞世尔,目录号ER1342)消化序列21且符号为pD912-ProtK的质粒DNA而获得的。根据巴斯德毕赤酵母菌株BG10细胞供应商(ATUM,美国)的建议,在添加了200pg/ml博来霉素的YPDS选择培养基上对巴斯德毕赤酵母/pD912-ProtK酵母菌细胞的阳性克隆进行选择,然后将其转移到添加了200pg/ml博来霉素的YPD培养基上。在从酵母细胞中分离出的基因组DNA模板上,使用实施例2中的寡核苷酸进行PCR扩增,以确认酵母基因组中是否存在重组的ProtK基因,其符号为巴斯德毕赤酵母/pD912-ProtK。
实施例9.分别使用巴斯德毕赤酵母/pD912-ProtK-G、Pichia Pink/pink_HC-ProtK-WT细胞或巴斯德毕赤酵母/pD912-ProtK细胞获得白色念球菌蛋白酶K,并比较重组蛋白酶K(ProtK-G)和野生型蛋白酶K(ProtK-WT或ProtK)的表达效率。
分别在实施例5、6或8中获得的Pichia Pink/pink_HC-ProtK-WT、巴斯德毕赤酵母/pD912-ProtK-G或巴斯德毕赤酵母/pD912-ProtK的表达菌株分别产生重组(ProtK-G)、天然(ProtK-WT)或野生型成熟蛋白酶K多肽,将所述表达菌株在MGY培养基上于30℃下培养18-20小时,直到用分光光度计在600nm处测得的细胞密度,即OD
通过离心分离或使用孔径为0.2微米的滤盒以切向流过滤的手段分离酵母生物质后,使用疏水相互作用色谱床(例如苯基Sepharose HS(思拓凡(Cytiva)目录号17097399))或羟基磷灰石色谱床对来自培养后培养基的蛋白质进行纯化,然后通过碳酸铵溶液透析纯化,随后冷冻干燥以得到具有酶促活性的最终产品。
图3显示了Pichia Pink/pink_HC-ProtK-WT、巴斯德毕赤酵母/pD912-ProtK-G和巴斯德毕赤酵母/pD912-ProtK菌株在培养过程中以及诱导后2、3和4天表达水平的比较。在巴斯德毕赤酵母/pD912-ProtK-G菌株中,重组蛋白酶K(ProtK-G)的表达效率比相同表达系统中巴斯德毕赤酵母/pD912-ProtK菌株的原生蛋白酶(ProtK)表达水平高出约10%,并且比在Pichia Pink/pink_HC-ProtK-WT菌株中的表达高出约30%。Pichia Pink
事实证明,巴斯德毕赤酵母/pD912-ProtK-G表达菌株产生白色念球菌蛋白酶K的效率最高。产量差异为10%,并且如果工艺扩大到1000L生产规模,则一次发酵可以多产生260g的蛋白质。
实施例10.与在核酸纯化过程中的天然蛋白酶K,ProtK-WT相比,带有经修饰序列的蛋白酶K,ProtK-G能更快地失活并去除蛋白酶K。
来自白色念球菌的蛋白酶K是具有极高特异性活性的广谱内肽酶,可广泛用于分离核酸(DNA和RNA)且不会破坏其结构,还可用于消化蛋白质,包括可能会降低DNA或RNA终产物纯度的DNA酶和RNA酶以及其他与核酸相互作用的蛋白质。蛋白酶K在多种缓冲液条件下都能保持较高的活性,添加少量SDS表面活性剂(0.1%-0.5%)还能活化蛋白酶K。有效消化蛋白质污染物(包括分离过程中添加的蛋白酶K)是获得高质量DNA或RNA产品的条件,纯化过程中出现的任何蛋白质残留都会对纯化样品的质量产生负面影响。这对于制备用于qPCR测序和诊断的样品极为重要,因为制备的样品中的蛋白质污染可能会导致错误的结果。
为了证明本发明蛋白酶K变体在DNA和/或RNA纯化过程中有效失活和去除蛋白酶K的可能性,在无应激因子纯化核酸的典型条件(在10mM Tris-HCl pH 7.5,37℃孵育)下和添加1% SDS(在10mM Tris-HCl pH 7.5,1% SDS,37℃孵育)的应激条件下比较了两种变体(序列号12的ProtK-G和序列号1的ProtK-WT)的活性。
意想不到的是,与野生型蛋白酶或ProtK-WT相比,重组蛋白酶K或ProtK-G在应激条件下失去活性的速度更快,这使得在DNA和/或RNA分离过程中进行核酸相互作用蛋白消化步骤后,更容易去除残留的蛋白酶K,这与天然蛋白ProtK-WT形成鲜明对比。两种蛋白质在标准和应激孵育条件下的比较结果见图4。
在应激条件下培养后,变体的消化率仅为1.9%,而原始活性为69.7%。在相同条件下将参考蛋白ProtK-WT与表面活性剂一起孵育时,消化率保持在30%以上。
所获得的结果表明,在适当的条件下(1%表面活性剂),无需使用专用的试剂/抑制剂
这就为轻松使酶失活提供了可能,尤其是在需要高纯度DNA和RNA产品的核酸纯化过程中,而无需使用会损害分离核酸产品的其他化学或物理因素。
实施例11.利用nanoDSF技术评估重组蛋白酶K(ProtK-G)和野生型蛋白酶K(ProtK-WT)在苛性条件缓冲下的热折叠。
使用nanoDSF技术评估了C末端带有甘氨酸修饰的蛋白酶K的重组变体(序列22)和野生型酶(序列4;现有技术中已知的市场产品)的热稳定性。两种蛋白酶分别在包含离子表面活性剂的ATL缓冲液(恰根(QIAGEN),目录号19076)或在pH>8的包含离液胍盐的ACL缓冲液(恰根,目录号939017)中以相同浓度制备。使用普罗米修斯公司(Prometheus)的差示扫描荧光仪进行热稳定性测量。将样品从20摄氏度加热到95摄氏度,在330nm和350nm处记录固有荧光的变化。使用普罗米修斯公司软件对数据进行分析,以确定蛋白质的热折叠。根据330/350纳米荧光的一阶导数计算出了ProtK-G和ProtK-WT的熔融温度(Tm),见表1。
出乎意料的是,与野生型酶ProtK-WT相比(Tm分别为61.0℃和47.0℃),重组蛋白酶K ProtK-G在添加了离子表面活性剂或离液胍盐的缓冲液中的熔融温度(Tm分别为54.5℃和40.1℃)明显较低(表1)。获得的结果与实施例10中观察到的数据一致,其中在离子表面活性剂存在下ProtK-G以比ProtK-WT更快的速率失去活性。
与野生型酶(ProtK-WT)相比,本发明的ProtK-G变体具有更高的热失稳性(thermolability),这为在标准核酸纯化过程中在较低温度下更容易的灭活和酶去除提供了可能。
表1——利用nanoDSF技术对重组的ProtK-G和原生ProtK-WT的热折叠进行比较。
- 高表达高比活蛋白酶K突变体序列、毕赤酵母表达质粒的构建及菌株筛选和纯化方法
- 高比活角蛋白酶突变体、毕赤酵母表达质粒的构建及菌株筛选和纯化方法
