复合型糖天冬酰胺及其制造方法
文献发布时间:2024-07-23 01:35:12
技术领域
本发明涉及复合型糖天冬酰胺及其制造方法。
背景技术
糖链是单糖连结而成的生物体高分子,由于作为基本键合单位的单糖具有多个键合位点,因此其结构复杂。
生物体内的糖链存在于蛋白质中、细胞表面,参与蛋白质、细胞的识别、信息传递。
具有这样的特征的糖链被用于医疗领域中。例如,作为抗体药物的有效成分的抗体通常具有糖链结构。可期待具有均一糖链的抗体的利用将会带来抗体药物的副作用的抑制、药效的提高及血浆半衰期的延长这样的抗体药物的品质、功能提高。
另外,已知糖链结构的异常与各种疾病相关,并且已经尝试利用糖链来阐明疾病的机理。另外,在阐明疾病的机理的同时,也尝试了糖链在诊断药中的应用。
在具有复杂结构的糖链中,已知具有平分型GlcNAc结构、核心岩藻糖结构的糖链与癌症等疾病相关。因此,进行了下述尝试:从生物体中提取出具有平分型GlcNAc结构及/或核心岩藻糖结构的糖链,并对它们的结构进行鉴定、或者通过化学合成来制造。
非专利文献1公开了对来源于鸡的血清IgG中的糖部分的结构进行分析。非专利文献1中,为了分析糖部分的结构,使用了通过还原氨化反应用2-氨基吡啶(PA)将还原末端的N-乙酰葡糖胺的1位衍生化而得到的化合物。
非专利文献2~3公开了用于将平分型GlcNAc结构导入糖链中的化学合成法。
非专利文献4公开了用于将平分型GlcNAc结构和核心岩藻糖结构导入糖链中的化学合成法。
非专利文献5公开了通过酶化学合成向平分型GlcNAc型糖链中导入Gal的合成法。
现有技术文献
非专利文献
非专利文献1:Glycobiology(2004)vol 14,pp275-292
非专利文献2:Chem.Asian J.(2018)vol 13,pp1544-1551
非专利文献3:Angew.Chem.Int.Ed.(2016)vol 55,pp10487-10492非专利文献4:Angew.Chem.Int.Ed.(2018)vol 57,pp14543-14549非专利文献5:ChemBioChem(2020)vol21,pp3212-3215
发明内容
发明所要解决的课题
然而,非专利文献1~5没有公开对具有平分型GlcNAc结构和核心岩藻糖结构的复合型糖天冬酰胺进行化学合成、或者将具有平分型GlcNAc结构和核心岩藻糖结构的复合型糖天冬酰胺单独分离。
本申请所要解决的课题在于提供具有平分型GlcNAc结构和核心岩藻糖结构的新型复合型糖天冬酰胺及其制造方法。
用于解决课题的手段
本申请的发明人进行深入研究,结果发现了具有平分型GlcNAc结构和核心岩藻糖结构的新型复合型糖天冬酰胺及其制造方法,从而完成了本发明。
即,本发明如下所述。
[1]复合型糖天冬酰胺,其为来源于鸟类抗体的复合型糖天冬酰胺,
具有平分型GlcNAc结构和核心岩藻糖结构,其中,Asn残基可以被保护。
[2]如[1]所述的复合型糖天冬酰胺,其中,复合型糖天冬酰胺的糖链由9~13糖中的任一者构成,其中,Asn残基可以被保护。
[3]如[1]或[2]所述的复合型糖天冬酰胺,其具有下述结构,其中,Asn残基可以被保护。
[化学式1]
[4]如[3]所述的复合型糖天冬酰胺,其中,在GlcNAc-Man-Man的GlcNAc中的一者或两者上键合有Gal或Neu5Ac-Gal,其中,Asn残基可以被保护。
[5]制造复合型糖天冬酰胺的方法,其包括:
准备含有来源于鸟类抗体的复合型糖天冬酰胺的混合物的工序;及
使该混合物从阴离子交换树脂中通过,将复合型糖天冬酰胺纯化的工序,
在纯化工序中,将复合型糖天冬酰胺按唾液酸的数量分离。
[6]如[5]所述的方法,其中,混合物的准备工序包括:
对鸟类抗体进行改性的工序;及
用蛋白质分解酶将经改性的鸟类抗体分解的工序。
[7]如[6]所述的方法,其中,在鸟类抗体的改性工序中,通过热或有机溶剂对鸟类抗体进行改性。
发明效果
根据本发明,能够提供具有平分型GlcNAc结构和核心岩藻糖结构的新型复合型糖天冬酰胺及其制造方法。
附图说明
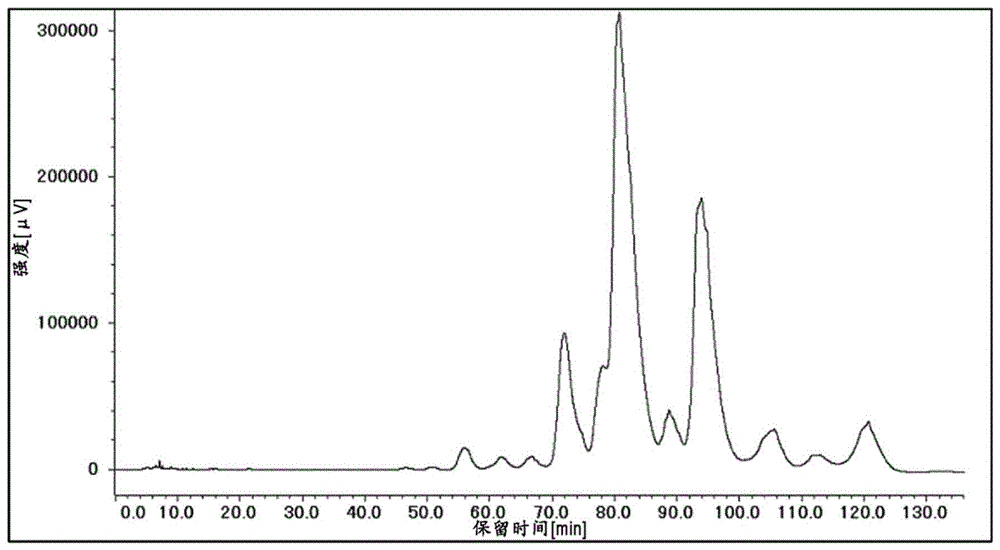
[图1]示出实施例2中分离出了糖数不同的各中性糖天冬酰胺衍生物的反相色谱的结果。
[图2]示出从反相色谱中约80分钟后洗脱的级分得到的、唾液酸数为0、且具有平分型GlcNAc结构和核心岩藻糖结构的11糖的复合型糖天冬酰胺衍生物的
[图3]示出从反相色谱中约80分钟后洗脱的级分得到的、唾液酸数为0、且具有平分型GlcNAc结构和核心岩藻糖结构的11糖的复合型糖天冬酰胺衍生物的质谱结果。
[图4]示出从反相色谱中约92分钟后洗脱的级分得到的、唾液酸数为0、且具有平分型GlcNAc结构和核心岩藻糖结构的10糖的复合型糖天冬酰胺衍生物的
[图5]示出从反相色谱中约92分钟后洗脱的级分得到的、唾液酸数为0、且具有平分型GlcNAc结构和核心岩藻糖结构的10糖的复合型糖天冬酰胺衍生物的质谱结果。
[图6]示出从反相色谱中约102分钟后洗脱的级分得到的、唾液酸数为0、且具有平分型GlcNAc结构和核心岩藻糖结构的10糖的复合型糖天冬酰胺衍生物的质谱结果。
[图7]示出从反相色谱中约118分钟后洗脱的级分得到的、唾液酸数为0、且具有平分型GlcNAc结构和核心岩藻糖结构的9糖的复合型糖天冬酰胺衍生物的质谱结果。
[图8]示出唾液酸数为1、且具有平分型GlcNAc结构和核心岩藻糖结构的12糖的复合型糖天冬酰胺衍生物的
[图9]示出唾液酸数为1、且具有平分型GlcNAc结构和核心岩藻糖结构的12糖的复合型糖天冬酰胺衍生物的质谱结果。
[图10]示出唾液酸数为2、且具有平分型GlcNAc结构和核心岩藻糖结构的13糖的复合型糖天冬酰胺衍生物的质谱结果。
[图11]示出从反相色谱中约102分钟后洗脱的级分得到的、唾液酸数为0、且具有平分型GlcNAc结构和核心岩藻糖结构的10糖的复合型糖天冬酰胺衍生物的
[图12]示出从反相色谱中约118分钟后洗脱的级分得到的、唾液酸数为0、且具有平分型GlcNAc结构和核心岩藻糖结构的9糖的复合型糖天冬酰胺衍生物的
[图13]示出唾液酸数为2、且具有平分型GlcNAc结构和核心岩藻糖结构的13糖的复合型糖天冬酰胺衍生物的
[图14]示出唾液酸数为2、且具有平分型GlcNAc结构和核心岩藻糖结构的13糖的复合型糖天冬酰胺衍生物的质谱结果。
具体实施方式
以下,对用于实施本发明的方式进行详细说明。需要说明的是,本发明不限于以下的实施方式,可以在其主旨的范围内进行各种变形而实施。
(复合型糖天冬酰胺)
本发明的复合型糖天冬酰胺为来源于鸟类抗体的复合型糖天冬酰胺,具有平分型GlcNAc结构和核心岩藻糖结构。
复合型糖天冬酰胺具有复合型糖键合于天冬酰胺而成的基本骨架。通常,作为N-键合型糖链,已知高甘露糖型(high mannose)、混合型(hybrid)、复合型(complex)糖链,本发明的复合型糖天冬酰胺具有N-键合型糖链之中的复合型糖链。
本发明的复合型糖天冬酰胺为来源于鸟类抗体的复合型糖天冬酰胺,具有鸟类抗体中包含的复合型糖天冬酰胺的结构。因此,本发明的复合型糖天冬酰胺的结构的整体或一部分可以与鸟类抗体中包含的复合型糖天冬酰胺的结构一致。
此处,鸟类抗体是指能够从鸟类得到的抗体。鸟类抗体没有特别限定,抗体的所有氨基酸序列来源于鸟类。
作为鸟类,可举出鸡、鹅、鸭等,优选为鸡。
鸟类抗体的同种型(isoform)也没有特别限定,可举出IgY、IgA、IgM,优选为IgY。
可以利用以往已知的方法从鸟类的蛋、血液等中获得鸟类抗体。作为鸟类抗体,没有特别限定,可以利用来源于蛋的抗体。其中,作为鸟类抗体,可以为来源于鸡、鹅、鸭等的蛋的抗体,由于能够从鸡蛋获得大量IgY,因此可以利用来源于鸡蛋的抗体。
关于鸟类抗体,示例出IgY进行说明时,IgY具有Fab区域和Fc区域。
鸟类抗体的Fab区域由以二硫键键合的重链和轻链构成,介由铰链区与Fc区域连结。
本发明的来源于鸟类抗体的复合型糖天冬酰胺为鸟类抗体中包含的复合型糖天冬酰胺,因此可以为来源于IgY、IgA、IgM的复合型糖天冬酰胺,也可以为来源于IgY的Fab区域、Fc区域这样的抗体片段的复合型糖天冬酰胺。
复合型糖链优选具有介由还原末端与天冬酰胺键合的被称为核心五糖(corepentasaccharide)的结构。
作为介由还原末端与天冬酰胺键合的核心五糖的结构,可举出以下的结构。
[化学式2]
本说明书中,Asn是指天冬酰胺,Man是指甘露糖,GlcNAc是指N-乙酰葡糖胺,Neu5Ac是指唾液酸,Gal是指半乳糖,Fuc是指岩藻糖。上述结构中,存在于左端的2个Man形成非还原末端。
各糖之间以及GlcNAc与Asn之间的直线是指连接键,各键只要是来源于鸟类抗体的结构中存在的键即可,没有特别限定,可以为α键、β键。
本发明的复合型糖天冬酰胺中的糖链结构除了核心五糖的结构以外,还可以为键合有N-乙酰葡糖胺、唾液酸、半乳糖、岩藻糖等的结构。可以在核心五糖的非还原末端侧键合有N-乙酰葡糖胺、唾液酸、半乳糖等。此外,作为本发明的复合型糖天冬酰胺的非还原末端侧的结构,可以具有支化结构。
(平分型GlcNAc结构)
所谓平分型GlcNAc结构,为具有下述N-乙酰葡糖胺的结构,所述N-乙酰葡糖胺键合于N-键合型糖链的核心五糖之中的与GlcNAc键合的甘露糖上。
(核心岩藻糖结构)
所谓核心岩藻糖结构,为具有下述岩藻糖的结构,所述岩藻糖键合于N-键合型糖链的核心五糖之中的与Asn键合的还原末端的N-乙酰葡糖胺上。
作为具有平分型GlcNAc结构和核心岩藻糖结构的糖链,优选具有以下的结构。
[化学式3]
上述结构中,与被记载为非还原末端的Man键合的GlcNAc相当于平分型GlcNAc结构,Fuc相当于核心岩藻糖结构。
复合型糖天冬酰胺的糖链结构没有特别限定,优选为具有由9~13糖中的任一者构成的糖链的、复合型糖天冬酰胺。
由9糖构成的糖链例如具有以下的结构。
[化学式4]
作为10~13糖的糖链结构,可以在由9糖构成的糖链的GlcNAc-Man-的GlcNAc中的一者或两者上键合有半乳糖或唾液酸。该情况下,优选在不包括平分型GlcNAc结构的GlcNAc在内的GlcNAc中的一者或两者上键合有半乳糖或唾液酸。
作为糖-糖之间的各键,只要非还原末端侧的糖所键合的还原末端侧的糖的羟基的位置也为来源于鸟类抗体的结构中存在的位置,就没有特别限定,糖-糖之间的各键可以为1→2键、1→3键、1→4键、1→6键。另外,1→2键、1→3键、1→4键、1→6键各自可以为α键,也可以为β键。
糖-天冬酰胺的键通常为1→N键,优选为β1→N键。
N-乙酰葡糖胺、甘露糖、半乳糖、唾液酸各自通常为D糖。
岩藻糖通常为L糖。
复合型糖天冬酰胺的糖链结构为由9~13糖构成的糖链结构的情况下,优选为具有以下具体示出的结构的糖链结构。
复合型糖天冬酰胺的糖链部分由9糖构成的情况下,可以具有以下的结构。
以下的结构中,例如,在GlcNAc与Man的键合中β1→2是指非还原末端侧的N-乙酰葡糖胺在1位与还原末端侧的甘露糖的2位羟基进行β键合。另外,β1→N是指还原末端的N-乙酰葡糖胺在1位与Asn的N进行β键合。在以下所示的9~13糖的情况下的糖链中,也同样。
Man3GlcNAc5Fuc(9糖)
[化学式5]
复合型糖天冬酰胺的糖链部分由10糖构成的情况下,可以具有以下的结构。
GalMan3GlcNAc5Fuc(10糖)(1)
[化学式6]
GalMan3GlcNAc5Fuc(10糖)(2)
[化学式7]
复合型糖天冬酰胺的糖链部分由11糖构成的情况下,可以具有以下的结构。
Gal2Man3GlcNAc5Fuc(11糖)(1)
[化学式8]
Neu5AcGalMan3GlcNAc5Fuc(11糖)(2)
[化学式9]
Neu5AcGalMan3GlcNAc5Fuc(11糖)(3)
[化学式10]
复合型糖天冬酰胺的糖链部分由12糖构成的情况下,可以具有以下的结构。
Neu5AcGal2Man3GlcNAc5Fuc(12糖)(1)
[化学式11]
Neu5AcGal2Man3GlcNAc5Fuc(12糖)(2)
[化学式12]
复合型糖天冬酰胺的糖链部分由13糖构成的情况下,可以具有以下的结构。
Neu5Ac2Gal2Man3GlcNAc5Fuc(13糖)
[化学式13]
天冬酰胺为L-天冬酰胺的情况下,具有以下的结构。在N-键合型糖链中,天冬酰胺存在于N末端,天冬酰胺以CONH
[化学式14]
就本发明的复合型糖天冬酰胺中的天冬酰胺而言,作为与糖链键合的CONH
Asn残基可以被保护是指天冬酰胺残基中的氨基及/或羧基被保护。
天冬酰胺残基被保护的情况下的、被保护是指利用以往已知的氨基酸的保护基、具体而言利用氨基及羧基的保护基进行保护。
关于可用作氨基、羧基的保护基的以往已知的氨基酸的保护基,例如,选择Greene’s Protective Groups in Organic Synthesis中记载的保护基即可。
作为氨基的保护基,没有特别限定,例如,可举出Fmoc基、叔丁氧基羰(Boc)基、苄氧基羰(Cbz或Z)基、对甲氧基苄氧基羰(Z(OMe)或pMZ)基、2-(对联苯基)异丙氧基羰(Bpoc)基等。
作为羧基的保护基,没有特别限定,例如,可举出甲酯基、乙酯基、苄酯基、叔丁酯基等。甲酯基、乙酯基、苄酯基、叔丁酯基分别为由甲醇、乙醇、苄醇、叔丁醇与羧基形成酯所带来的保护基。
天冬酰胺的氨基、羧基可以以游离的状态(NH
另外,天冬酰胺的氨基、羧基也可以为盐的状态。此处,盐的情况下,没有特别限定,例如,可以为盐酸盐、硫酸盐、磷酸盐等无机酸盐;乙酸盐、丙酸盐、酒石酸盐、富马酸盐、马来酸盐、苹果酸盐、柠檬酸盐、甲磺酸盐、对甲苯磺酸盐、三氟乙酸盐等有机酸盐;等等,例如,可以为钠盐、钾盐、钙盐、镁盐等碱金属盐或碱土金属盐。
(复合型糖天冬酰胺的制造方法)
制造本发明的复合型糖天冬酰胺的方法为包括下述工序的制造复合型糖天冬酰胺的方法:
准备含有来源于鸟类抗体的复合型糖天冬酰胺的混合物的工序;及
使该混合物从阴离子交换树脂中通过,将复合型糖天冬酰胺纯化的工序,
在纯化工序中,将复合型糖天冬酰胺按唾液酸的数量分离。
(含有复合型糖天冬酰胺的混合物的准备)
在准备含有来源于鸟类抗体的复合型糖天冬酰胺的混合物的工序中所准备的混合物中,包含从鸟类抗体中切出的复合型糖天冬酰胺。
从鸟类抗体中切出的复合型糖天冬酰胺通常包含多种复合型糖天冬酰胺。
混合物中只要含有1种以上的复合型糖天冬酰胺,就没有特别限定,可以包含除了本发明的复合型糖天冬酰胺以外的来源于鸟类抗体的成分。
作为除了该复合型糖天冬酰胺以外的来源于鸟类抗体的成分,可以为除了本发明的复合型糖天冬酰胺以外的糖天冬酰胺,也可以为来源于鸟类抗体的肽片段、糖链、氨基酸、糖肽。
另外,混合物中也可以包含并非来源于鸟类抗体的成分。作为并非来源于鸟类抗体的成分,没有特别限定,例如,可举出为了将鸟类抗体改性、或分解所需的成分等。
作为制造复合型糖天冬酰胺的方法中使用的鸟类抗体,可以参照与就上述复合型糖天冬酰胺进行说明的鸟类抗体有关的记载而应用,也可以使用由以往已知的方法得到的鸟类抗体。
鸟类抗体没有特别限定,只要为来源于鸟类的抗体即可,抗体的所有氨基酸序列来源于鸟类。
作为鸟类,可举出鸡、鹅、鸭等,优选为鸡。
鸟类抗体的同种型(isoform)也没有特别限定,可举出IgY、IgA、IgM,优选为IgY。
可以利用以往已知的方法从鸟类的蛋、血液等中获得鸟类抗体。作为鸟类抗体,没有特别限定,可以利用来源于蛋的抗体。其中,作为鸟类抗体,也可以利用来源于鸡、鹅、鸭等的蛋的抗体这样的来源于鸡蛋的抗体。
作为鸟类抗体,可以直接使用IgY、IgA、IgM等,也可以使用由以往已知的方法获得的包含Fab区域及/或Fc区域等抗体片段的级分。
准备含有来源于鸟类抗体的复合型糖天冬酰胺的混合物时,在使用鸟类抗体的Fab区域、F(ab’)
为了准备含有来源于鸟类抗体的复合型糖天冬酰胺的混合物,可以使用通过将鸟类抗体片段化而得到的鸟类抗体的Fab区域、F(ab’)
通过鸟类抗体的片段化而得到的除了Fab区域、F(ab’)
(鸟类抗体的分解)
准备含有来源于鸟类抗体的复合型糖天冬酰胺的混合物的工序中,可以包括将鸟类抗体分解的工序。需要说明的是,鸟类抗体的分解工序中的鸟类抗体是指IgY、IgA、IgM等、或其抗体片段。
作为抗体片段,没有特别限定,例如,可举出Fab区域、F(ab’)
将鸟类抗体分解的方法只要是能够将鸟类抗体分解而得到含有复合型糖天冬酰胺的混合物的方法,就没有特别限定,利用以往已知的方法将鸟类抗体分解即可。
为了将鸟类抗体分解,例如,可以利用蛋白质分解酶将鸟类抗体分解。
通过用蛋白质分解酶将鸟类抗体分解,复合型糖与在构成鸟类抗体的氨基酸序列中键合的天冬酰胺一起,作为复合型糖天冬酰胺从鸟类抗体中切出。
在鸟类抗体的基于蛋白质分解酶的反应液中,存在包含来源于鸟类抗体的复合型糖天冬酰胺的混合物。
另外,该复合型糖天冬酰胺以外的来源于鸟类抗体的成分也可能存在于鸟类抗体的基于蛋白质分解酶的反应液中。
作为将鸟类抗体分解的方法中使用的蛋白质分解酶,只要是能够将复合型糖所键合的天冬酰胺切出的分解酶,就没有特别限定,例如,可举出链丝菌蛋白酶E(Actinase E)、链霉蛋白酶(pronase)、Orientase等。
其中,从底物特异性的观点考虑,优选链丝菌蛋白酶E。
就基于蛋白质分解酶的反应温度而言,只要蛋白质分解酶保持酶活性,就没有特别限定,例如,为25℃~50℃的范围内的温度,优选为35℃~45℃的范围内的温度。
就基于蛋白质分解酶的反应时间而言,只要能够得到含有复合型糖天冬酰胺的混合物,就没有特别限定,例如,为12小时~168小时的范围内的时间,优选为24小时~96小时的范围内的时间。
在基于蛋白质分解酶的反应后,例如,可以将使蛋白质分解酶失活而得到的反应液作为包含复合型糖天冬酰胺的混合物。另外,也可以将利用柱层析等对蛋白质分解酶失活后得到的反应液进一步进行粗纯化而得到的溶液作为包含复合型糖天冬酰胺的混合物。
蛋白质分解酶的失活、基于柱层析等的粗纯化可以利用以往已知的方法实施。
其中,准备含有来源于鸟类抗体的复合型糖天冬酰胺的混合物的工序优选还包括将含有复合型糖天冬酰胺的混合物中包含的氨基酸、肽等除去的工序。
作为可利用的以往已知的将氨基酸、肽等除去的工序,例如,可举出使用了棉柱的纯化法。例如可以利用Chinese J.Anal.Chem.,(2020),vol 48(1),pp34-39.中记载的方法作为使用了棉柱的纯化法将氨基酸、肽等除去。
(鸟类抗体的改性)
作为含有复合型糖天冬酰胺的混合物的准备工序,可以还包括对鸟类抗体进行改性的工序来作为将鸟类抗体分解的工序的前工序。
对鸟类抗体进行改性的方法只要可使鸟类抗体的立体结构发生变化,就没有特别限定,利用以往已知的方法对鸟类抗体进行改性即可。
为了对鸟类抗体进行改性,例如,可举出通过热或有机溶剂进行改性的方法等。
通过在将鸟类抗体分解之前,对鸟类抗体进行改性,从而能够使鸟类抗体的立体结构发生变化,能够提高基于蛋白质分解酶的鸟类抗体的分解反应性。
在进行热处理来对鸟类抗体进行改性的情况下,从基于蛋白质分解酶的反应性的观点考虑,优选在以下这样的反应条件下实施热处理。
热处理可以通过对包含鸟类抗体的溶液直接施加一定时间的热来进行。
反应温度没有特别限定,例如,为65℃~95℃的范围内的温度,优选为70℃~90℃的范围内的温度,更优选为70℃~80℃的范围内的温度。
反应时间没有特别限定,例如,为1分钟~20分钟的范围内的时间,优选为5分钟~10分钟的范围内的时间。
作为包含鸟类抗体的溶液的溶剂,没有特别限定,例如,优选为水,可以为缓冲液,也可以为水溶液。
在进行有机溶剂处理来对鸟类抗体进行改性的情况下,从基于蛋白质分解酶的反应性的观点考虑,优选在以下这样的反应条件下实施有机溶剂处理。
有机溶剂处理可以向包含鸟类抗体的溶液添加有机溶剂、并保持一定时间来进行。
作为有机溶剂,没有特别限定,例如,可举出丙酮、甲醇、乙醇、2-丙醇、氯仿、乙酸乙酯等。
作为有机溶剂,可以使用一种溶剂,也可以使用两种以上的溶剂的混合溶剂。
另外,关于水溶性的有机溶剂,可以利用包含有机溶剂的水溶液对鸟类抗体进行改性。
反应时间没有特别限定,例如,为1小时~24小时的范围内的时间,优选为3小时~12小时的范围内的时间。
反应温度没有特别限定,例如,可以为室温。
在有机溶剂处理中,可以将鸟类抗体直接浸渍在有机溶剂中或与有机溶剂接触来进行处理,可以对包含鸟类抗体的溶液添加有机溶剂,也可以对有机溶剂添加包含鸟类抗体的溶液。
(复合型糖天冬酰胺的纯化)
将复合型糖天冬酰胺纯化的工序是将由前工序得到的含有来源于鸟类抗体的复合型糖天冬酰胺的混合物从阴离子交换树脂中通过而纯化的工序。
在进行本工序之前的混合物中,包含从鸟类抗体中切出的复合型糖天冬酰胺,通常,包含多种复合型糖天冬酰胺。利用本工序,将混合物中包含的复合型糖天冬酰胺按唾液酸的数量分离。
作为复合型糖天冬酰胺中包含的唾液酸的数量,没有特别限定,例如,为0~2。
所谓将混合物中包含的复合型糖天冬酰胺按唾液酸的数量分离,是指:在基于阴离子交换树脂的洗脱液中,复合型糖天冬酰胺根据唾液酸的数量而依次被洗脱出,由此能够作为唾液酸的数量例如为0、1、2个的复合型糖天冬酰胺的各级分进行分离并分取。
在唾液酸的数量为0个的复合型糖天冬酰胺的级分、为1个的复合型糖天冬酰胺的级分、为2个的复合型糖天冬酰胺的级分中,可以各自包含多种复合型糖天冬酰胺。
在将包含复合型天冬酰胺的混合物从阴离子交换树脂中通过而将复合型糖天冬酰胺纯化之前,可以利用以往已知的方法进行包含复合型天冬酰胺的混合物的粗纯化。
作为阴离子交换树脂,没有特别限定,例如,可举出强阴离子交换树脂、弱阴离子交换树脂等。
作为阴离子交换树脂的基材,没有特别限定,例如,可举出苯乙烯、二乙烯基苯、纤维素、琼脂糖等。
作为强阴离子交换树脂,例如,可举出在基材中导入有季氨基的树脂。
作为弱阴离子交换树脂,例如,可举出在基材中导入有叔氨基、二乙基氨基乙基、羧甲基、多胺等的树脂。
作为将包含复合型糖天冬酰胺的混合物从阴离子交换树脂中通过而纯化的方法,没有特别限定,可举出阴离子交换色谱。
作为阴离子交换色谱中使用的流动相,可以使用以往已知的缓冲液。
作为缓冲液中使用的溶剂,没有特别限定,例如,可举出水、乙腈、醇等,可以使用一种溶剂,也可以使用两种以上的溶剂的混合溶剂。
作为缓冲液的成分,没有特别限定,例如,可举出乙酸、磷酸、柠檬酸、烷基胺、铵、三羟基甲基氨基甲烷、吡啶等保持缓冲能力的成分,可以使用一种成分,也可以使用两种以上的成分。
流动相的pH没有特别限定,优选为从中性至碱性的范围内的pH,更优选为pH7~pH10的范围内的pH。
在利用阴离子交换色谱对包含复合型糖天冬酰胺的混合物进行纯化的工序中,可以利用梯度条件下的流动相进行洗脱。例如,在流动相中使用梯度条件下的流动相的情况下,可以在pH为7~10的范围内的梯度条件下进行洗脱。
在制造本发明的复合型糖天冬酰胺的方法中,为了进一步进行纯化,可以包括对按唾液酸的数量分离的复合型糖天冬酰胺进行纯化的工序。作为对按唾液酸的数量分离的复合型糖天冬酰胺进行纯化的工序,为了提高纯度,可以对按唾液酸的数量分离的复合型糖天冬酰胺进一步进行纯化。
另外,作为按唾液酸的数量分离的复合型糖天冬酰胺,有时包含虽然唾液酸的数量相同但糖链结构不同的糖天冬酰胺,因此可以对糖链结构不同的糖天冬酰胺进一步进行纯化。
用于进一步纯化的方法没有特别限定,可以使用以往已知的糖天冬酰胺等糖肽的纯化方法。
其中,作为用于进一步纯化的方法,可以将利用阴离子交换色谱按唾液酸的数量分离的复合型糖天冬酰胺直接用于下一纯化工序,但也可以为了进行分离纯化而在天冬酰胺中导入保护基。
可以通过在复合型糖天冬酰胺的天冬酰胺中导入保护基来进行糖链结构不同的糖天冬酰胺的分离纯化,其中,可以导入脂溶性保护基来进行糖链结构不同的糖天冬酰胺的分离纯化。
在制造本发明的复合型糖天冬酰胺的方法中,为了进一步进行纯化,可以包括在按唾液酸的数量分离的复合型糖天冬酰胺中导入保护基的工序。
对复合型糖天冬酰胺导入保护基的反应没有特别限定,可利用以往已知的方法实施。
作为导入糖天冬酰胺中的保护基,可以参照就上述天冬酰胺的保护基进行说明的记载而应用,其中,可举出Fmoc基、叔丁氧基羰(Boc)基、苄氧基羰(Cbz或Z)基、对甲氧基苄氧基羰(Z(OMe)或pMZ)基、2-(对联苯基)异丙氧基羰(Bpoc)基等氨基的保护基、以及甲酯基、乙酯基、苄酯基、叔丁酯基等羧基的保护基。其中,可以使用Fmoc基或/及甲酯基。
另外,在将保护基导入糖天冬酰胺的工序中,可以向唾液酸的游离的羧基导入保护基。唾液酸的游离的羧基也可参照就上述天冬酰胺的保护基进行说明的记载来应用,可以利用氨、甲胺、芳香族胺等对羧基进行酰胺化而保护。其中,可举出甲酯基、乙酯基、苄酯基、叔丁酯基等羧基的保护基。其中,可以使用甲酯基。
对于根据情况导入有保护基的复合型糖天冬酰胺,没有特别限定,例如,可以利用反相色谱、亲水性相互作用液相色谱、正相色谱、离子交换色谱、亲和色谱或尺寸排阻色谱等进行纯化。
各色谱可利用以往已知的方法实施。另外,可以将各色谱组合来实施。
通过进一步进行复合型糖天冬酰胺的纯化,能够将本发明的各复合型糖天冬酰胺分别分取。导入有保护基的复合型糖天冬酰胺中的保护基的脱保护可利用以往已知的方法实施。
作为反相色谱中使用的载体,没有特别限定,例如,可举出以二氧化硅为基材并将十八烷基、辛基、苯基、氰基丙基、甲基等固定化于填充剂表面而得到的载体,其中,优选ODS树脂。
作为亲水性相互作用液相色谱中使用的载体,没有特别限定,例如,可举出以二氧化硅为基材、并将经氨基丙基、酰胺基、二醇、氰基、氨基甲酰基等修饰的硅胶、聚合物基材等固定化于填充剂表面而得到的载体。
作为色谱中使用的流动相,例如,没有特别限定,可举出水、乙腈、醇等,可以使用一种溶剂,也可以使用两种以上的溶剂的混合溶剂。另外,流动相中可以添加酸、碱,也可以利用梯度条件下的流动相进行洗脱。
另外,在对按唾液酸的数量分离的复合型糖天冬酰胺进行纯化的工序中,为了分离及单独分离出糖链不同的各复合型糖天冬酰胺,基于色谱的复合型糖天冬酰胺的纯化不限于一次,也可以进行多次。进而,在基于色谱的纯化之前,可以包括对复合型糖天冬酰胺进行粗纯化的工序。
实施例
以下,利用实施例及比较例进一步具体地说明本实施方式,但本实施方式不仅限于这些实施例。需要说明的是,本实施方式中使用的测定方法如下所述。
[HPLC分析]
日本分光公司制LC-2000系列PLUS
检测器:UV 273nm
岛津制作所公司制Nexera Prep系列
检测器:UV 301nm
反相柱:InertSustain AQ-C18 column 5μm,10×250mm
HILIC柱:InertSustain Amide column 5μm,10×250mm
[质谱]
岛津制作所公司制AXIMA-CFRplus
离子化:MALDI
模式:线性正离子(Linear Positive)
岛津制作所公司制MALDI-8030
模式:线性正离子
[
JEOL制JNE-ECA500型FTNMR波谱仪(500MHz)
溶剂:D
<实施例1>
(a)将约6.5g的包含IgY的级分于80℃孵育10分钟,调整为Tris-盐酸·氯化钙缓冲液(pH=8.0,3.0L),以成为0.05%的质量浓度的方式加入叠氮化钠。进而,加入链丝菌蛋白酶E(科研制药公司制,650mg),于37℃反应48小时。
(b)反应结束后,经过离心分离回收上清液。使用填充了棉(Cotton)的柱,在梯度(CH
(c)对得到的糖天冬酰胺的级分进行减压浓缩,应用于阴离子交换载体(JNC公司制,Cellufine A-500),进行阴离子交换色谱。作为流动相,使用10%乙腈(pH=9.5)与3%乙酸:乙腈=9:1(pH=7.3)的梯度(100:0→97:3→80:20)。在流动相的比率为100:0时,洗脱出没有键合唾液酸的糖天冬酰胺。在流动相的比率为97:3时,洗脱出键合有1个唾液酸的糖天冬酰胺。在流动相的比率为80:20时,洗脱出键合有2个唾液酸的糖天冬酰胺。利用质谱确认了所得到的糖天冬酰胺的存在。
<实施例2>
(a)使用填充了棉的柱,对实施例1中得到的唾液酸数为0的糖天冬酰胺(中性糖天冬酰胺)组进行脱盐,并进行减压浓缩。使得到的残留物(约28.0mg)溶解于水·丙酮溶剂(水/丙酮=3/2,1mL)中,加入碳酸氢钠(9.7mg)。加入N-(9-芴甲氧羰基氧基)琥珀酰亚胺(Fmoc-OSu,19.5mg),于室温反应2小时,通过TLC板确认了反应结束。
(b)使用反相柱,将得到的经Fmoc化的唾液酸数为0的天冬酰胺衍生物组(中性糖天冬酰胺衍生物组)进行脱盐,然后使用HPLC进行反相色谱(梯度:0.1%三氟乙酸的乙腈溶液/0.1%三氟乙酸水溶液=16/84,3mL/min,140min),分离出糖数不同的各中性糖天冬酰胺(图1)。
(c)将反相色谱中约80分钟后洗脱的级分分取,并进行减压浓缩,然后使用HPLC进行HILIC纯化(梯度:CH
(d)将反相色谱中约92分钟后洗脱的级分分取,并进行减压浓缩,然后使用HPLC进行HILIC纯化(梯度:CH
(e)将反相色谱中约102分钟后洗脱的级分分取,并进行减压浓缩,然后使用HPLC进行HILIC纯化(梯度:CH
(f)将反相色谱中约118分钟后洗脱的级分分取,并进行减压浓缩,然后使用HPLC进行HILIC纯化(梯度:CH
<实施例3>
(a)使用填充了棉的柱,将实施例1中得到的唾液酸数为1的糖天冬酰胺组进行脱盐,并进行减压浓缩。使得到的残留物(约18.2mg)溶解于水·丙酮溶剂(水/丙酮=3/2,1mL)中,加入碳酸氢钠(5.2mg)。加入N-(9-芴甲氧羰基氧基)琥珀酰亚胺(Fmoc-OSu,10.4mg),于室温反应2小时,通过TLC板确认了反应结束。
(b)使用反相柱,将得到的经Fmoc化的唾液酸数为1的天冬酰胺衍生物组(酸性糖天冬酰胺衍生物组)进行脱盐,然后使用HPLC进行反相色谱(梯度:0.1%三氟乙酸的乙腈溶液/0.1%三氟乙酸水溶液=17/83,3mL/min,60min),将约40分钟后洗脱的包含唾液酸数为1的天冬酰胺衍生物的级分回收。
(c)将反相色谱中约40分钟后洗脱的级分分取,并进行减压浓缩,然后使用HPLC进行HILIC纯化(梯度:CH
(d)针对得到的复合型糖天冬酰胺衍生物的一部分,加入MeOH(20μL)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(250mM)、1-羟基苯并三唑一水和物(250mM),于37℃反应1小时。示出得到的复合型糖天冬酰胺的甲基化衍生物的质谱结果(图9)。确认了具有作为Neu5AcGal2Man3GlcNAc5Fuc(12糖)(1)示出的结构的复合型糖天冬酰胺。
<实施例4>
(a)使用填充了棉的柱,将实施例1中得到的唾液酸数为2的糖天冬酰胺组进行脱盐,并进行减压浓缩。针对得到的残留物(约1.2mg)的一部分,加入MeOH(20μL)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(250mM)、1-羟基苯并三唑一水和物(250mM),于37℃反应1小时。示出得到的复合型糖天冬酰胺的甲基化衍生物的质谱结果(图10)。确认了具有作为Neu5Ac2Gal2Man3GlcNAc5Fuc(13糖)示出的结构的复合型糖天冬酰胺。
<实施例5>
(a)与实施例1及实施例2同样地对约100g的IgY进行处理,得到实施例2(e)中记载的GalMan3GlcNAc5Fuc(10糖)(2)3.0mg。示出得到的复合型糖链的
<实施例6>
(a)与实施例1及实施例2同样地对约100g的IgY进行处理,得到实施例2(f)中记载的Man3GlcNAc5Fuc(9糖)9.3mg。示出得到的复合型糖链的
<实施例7>
(a)与实施例1及实施例4同样地对约100g的IgY进行处理,得到唾液酸数为2的糖天冬酰胺组174.1mg。使得到的唾液酸数为2的糖天冬酰胺组溶解于水·丙酮溶剂(水/丙酮=3/2,18mL)中,加入碳酸氢钠(117.01mg)。加入N-(9-芴甲氧羰基氧基)琥珀酰亚胺(Fmoc-OSu,191.1mg),于室温反应4小时,通过TLC板确认了反应结束。
(b)使用反相柱,将得到的经Fmoc化的唾液酸数为2的天冬酰胺衍生物组进行脱盐,然后使用HPLC进行HILIC纯化(梯度:CH
(c)针对得到的复合型糖天冬酰胺衍生物的一部分,加入MeOH(20μL)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(250mM)、1-羟基苯并三唑一水和物(250mM),于37℃反应1小时。示出得到的复合型糖天冬酰胺的甲基化衍生物(Fmoc保护体)的质谱结果(图14)。确认了具有作为Neu5Ac2Gal2Man3GlcNAc5Fuc(13糖)示出的结构的复合型糖天冬酰胺。
- 糖化反应液、糖化酶组合物、糖的制造方法及乙醇的制造方法
- 3支链型糖链天冬酰胺衍生物、该糖链天冬酰胺、该糖链和它们的制造方法
- 糖链天冬酰胺衍生物、糖链天冬酰胺和糖链以及它们的制造方法
