用于治疗便秘的活性成分组及其关键靶点组合
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于医药技术领域,具体涉及用于治疗便秘的活性成分组及其关键靶点组合。
背景技术
便秘是一种高度异质性疾病,涉及多种病理生理因素。中医药具有同样复杂的多组分、多靶点和多机制特性。此外,数千年来,中医药一直被用于治疗这种常见的人类疾病。因此,中医药在现代也是一种很有前途的便秘替代疗法。中药配方麻子仁丸(MZRW)也被称为麻仁丸,最早记录在中医经典著作《伤寒论》中。它用于治疗便秘已有2000多年的历史。MZRW由六种草药组成:火麻仁、大黄、白芍、苦杏仁、枳实、厚朴。随机对照试验(RCT)研究表明,它对各种亚型便秘有效且无副作用。291名功能型便秘患者的随机对照试验显示,与番泻叶(Senna)(Senna是美国食品药品监督管理局批准的非处方、单一成分、市场上的一线泻药)相比,它显著增加了结肠转运;它减少了整体的便秘症状的次数和严重程度,包括用力排便;它改善了通便;并显示出较好的可持续效果。
CDD-2101是一种标准化MZRW配方,根据良好生产规范(GMP)标准进行质量控制生产。我们使用CDD-2101来研究MZRW的作用机制,然而,CDD-2101治疗便秘的潜在机制尚未清楚,仍然需要对CDD-2101的作用靶点和有效成分做进一步的研究,以提高便秘疾病诊疗的精度和效果,为将CDD-2101开发成一种比目前可用的药物更有效、副作用更少的便秘治疗方法提供基础。
发明内容
有鉴于此,本发明提供了用于治疗便秘的活性成分组及其关键靶点组合,以解决背景技术部分描述的技术问题。
本申请为解决其技术问题而提供的用于治疗便秘的活性成分组为:
一种用于治疗便秘的活性成分组,该活性成分组包括大黄酸、橙皮素、芍药内酯苷、厚朴酚。
作为优选,活性成分组与便秘关键靶点组合之间为强结合,便秘关键靶点组合包括RXRA、CYP1A1、CYP1A2和PLA2G4。
作为优选,活性成分组能够调节胆汁酸分泌、类固醇激素生物合成、甘油磷脂代谢和亚油酸代谢。
作为优选,使用活性成分组治疗便秘的生物标志物为8,11,14-二十碳三烯酸、皮质醇、溶血磷脂酰乙醇胺和鹅去氧胆酸。
作为优选,活性成分组来自CDD-2101。
作为优选,CDD-2101包括火麻仁、大黄、苦杏仁、厚朴。
本申请为解决其技术问题而提供的用于治疗便秘的活性成分组的便秘关键靶点组合为:
一种用于治疗便秘的活性成分组的便秘关键靶点组合,活性成分组包括大黄酸、橙皮素、芍药内酯苷、厚朴酚;便秘关键靶点组合包括RXRA、CYP1A1、CYP1A2和PLA2G4;活性成分组和关键靶点组合之间为强结合。
有益的技术效果:
本申请提供的用于治疗便秘的活性成分组及其关键靶点组合,通过在活性成分组和便秘关键靶点组合之间建立强结合,能够通过调节胆汁酸分泌、类固醇激素生物合成、甘油磷脂代谢和亚油酸代谢,有效预防和治疗便秘。同时还公开了采用活性成分组诊断和治疗便秘的生物检测标志物。
以下结合说明书附图和具体实施方式,对本申请的技术方案和技术效果进行详细介绍。
附图说明
图1:四组小鼠在治疗后0-9小时内的粪便颗粒数量(A)及其含水量(B):
Control(对照组);Model(模型组,洛哌丁胺诱导);CDD-2101(洛哌丁胺诱导+CDD-2101治疗);Senna(阳性对照组、洛哌丁胺诱导+Senna治疗);
所有数据均表示为平均值±SEM(平均值的标准误差),n=6,*p<0.05,**p<0.01;
图2:在正离子模式(A)和负离子模式(B)质谱扫描模式下,四组小鼠粪便样本中代谢谱的PLS-DA评分图;
图3:差异代谢产物鉴定和通路分析图;
(A)模型组与对照组的代谢物火山图;
(B)CDD-2101治疗组与模型组的代谢物火山图;
(C)对照组与模型组与CDD-2101组鉴定的差异代谢物的热图;
(D)对应于热图的哑铃图:对照组与模型组(蓝色)和CDD-2101治疗组与模型组(红色);
(E)粪便中胆汁酸的靶向分析(n=6);
(F)粪便样品中差异代谢物富集的代谢通路;
图4:网络药理学分析图;
(A)CDD-2101的色谱图;
(B)Senna的色谱图;
(C)CDD-2101治疗后的粪便样本的色谱图;
(D)Senna治疗后的粪便样本的色谱图;
(E)潜在靶基因的PPI网络图;
(F)从PPI网络中鉴定的枢纽基因;
(G)前24位显著丰富的潜在靶基因生物学功能的GO分析结果;
(H)前20位显著丰富的潜在靶基因的信号通路和代谢通路的KEGG分析;
图5:综合网络分析图;
(A)化合物(代谢物)-反应-酶-基因网络图用于关键代谢物和靶标的识别(化合物为六边形,基因为圆形,关键化合物和基因为黄色节点);
(B)化合物(成分)-靶标-通路-代谢物网络图(具有不同颜色和形状的不同类别的节点);
图6:最强结合力对的详细分子对接结果;IC50是引用先前研究已报告的在体外酶试验测定中的数据;
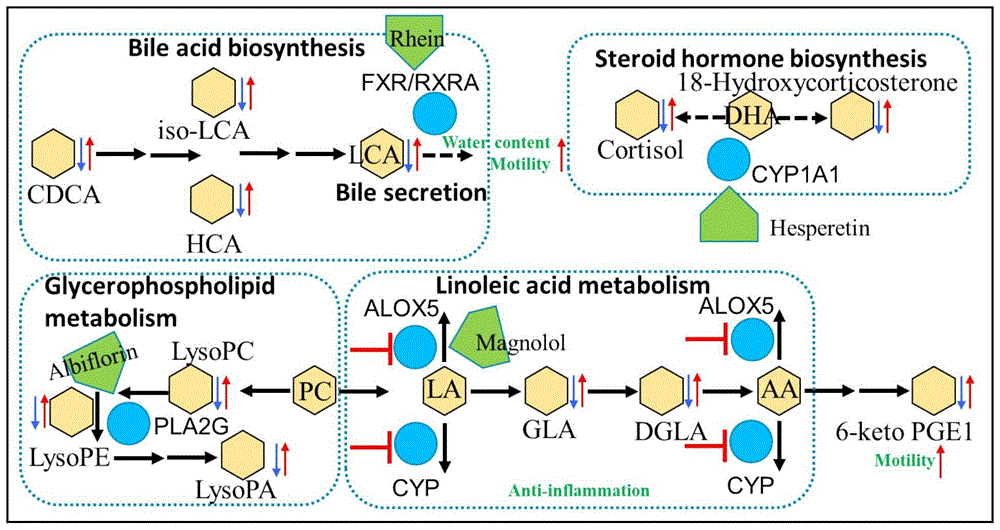
图7:四个主要成分(大黄酸、橙皮素、芍药内酯苷和厚朴酚)缓解便秘的综合代谢通路图(胆汁酸和类固醇生物合成、甘油磷脂和亚油酸代谢);代谢物附近的第一个和第二个箭头从左到右表示对照组与模型组和模型组与CDD-2101组的变化;AA(花生四烯酸)、LA(亚油酸);
图8:质量控制(QC)样品代谢组学分析中的RSD%分布;
图9:代谢组学的PLS-DA验证;
图10:(A)对照组与模型组与Senna组鉴定的差异代谢物的热图;(B)对应于热图的哑铃图,对照组对模型组(蓝色)和Senna组对模型组(红色)。
具体实施方式
以下通过具体验证实验及其理论研究对本申请公开的用于治疗便秘的活性成分组及其关键靶点组合进行详细说明。
1.材料和方法
1.1试剂和材料
由南宁培力(PuraPharm)制药有限公司生产的CDD-2101是从六种植物原料中提取的水提取物,包括火麻仁(35.7%;w/w)、大黄(17.9%;w/w),苦杏仁(17.9%;w/w)、厚朴(10.7%;w/w),白芍(8.9%;w/w),枳实(8.9%;w/w)。CDD-2101的生产工艺和质量控制与已上市的MZRW没有差别,MZRW已获得国家医疗产品管理局的批准和监督。Senna片缓泻剂购自香港万宁商店,每片的标签含量为8.6mg。盐酸洛哌丁胺购自成都曼斯特生物技术有限公司。甲醇(霍尼韦尔公司,法国)、乙腈(德山公司,韩国)和甲酸(VWR,美国)为HPLC级。辛弗林、苦杏仁苷、芍药内酯苷、柚皮苷、橙皮苷、芦荟大黄素、大黄酸、大黄素、芦荟大色素、和厚朴酚、厚朴酚和大黄酚的对照品购自中国国家食品药品监督管理研究院。大麻酰胺B、橙皮素、亚油酸、苯甲醛、苯甲酸、柚皮素、番泻叶苷A和番泻叶苷B购自ChemFace(中国)。所有标准品的纯度均≥98.0%(HPLC)。
1.2动物和洛哌丁胺诱导的急性模型
从香港中文大学实验动物服务中心获得6周龄雄性(18-22g)C57BL/6J Musmusculus。所有小鼠都被安置在一个环境受控的动物房(22±1℃;约50%相对湿度)中,有12小时的明暗循环,并喂食正常的啮齿动物饮食和水。动物护理获香港浸会大学人类及动物学科在教学及研究方面的应用委员会批准(REC/19-20/0300)。
将小鼠随机分为以下四组(每组n=6):对照组、洛哌丁胺组、洛哌丁胺+CDD-2101组和洛哌丁胺+Senna组。对照组小鼠仅口服Milli-Q水。其他组口服洛哌丁胺(2.5mg/kg体重)。CDD-2101治疗组和Senna治疗组分别基于用于便秘患者的MZRW和Senna的临床剂量给药。CDD-2101组按临床剂量30g/d/kg体重口服给药。Senna组按临床剂量每天8片给药。
1.3粪便样品的采集和制备
丢弃前5分钟内产生的所有粪便颗粒。然后收集粪便样本,并记录接下来9小时的频率。将粪便颗粒放入置于干冰中的试管中。收集后,将其储存在-80℃下以备进一步使用。根据颗粒频率计算胃肠动力。粪便分泌物量由颗粒含水率测定。
称重粪便样品,将其置于1.5mL的Eppendorf管中,冷冻干燥并匀浆。将约15mg粉状粪便加入500μL预冷的80%甲醇溶液中。然后将它们与珠粒均质化5分钟,并在-80℃下孵育4小时。将提取物离心(18000×g,4℃)10分钟。收集上清液并干燥。将100μL预冷的甲烷/水(1:1)加入上清液中,混合物涡旋5分钟,然后离心(18000×g,4℃)10分钟。收集上清液并在-80℃下储存,直到分析。
1.4代谢组学分析
代谢组学分析在1290Infinity超高效液相色谱(UHPLC)柱上进行,该柱与6546Q-TOF质谱仪(UHPLC/Q-TOF-MS)(安捷伦科技公司,美国加利福尼亚州圣克拉拉)耦合。色谱分离在40℃的ZORBAXEclipsePlusC18柱(2.1mm×100mm,1.8μm,安捷伦)上进行。流动相由0.1%甲酸水溶液作为流动相A,0.1%甲酸乙腈溶液作为流动相B组成。梯度程序如下:1%B(0-1.0分钟),1至100%B(1.0-12.5分钟),100-100%B(12.5-14.5分钟),100-1%B(14.5-14.7分钟),并保持在1%B(17.7分钟)。注射量为8μL;流速为0.4mL/min。在正离子和负离子两种模式下进行质谱分析。电喷雾电离(ESI)源设置有以下参数:气体温度,300℃;干燥气体,8升/分钟,喷雾器,45磅/平方英寸;鞘气温度,350℃,鞘气流量,8L/min;毛细管电压,3.0kV。MS1全扫描范围为m/z 80-1000。MS2全扫描参数如下:全扫描范围,m/z 40~1000;碰撞能量,分别为10、20和40eV。
1.5代谢产物鉴定和代谢途径分析
使用ProteoWizard工具集中的MSConvertGUI软件将获取的MS1原始数据转换为mzXML格式。通过将局部二次(黄土)回归模型拟合到合并QC样本的中值强度,对强度进行信号漂移和批量效应校正。对于多变量统计分析,使用SIMCA-P软件进行监督偏最小二乘判别分析(PLS-DA)。差异倍数(FC)>1.2或<0.8,p值<0.05的峰被认为是潜在的差异化合物。这些化合物的鉴定首先通过将准确的MS和MS/MS(ppm<5)与人类代谢组数据库(HMDB)进行比较来进行。有些是经过真实标准品验证的。热图使用R中的pheatmap软件包绘制。代谢通路分析由MetaboAnalyst5.0进行(https://www.metaboanalyst.ca/)基于京都基因和基因组百科全书(KEGG,https://www.genome.jp/kegg/)。
1.6网络药理学构建
首先,使用UHPLC/Q-TOF-MS对CDD-2101和粪便中的植物化学化合物组成进行表征,其参数与第1.4节所述的代谢组学分析相同。一些化学成分被选为潜在的活性化合物,是因为它们在CDD-2101和粪便中的高丰度,也经过了商业标准品的验证,并且在药理学文献中被广泛报道。其次,通过在BindingDB(
这些蛋白质被导入UniProtKB(http://www.uniprot.org/)以标准化蛋白质和相关基因的名称。通过STRING数据库建立了蛋白质-蛋白质相互作用(PPI)网络(
1.7代谢组学和网络药理学的综合网络分析
为了找到改变的关键代谢产物、相关通路及其靶标,构建并分析了各种网络。首先,将代谢组学鉴定的差异代谢产物和网络药理学预测的基因导入装有MetScape的Cytoscape中;这产生了化合物(代谢产物)-反应-酶-基因网络。进行这种构建是为了可视化代谢物、酶和基因之间的相互作用和关系。其次,将、组成的药材、活性化合物(成分)、基因、通路和代谢产物输入到Cytoscape中以获得网络。第三,通过整合两个完整的网络获得了关键的代谢产物、基因和活性化合物。
1.8分子对接
使用CBDock在线分子对接探索关键活性化合物和靶标蛋白的对接(http://clab.labshare.cn/cb-dock/php/blinddock.php)。受体蛋白的PDP文件下载自https//www.rcsb.org/,活性成分(配体)SDF文件从PubChem数据库下载(http//pubchem.ncbi.nlm.nih.gov)。所有准备好的文件都上传到CBDock网站。在确定对接口袋坐标后,使用CBdock进行分子对接和构象评分。得分越低,配体与受体的结合就越稳定,用于初步评估化合物与靶标结合的亲和力。
1.9统计分析
通过单因素方差分析进行统计分析,然后使用GraphPadPrism7(GraphPadSoftware,股份有限公司,LaJolla,CA,USA)进行Dunnett多重比较。p值<0.05被认为具有统计学意义。
2.结果
2.1CDD-2101治疗可改善便秘
通过粪便颗粒的数量和含水量评估CDD-2101和阳性对照Senna的便秘和治疗效果。如图1A所示,与对照组相比,洛哌丁胺组的粪便颗粒累积数量显著减少(p<0.05,21.5±2.7vs32.5±3.9颗粒/9h)。然而,与模型组相比,CDD-2101处理组的粪便颗粒数量显著增加(p<0.05,30.2±1.9颗粒/9h),并且与对照组的增加程度相同。与模型组相比,Senna组(阳性对照)的粪便颗粒数量略有增加。
如图1B所示,与对照组相比,洛哌丁胺组的粪便颗粒含水率(%)显著降低(p<0.005,48.2±2.1vs61.1±2.0/9h)。相反,与模型组相比,CDD-2101组的含水率显著增加(p=0.017,57.9±2.7/9h),并与对照组相比得到了相同程度的改善。此外,与包括对照组在内的其他组相比,Senna组的含水率显著较高(p<0.01,72.7±1.8/9h)。Senna组动物(16.7%)出现轻微腹泻。上述结果表明,摄入CDD-2101和Senna均可缓解便秘,然而Senna则表现出腹泻的不良反应。
2.2代谢组学分析
从所有粪便颗粒中提取了超过10000个峰。通过QC样品的性能评估代谢组学分析的稳定性和重复性。如图8所示,在正离子和负离子扫描模式下,87.1%和82.9%的代谢物的RSD%<30%。这些数据表明,目前的方法是稳定和可重复的。
为了研究粪便样本所反映的四组之间的整体代谢变化,我们进行了PLS-DA多变量统计分析。如图2所示,PLS-DA评分图显示,来自不同组的样本相互聚集,表明组间不同的代谢状况。粪便样本(正离子模式)PLS-DA中R2X、R2Y和Q2的参数分别为0.469、0.994和0.867。粪便样本(负离子模式)的PLS-DA中R2X、R2Y和Q2的参数分别为0.466、0.993和0.825(图9)。R2Y和Q2的高水平显示了PLS-DA模型对样本分类信息的良好解释能力和预测能力。这些结果表明洛哌丁胺和CDD-2101引起明显的代谢变化。
2.3差异代谢产物鉴定和通路分析
基于FC和p值的截取,模型与对照组和CDD-2101治疗组与模型组的粪便样本中分别有1305和1835个差异代谢物表达。洛哌丁胺诱导后(模型与对照组),508个代谢物下调,797个代谢物上调。CDD-2101治疗后,1057个代谢物上调(CDD-2101与模型相比),778个代谢物下调。结果在火山图中可视化(图3A-B)。
根据HMDB,对照组和模型组共鉴定出52种代谢产物,并在粪便中差异表达。CDD-2101治疗成功恢复了33种代谢产物的水平(表1)。为了可视化代谢物的变化,我们绘制了热图和哑铃图。图3C和3D显示,洛哌丁胺模型组的候选代谢产物发生了变化,CDD-2101组的大多数代谢产物发生逆转,表明CDD-2101治疗减轻了代谢紊乱。相反,与Senna组相关的代谢产物较少,代谢扰动的改善程度也与对照组不同(图10)。
值得一提的是,CDD-2101和Senna组中相对较多的胆汁酸相关代谢产物发生了显著改变。因此,我们对胆汁酸(BA)进行了有针对性的定量分析(图3E)。在测试的胆汁酸中,与对照组相比,模型小鼠组粪便中的总胆汁酸、猪胆酸(HCA)、鹅去氧胆酸(CDCA)、异石胆酸(iso-LCA)和石胆酸(LCA)减少。有趣的是,CDD-2101治疗组的水平与对照组的水平相当。尽管Senna治疗改善了胆汁酸相关代谢,但一些代谢产物水平(CDCA、iso-LCA和HCA)甚至显著高于对照组。这些结果表明,CDD-2101可以通过调节胆汁酸相关的代谢途径来预防便秘。
为了进一步探索CDD-2101调节的便秘相关代谢途径,将这些差异代谢产物导入MetaboAnalyst5.0。如图3F所示,粪便中富集了12种代谢通路,包括花生四烯酸代谢、甘油磷脂代谢、不饱和脂肪酸生物合成、亚油酸代谢、精氨酸和脯氨酸代谢、初级胆汁酸生物合成和类固醇激素生物合成等。
2.4网络药理学
网络药理学和粪便植物化学的结合策略为CDD-2101活性成分对抗便秘的潜在靶点和通路提供了新的见解。基于本发明中的植物化学分析,从CDD-2101中鉴定出17个原型化合物。据报道,它们是CDD-2101六种草药中相应的主要成分。在许多研究中,这些化合物经常在血液和粪便中检测到,并被广泛认为是具有药理活性的化合物。我们还在粪便中鉴定了四种源自这些原型成分的代谢产物。因此,共有21种化合物(原型+代谢物)被选为网络药理学研究的候选化合物(图4A和C,表2)。我们发现,一些生物利用度相对较低的原型成分,即芍药苷、芍药内酯苷、苦杏仁苷、橙皮苷和柚皮苷,可以代谢为苯甲酸、苯甲醛、橙皮素和柚皮素发挥生物活性,这与以前的研究一致。番泻苷A和B(Senna的主要成分)可以代谢为大黄酸,大黄酸也是CDD-2101的主要成分(图4A-D,表2)。
表2 CDD-2101和Senna的主要成分,从CDD-2101和Senna中选择的成分作为网络药理学研究的候选化合物。
斜体字表示相应草药原型成分的代谢产物。HMR:火麻仁;DH:大黄;BS:白芍;KXR:苦杏仁;ZS:枳实;HP:厚朴。
随后,我们从BindingDB和STITCH中收集了CDD-2101候选活性成分的122个靶标,并从GeneCards数据库中收集了5272个与便秘有关的靶标。经过匹配分析,鉴定出86个CDD-2101化合物为对抗便秘的潜在靶点。此外,为了选择CDD-2101抗便秘的枢纽基因,我们通过Cytoscape构建了PPI网络。图4E给出了83个靶标内所有关系的视图(其他三个基因未连接)。我们使用CytoHubba计算关系度。结合10种计算方法的得分,前10个基因被认为是CDD-2101对抗便秘的枢纽基因(RXRA、CYP1A1、PLA2G4、PTGS2、ACHE、ESR1、CYP1A2、CYP19A1、CYP2B6、PPARG)(图4F,表3)。
表3 CytoHubba对枢纽基因的评价。
为了确定潜在靶点的便秘缓解和肠道保护功能,我们进行了GO和KEGG通路富集分析。GO分析中最重要的生物功能成分是脂肪酸、脂质、胆固醇、类固醇和与生物过程相关的激素(图4G)。根据KEGG富集分析(图4H),受显著影响的通路主要集中在类固醇激素生物合成、花生四烯酸代谢、视黄醇代谢、胆汁分泌、叶酸生物合成、亚油酸代谢、色氨酸代谢、PPAR信号通路、内分泌抵抗、IL-17信号通路和甘油磷脂代谢。显然,网络药理学预测的途径包括了代谢组学富集的大多数通路。通路分析结果的高度一致性使我们能够建立一个全面的网络分析平台,以破译CDD-2101对抗便秘的关键靶点和机制。
2.5代谢组学和网络药理学的综合分析
为了全面了解CDD-2101治疗便秘的机制,我们基于代谢组学分析和网络药理学结果构建了两个完整的相互作用网络,并通过Cytoscape进行了匹配。首先,基于差异代谢产物和潜在靶标,化合物-反应-酶-基因网络显示RXRA、CYP1A1、CYP1A2和PLA2G4可能是关键靶标,8,11,14-二十碳三烯酸、18-羟基皮质酮、皮质醇、LysoPE(20:4(8Z,11Z,14Z,17Z)/0:0)(LysoPE)和CDCA可能是CDD-2101调节的关键代谢产物(图5A)。其次,基于化合物-靶标-通路-代谢物网络,我们发现胆汁分泌、类固醇激素生物合成、甘油磷脂代谢和亚油酸代谢可能是关键途径,其中芍药内酯苷、大黄酸、橙皮素和厚朴酚是关键活性成分(图5B)。最后,通过匹配这两个综合网络,我们发现了可能在CDD-2101治疗便秘效果中发挥重要作用的代谢产物、靶标、通路和成分。表4中对它们进行了总结。需要进一步验证。
表4 CDD-2101的关键活性成分、靶标、代谢产物和通路。
橙皮素:CDD-2101中橙皮苷的代谢产物类型;
大黄酸:来源于Senna中的代谢型,而CDD-2101中的原型化学成分。
2.6分子对接验证
为了进一步研究关键活性化合物和靶标之间相互作用的可能性,我们进行了分子对接研究(图6)。通常,结合的亲和力低于-5kJ/mol被认为表明良好的相互作用。RXRA的对接分析表明,大黄酸在活性位点与E260、ILE318、VAL259和R371发生氢键相互作用,结合能为-7.6kJ/mol。在与CYP1A1的相互作用中,橙皮素与GLY459、PHE381、VAL382、THR385、ILE386发生氢键相互作用,结合能为-9.3kJ/mol。在与PLA2G4的相互作用中,芍药内酯苷与ASP93、ALA94、ASN95、TYR96形成氢键,能量为-6.4kJ/mol。在与CYP1A2的相互作用中,厚朴酚与THR224、ALA370、ARG372、GLU374形成氢键,能量为-8.1kJ/mol。这些对接结果表明活性化合物和靶标之间具有高亲和力。事实上,体外酶试验测定已经显示出它们的结合具有很强的亲和力。
3.讨论
便秘很常见,但很难治疗,更不用说治愈了。研究表明,其病因与多种病理生理因素有关。某些中药配方已经成功地治疗了便秘,也许是因为它包含针对多个方面的多种成分。到目前为止,科学还无法分离、鉴定和理解中草药的多组分/多靶标方面。代谢组学和网络药理学是可以用于这一目的的两个强大的新工具。许多使用粪便代谢组学的研究发现,与对照组相比,便秘的人类表型和动物在代谢谱和代谢生物标志物水平方面都存在差异。在这里,我们在粪便中鉴定了33种显著的差异代谢产物,以及它们的相关通路。网络药理学极大地改进了CDD-2101治疗便秘的代谢物筛选,并解释了相关的生化机制。通过新的综合网络分析方法,将代谢组学与网络药理学相结合(图7),我们发现源自草药中的四种主要活性成分(大黄酸、橙皮素、芍药内酯苷和厚朴酚)与四个关键靶标(分别为RXRA、CYP1A1、CYP1A2和PLA2G4)强结合,调节相关代谢途径(分别为胆汁酸分泌、类固醇激素生物合成、甘油磷脂代谢和亚油酸代谢)以缓解便秘,关键代谢产物(8,11,14-二十碳三烯酸、皮质醇、LysoPE和CDCA)可作为诊断和治疗的生物标志物。该策略为验证两种方法的结果提供了一个可行的解决方案。筛选其他天然药物开发中的代谢产物和靶标也是可行的。
先前的研究已经证实,便秘或腹泻可能是由胆汁酸异常输送到结肠引起的。胆汁酸在调节粪便含水量方面具有重要作用。例如,一些胆汁酸,如脱氧胆酸,会增加结肠中水和电解质的分泌。其他胆汁酸可以影响结肠运动活动。例如,次级胆汁酸水平降低会减少肠嗜铬细胞释放5-羟色胺,从而影响肠道运动从而诱发便秘。在此,我们的代谢组学结果显示,与对照组相比,模型组的次级胆汁酸(如LCA)和总胆汁酸均显著降低。相反,CDD-2101治疗组的胆汁酸总量显著增加。网络药理学表明,CDD-2101中的一些活性成分可能主要作用于靶RXRA,调节胆汁酸代谢。这些化合物包括大黄酸、柚皮素、辛弗林和芍药内酯苷。番泻叶中的主要活性成分(番泻叶苷)已被证明在结肠中代谢为大黄酸。因此,CDD-2101和Senna可能主要作用于RXRA调节胆汁酸代谢以治疗便秘。在肝脏中,FXR/RXR下调CYP7A1的表达,导致胆汁酸合成和分泌减少。分子对接表明,在这些活性成分中,大黄酸对RXRA的亲和力最强。先前的研究表明,大黄酸与FXR/RXR具有良好的结合活性,可增加胆汁酸合成和胆汁分泌。CDD-2101治疗后,与初级胆汁酸合成、次级胆汁酸合成和胆汁分泌相关的代谢产物恢复正常。然而,一些过量的胆汁酸可能会引起腹泻,这可能解释了Senna组轻微腹泻的原因,其中CDCA和iso-LCA水平显著高于对照组。
类固醇激素水平降低与严重便秘有关。在模型组中,类固醇激素生物合成途径的下游代谢产物皮质醇和18-羟基皮质酮下调,而在CDD-2101中被成功恢复正常水平。类固醇激素来源于胆固醇。在孕酮的生物合成中,胆固醇首先通过双功能酶复合物转化为孕烯醇酮。孕激素和雌激素与便秘的发展有关。据报道,橙皮素、厚朴酚和柚皮素与CYP1A1酶结合,调节类固醇激素生物合成,以缓解便秘。柚皮苷和橙皮苷是CDD-2101中的主要化合物,已被证明在结肠中分别代谢为柚皮素和橙皮素。因此,我们可以得出结论,原型化合物及其代谢产物类型可以用于调节类固醇激素水平来治疗便秘。
CDD-2101组鉴定的代谢产物分为溶血磷脂酸(LysoPA)、溶血磷脂酰胆碱(LysoPC)和溶血磷脂酰乙醇胺(LysoPE);三者均与甘油磷脂代谢密切相关。这些代谢产物,包括其前体磷脂酰胆碱,在胃肠道粘液屏障中含量丰富,其疏水特性被认为在维持粘液完整性方面发挥作用。我们发现,芍药内酯苷和厚朴酚刺激胞浆磷脂酶A2(cPLA2,PLA2G4)磷酸化。这种刺激,再加上橙皮苷和芦荟大黄素与ACHE酶的结合,可以有效调节这一途径,保护肠道粘液屏障。
大量证据表明,亚油酸代谢与便秘及相关治疗密切相关。然而,具体过程和机制尚不清楚。在这里,我们发现γ-亚麻酸和二高-γ-亚麻酸酯(其下游代谢产物)在模型组中显著下调,在CDD-2101组中上调。这两种代谢产物促进M2巨噬细胞的产生,并抑制IL-6、IL-1β和TNF-α的产生和作用,这对确定抗炎事件的最终状态至关重要。此外,它们可以被引入花生四烯酸代谢,并最终代谢为6-酮前列腺素E1(6-酮PGE1),这是一种稳定的前列环素(PGI2)代谢产物。这种代谢产物与PGI2一样,可以促进胃肠平滑肌收缩,增加运动能力,缓解便秘。需要注意的是,LA和AA是这两种代谢途径的中枢节点。有趣的是,厚朴酚已被证明在体外和体内强烈抑制CYP1A2和ALOX5酶,这可能解释了CDD-2101治疗如何成功恢复代谢产物。
我们还使用综合代谢组学-网络药理学平台对Senna进行了比较研究,分析了其代谢产物、相关通路、靶标和活性成分。发现,主要成分番泻叶苷A和B被代谢为活性成分大黄酸,大黄酸可能与FXR/RXRA二聚体结合,调节胆汁酸相关代谢途径,以缓解便秘,就像CDD-2101一样。差异代谢产物和治疗指数支持了这一点。然而,Senna组也出现了一些不良反应(轻微腹泻),相关胆汁酸代谢产物的恢复率高于对照组。先前的研究已经证实,便秘或腹泻可能是由胆汁酸异常输送到结肠引起的。用单一成分和单一靶点治疗便秘可能会导致相关通路的过度调节。总的来说,用多种成分治疗便秘,针对多个靶点,应该意味着对相关通路进行更好的稳态控制。
由上述描述可知,本发明首先开发了一种基于代谢组学和网络药理学的新的综合方法来阐明复杂天然药物的生化机制。然后,使用该方法研究了中药配方的标准化生产版本CDD-2101。发现配方中草药成分的四种主要活性成分与四个关键靶点紧密结合。这已经通过我们的分子对接和以前的体外和体内研究得到了验证。第三,调节胆汁酸分泌、类固醇激素生物合成、甘油磷脂代谢和亚油酸代谢以缓解便秘。最后,将CDD-2101与市场一线单配分泻药Senna进行了比较,发现CDD-2101更有效,副作用更少。代谢组学结果表明,CDD-2101的多因子活性解释了其优越的疗效。
以上结合说明书附图和具体实施例对本发明的技术方案和技术效果进行了详细阐述,应该说明的是,说明书中公开的具体实施方式仅是本发明较佳的实施案例而已,领域的技术人员还可以在此基础上开发出其他的实施案例;任何不脱离本发明创新理念的简单变形和等同替换均涵盖于本发明,属于本专利的保护范围。
- 一种用于治疗便秘的中药活性成分组合物
- 抗感染活性成分组合以及它们用于局部治疗脚趾甲和手指甲真菌感染的应用
