水解蛋白乳制品中残留蛋白的检测方法
文献发布时间:2024-04-18 19:52:40
技术领域
本发明属于食品检测技术领域,具体涉及水解蛋白乳制品中残留蛋白的检测方法。
背景技术
母乳对于0~12月龄的婴儿来说是最理想的食物,其包含了婴儿生长发育所需要的几乎所有营养物质,以及各种生物活性成分和免疫因子。母乳不仅能够满足婴幼儿生长的营养需求,同时还能够增强新生儿的免疫力。而当出现因各种原因不能母乳喂养的情况时,如疾病困扰、乳汁分泌不足或无乳汁分泌等,则需要选择其他营养物质来代替母乳。
牛乳因含有较丰富的蛋白质、脂肪、矿物质、维生素等常被人们选择,尤其是牛乳中的必需氨基酸和非必需氨基酸均为人体生长发育所需要的,且牛乳蛋白消化率远远高于植物蛋白质,是完全蛋白质,因此以牛乳为原料的婴儿配方乳粉成为了母乳的最佳替代品。但是约有3%~4%的婴幼儿对牛奶蛋白过敏(Cow’s Milk Protein Allergy,CMPA),其主要表现为胃肠道反应,如呕吐、肠绞痛和难治愈性腹泻等,亦有部分CMPA患儿可出现血管水肿、荨麻疹、湿疹、鼻炎、瘙痒、体重减轻及哮喘甚至昏厥等症状,该过敏反应对小肠黏膜和肝功能的损伤也有报道。
牛奶含有酪蛋白、α-乳白蛋白、β-乳球蛋白、牛血清白蛋白及免疫球蛋白等常见的蛋白质,它们对婴儿来说是异种蛋白,有可能成为过敏原,可致变态反应。现市场上为提高营养成分常会在婴幼儿牛奶配方中添加大量乳清蛋白(>33%),使过敏问题更加突出。引用文献1公开了牛乳中主要的致敏蛋白的致敏机理,这些异种蛋白均为大分子蛋白质且构象完整,通常含有能被机体免疫系统识别的构象表位或线性表位而表现出致敏性,其致敏原因与其分子量也有一定的关系。因此,改变食物中的蛋白质构象和分子量,从而降低食物中蛋白质的致敏性对防治食物过敏十分重要。引用文献2公开了常用的降低牛奶蛋白致敏性的方法,例如将牛奶蛋白加热到80℃以上会破坏蛋白质的球状结构,从而破坏构象表位,而并不破坏线性表位。酶水解是目前最有效的降低致敏性的方法。根据所用酶的类型和水解条件,可以获得具有或多或少致敏性的不同长度的肽。
食物蛋白过敏的病人一般采用特殊医学用途配方食品(以下简称“特医食品”),是指为了满足进食受限、消化吸收障碍、代谢紊乱或特定疾病状态人群对营养素或膳食的特殊需要,专门加工配制而成的配方食品,须在医生或临床营养师指导下食用。特医食品能为临床病人提供营养支持,在国内外广受关注。
根据国家标准GB 25596—2010,常见的特殊医学用途婴儿配方食品的产品类别包括乳蛋白部分水解配方、乳蛋白深度水解配方或氨基酸配方以及氨基酸代谢障碍配方。其中乳蛋白部分水解配方食品的设计目标人群就是对乳蛋白过敏存在高风险的婴幼儿,其主要通过加热或酶水解手段,将配方中的乳蛋白分子加工变成小分子乳蛋白、肽段和氨基酸,从而一方面可以降低原大分子乳蛋白的致敏性,另一方面利用小分子乳蛋白可以帮助建立耐受性,进而提高消化率。乳蛋白深度水解配方或氨基酸配方食品的设计目标人群是对食物蛋白过敏的婴儿,其通过加工已不含有完整的食物蛋白,通常以氨基酸的形式为婴幼儿提供营养。目前,水解蛋白配方食品的研发解决了婴幼儿对牛乳蛋白过敏或不耐受的问题,同时,水解后的乳清蛋白还具有抗氧化等作用,水解蛋白配方食品的优势及其功能性普遍得到了消费者的认可,市场也在不断扩大。
在《特殊医学用途配方食品注册管理办法》出台后,特医食品市场开始走向正规化,国家市场监督管理总局审评中心明确要求乳蛋白水解配方食品提交审核材料中需要明确残留蛋白的检验方法及证明材料。但是国内外现有方法均难以检测此项目,即无法评价水解蛋白配方乳粉生产过程及成品水解程度及效果,相应的,对于乳蛋白水解配方食品也缺乏有效的质量控制手段。
此外,毛细管电泳是一类以毛细管为分离通道、以高压直流电场为驱动力的液相分离技术。其可利用不同蛋白质在缓冲液条件下的迁移速度的不同而实现蛋白质分离检测。其中,十二烷基硫酸钠毛细管电泳法是在十二烷基硫酸钠聚丙烯酰胺凝胶电泳的基础上演变而来的毛细管电泳技术,其目前主要是作为抗体药物纯度检测的方法。例如,引用文献3公开了一种优化的十二烷基硫酸钠毛细管凝胶电泳纯度检测方法及其应用。所述检测方法具备抗体纯度检测重复性好、准确度高、操作方便等优点,同时能够节省方法开发的时间和费用等,提高了抗体纯度检测的效率和准确率,为抗体制备和分析提供了一种高效优质的检测方法。
然而目前,利用毛细管电泳分离或检测水解蛋白乳制品中的残留蛋白的方法尚未有过公开报道。
引用文献:
引用文献1:王明礼,钱珊珊,李艾黎,姜瞻梅,侯俊财.降低牛乳致敏性方法的研究进展[J].中国乳品工业,2021,49(07):25-31;
引用文献2:FritschéR.Animal models in food allergy:assessment ofallergenicity and preventive activity of infant formulas.Toxicol Lett.2003Apr11;140-141:303-9;
引用文献3:CN114397445A。
发明内容
发明要解决的问题
基于以上现有技术中存在的,例如现有技术无法有效评价水解蛋白乳制品生产过程及成品水解程度效果等方面的问题,本发明旨在提供一种水解蛋白乳制品中残留蛋白的检测方法,根据乳蛋白水解前后分子量的不同,利用十二烷基硫酸钠毛细管电泳法有效的分析水解样品中的乳蛋白的存留情况,尤其适合检测水解蛋白配方乳粉中的残留蛋白。
用于解决问题的方案
本发明发现,可以通过以下的技术方案来解决上述技术问题:
[1].一种水解蛋白乳制品中残留蛋白的检测方法,其中,所述方法包括如下步骤:
样品制备的步骤:定容所述水解蛋白乳制品,并与已知质量浓度并且已知分子量的内标物混合得到混合物,提取所述混合物中的蛋白组分,并使用碳酸钠-碳酸氢钠缓冲溶液定容,得到含有蛋白组分的成分(A1);
样品处理的步骤:将所述成分(A1)与十二烷基硫酸钠混合,获得含有变性蛋白组分的成分(A2),将所述成分(A2)与荧光探针混合进行荧光探针标记,随后去除未标记的荧光探针并置换缓冲溶液为磷酸盐缓冲溶液,得到含有蛋白组分的成分(A);
毛细管电泳步骤:针对所述成分(A)进行毛细管凝胶电泳,检测荧光数据。
[2].根据[1]所述的方法,其中,所述蛋白组分包括水解蛋白和存在或不存在的残留蛋白。
[3].根据[1]或[2]所述的方法,其中,所述碳酸钠-碳酸氢钠缓冲溶液的pH值为10.0±0.5,所述磷酸盐缓冲溶液的pH为7.8±0.2。
[4].根据[1]~[3]中任一项所述的方法,其中,所述内标物的分子量大小为10000Da。
[5].根据[1]~[4]中任一项所述的方法,其中,所述荧光探针包括荧光素5-异硫氰酸酯。
[6].根据[1]~[5]中任一项所述的方法,其中,所述提取所述水解蛋白乳制品中的蛋白组分的操作以及所述去除未标记的荧光探针的操作均通过超滤的方式进行。
[7].根据[6]所述的方法,其中,所述超滤装置的截留分子量大于等于3000Da。
[8].根据[1]~[7]中任一项所述的方法,其中,在所述毛细管电泳步骤中,使用毛细管电泳仪结合激光诱导荧光检测器进行检测分析。
[9].根据[1]~[8]中任一项所述的方法,其中,所述荧光数据包括残留蛋白的激光诱导的荧光强度。
[10].根据[1]~[9]中任一项所述的方法,其中,所述方法的蛋白检出限小于0.01mg/kg。
发明的效果
通过以上技术方案的实施,与现有技术相比,本发明取得了以下有益效果:
(1)本发明使用十二烷基硫酸钠毛细管电泳分析水解蛋白乳制品中的蛋白水解程度,根据水解蛋白与残留蛋白之间的分子量差异,通过在样品中添加已知分子量的内标物,可有效区分不同分子量的蛋白质,从而定量检测水解蛋白乳制品中的残留蛋白。
(2)本发明利用荧光探针,例如荧光素5-异硫氰酸酯对蛋白质进行衍生标记,并结合激光诱导荧光检测器对标记后的蛋白质样品进行分析,相比UV检测器和PDA检测器等,可以有效区分不同分子量的蛋白质。
(3)本发明提供的检测方法灵敏度高,检出限小于0.01mg/kg,可以高效鉴定出水解蛋白乳制品中极低含量的蛋白残留,降低产品致敏风险。
本发明提供的水解蛋白乳制品中残留蛋白的检测方法可以高效鉴定水解蛋白乳制品中的蛋白质水解程度,以对工艺过程和产品质量进行有效监控。
附图说明
图1:BSA标准品的十二烷基硫酸钠毛细管凝胶电泳图谱,其中横坐标为时间单位Minutes,纵坐标为荧光单位RFU。
图2:浓缩乳清蛋白粉原料样品十二烷基硫酸钠毛细管凝胶电泳图谱,其中横坐标为时间单位Minutes,纵坐标为荧光单位RFU。
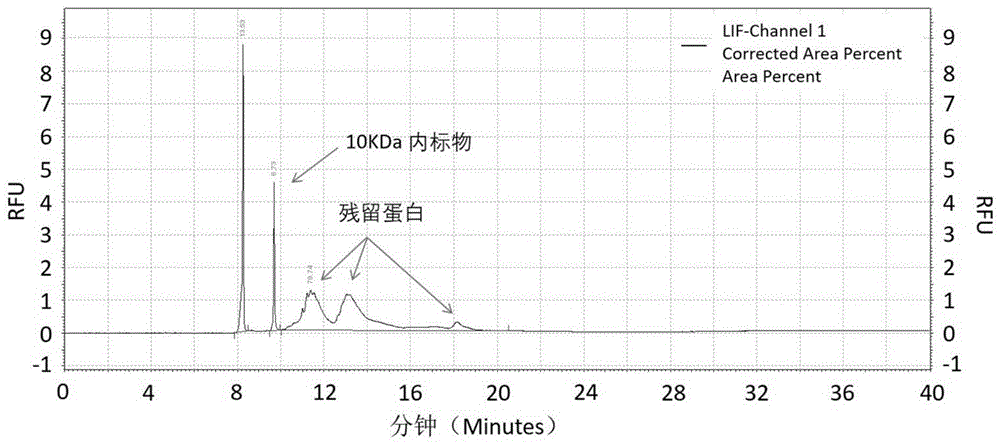
图3:水解蛋白样品的十二烷基硫酸钠毛细管凝胶电泳图谱,其中横坐标为时间单位Minutes,纵坐标为荧光单位RFU。
图4:对比例1中未添加10000Da内标的样品、使用PDA检测器的十二烷基硫酸钠毛细管凝胶电泳图谱,其中横坐标为时间单位Minutes,纵坐标为吸光度单位AU。
图5:对比例2中使用UV检测器时样品的十二烷基硫酸钠毛细管凝胶电泳图谱,其中横坐标为时间单位Minutes,纵坐标为吸光度单位AU。
具体实施方式
以下对本发明的实施方式进行说明,但本发明不限定于此。本发明不限于以下说明的各构成,在发明请求保护的范围内可以进行各种变更,而适当组合不同实施方式、实施例中各自公开的技术手段而得到的实施方式、实施例也包含在本发明的技术范围中。
除非另有说明,本发明术语具有如下含义:
在本发明中,使用“数值A~数值B”表示的数值范围是指包含端点数值A、B的范围。
在本发明中,使用“以上”或“以下”表示的数值范围是指包含本数的数值范围。
在本发明中,使用“可以”表示的含义包括了进行某种处理以及不进行某种处理两方面的含义。
在本发明中,使用“任选”或“任选地”表示某些物质、组分、执行步骤、施加条件等因素使用或者不使用。
在本发明中,如没有特殊说明,所使用的“常温”通常指的23±2℃时的温度。
在本发明中,所使用的单位名称均为国际标准单位名称,并且如果没有特别声明,所使用的“%”均表示重量或质量百分含量。
在本发明中,术语“约”或“基本上”、“实质上”可以表示:一个值包括测定该值所使用的装置或方法的误差的标准偏差。用以界定本发明的数值范围与参数皆是约略的数值,此处已尽可能精确地呈现具体实施例中的相关数值。然而,任何数值本质上不可避免地含有因前述测试装置或方法所致的标准偏差。因此,除非另有明确的说明,应当理解本发明所用的所有范围、数量、数值与百分比均经过“约”的修饰。在此处,“约”通常是指实际数值与理论模型或理论数据或目标值的标准偏差在3%、优选为2%、更优选为1%范围以内。
在本发明中,所提及的“一些具体/优选的实施方案”、“另一些具体/优选的实施方案”、“实施方案”等是指所描述的与该实施方案有关的特定要素(例如,特征、结构、性质和/或特性)包括在此处所述的至少一种实施方案中,并且可存在于其它实施方案中或者可不存在于其它实施方案中。另外,应理解,所述要素可以任何合适的方式组合在各种实施方案中。
在本发明中,使用“D”或“Da”表示分子量的单位“Dalton”,即“道尔顿”。
在本发明中,术语“水解蛋白”是指已经水解或者分解成为更短的肽片段和/或氨基酸的蛋白,当蛋白质氨基酸链中的一个或多个肽键断裂时,蛋白水解。肽键的断裂可以是有意完成的(即蛋白质经过了例如酶、酸、碱或者其组合处理等以目标是使肽键断裂的方式的加工或者处理),也可以是在制造过程中无意或者附带出现(例如由于加热或者剪切而附带出现)。
在本发明中,对于术语“残留蛋白”的定义可参见欧洲食品安全局(EFSA)技术说明https://doi.org/10.2903/j.efsa.2020.6304,残留蛋白是指经过或未经过肽键断裂的方式有意的加工或者处理的蛋白质,残留蛋白在水解蛋白乳制品中的含量可近似为分子量分布中>10000Da的百分含量,而水解蛋白(肽)在水解蛋白乳制品中的含量可近似为分子量分布中<10000Da的百分含量。
另外,除非另有定义,本发明所用的其他的技术和科学术语具有与本发明所属技术领域中的普通技术人员所通常理解的相同含义。
本发明主要是基于如下见解而得到:
乳蛋白中的主要组分包括α-乳白蛋白、β-乳球蛋白、α-酪蛋白、β-酪蛋白、κ-酪蛋白、血清白蛋白、乳铁蛋白和免疫球蛋白G等,上述蛋白分子量均大于10000Da,为了制备水解蛋白乳制品(例如水解蛋白配方乳粉)需要对上述乳蛋白进行水解,水解后蛋白平均分子量将小于10000Da,因此可以利用10000Da作为内标,利用十二烷基硫酸钠毛细管电泳法分析水解样品中是否含有分子量大于10000Da的乳蛋白残留。
更进一步地,本发明利用十二烷基硫酸钠毛细管凝胶电泳分析水解蛋白乳制品中残留蛋白的原理是样品经过超滤处理后,分子量10000Da以上的蛋白及肽被保留,利用10000Da作为内标分界点,用荧光探针荧光素5-异硫氰酸酯对保留的蛋白质及肽进行衍生标记,结合激光诱导荧光检测器(LIF检测器)对标记后的蛋白质样品进行分析。荧光素5-异硫氰酸酯标记蛋白和/或肽样品的反应原理如下:
(水解蛋白乳制品)
本发明所述的水解蛋白乳制品可以是乳蛋白部分水解配方食品(即乳蛋白经加工分解成小分子乳蛋白、肽段和氨基酸)、乳蛋白深度水解配方食品或氨基酸配方食品(即配方中不含食物蛋白)。
另一方面,本发明所针对的水解蛋白乳制品,原则上没有限制,从鉴定方法适用的普遍性角度考虑,本发明的水解蛋白乳制品可以为乳粉制品、液体乳制品或乳清制品。对于乳制品的乳源,本发明没有特别的限制,例如可以为牛乳来源、羊乳来源等,优选为牛乳来源的乳制品。
(水解蛋白乳制品中残留蛋白的检测方法)
本发明提供了一种水解蛋白乳制品中残留蛋白的检测方法,其包括如下步骤:
样品制备的步骤:定容所述水解蛋白乳制品,并与已知质量浓度并且已知分子量的内标物混合得到混合物,提取所述混合物中的蛋白组分,并使用碳酸钠-碳酸氢钠缓冲溶液定容,得到含有蛋白组分的成分(A1);
样品处理的步骤:将所述成分(A1)与十二烷基硫酸钠混合,获得含有变性蛋白组分的成分(A2),将所述成分(A2)与荧光探针混合进行荧光探针标记,随后去除未标记的荧光探针并置换缓冲溶液为磷酸盐缓冲溶液,得到含有蛋白组分的成分(A);
毛细管电泳的步骤:针对所述成分(A)进行十二烷基硫酸钠毛细管凝胶电泳法分离,检测荧光数据。
样品制备的步骤
为了方便后续统计残留蛋白的含量,可以对所述水解蛋白乳制品进行定容,以确定其蛋白浓度。
进一步地,为了后续检测时能够准确区分水解蛋白与残留蛋白,还需要向水解蛋白乳制品中加入已知质量浓度的已知分子量的内标物,从而得到混合物。在一些具体的实施方案中,所述内标物的分子量小于所述蛋白组分中的所有残留蛋白的分子量且大于所有水解蛋白的分子量;优选地,考虑到上述残留蛋白的分子量,可以选用分子量为10000Da的内标物。
进一步地,为了检测水解蛋白乳制品中的残留蛋白,从提高检测准确性以及检测的便利性角度考虑,需要对所述混合物中的蛋白组分进行提取。
本发明对所述蛋白组分的提取方法不做特别限定,在一些具体的实施方案中,可以通过超滤的方式进行蛋白组分提取。在一些更具体的实施方案中,通过超滤法可以提取分子量大于等于3000Da,优选大于等于6000Da,更优选大于等于10000Da的蛋白组分。
在一些实施方案中,通过上述提取步骤得到的所述蛋白组分包括水解蛋白和可能存在的一种或多种残留蛋白。其中,残留蛋白主要包括未经水解的酪蛋白和乳清蛋白,酪蛋白主要包括α-酪蛋白、β-酪蛋白和κ-酪蛋白等,乳清蛋白主要包括α-乳白蛋白、β-乳球蛋白、血清白蛋白、乳铁蛋白和免疫球蛋白等。
在一些具体的实施方案中,可以用水提取上述蛋白组分。示例性的,如果水解蛋白乳制品为液体制品可以利用水稀释后进行蛋白提取,如果水解蛋白乳制品为奶粉等固体制品,可以利用水溶解后进行蛋白提取。
为了方便后续荧光探针的标记处理同时方便后续统计残留蛋白的含量,可以利用碳酸钠-碳酸氢钠缓冲溶液定容蛋白组分,并且可以控制其pH值为10.0±0.5。
样品处理的步骤
由于本发明是根据水解蛋白与残留蛋白的分子量不同来检测残留蛋白的,因此,需要避免蛋白的二、三级结构对毛细管电泳产生影响,典型的,在毛细管电泳前需要对通过样品制备的步骤获得的成分(A1)中的蛋白组分进行变性。在一些实施方案中,蛋白组分的变性利用十二烷基硫酸钠进行,十二烷基硫酸钠是阴离子去污剂,作为变性剂和助溶试剂,它能断裂分子内和分子间的氢键,使分子去折叠,破坏蛋白分子的二、三级结构。此外,十二烷基硫酸钠和蛋白结合后,还会使蛋白组分所带的负电荷远超蛋白原有的电荷量,消除了不同分子间的电荷差异和结构差异。
进一步地,为了后续能够准确定量不同分子量的蛋白质,并考虑到检测分析操作的便利性,在一些实施方案中,还包括对蛋白组分进行荧光探针标记的处理步骤。在一些具体的实施方案中,所述荧光探针包括荧光素5-异硫氰酸酯,其可以和蛋白质、短肽或氨基酸中的氨基发生反应,使得蛋白组分带有荧光基团,在特定的激发光下可发出明亮的荧光。
进一步地,为了降低未结合的荧光探针等物质对后续检测过程产生影响,利用超滤法去除所有未结合的荧光探针。在一些具体的实施方案中,所述超滤的装置的截留分子量大于等于3000Da,优选超滤装置的截留分子量与样品制备的步骤中提取蛋白组分时使用的超滤装置的截留分子量相同。
为了后续毛细管电泳操作的便利性,可以在超滤去除未标记的荧光探针的同时,将蛋白组分的所在体系置换为磷酸盐缓冲溶液,并可以控制其pH值为7.8±0.2。
在一些实施方案中,最终得到的待检测的成分(A)为一种水分散体系,其中包含经过变性及荧光探针标记的蛋白组分和内标物。
毛细管电泳的步骤
本发明对毛细管电泳的设备没有特别限制,可以从本领域现有的设备中进行合理选择。在一些实施方案中,本发明使用毛细管电泳仪结合激光诱导荧光检测器进行检测分析。可以选用的毛细管电泳仪包括SCIEX PA800Plus等。对于毛细管,优选使用非涂层毛细管,有效长度为10~30cm。对于激光诱导荧光检测器的激发波长和发射波长主要取决于待检测的荧光基团,示例性的,激发波长为460~500nm,发射波长为550~570nm。
对于毛细管电泳的具体条件,本发明不做特别的限制,例如电泳电压可以为10~30kV,电泳时间可以为20~50min,电泳时可以控制毛细管温度为10~50℃。
对于检测得到的荧光数据,可以使用激光诱导的荧光图谱进行表征。进一步地,如果水解蛋白乳制品中存在残留蛋白,荧光图谱中会出现保留时间大于内标物保留时间的峰。相应的,根据内标物的上机浓度及其峰面积,残留蛋白的峰面积及其上机浓度,以及样品用量,即可定量检测残留蛋白。
本发明利用BSA作为残留蛋白对照品进行实验方法检出限的确定,通过实验研究,本发明提供的水解蛋白乳制品中残留蛋白的检测方法的蛋白检出限小于0.01mg/kg BSA。
实施例
以浓缩乳清蛋白为原料,经蛋白酶解工艺处理后变为水解蛋白配方蛋白原料,添加碳水化合物、维生素及微量元素等营养物质作为水解配方奶粉的非蛋白来源,处理后分子量分布范围为1~500Da占比3-5%,500~1000Da占比10-12%,1000~3000Da占比18-22%,3000~5000Da占比30-35%,5000~10000Da占比30-35%,>10000Da占比0%,此样品作为水解蛋白样品。以下将通过具体的十二烷基硫酸钠毛细管电泳分析实例对本发明做出进一步的说明。
1 试剂和材料
1.1试剂
除非另有规定,仅使用分析纯试剂,纯水为GB/T 6682规定的一级水。
1.1.1碳酸氢钠(NaHCO
1.1.2碳酸钠(Na
1.1.3磷酸二氢钠(NaH
1.1.4磷酸氢二钠(Na
1.1.5十二烷基硫酸钠(SDS):CAS No.151-21-3,来源于sigma-Aldrich P/NL3771。
1.1.6荧光素5-异硫氰酸酯:CAS No.3326-32-7,来源于sigma-Aldrich F7250-50MG。
1.1.7二甲基亚砜(DMSO):来源于Sigma-Aldrich P/N 154938。
1.1.8 10000Da内标:5mg/mL,来源于AB SCIEX P/N A26487。
1.1.9牛血清白蛋白(BSA):CAS No.9048-46-8,来源于sigma-Aldrich P/NA1933。
1.1.10三羟甲基氨基甲烷(Tris)。
1.1.11硼酸(H
1.1.12葡聚糖:来源于Sigma-Aldrich P/N D5376。
1.1.13乙二胺四乙酸(EDTA)。
1.1.14丙三醇(C
1.2试剂配制
1.2.1标记反应缓冲液(0.1M碳酸钠-碳酸氢钠缓冲溶液,pH=10.0)
1.2.1.1制备0.1M碳酸氢钠溶液:称取4.20g碳酸氢钠(1.1.1),转移到500mL容量瓶中,加入250mL超纯水并用磁力搅拌棒搅拌至完全溶解,取出搅拌棒,加水定容至500mL。
1.2.1.2制备0.1M碳酸钠溶液:称取5.3g碳酸钠(1.1.2),转移到500mL容量瓶中,加入250mL超纯水并用磁力搅拌棒搅拌至完全溶解,取出搅拌棒,加水定容至500mL。
1.2.1.3将60mL的0.1M碳酸钠溶液与40mL的0.1M碳酸氢钠溶液混合均匀,使用前验证pH为10.0±0.5。
1.2.2磷酸缓冲溶液(0.1M,pH=7.8)
1.2.2.1制备0.2M磷酸二氢钠溶液(1.1.3):称取2.40g磷酸二氢钠倒入含有50mL超纯水的100mL容量瓶中,搅拌至溶解,定容至100mL。
1.2.2.2制备0.2M磷酸氢二钠溶液(1.1.4):称取2.84g磷酸氢二钠倒入含有50mL超纯水的100mL容量瓶中,搅拌至溶解,定容至100mL。
1.2.2.3将2.65mL的0.2M磷酸二氢钠溶液(1.2.2.1)与45.75mL的0.2M磷酸氢二钠(1.2.2.2)溶液混合。用超纯水定容至100mL。使用前验证pH为7.8±0.2。
1.2.3SDS溶液
称取4.00g SDS(1.1.5),倒入装有60mL水的烧杯中搅拌直至完全溶解,定容至100mL,配制成4% SDS溶液,室温可保存3个月。
1.2.4荧光素5-异硫氰酸酯荧光探针储备液
在含有冻干荧光素5-异硫氰酸酯(1.1.6)的小瓶中,加入2.5mL二甲基亚砜(DMSO)(1.1.7),涡旋溶解;每50μL分装到棕色瓶中,盖上盖子;保存在-15~-35℃范围的冷冻箱中,保质期1年。
1.2.5荧光素5-异硫氰酸酯荧光探针工作溶液
使用前取一瓶50μL荧光素5-异硫氰酸酯标记荧光探针储备液,加入400μL DMSO(1.1.7),混匀后立即使用,丢弃未使用的溶液。
1.2.6BSA对照溶液制备
称取100mg BSA对照品(1.1.9),加水溶解,定容到100mL,漩涡混匀,此为储备液;取储备液1mL,定容至100mL,混匀,此为中间液;取中间液1mL,定容至10mL,配置成浓度为1μg/mL的标准品对照液,相当于1mg/kg。
1.2.7运行电解质溶液
称取0.7266g三羟甲基氨基甲烷(1.1.10)和0.3710g硼酸(1.1.11)溶于9mL水中。加入20mg十二烷基硫酸钠(1.1.5)、1.00g葡聚糖(1.1.12)、14.60mg乙二胺四乙酸(1.1.13)和1mL丙三醇(1.1.14),混匀,静置12h,使葡聚糖完全溶解。
2仪器和设备
2.1毛细管电泳仪:型号为SCIEX PA800Plus,配备LIF检测器(激发波长488nm,发射波长560nm)。
2.2天平:感量0.01g、0.01mg。
2.3旋涡混合器。
2.4离心机。
2.5pH计:精度为0.01。
2.6超滤管:截留分子量为3000Da。
3 分析步骤
3.1 样品制备
称取10mg水解蛋白样品,精确至0.01mg,用水定容至10mL。取500μL样品溶液于3000Da的超滤管中(上层),加入5μL预先用水稀释10倍的10000Da内标(1.1.8),上层漩涡混匀,4000RCF离心25min。保留超滤管上层少量液体,加入pH=10.0的0.1M碳酸钠-碳酸氢钠缓冲溶液至最终体积为500μL。
3.2样品变性
3.2.1样品处理
取制备好的样品(3.1)400μL,加入15μL的4% SDS(1.2.3),轻轻混合并在50℃下加热10min。
3.2.2对照品处理
取400μL BSA稀释液(1.2.6)加入15μL的4% SDS(1.2.3)。向对照管中加入5μL稀释10倍后的10000Da内标,轻轻混合并在50℃下加热10min。此样品仅作为检出限样品对照使用。
3.3样品探针标记
取3.2步骤的样品200μL,加入10μL荧光素5-异硫氰酸酯荧光探针工作溶液(1.2.5),短暂涡旋、离心,在40±3℃,孵育50min。
3.4去除未标记荧光探针及缓冲液置换
加入200μL标记样品(3.3)至超滤管中,4000RCF离心10min。并重复操作多次,直至超滤管中没有蓝色,表示未标记的荧光探针被彻底清除干净;在超滤管中加入pH=7.8的磷酸盐缓冲液(1.2.2)至总体积为500μL,转移至内插管中进行上机分析。
4 测定步骤
4.1 毛细管电泳参考条件
非涂层毛细管,毛细管有效长度/总长度:20cm/30cm;毛细管电泳最大电压为30kV,最大电流为300μA;毛细管温度为40℃,样品保存温度为20℃。
LIF检测器条件设置:LIF动态范围为100RFU(相对荧光单位),激发波长为488nm,发射波长为560nm,采集频率为0.5Hz。过滤器设置为“Normal”,峰宽采集点设置为16~25。使用直接吸收进行检测。
表1平衡程序
表2分离程序
表3关机程序
分析结果的表述
残留蛋白占总蛋白的比例的计算方法:
5.1 10000Da内标上机浓度计算:
式中:
c----10000Da内标上机浓度,单位为微克每毫升(μg/mL);
c
f----样品制备(3.1)中10000Da内标稀释倍数,本实施例为10;
V
V
V
V
V
V
V
V
本实施例经计算最终10000Da上机浓度为1.84μg/mL。
5.2残留蛋白上机浓度计算:
式中:
c
c----10000Da内标上机浓度,本实施例为1.84μg/mL;
S
S
5.3残留蛋白含量计算:
式中:
X----残留蛋白含量,单位为克每千克(g/kg);
c
m----样品质量,单位为毫克(mg),本实施例为10mg;
V----上机液定容体积,本实施例为10mL。
f----稀释倍数,本实施例为2.72。
注:残留蛋白峰面积由内标峰位置之后的蛋白峰面积(不包括内标峰面积)加和得到。总蛋白峰面积由所有蛋白峰面积(包括内标峰面积)加和得到。
以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留到小数点后两位。如果分析结果在方法的检出限以下,可以用“未检出,<0.01mg/kg BSA”表示分析结果。若检出,可根据内标含量推算蛋白残留含量。
本方法检出限表示为“<0.01mg/kg BSA”,BSA对照溶液峰面积占所有峰面积之和,范围应在10%~15%之间,若超过范围,此批样品需要重新制备。
实验结果如图3~图5所示。
图1示出了BSA标准品的毛细管凝胶电泳图谱,可以看出BSA分子量大于10000Da内标分子量,出峰较晚。
图2示出了浓缩乳清蛋白粉的毛细管凝胶电泳图谱,可以看出残留蛋白分子量大于10000Da内标分子量,出峰较后,且该样品中含有较多的残留蛋白,经计算样品残留蛋白含量29.6mg/kg。
图3示出了经水解工艺处理后水解蛋白样品的毛细管凝胶电泳图谱。结果计算,因残留蛋白峰面积为0,经计算残留蛋白含量为未检出(或者残留蛋白未达到检出限),可见其中没有残留蛋白,达到完全水解的目的,样品检测合格。由此证明,本发明提供的毛细管凝胶电泳方法可以有效分离并定量检测水解蛋白乳制品中的残留蛋白。
对比例1
重复实施例,除了3.1样品制备时未加入10000Da内标。使用PDA检测器(光电二极管阵列检测器)对样品进行检测。
实验结果如图4所示,证明本发明在不加入10000Da内标时无法准确判定是否为水解蛋白或残留蛋白。同时使用PDA检测器样品灵敏度相对LIF较差,无法识别痕量大于10000Da以上分子量的蛋白质。
对比例2
重复实施例,除了4.1中不使用LIF检测器,改为使用UV检测器(紫外检测器)外。
实验结果如图5所示,峰形较大,将大部分蛋白峰包含进去,无法分离不同分子量蛋白质。
以上所述的仅是本发明的实施方式,在此应当指出,对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出改进,但这些均属于本发明的保护范围。
产业上的可利用性
本发明提供的水解蛋白乳制品中残留蛋白的检测方法可以在工业中使用。
- 用于水下密度采集设备的数据处理系统及其数据处理方法
- 一种多参数水质数据并行采集系统的数据收集处理方法
- 工业互联网数据的智能采集处理方法及系统
- 一种智能化工业互联网在线数据采集系统及其使用方法
