一种D型氨基酸修饰TMTP1多肽配体放射性探针及其制备方法和应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于放射性探针技术领域,具体涉及一种D型氨基酸修饰TMTP1多肽配体放射性探针及其制备方法和应用。
背景技术
肿瘤的发生和转移机制目前尚不完全清楚。然而,早期癌症的诊断以及对肿瘤的恶性程度和转移能力的确定对于患者的生存率和生存质量具有重要意义。正电子发射计算机断层扫描(Positron Emission Tomography,PET)在癌症诊断与分期、肿瘤复发与转移的检测、放疗治疗规划以及癌症治疗效果评估方面都有着传统医学影像技术难以比拟的优势。目前临床上对肿瘤诊断应用最广的是[18F]FDG,非特异性、氟的辐射暴露和静息状态要求都是[18F]FDG的应用限制因素,另外[18F]FDG对肿瘤是否具有转移能力也无法做出准确的判断,故新型分子影像探针仍然亟待开发。
正电子核素68Ga具有许多优点,包括短半衰期(68分钟),适合标记能够快速分布并到达靶点的小分子化合物。它在体内的快速代谢和排泄使得在注射后的1小时左右可以获得高质量的图像。较短的半衰期有效降低了患者接受的辐照剂量。此外,68Ga具有优良的核素性质,可以与靶向分子配体进行简单的化学标记,并且可以通过68Ge-68Ga锗镓发生器进行制备。这使得68Ga应用越来越广泛,并在PET显像中的应用仅次于18F。68Ga放射性药物已广泛应用于研究靶向受体(如G蛋白偶联受体、人表皮生长因子受体、叶酸和尿激酶受体等)、酶、抗原以及与生命活动相关的过程,如肿瘤血管生成、缺氧、增殖、凋亡和糖酵解等。此外,68Ga还用于心肌灌注、肺灌注成像以及炎症和感染成像等领域的研究。其中,68Ga-DOTATOC已成功应用于日常临床中的神经内分泌肿瘤诊断,并取得了良好的效果。此外,其他多种68Ga标记药物,如[68Ga]DOTATATE和[68Ga]PSMA,也在临床研究中得到广泛的应用。
这些研究和临床应用表明,68Ga放射性药物具有广泛的适应性和潜力。它们能够提供非侵入性的分子级显像,帮助医生了解肿瘤和其他疾病的生物学特征,指导治疗决策和评估治疗效果。通过结合靶向分子配体,68Ga放射性药物为个体化医学和精准治疗提供了有力工具,有望进一步改善患者的诊断和治疗结果。
现有技术中,科研人员利用18F标记TMTP1,合成PET探针[18F]AlF-NOTA-G-TMTP1进行体内评价,结果证明其可以特异性靶向高转移肝癌,在注射探针40min后,具有较高的肿瘤肌肉比,而且肝脏摄取很低,具有良好的应用前景(Li,Y.;Zhang,D.;Shi,Y.;Guo,Z.;Wu,X.;Ren,J.L.;Zhang,X.;Wu,H.,Syntheses and preliminary evaluation of[(18)F]AlF-NOTA-G-TMTP1 for PET imaging of high aggressive hepatocellularcarcinoma.Contrast Media Mol Imaging 2016,11(4),262-71)。虽然该[18F]AlF-NOTA-G-TMTP1有比较好的显像效果,但其血液清除较快,体内稳定性不好,代谢过快,会影响其进一步的应用。
发明内容
本发明目的在于克服现有技术缺陷,提供一种D型氨基酸修饰TMTP1多肽配体放射性探针。
本发明的另一目的在于提供上述D型氨基酸修饰TMTP1多肽配体放射性探针的制备方法。
本发明的再一目的在于提供上述D型氨基酸修饰TMTP1多肽配体放射性探针的应用。
本发明的技术方案如下:
一种D型氨基酸修饰TMTP1多肽配体放射性探针,为修饰68Ga的NOTA-G-TMTP1,
其中,TMTP1的氨基酸序列如SEQ ID NO.01所示,其N端起第三位的V为D型氨基酸,且NOTA-G-TMTP1的结构式为
上述D型氨基酸修饰TMTP1多肽配体放射性探针在制备肿瘤诊断试剂盒中的应用。
一种肿瘤诊断试剂盒,其具有上述D型氨基酸修饰TMTP1多肽配体放射性探针。
上述D型氨基酸修饰TMTP1多肽配体放射性探针的制备方法,包括如下步骤:
(1)制备NOTA-G-TMTP1;
(2)制备68Ga盐酸淋洗液;
(3)制备68Ga-NOTA-G-TMTP1;
(4)纯化所制得的68Ga-NOTA-G-TMTP1,即得所述D型氨基酸修饰TMTP1多肽配体放射性探针。
在本发明的一个优选实施方案中,所述步骤(1)为:利用固相合成技术合成TMTP1改性多肽,并利用NOTA-NHS活化酯对其进行修饰,再经HPLC分离纯化后,冻干获得NOTA-G-TMTP1。
在本发明的一个优选实施方案中,所述步骤(2)为:用盐酸溶液淋洗Ge-68/Ga-68发生器,获得68Ga68Ga盐酸淋洗液。
进一步优选的,所述步骤(2)为:用3-5mL 0.04-0.06M的盐酸溶液淋洗Ge-68/Ga-68发生器,获得68Ga盐酸淋洗液。
在本发明的一个优选实施方案中,所述步骤(3)为:取步骤(1)制得的NOTA-G-TMTP1溶解于0.24-0.26M醋酸钠缓冲液中,然后加入68Ga盐酸淋洗液,加热90-102℃反应8-12min,制得68Ga-NOTA-G-TMTP1。
进一步优选的,所述步骤(4)为:步骤(1)制得的NOTA-G-TMTP1、醋酸钠缓冲液和步骤(2)制得的68Ga盐酸淋洗液的比例为28-32μg、0.8-1.2mL∶3.8-4.2mL。
在本发明的一个优选实施方案中,将步骤(3)所制得的68Ga-NOTA-G-TMTP1缓慢注入事先活化过的Sep-Pak C18柱,再用10~20mL蒸馏水淋洗除去水溶性杂质,吹干后用600~800μL的乙醇淋洗,淋洗液用氮气吹干后,加入生理盐水溶解,即得
本发明的有益效果是:
1、本发明对TMTP1(NVVRQ,SEQ ID NO.01)进行了化学修饰,利用对应D氨基酸对其修饰,使其在经过放射性标记后,不影响其生物活性。
2、本发明的68Ga-NOTA-G-TMTP1(NVvRQ)可特异性靶向高转移肿瘤的生物学特性,对高转移肿瘤进行早期诊断。
3、本发明的68Ga-NOTA-G-TMTP1(NVvRQ))具有更优异的药动学性质,具有更高的肿瘤摄取绝对值和肿瘤/肝脏摄取比,对于肝癌的诊断更有优势。
4、本发明的68Ga-NOTA-G-TMTP1(NVvRQ))的标记方法简单,易于实现自动化合成,标记产率高,这对半衰期较短的放射性核素来说非常重要,更加有利于放射性标记化合物的商业应用于临床推广。
附图说明
图1为本发明对比例1中68Ga-NOTA-G-nVVRQ利用HPLC测定其放化纯度的结果图。
图2为本发明对比例1中68Ga-NOTA-G-nVVRQ在荷瘤小鼠(SMMC-7721)中microPET显像冠状面断层图。
图3为本发明对比例2中68Ga-NOTA-G-NvVRQ利用HPLC测定其放化纯度的结果图。
图4为本发明对比例2中68Ga-NOTA-G-NvVRQ在荷瘤小鼠(SMMC-7721)中microPET显像冠状面断层图。
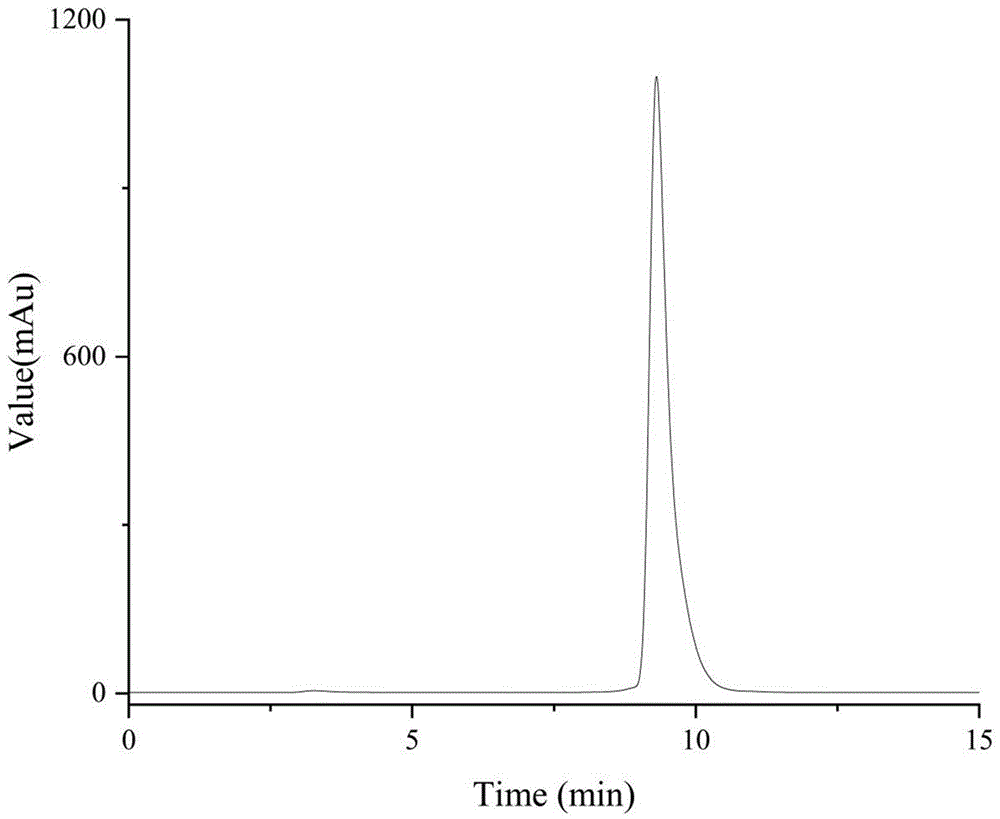
图5为本发明实施例1中68Ga-NOTA-G-NVvRQ利用HPLC测定其放化纯度的结果图。
图6为本发明实施例1中68Ga-NOTA-G-NVvRQ在荷瘤小鼠(SMMC-7721)中microPET显像冠状面断层图。
图7为本发明对比例3中68Ga-NOTA-G-NVVrQ利用HPLC测定其放化纯度的结果图。
图8为本发明对比例3中68Ga-NOTA-G-NVVrQ在荷瘤小鼠(SMMC-7721)中microPET显像冠状面断层图。
图9为本发明对比例4中68Ga-NOTA-G-NVVRq在荷瘤小鼠(SMMC-7721)中microPET显像冠状面断层图。
图10为本发对比例4中68Ga-NOTA-G-NVVRq在荷瘤小鼠(SMMC-7721)中microPET显像冠状面断层图。
图11为本发明对比例5中68Ga-NOTA-G-nvvrq在荷瘤小鼠(SMMC-7721)中microPET显像冠状面断层图。
图12为本发明对比例5中68Ga-NOTA-G-nvvrq在荷瘤小鼠(SMMC-7721)中microPET显像冠状面断层图。
图13为本发明对比例6中68Ga-NOTA-G-qrvvn在荷瘤小鼠(SMMC-7721)中microPET显像冠状面断层图。
图14为本发明对比例6中68Ga-NOTA-G-qrvvn在荷瘤小鼠(SMMC-7721)中microPET显像冠状面断层图。
具体实施方式
以下通过具体实施方式结合附图对本发明的技术方案进行进一步的说明和描述。
实施例1
(1)制备NOTA-G-NVvRQ
将30mg多肽G-NVvRQ(定制于中国多肽公司)溶于1mL DMF(二甲基甲酰胺)中,加入50mg 1,4-二乙酸-1,4,7-三氮杂环壬烷-7-乙酸N-羟基琥柏酰亚胺酯(NOTA-NHS ester,购买于CheMatech公司),然后加入DIEA(N,N-二异丙基乙胺)将pH调节到8.0-8.5,室温搅拌过夜,经HPLC分离纯化,收集目标产物的馏分,合并后冻干,得目标产物NOTA-G-NVvRQ,经过质谱分析确认。
上述HPLC分离,流动相A为0.1%三氟乙酸水溶液,B为0.1%三氟乙酸乙腈,梯度洗脱条件,0-10min,95%A;10-25min,95%A-15%A;25-40min,15%A流速为5mL/min,检测波长为220nm.
上述HPLC分析,流动相A为0.1%三氟乙酸水溶液,B为0.1%三氟乙酸乙腈,梯度洗脱条件:0-15min,99%A~50%A,流速为1mL/min,检测波长为220nm
MS,m/z:958.19([M+H]
(2)制备
(3)制备68Ga-NOTA-G-NVvRQ:向10mL的青霉素瓶中加入30μgNOTA-G-NVvRQ,然后加入1mL 0.25M醋酸钠缓冲液溶解,然后再加入4mL 68Ga的盐酸淋洗液(30~40mCi)。混合物摇匀后在80~110℃反应10~20min,冷却至常温,用HPLC测定其标记率。
(4)纯化所制得的68Ga-NOTA-G-NVvRQ,即得所述68Ga标记68Ga-NOTA-G-NVvRQ:将以上反应液缓慢注入事先活化过的Sep-Pak C18柱,再用20mL蒸馏水淋洗除去水溶性杂质,吹干后用600-800μL的乙醇淋洗,氮气吹干乙醇后用0.9%的生理盐水溶解,用HPLC测定其保留时间和放化纯,观察其外观性状是否为无色澄清透明液体。经衰变校正的放化产率约80-95%,放化纯度>95%(图5)。
(5)荷SMMC-7721肿瘤裸鼠MicroPET显像:SMMC-7721荷瘤裸鼠麻醉状态下经尾静脉分别注射0.1ml 68Ga-NOTA-G-NVvRQ(7.4MBq)并于注射后30-35min进行静态microPET/CT断层扫描(Siemens Inveon),图像采集后通过三维有序子集最大期望值法three-dimensional ordered subset expectation maximization(3D OPMAP)algorithm进行空间重构。在衰变校正的冠状面显像图中,圈出肿瘤、正常组织和器官的感兴趣区域(regionof interest,ROI),计算肿瘤模型中肿瘤摄取ID%/g为0.92±0.09,和肿瘤/非肿瘤(T/NT)的放射性比值:肿瘤/肝脏=1.78±0.41,肿瘤/肌肉=2.62±0.29,其肿瘤摄取绝对值与靶与非靶比都比未经修饰的68Ga-NOTA-G-NVVRQ(肿瘤摄取ID%/g=0.52±0.15,肿瘤/肝脏=1.37±0.26,肿瘤/肌肉=1.73±0.27)高,另外,其本底清除速率快,肿瘤摄取高且驻留时间长,肝脏摄取低,具有优异的体内药动学性质(如图6所示)。
对比例1:
(1)制备NOTA-G-nVVRQ
将30mg多肽G-nVVRQ(定制于美国多肽公司)溶于1mL DMF(二甲基甲酰胺)中,加入50mg 1,4-二乙酸-1,4,7-三氮杂环壬烷-7-乙酸N-羟基琥柏酰亚胺酯(NOTA-NHS ester,购买于CheMatech公司),然后加入DIEA(N,N-二异丙基乙胺)将pH调节到8.0-8.5,室温搅拌过夜,经HPLC分离纯化,收集目标产物的馏分,合并后冻干,得目标产物NOTA-G-nVVRQ,经过质谱分析确认。MS,m/z:957.83([M+H]
(2)制备
(3)制备68Ga-NOTA-G-nVVRQ:向10mL的青霉素瓶中加入30μgNOTA-G-nVVRQ,然后加入1mL 0.25M醋酸钠缓冲液溶解,然后再加入4mL 68Ga的盐酸淋洗液(30~40mCi)。混合物摇匀后在80~110℃反应10~20min,冷却至常温,用HPLC测定其标记率。
(4)纯化所制得的68Ga-NOTA-G-nVVRQ,即得所述68Ga标记68Ga-NOTA-G-nVVRQ:将以上反应液缓慢注入事先活化过的Sep-Pak C18柱,再用20mL蒸馏水淋洗除去水溶性杂质,吹干后用600-800μL的乙醇淋洗,氮气吹干乙醇后用0.9%的生理盐水溶解,用HPLC测定其保留时间和放化纯,观察其外观性状是否为无色澄清透明液体。经衰变校正的放化产率约80-95%,放化纯度>98%(图1)。
(5)荷SMMC-7721肿瘤裸鼠MicroPET显像:SMMC-7721荷瘤裸鼠麻醉状态下经尾静脉分别注射0.1ml 68Ga-NOTA-G-nVVRQ(7.4MBq)并于注射后30-35min进行静态microPET/CT断层扫描(Siemens Inveon),图像采集后通过三维有序子集最大期望值法three-dimensional ordered subset expectation maximization(3D OPMAP)algorithm进行空间重构。在衰变校正的冠状面显像图中,圈出肿瘤、正常组织和器官的感兴趣区域(regionof interest,ROI),计算肿瘤模型中肿瘤摄取ID%/g为0.94±0.17,肿瘤/非肿瘤(T/NT)的放射性比值:肿瘤/肝脏=1.34±0.08,肿瘤/肌肉=2.16±0.36,在肿瘤绝对摄取值(ID%/g为0.92±0.09)相差不大,在靶/非靶比方面比68Ga-NOTA-G-NVvRQ(肿瘤/肝脏=1.78±0.41,肿瘤/肌肉=2.62±0.29)性质略差一些(如图2所示)。
对比例2:
(1)制备NOTA-G-NvVRQ
将30mg多肽G-NvVRQ(定制于美国多肽公司)溶于1mL DMF(二甲基甲酰胺)中,加入50mg 1,4-二乙酸-1,4,7-三氮杂环壬烷-7-乙酸N-羟基琥柏酰亚胺酯(NOTA-NHS ester,购买于CheMatech公司),然后加入DIEA(N,N-二异丙基乙胺)将pH调节到8.0-8.5,室温搅拌过夜,经HPLC分离纯化,收集目标产物的馏分,合并后冻干,得目标产物NOTA-G-NvVRQ,经过质谱分析确认。MS,m/z:958.03([M+H]
(2)制备
(3)制备68Ga-NOTA-G-NvVRQ:向10mL的青霉素瓶中加入30μgNOTA-PEG12-TMTP1,然后加入1mL 0.25M醋酸钠缓冲液溶解,然后再加入4mL68Ga的盐酸淋洗液(30~40mCi)。混合物摇匀后在80~110℃反应10~20min,冷却至常温,用HPLC测定其标记率。
(4)纯化所制得的68Ga-NOTA-G-NvVRQ,即得所述68Ga标记NOTA-G-NvVRQ:将以上反应液缓慢注入事先活化过的Sep-Pak C18柱,再用20mL蒸馏水淋洗除去水溶性杂质,吹干后用600-800μL的乙醇淋洗,氮气吹干乙醇后用0.9%的生理盐水溶解,用HPLC测定其保留时间和放化纯,观察其外观性状是否为无色澄清透明液体。经衰变校正的放化产率约80-95%,放化纯度>95%(图3)。
(5)荷SMMC-7721肿瘤裸鼠MicroPET显像:SMMC-7721荷瘤裸鼠麻醉状态下经尾静脉分别注射0.1ml 68Ga-NOTA-G-NvVRQ(7.4MBq)并于注射后30-35min进行静态microPET/CT断层扫描(Siemens Inveon),图像采集后通过三维有序子集最大期望值法three-dimensional ordered subset expectation maximization(3D OPMAP)algorithm进行空间重构。在衰变校正的冠状面显像图中,圈出肿瘤、正常组织和器官的感兴趣区域(regionof interest,ROI),计算肿瘤模型中肿瘤摄取ID%/g为0.57±0.07,肿瘤/非肿瘤(T/NT)的放射性比值:肿瘤/肝脏=1.43±0.30,肿瘤/肌肉=1.71±0.08,比68Ga-NOTA-G-NVvRQ(肿瘤摄取ID%/g为0.92±0.09,肿瘤/肝脏=1.78±0.41,肿瘤/肌肉=2.62±0.29)性质相差较多(如图4所示)。
对比例3:
(1)制备NOTA-G-NVVrQ
将30mg多肽G-NVVrQ(定制于美国多肽公司)溶于1mL DMF(二甲基甲酰胺)中,加入50mg 1,4-二乙酸-1,4,7-三氮杂环壬烷-7-乙酸N-羟基琥柏酰亚胺酯(NOTA-NHS ester,购买于CheMatech公司),然后加入DIEA(N,N-二异丙基乙胺)将pH调节到8.0-8.5,室温搅拌过夜,经HPLC分离纯化,收集目标产物的馏分,合并后冻干,得目标产物NOTA-G-NVVrQ,经过质谱分析确认。MS,m/z:957.60([M+H]
(2)制备
(3)制备68Ga-NOTA-G-NVVrQ:向10mL的青霉素瓶中加入30μgNOTA-G-NVVrQ,然后加入1mL 0.25M醋酸钠缓冲液溶解,然后再加入4mL 68Ga的盐酸淋洗液(30~40mCi)。混合物摇匀后在80~110℃反应10~20min,冷却至常温,用HPLC测定其标记率。
(4)纯化所制得的68Ga-NOTA-G-NVVrQ,即得所述68Ga标记NOTA-G-NVVrQ:将以上反应液缓慢注入事先活化过的Sep-Pak C18柱,再用20mL蒸馏水淋洗除去水溶性杂质,吹干后用600-800μL的乙醇淋洗,氮气吹干乙醇后用0.9%的生理盐水溶解,用HPLC测定其保留时间和放化纯,观察其外观性状是否为无色澄清透明液体。经衰变校正的放化产率约80-95%,放化纯度>98%(图7)。
(5)荷SMMC-7721肿瘤裸鼠MicroPET显像:SMMC-7721荷瘤裸鼠麻醉状态下经尾静脉分别注射0.1ml 68Ga-NOTA-G-NVVrQ(7.4MBq)并于注射后30-35min进行静态microPET/CT断层扫描(Siemens Inveon),图像采集后通过三维有序子集最大期望值法three-dimensional ordered subset expectation maximization(3D OPMAP)algorithm进行空间重构。在衰变校正的冠状面显像图中,圈出肿瘤、正常组织和器官的感兴趣区域(regionof interest,ROI),计算肿瘤模型中肿瘤摄取ID%/g为0.91±0.06,肿瘤/非肿瘤(T/NT)的放射性比值:肿瘤/肝脏=1.56±0.28,肿瘤/肌肉=2.12±0.22,比68Ga-NOTA-G-NVvRQ(肿瘤摄取ID%/g为0.92±0.09,肿瘤/肝脏=1.78±0.41,肿瘤/肌肉=2.62±0.29)性质略差一些(如图8所示)。
对比例4:
(1)制备NOTA-G-NvvRq
将30mg多肽G-NVVRq(定制于美国多肽公司)溶于1mL DMF(二甲基甲酰胺)中,加入50mg 1,4-二乙酸-1,4,7-三氮杂环壬烷-7-乙酸N-羟基琥柏酰亚胺酯(NOTA-NHS ester,购买于CheMatech公司),然后加入DIEA(N,N-二异丙基乙胺)将pH调节到8.0-8.5,室温搅拌过夜,经HPLC分离纯化,收集目标产物的馏分,合并后冻干,得目标产物NOTA-G-NVVRq,经过质谱分析确认。MS,m/z:957.63([M+H]
(2)制备
(3)制备68Ga-NOTA-G-NVVRq:向10mL的青霉素瓶中加入30μgNOTA-G-NVVRq,然后加入1mL 0.25M醋酸钠缓冲液溶解,然后再加入4mL 68Ga的盐酸淋洗液(30~40mCi)。混合物摇匀后在80~110℃反应10~20min,冷却至常温,用HPLC测定其标记率。
(4)纯化所制得的68Ga-NOTA-G-NVVRq,即得所述68Ga标记NOTA-G-NVVRq:将以上反应液缓慢注入事先活化过的Sep-Pak C18柱,再用20mL蒸馏水淋洗除去水溶性杂质,吹干后用600-800μL的乙醇淋洗,氮气吹干乙醇后用0.9%的生理盐水溶解,用HPLC测定其保留时间和放化纯,观察其外观性状是否为无色澄清透明液体。经衰变校正的放化产率约80-95%,放化纯度>98%(图9)。
(5)荷SMMC-7721肿瘤裸鼠MicroPET显像:SMMC-7721荷瘤裸鼠麻醉状态下经尾静脉分别注射0.1ml 68Ga-NOTA-G-NVVRq(7.4MBq)并于注射后30-35min进行静态microPET/CT断层扫描(Siemens Inveon),图像采集后通过三维有序子集最大期望值法three-dimensional ordered subset expectation maximization(3D OPMAP)algorithm进行空间重构。在衰变校正的冠状面显像图中,圈出肿瘤、正常组织和器官的感兴趣区域(regionof interest,ROI),计算肿瘤模型中肿瘤摄取ID%/g为0.64±0.20,肿瘤/非肿瘤(T/NT)的放射性比值:肿瘤/肝脏=2.12±0.19,肿瘤/肌肉=2.41±0.13,肿瘤/肝脏比值比68Ga-NOTA-G-NVvRQ(肿瘤/肝脏=1.78±0.41)稍高一些,但是肿瘤摄取绝对值和肿瘤/肌肉比值相比68Ga-NOTA-G-NVvRQ(肿瘤摄取ID%/g为0.92±0.09,肿瘤/肌肉=2.62±0.29)性质差较多(如图10所示)。
对比例5:
(1)制备NOTA-G-nvvrq
将30mg多肽G-nvvrq(定制于美国多肽公司)溶于1mL DMF(二甲基甲酰胺)中,加入50mg 1,4-二乙酸-1,4,7-三氮杂环壬烷-7-乙酸N-羟基琥柏酰亚胺酯(NOTA-NHS ester,购买于CheMatech公司),然后加入DIEA(N,N-二异丙基乙胺)将pH调节到8.0-8.5,室温搅拌过夜,经HPLC分离纯化,收集目标产物的馏分,合并后冻干,得目标产物NOTA-G-nvvrq,经过质谱分析确认。MS,m/z:957.80([M+H]
(2)制备
(3)制备68Ga-NOTA-G-nvvrq:向10mL的青霉素瓶中加入30μgNOTA-G-nvvrq,然后加入1mL 0.25M醋酸钠缓冲液溶解,然后再加入4mL 68Ga的盐酸淋洗液(30~40mCi)。混合物摇匀后在80~110℃反应10~20min,冷却至常温,用HPLC测定其标记率。
(4)纯化所制得的68Ga-NOTA-G-nvvrq,即得所述68Ga标记NOTA-G-nvvrq:将以上反应液缓慢注入事先活化过的Sep-Pak C18柱,再用20mL蒸馏水淋洗除去水溶性杂质,吹干后用600-800μL的乙醇淋洗,氮气吹干乙醇后用0.9%的生理盐水溶解,用HPLC测定其保留时间和放化纯,观察其外观性状是否为无色澄清透明液体。经衰变校正的放化产率约80-95%,放化纯度>98%(图11)。
(5)荷SMMC-7721肿瘤裸鼠MicroPET显像:SMMC-7721荷瘤裸鼠麻醉状态下经尾静脉分别注射0.1ml 68Ga-NOTA-G-nvvrq(7.4MBq)并于注射后30-35min进行静态microPET/CT断层扫描(Siemens Inveon),图像采集后通过三维有序子集最大期望值法three-dimensional ordered subset expectation maximization(3D OPMAP)algorithm进行空间重构。在衰变校正的冠状面显像图中,圈出肿瘤、正常组织和器官的感兴趣区域(regionof interest,ROI),计算肿瘤模型中肿瘤摄取ID%/g为0.85±0.36,肿瘤/非肿瘤(T/NT)的放射性比值:肿瘤/肝脏=1.49±0.38,肿瘤/肌肉=2.12±0.31,比68Ga-NOTA-G-NVvRQ(肿瘤摄取ID%/g为0.92±0.09,肿瘤/肝脏=1.78±0.41,肿瘤/肌肉=2.62±0.29)性质略差一些(如图12所示)。
对比例6:
(1)制备NOTA-G-qrvvn
将30mg多肽G-qrvvn(定制于美国多肽公司)溶于1mL DMF(二甲基甲酰胺)中,加入50mg 1,4-二乙酸-1,4,7-三氮杂环壬烷-7-乙酸N-羟基琥柏酰亚胺酯(NOTA-NHS ester,购买于CheMatech公司),然后加入DIEA(N,N-二异丙基乙胺)将pH调节到8.0-8.5,室温搅拌过夜,经HPLC分离纯化,收集目标产物的馏分,合并后冻干,得目标产物NOTA-G-qrvvn,经过质谱分析确认。MS,m/z:957.70([M+H]
(2)制备
(3)制备68Ga-NOTA-G-qrvvn:向10mL的青霉素瓶中加入30μgNOTA-G-qrvvn,然后加入1mL 0.25M醋酸钠缓冲液溶解,然后再加入4mL 68Ga的盐酸淋洗液(30~40mCi)。混合物摇匀后在80~110℃反应10~20min,冷却至常温,用HPLC测定其标记率。
(4)纯化所制得的68Ga-NOTA-G-qrvvn,即得所述68Ga标记NOTA-G-qrvvn:将以上反应液缓慢注入事先活化过的Sep-Pak C18柱,再用20mL蒸馏水淋洗除去水溶性杂质,吹干后用600-800μL的乙醇淋洗,氮气吹干乙醇后用0.9%的生理盐水溶解,用HPLC测定其保留时间和放化纯,观察其外观性状是否为无色澄清透明液体。经衰变校正的放化产率约80-95%,放化纯度>98%(图13)。
(5)荷SMMC-7721肿瘤裸鼠MicroPET显像:SMMC-7721荷瘤裸鼠麻醉状态下经尾静脉分别注射0.1ml 68Ga-NOTA-G-qrvvn(7.4MBq)并于注射后30-.35min进行静态microPET/CT断层扫描(Siemens Inveon),图像采集后通过三维有序子集最大期望值法three-dimensional ordered subset expectation maximization(3D OPMAP)algorithm进行空间重构。在衰变校正的冠状面显像图中,圈出肿瘤、正常组织和器官的感兴趣区域(regionof interest,ROI),计算肿瘤模型中肿瘤摄取ID%/g为0.71±0.11,肿瘤/非肿瘤(T/NT)的放射性比值:肿瘤/肝脏=1.98±0.56,肿瘤/肌肉=2.22±0.24,肿瘤/肝脏比值比68Ga-NOTA-G-NVvRQ(肿瘤/肝脏=1.78±0.41)稍高一些,但是肿瘤摄取绝对值和肿瘤/肌肉比值相比68Ga-NOTA-G-NVvRQ(肿瘤摄取ID%/g为0.92±0.09,肿瘤/肌肉=2.62±0.29)性质差较多(如图14所示)。
以上所述,仅为本发明的较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
- 一种自组装核酸适配体/蛋白质复合纳米探针、制备方法、试剂盒及其应用
- 一种pH响应型自辅因子DNAzyme ZnO纳米探针及其制备方法与应用
- 一种比率型粘性耀斑荧光探针及其制备方法和应用
- 一种近红外比率型半胱氨酸荧光探针及其制备方法和应用
- 一种基于半花菁的反应型Hg2+荧光探针Cy-PT及其制备方法和应用
- 一种TMTP1多肽配体放射性探针及其制备方法和应用
- 一种基于适配体修饰二氧化硅@石墨烯量子点的双光子信号放大探针的制备方法及应用
