基于新型冠状病毒抗原的乳胶微球免疫层析试纸条及其制备方法
文献发布时间:2023-06-19 10:11:51
技术领域
本发明涉及一种多样本的快速定性检测试纸条及制备方法,尤其是利用免疫乳胶微球层析技术测定血液、血清、唾液、粪便等多样本中新型冠状病毒抗原的快速定性检测试纸条及其制备方法。
背景技术
目前COVID-19的检测方法主要是针对鼻咽部分泌物或采集血液进行病毒核酸RT-PCR检测为主,肺部X光为辅,但由于病毒RNA容易降解,测定结果易受样品采集和处理的影响。此外,虽然核酸检测方法敏感度较高,但要求生物安全II级实验室以及需昂贵的实验设备和专业的技术人员,由于检测能力的限制导致目前新型冠状病毒疑似病例远远高于确诊病例;同时,导致偏远地区的疑似样本必须送到专门的实验室进行核酸检测,运输过程中温度等不可控因素降低了样本的质量易造成假阴性,且运输距离和时间的增长也增加了病毒传播的可能性。除了核酸检测,还有对新型冠状病毒IgM/IgG抗体血清学的检测,该方法操作简便,快速,无需仪器设备,适合现场筛查。但是由于个体差异导致体内IgG/IgM浓度不尽相同,造成检测抗体血清学试验作为早期诊断方法容易出现假阴性。因此,建立一种克服体内早期抗体不足,且检测时间短、操作简单、灵敏度高、特异性高以及易于大规模推广的COVID-19测定方法,对患者提供早期、准确的实验室诊断是可行而必要的。
发明内容
为了解决新型冠状病毒大量的检测需求,本发明提供一种基于新型冠状病毒抗原的乳胶微球免疫层析试纸条及其制备方法,本发明是申请人对其在先申请,2020106817702检测新型冠状病毒的胶体金免疫层析试纸条及其制备方法的进一步改进,试纸条采用乳胶微球,双抗体夹心免疫法制备。乳胶微球灵敏度比胶体金更高,因此最低检测线也更低。同时乳胶微球属于化学键的连接,也更加的稳定。同时,针对新型冠状病毒抗原的检测不同于之前的申请,抗原不仅只存在于人体血液中,还可能存活于空气、食品、粪便中,可以有效扩大检测范围。
实现本发明目的的技术方案是:
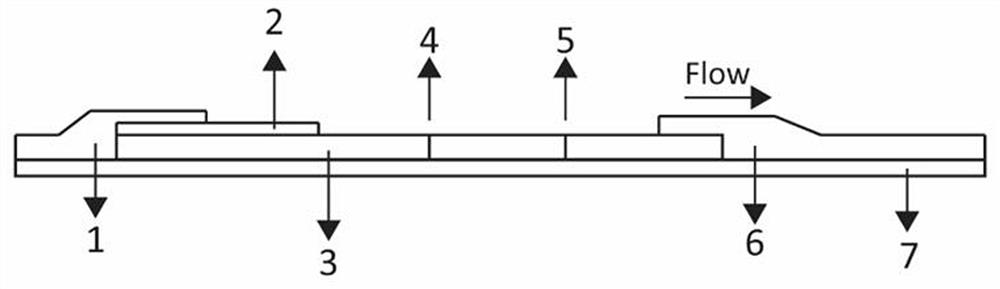
第一方面,本发明提供一种基于新型冠状病毒抗原的乳胶微球免疫层析试纸条,包括PVC底板,所述PVC底板上从左到右依次搭接样品垫、乳胶微球垫、硝酸纤维素膜和吸水滤纸;
所述乳胶微球垫上包被有乳胶微球标记的重组鼠抗人新型冠状病毒第一抗体;
所述硝酸纤维素膜上包被有重组鼠抗人新型冠状病毒第二抗体作为检测线,以及包被有重组羊抗鼠新型冠状病毒抗体作为质控线。
所述乳胶微球标记的重组鼠抗人新型冠状病毒第一抗体的浓度为3-18μg/mL,其在乳胶微球垫上的包被量为200uL;
所述重组鼠抗人新型冠状病毒第二抗体的浓度为0.5-3mg/ml,包被量为30uL;
所述重组羊抗鼠新型冠状病毒抗体的浓度为0.5-3mg/ml,包被量为30uL。
所述乳胶微球垫上还包括分离剂,所述分离剂为酪蛋白、BSA或PEG6000(聚乙二醇6000)中的任意一种或至少两种的组合,优选为浓度10%的PEG6000。
发明人发现在乳胶微球垫上加入分离剂,使得重组鼠抗人新型冠状病毒第一抗体与乳胶微球颗粒的结合更加稳定,进一步降低了乳胶微球免疫层析试纸条的检测限,不仅如此,相比于BSA和酪蛋白,采用所述PEG6000作为分离剂时,乳胶微球标记物的复溶性和检测性能会进一步提升。
所述乳胶微球垫上的乳胶微球颗粒的粒径为300-400nm。
所述检测线的距离为3-5cm,检测线与质控线的距离为3-5cm,检测线和质控线相互不受干扰。
所述样品垫为玻璃纤维膜或聚酯纤维膜;所述乳胶微球垫为玻璃纤维膜。
本发明中,所述乳胶微球免疫层析试纸条采用双抗体夹心免疫法,若检测样本为阳性,其中的样本中的新型冠状病毒抗原与乳胶微球标记的重组鼠抗人新型冠状病毒第一抗体结合形成复合物,在层析作用下复合物沿纸条向前移动,经过检测线时与预包被的重组鼠抗人新型冠状病毒第二抗体反应,形成免疫复合物而呈现红色条带,游离乳胶微球标记重组鼠抗人新型冠状病毒第一抗体则在质控线与重组羊抗鼠新型冠状病毒抗体结合显现红色条带;若检测样本为阴性,其中样本中不含有新型冠状病毒抗原,不会形成免疫复合物,在检测线处不会出现条带,仅在质控线显色;质控线在检测阳性样本和阴性样本时均应出现条带,所显现的红色条带是判定层析过程是否是正常的标准,同时也作为试剂的内控标准。
本发明,硝酸纤维素膜上包被的病毒抗体为鼠源性抗体,所述作为质控线的抗体为羊抗鼠抗体。鼠源性抗体是目前商业化抗体中最常见的抗体形式,来源广泛,成本较低,并且特异性和稳定性好。所述病毒抗体可以是多克隆抗体或单克隆抗体,制备所述多克隆抗体或单克隆抗体的方法是本领域技术人员公知的,比如可以用相应病毒免疫动物,如鼠,从动物血清中纯化多克隆抗体,但是多克隆抗体相比单克隆抗体可能存在特异性不强的问题,有可能有假阳性结果的产生。具体到本发明,所述病毒抗体虽然可以采用多克隆抗体,但是单克隆抗体具有更明显的优势,因此是本发明的优选,制备所述单克隆抗体的方法比如可以是用相应病毒免疫动物,如鼠,取动物脾脏B细胞与小鼠骨髓瘤细胞融合形成杂交瘤细胞,从中获取特异性较强的单克隆抗体。
第二方面,本发明提供一种如第一方面所述的乳胶微球免疫层析试纸条的制备方法,包括以下步骤:
(1)制备乳胶微球垫,在乳胶微球垫上包被乳胶微球标记的重组鼠抗人新型冠状病毒第一抗体;
(2)制备硝酸纤维素膜,在硝酸纤维素膜上重组鼠抗人新型冠状病毒第二抗体作为检测线,包被重组羊抗鼠新型冠状病毒抗体作为质控线;
(3)在PVC底板上从左到右依次搭接样品垫、乳胶微球垫、硝酸纤维素膜和吸水滤纸,即得。
本发明制备方法中,所述抗体包被为本领域的常规技术手段 ,没有特殊限定,本领域技术人员可以根据实际需要进行选择和制备。
本发明制备方法中,抗体包被的抗体包被缓冲液为PBS缓冲液或PB缓冲液中的任意一种或至少两种的组合。
所述PBS缓冲液的pH值为6-8.5,优选为7-8。
所述PB缓冲液的pH值为7-8,优选为7.2-7.4。
本发明制备方法中,所述乳胶微球垫的制备,包括以下步骤:
(1)器皿洗干净,采用氢氧化钠缓冲液将乳胶微球颗粒的pH值调整至8.5,加入器皿中,再向其中加入终浓度10%的分离剂,再加入重组鼠抗人新型冠状病毒第一抗体稀释液至终浓度30μg/mL,搅拌40min,得到乳胶微球溶液;
(2)向步骤(1)得到的乳胶微球溶液中加入10%封闭液至终浓度到1%进行封闭15min;
所述封闭液为酪蛋白和/或BSA溶液;
(3)将步骤(2)得到的乳胶微球溶液使用4℃、12000 rpm进行离心40min,离心后去上清,使用复溶液复溶沉淀,得到重组鼠抗人新型冠状病毒第一抗体标记液;
所述复溶液为0.015%吐温20和0.015%BSA两种溶液的混合;
(4)将步骤(3)得到的重组鼠抗人新型冠状病毒第一抗体标记液使用喷金划膜仪按0.1μL/mm进行喷涂到乳胶微球垫上;
(5)将步骤(4)的乳胶微球垫在37℃烘箱中干燥240min,干燥后加干燥剂密封保存,即得到乳胶微球垫。
第三方面,本发明提供一种检测新型冠状病毒的乳胶微球免疫层析试剂盒,所述试剂盒包括如第一方面所述的乳胶微球免疫层析试剂条。
第四方面,本发明提供如第一方面所述的乳胶微球免疫层析试剂条和/或如第三方面所述的检测试剂盒用于检测新型冠状病毒。
本发明中,所述试纸条的使用方法,具体如下:
(1)吸取10μL待检样本缓慢滴加于试纸条的加样孔中;
(2)计时,10-15分钟读取结果,15分钟后结果可能出现异常。
结果分析:
阳性(+):出现两条红色条带,检测线和质控线,表示样本中存在新型冠状病毒抗体。
阴性(-):仅质控线出现一条红色条带,检测线无红色条带出现,表示样本中没有新型冠状病毒。
无效:质控线未出现红色条带,可能是由于不正确的操作或试剂已失效。在任何情况下,应重新测试。如果问题仍然存在,应立即停止使用此批号产品,并与当地供应商联系。
注意:由于样本中新型冠状病毒抗体浓度的不同,检测线的红色条带会显现出不同深浅的颜色。但是,本试剂的测试结果不能做为判定样本中新型冠状病毒抗体滴度高低的依据。
本发明乳胶微球免疫层析试纸条通过对新型冠状病毒抗原的检测,有效地解决了IgG和IgM存在窗口期的问题,实现了对多种低浓度样本的快速检测,并且试纸条具有较好的敏感性、特异性、重复性和稳定性,能提供更准确可靠的检验结果。本发明采用标记了乳胶微球的重组鼠抗人新型冠状病毒第一抗体的样本垫与喷涂包被了重组鼠抗人新型冠状病毒第二抗体硝酸纤维素膜的组合。采用双抗体夹心免疫层析的原理,实际样本中的新型冠状病毒抗原在侧向移动的过程中会与标记了乳胶微球的重组鼠抗人新型冠状病毒第一抗体相结合,形成免疫复合物,并最终在检测线以及质控线上显色呈现结果。具备检测时间短、操作简单、灵敏度高、特异性高以及易于大规模推广等优点。
与现有技术相比,具有如下有益效果:
(1)本发明所述乳胶微球免疫层析试纸条采用双抗体夹心免疫法检测新型冠状病毒,具有较好的敏感性、特异性、重复性和稳定性,对目标化合物的回收率较高,检验结果准确可靠;
(2)本发明所述乳胶微球免疫层析试纸条通过在乳胶微球垫添加分离剂,使得重组新型冠状病毒与乳胶微球颗粒的结合更加稳定,进一步降低了乳胶微球免疫层析试纸条的检测限;
(3)本发明所述乳胶微球免疫层析试纸条对于新型冠状病毒抗体的检测均有较高的灵敏度和特异性。
附图说明
图1为本发明乳胶微球免疫层析试纸条的结构示意图;
图中,1.样品垫 2.乳胶微球垫 3.硝酸纤维素膜 4.检测线 5.质控线 6. 吸水滤纸 7. PVC底板。
具体实施方式
下面结合实施例和附图对本发明内容作进一步的说明,但不是对本发明的限定。
下述实施例中的实验方法,如无特殊说明,均为常规方法;所用的实验材料,如无特殊说明,均为自常规生化试剂厂商购买得到的。
实施例中所用的试剂和仪器设备的来源:
乳胶微球购自赛默飞世尔科技(中国)有限公司,重组鼠抗人新型冠状病毒第一抗体、重组鼠抗人新型冠状病毒第二抗体、重组羊抗鼠新型冠状病毒抗体购自深圳幂次方生物科技有限公司;硝酸纤维素膜购自默克密理博;三维平面划膜仪购自上海金标生物科技有限公司;切条机购自上海金标生物科技有限公司;PVC胶板、吸水纸、玻璃纤维膜和卡壳购自上海金标生物科技有限公司。
实施例1:乳胶微球免疫层析试纸条的制备
乳胶微球免疫层析试纸条按照下述方法制备,其结构如图1所示:
在聚氯乙烯(PVC) 底板7上从左到右依次相互搭接地贴上样品垫1、乳胶微球垫2、硝酸纤维素膜3和吸水滤纸6,然后将PVC底板7及贴附的材料切成宽度为3mm的试纸条,并装入卡壳内,卡壳上开有加样区和显色区(观察区域)。
其中,样品垫1为玻璃纤维膜;乳胶微球垫2上包埋有浓度为2-18ug/mL的乳胶微球标记的重组新型冠状病毒第一抗原;硝酸纤维素膜8上包被有鼠抗人新型冠状病毒第二抗体作为检测线4,还包被有重组羊抗鼠新型冠状病毒抗体作为质控线5;检测线4与质控线5的距离为3cm。
实施例2:抗体包被
首先,用包被缓冲液0.05mol/L pH为7.2-7.4的PB稀释鼠抗人新型冠状病毒第二抗体和重组羊抗鼠新型冠状病毒抗体,得到检测线4重组鼠抗人新型冠状病毒第二抗体稀释液和质控线5重组羊抗鼠新型冠状病毒抗体稀释液;
其次,将得到的稀释液使用喷金划膜仪划到硝酸纤维素膜,按0.1μL/cm的条件进行划线;
最后,将硝酸纤维素膜置于烘箱37℃进行干燥3小时,干燥后加干燥剂密封保存;
实施例3:乳胶微球垫的制备
(1)器皿洗干净,采用氢氧化钠缓冲液将乳胶微球颗粒的pH值调整至8.5,加入器皿中,再向其中加入终浓度10%的PEG6000分离剂,再加入重组鼠抗人新型冠状病毒第一抗体稀释液至终浓度30μg/mL,搅拌40min,得到乳胶微球溶液;
(2)向步骤(1)得到的乳胶微球溶液中加入10%BSA封闭液至终浓度到1%进行封闭15min;
(3)将步骤(2)得到的乳胶微球溶液使用4℃、12000 rpm进行离心40min,离心后去上清,使用复溶液复溶沉淀,得到重组鼠抗人新型冠状病毒第一抗体标记液;
((4)将步骤(3)得到的重组鼠抗人新型冠状病毒第一抗体标记液使用喷金划膜仪按0.1μL/mm进行喷涂到乳胶微球垫上;
(5)将步骤(4)的乳胶微球垫在37℃烘箱中干燥240min,干燥后加干燥剂密封保存,即得到乳胶微球垫。
实施例4:
乳胶微球试纸条的组装,如图1所示:
首先,将包被好的硝酸纤维素膜3和乳胶微球垫2与吸水滤纸6、样品垫1在PVC底板7上进行组装;
其次,将得到的组装板用切条设备切成3mm的乳胶微球试纸条;
最后,将得到的试纸条置于密封袋中加干燥剂保存。
如图1所示,本发明的乳胶微球免疫层析试纸条的检测原理,具体如下:
将被检测样品搅入含有阻断剂的稀释液后滴加至样本垫,与乳胶微球标记的重组鼠抗人新型冠状病毒第一抗体进行标记,通过毛细作用至新型冠状病毒抗原的检测区域中:样品中抗原-抗体-乳胶微球的结合物向吸水纸一端的方向移动。如果被检测样品中含有该新型冠状病毒抗原,样品移动到检测线4即重组鼠抗人新型冠状病毒第二抗体稀释液时,抗原-抗体-乳胶微球的结合物被捕获,在质控线5处生成抗体-抗原-抗体-乳胶微球的结合物,因此显示一条红色条带;样品继续流动,样品移动到检测线4即重组羊抗鼠新型冠状病毒抗体时,抗体-乳胶微球的结合物被捕获,在质控线5处生成抗体-抗体-乳胶微球的结合物,会出现一条红色条带,证明该试纸条的有效性。若检测的实际样品中不存在新型冠状病毒抗原时,不会形成免疫复合物,则在检测线4处不会显示红色条带,仅在质控线5显色。只要质控线5不显色,证明该试纸条无效,需要重新检测实际样品。
- 基于新型冠状病毒抗原的乳胶微球免疫层析试纸条及其制备方法
- 一种检测甲、乙型流感病毒和新型冠状病毒抗原的时间分辨荧光免疫层析试纸条及制备方法
