一种花生肽钙螯合物及其制备方法和应用
文献发布时间:2023-06-19 18:58:26
技术领域
本发明涉及花生蛋白的深加工领域,具体涉及一种花生肽钙螯合物及其制备方法和应用。
背景技术
钙作为人体中含量最多的无机元素,在人体中约有700~1400g,其中99%的钙存在于骨骼和牙齿中,除了构成、保护及支持骨骼和牙齿外,充分的钙摄入能够减少骨损失、预防骨质疏松症和龋齿,另外还具有参与酶调节、参与血液凝固、调节细胞膜的通透性、调节肌肉的正常活动、参与神经活动等功能。由于人体中诸多生理功能的实现都需要钙的参与,钙摄入不足可能会导致很多不良后果。婴儿钙摄入不足容易引起生长发育迟缓、反复呼吸道感染、佝偻病等;妊娠期妇女钙元素缺乏容易引起妊娠高血压综合征以及影响胎儿生长发育等;老年人缺钙则容易引发骨质疏松症。
目前市场上的补钙产品主要有无机钙、有机钙、氨基酸螯合钙及肽螯合钙四种。无机钙剂主要是碳酸钙、磷酸钙、氧化钙等,有机钙剂主要是乳酸钙、葡萄糖酸钙和柠檬酸钙等。研究表明,无机钙剂溶解性差,吸收率低,刺激大量胃酸分泌,影响正常的消化功能;有机钙剂生物利用率虽高于无机钙剂,但含钙量低,受维生素D影响,总体利用率不高。氨基酸螯合钙可通过氨基酸载体被肠道完整吸收,生物利用率高,在细胞内缓慢释放钙离子,避免血钙迅速升高而导致的反馈抑制,但难以抵抗肠道中植酸、磷酸的沉淀作用。相比以上3种补钙产品,肽螯合钙生物利用度最高,一般以整体分子形式直接被肠道吸收,然后从门静脉进入血液循环,根据机体需要缓慢释放钙离子。肽螯合钙的这种吸收方式不易饱和,被吸收的速度快且耗能低,能有效提高肽螯合钙中钙的生物学效价。肽螯合钙是目前最具潜力的补钙产品,但大多数还处于研究阶段,因此具有较大的研发空间与市场潜力。目前研究发现酪蛋白磷酸肽、猪骨胶原肽、鱼鳞肽、大豆肽、核桃肽等能与钙结合形成可溶性复合物,维持人体小肠内钙的可溶状态,具有良好的促钙吸收能力,这与其钙离子结合活性密切相关。
花生是全世界及我国的重要农作物,其总产量的54%用于榨油。由于花生蛋白的溶解性较差,榨油后的饼粕并未得到充分利用,这造成了较严重的资源浪费。在植物蛋白资源中,花生蛋白居第三位,占蛋白总量的11%,是较理想的食用蛋白资源。花生蛋白中含有大量的人体必需氨基酸,其生物价(BV)为58,有效利用率高达98.4%。另外,与大豆蛋白相比,花生蛋白还具有易消化,所含腹胀因子少、无豆腥味等优点;而与菜籽、棉籽蛋白相比,花生蛋白所含毒性物质较少,是一种理想的食品工业基础原料。
本发明将提出一种花生多肽与钙螯合形成螯合物的技术,不仅能解决花生蛋白质资源浪费的问题,缓解人类食物、蛋白供给的不足,而且能促进游离钙离子的吸收,从而有效预防和改善因缺钙而引起的骨质疏松、佝偻病及过敏等健康问题。
发明内容
本发明的目的在于提出一种花生肽钙螯合物及其制备方法和应用。本发明通过对花生蛋白进行处理,获取花生蛋白中的活性多肽物质,然后所获取的花生多肽与钙离子鳌合形成花生肽钙螯合物作为钙补充剂,可以进一步提高人体对钙离子的吸收利用,对钙制剂的研发生产具有指导意义,且对花生高附加值产品的开发也具有重要意义。
为实现上述发明目的,本发明采用以下技术方案予以实现:
本发明提供了一种花生肽钙螯合物的制备方法,包括以下步骤:
(1)花生蛋白中加入碱性蛋白酶进行酶解,灭酶后加入复配酶进行二次酶解,得到花生蛋白酶解液;
(2)将步骤(1)的花生蛋白酶解液在酸性溶液中进行脱酰胺处理,得到脱酰胺酶解液;
(3)调节步骤(2)的脱酰胺酶解液pH至1~8,加入大孔树脂进行静态吸附,富集处理后,过滤得到花生多肽;
(4)在步骤(3)的花生多肽中加入无水氯化钙进行螯合反应,浓缩清洗后得到花生肽钙螯合物。
进一步的,所述步骤(1)中,碱性蛋白酶的加酶量为0.5%~6%(w/w),酶解反应时间为1h~4h,酶解反应温度为40℃~60℃,酶解反应pH为6.0~9.0。
进一步的,所述步骤(1)中,复配酶为ProteAXH肽酶、复合蛋白酶、木瓜蛋白酶、外切蛋白酶中的一种。
进一步的,所述步骤(1)中,复配酶与碱性蛋白酶的质量比为1:1,二次酶解的反应时间为2h~4h,酶解反应温度为45℃~65℃,酶解反应pH为6.0~7.0。
进一步的,所述步骤(2)中,酸性溶液为盐酸溶液,其浓度为0.2mol/L~1.0mol/L;脱酰胺处理的温度为70℃~95℃,处理时间为1h~5h。
进一步的,所述步骤(3)中,大孔树脂为D101、AB-8、DM301、XAD-2、ADS-7、IRA900C1、IRC76RCF中的一种;所述大孔树脂与脱酰胺酶解液的料液比为0.1:1~0.3:1(w/v)。
进一步的,所述步骤(3)中富集处理的温度为25℃~50℃,时间为3h~18h。
进一步的,所述步骤(4)中,无水氯化钙与花生多肽的质量比为1:1~1:5;所述螯合反应的温度为30℃~70℃,pH为3.0~8.0,时间为20min~120min。
本发明还提供了一种花生肽钙螯合物,其通过所述的制备方法制备而成的;所述花生肽钙螯合物的钙结合能力为138.77mg/g~164.34mg/g,粒径为465nm~638nm,电势为-23.4mV~-16.5mV。
进一步的,所述花生肽钙螯合物在胃中的解离率为60.2%~63.4%,在小肠中的溶解度保持在54%~59%。
本发明还提供了所述的花生肽钙螯合物在制备钙补充剂中的应用。
本发明与现有技术相比,具有以下优点和有益效果:
1、本发明的制备方法提高了花生加工过程中副产物的利用率,使其含有的活性物质得到充分开发利用,同时减少了对环境的污染。
2、本发明通过生物酶法获取花生生物活性肽,与钙离子结合形成的可溶性肽钙螯合物,更有利于钙吸收,可用于开发高值化的花生肽-钙补充剂。
3、本发明采用大孔树脂静态吸附进行富集处理,代替使用频率较高的超滤工艺,多肽损失减少,且大孔树脂可重复利用减少生产成本及资源浪费。
4、本发明的制备方法操作过程简单,不需要复杂的设备,由碱性蛋白酶与ProteAXH肽酶酶解获取花生肽的氮回收率最高达到87.89%,再经脱酰胺及富集处理后钙结合量最高可达164.34mg/g,而且肽钙螯合物具有良好的促钙吸收能力,提高了生产效率,适合工业化生产。
附图说明
图1为6种商业酶酶解花生蛋白的水解度、氮回收率及钙结合能力结果;
图2为蛋白酶复配酶解花生蛋白的水解度、氮回收率及钙结合能力结果;
图3为脱酰胺处理的温度(a)、时间(b)、酸浓度(c)对花生多肽钙结合能力的影响;
图4为7种树脂富集处理对花生多肽的钙结合能力的影响;
图5为富集处理的pH(a)、温度(b)、时间(c)、料液比(d)对花生多肽的钙结合能力及多肽损失率的影响;
图6为螯合pH变化对精制花生多肽钙结合能力的影响;
图7为螯合温度变化对精制花生多肽钙结合能力的影响;
图8为螯合反应时间变化对精制花生多肽钙结合能力的影响;
图9为螯合肽钙比变化对精制花生多肽钙结合能力的影响;
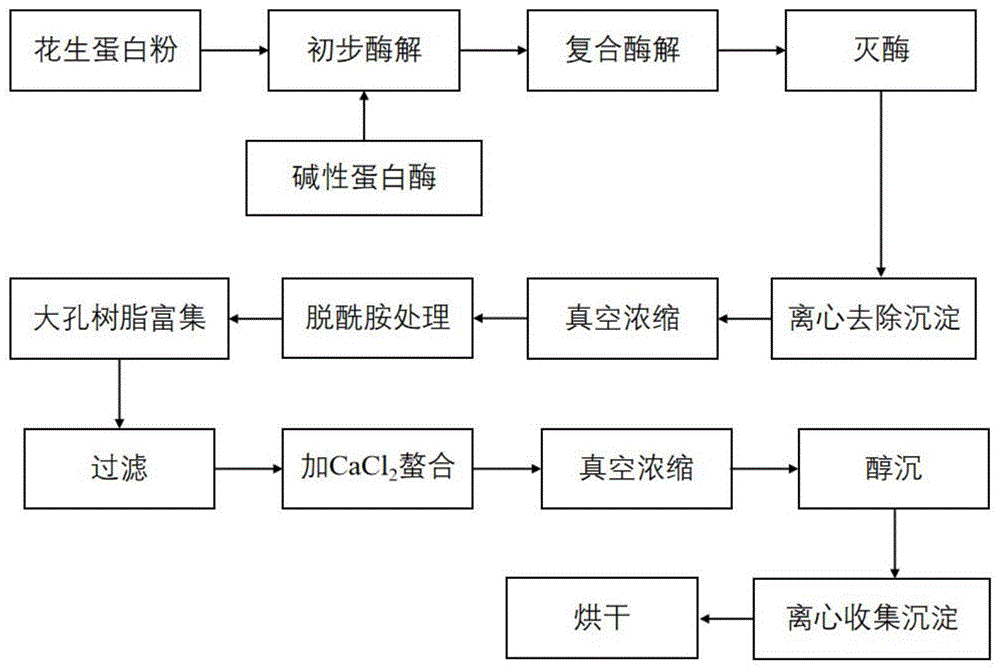
图10为本发明花生肽钙螯合物的制备工艺流程图;
图11为实施案例1-6中六种花生肽钙螯合物的钙结合能力的变化;
图12为实施案例1-6中六种花生肽钙螯合物的粒径图;
图13为实施案例1-6中六种花生肽钙螯合物的ζ电位图;
图14为模拟胃部环境中钙制剂的钙解离率随消化时间的变化情况;
图15为模拟肠道环境中钙制剂的钙溶解度随消化时间的变化情况。
具体实施方式
以下结合具体实施例对本发明的技术方案做进一步详细的说明。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件,未注明详细来源的材料,均为市售材料。
实验条件的测定:
1、蛋白酶种类对花生蛋白酶解效果的影响
将碱性蛋白酶、中性蛋白酶、酸性蛋白酶、木瓜蛋白酶、复合蛋白酶、Flavourzyme
利用不同蛋白酶水解花生蛋白,其对花生蛋白的水解度、氮回收率及钙结合能力的影响如图1所示。由图1可知,碱性蛋白酶的水解度、氮回收率及钙结合能力,分别为18.83%、82.26%、66.22mg/g,均高于其他酶制剂,木瓜蛋白酶次之。酸性蛋白酶的效果最差,其蛋白回收率、水解度及钙结合能力分别为10.29%、39.28%、40.09mg/g。蛋白质酶解的因素很多,酶的选择是一个关键因素,因为蛋白酶均有其专一性作用位点,不同的酶作用于蛋白质长肽链上不同的部位,会生成不同的酶解产物,因此酶的选择决定了产物的性质。
2、多种蛋白酶复配作用对花生蛋白酶解效果的影响
将ProteAXH肽酶、木瓜蛋白酶、复合蛋白酶、外切蛋白酶按照0.05%(w/w)的加酶量分别加入经碱性蛋白酶初步水解的花生蛋白水解液(底物浓度为5%)中,用NaOH或HCl调节到合适的pH值,放入恒温震荡水浴器(转速100~120r/min)调节到蛋白酶最适温度,水解4h,100℃沸水浴灭酶10min。水解液在10000r/min下离心15min,将上清液冻干。测定水解度、氮回收率及钙结合能力。
由图2可知,水解度与花生蛋白水解液结合钙离子能力呈现正相关,即水解液钙结合能力随着水解度的升高而升高。随着水解程度的加深,花生蛋白会暴露出更多可以与钙离子结合的位点,使水解液钙结合能力增强。因此选用蛋白酶复配提高水解度,从而提高目标多肽的活性。选用效果较好的木瓜蛋白酶、复合蛋白酶以及外切蛋白酶、ProteAXH肽酶与碱性蛋白酶进行复配,但因为不同蛋白酶的最适pH有所差异,因此选用多酶分步水解。由图2可知,ProteAXH肽酶与碱性蛋白酶复合效果最好,花生蛋白的水解度、蛋白质回收率及钙结合能力分别达到了32.19%、87.89%和84.09mg/g,与碱性蛋白酶单酶水解时分别增加了70.95%、6.84%和26.98%。
3、酸法脱酰胺改性对钙结合能力的影响
准确称取花生蛋白水解物冻干粉溶于0.2、0.4、0.6、0.8、1.0mol/L的盐酸中使其浓度达到3%(w/v),密封后于70、75、80、85、90、95℃下反应1、2、
3、4、5h。反应结束后,用NaOH调节其pH值至7.0,利用分子截留量为100Dal的透析袋在去离子水中透析以除去盐份,冷冻干燥后备用。
从图3(a)可以看出,花生多肽的钙结合能力随着温度的升高逐渐增大,当温度升到90℃时,花生多肽的钙结合能力不再改变。这可能是由于脱酰胺反应涉及天冬酰胺和谷氨酰胺的残基侧链上酰胺基团化学键的断裂(脱酰胺),此过程需消耗较高能量。因此,反应温度越高,花生多肽的脱酰胺度越高,钙结合能力越高。由图3(b)可知,钙结合能力随着反应时间的延长呈现先增大后平稳的趋势。当反应时间为2~4h时,花生多肽的钙结合能力明显增大,当继续反应达到5h时,花生多肽的钙结合能力不再改变。从图3(c)看出,花生多肽的钙结合能力随着酸浓度的升高呈现先增大后减小的趋势,酸浓度较低时,酰胺基团转化为羧基的数量较少,钙结合能力较低;当酸浓度为0.4mol/L时,钙结合力最高,酸浓度过高时,钙结合力反而下降。
4、树脂种类对钙结合能力的影响
称取处理好的D101、AB-8、DM301、XAD-2、ADS-7、IRA900C1、IRC76RCF树脂各10g,分别放入200mL具塞锥形瓶中,随后分别加入50mL浓度为20mg/mL的脱酰胺花生肽溶液,置于30℃恒温摇床中150r/min震荡12h,然后抽滤收集滤液,测定剩余多肽的钙结合能力及损失率。
从图4中可以看出,经大孔树脂DM301吸附后的多肽的钙结合能力是最高的,具体为157.49mg/g,多肽损失率20.00%。由于样品极性较大,适用中极性树脂进行分离。在7种树脂中,DM301型大孔树脂为中极性树脂,适用于具有一定弱极性和极性的物质,因此富集效果较好。
5、富集处理的温度、时间、pH、料液比对花生多肽的钙结合能力及多肽损失率的影响
称取处理好的DM301型大孔树脂10g,放入200mL具塞锥形瓶中,按照大孔树脂与多肽0.1:1、0.15:1、0.2:1、0.25:1或0.3:1的料液比加入脱酰胺花生肽溶液,调节其pH值至1.0、2.0、3.0、4.0、5.0、6.0、7.0或8.0,在25、30、35、40、45或50℃下反应3、6、9、12或18h,然后抽滤收集滤液,测定其钙结合能力及多肽损失率。
图5a反映了不同pH对水解液钙结合能力及多肽损失率的影响。从图5a中可以看出随着pH的变大,DM301树脂钙结合能力、多肽损失率先增大后逐渐下降;pH 2.0时的钙结合能力是最高的,为164.34mg/g。图5b为不同温度对DM301树脂钙结合能力及多肽损失率的影响。从图5b中可以看出,随着温度的升高,钙结合能力、多肽损失率先上升后下降,在30℃时DM301树脂的钙结合能力最高,为157.77mg/g。
图5c中可以看出,吸附时间越长,水解液的钙结合能力会越高,多肽损失率也会随着吸附时间延长而逐渐增大。当吸附时间达到9h之后,水解液的钙结合能力随时间变化不再有显著性提高,此时的钙结合能力为154.2mg/g,多肽损失率为20.93%,这是因为在9h左右树脂达到吸附平衡。图5d反映了DM301树脂料液比对水解液的钙结合能力及多肽损失率的影响。从图5d中可以看出,随着料液比的增加,水解液钙结合能力逐渐增加,同时多肽的损失率也逐渐上升,这是由于树脂添加量的增多使得多肽的吸附量也随之增加。图中显示0.2:1的料液比时,水解液的钙结合能力趋于稳定,为162.08mg/g,多肽的损失率同样趋于平缓。
6、螯合反应的温度、时间、pH、肽钙比对花生多肽的钙结合能力的影响
向浓度为3%的脱酰胺花生肽溶液中加入CaCl
由图6可知,随着pH值升高钙结合能力也在不断增加,原因可能是随着pH值升高反应体系中的H
从图7可以看出,随着温度的升高,钙离子结合能力有所提高,当反应温度为50℃时,多肽的钙结合能力达到最高,再随着温度的升高,与钙离子的结合能力逐渐变低,可能是由于生成肽钙螯合物时形成了新的化学键,会释放一定的热量,不利于正向反应的进行。但由于多肽与Ca
由图8可知,随着时间的延长,钙结合能力先增加后减小,在80min达到最大值。原因在于时间过短将导致反应不彻底,致使产物中含有大量的游离金属离子和配体,造成原料浪费。而螯合时间过长不仅会降低生产效率,而且可能会使螯合物发生解离作用,同时可能会产生不利于螯合反应进行的副反应。
从图9可知,随着肽钙质量比的增大,钙离子结合能力呈先增大后减小的趋势,在2:1时达到最大值。
实施例1
一、本实施例中花生肽钙螯合物的制备方法,包括以下步骤(制备工艺流程图参见图10):
1、将50g花生蛋白粉溶于1000mL蒸馏水后得到质量浓度为5%的花生蛋白粉溶液,调节溶液的pH为6.0后加入碱性蛋白酶0.42g,于40℃水浴恒温振荡器中酶解1h,反应结束后100℃沸水浴灭酶10min。
2、将上述酶解液的pH调整为7.0,然后加入0.42g ProteAXH肽酶,于50℃恒温振荡器中酶解4h,反应结束后100℃沸水浴灭酶10min,8000r/min下离心15min后取上清液。
3、将上清液经过真空浓缩,保持酶解液中底物浓度为3%(m/v)、盐酸浓度为0.2mol/L,于70℃恒温水浴中脱酰胺处理1h,反应结束后放置室温,4000r/min下离心10min取上清液得到脱酰胺酶解液。
4、将上述脱酰胺酶解液pH调至2.0,按照料液比0.1:1加入大孔吸附树脂D101,调整温度至25℃进行静态吸附3h,将富集处理后的多肽溶液过滤,收集滤液。
5、将上述滤液pH调节至3.0后按照肽钙质量比1:1加入无水氯化钙,迅速搅拌使其溶解,用保鲜膜封口后置于30℃水浴振荡器中反应20min。
6、反应结束后经过真空浓缩去除鳌合体系中三分之二的水分,在去除水分后的鳌合体系中加入5倍体积的无水乙醇,静置3h。
7、将静置后的鳌合体系进行离心,收集沉淀,用无水乙醇洗涤至上清液加入钙指示剂不变色,40℃烘干后即可获得花生肽钙螯合物。
二、花生肽钙螯合物性质研究
模拟胃液的制备:取6mL浓盐酸,加入去离子水定容至1L,用0.1mol/L HCl调节溶液pH至1.2后,加入胃蛋白酶使其含量达到9600U/L,溶液过滤后备用。
模拟小肠液的制备:取0.2mol/L磷酸氢二钠49mL和0.2mol/L磷酸二氢钠51mL均匀混合后,加入800mL去离子水,用0.1mol/L NaOH调节溶液pH至6.8,最后用去离子水定容至1L,再加入胰蛋白酶使其含量达到25000U/L,溶液过滤后备用。
结果如图11-13所示,花生肽钙螯合物的钙结合能力为145.23mg/g,粒径为465nm,电势为-23.4mV;如图14、15所示,花生肽钙螯合物在模拟胃液中消化3.5h后释放率为63.4%;在模拟小肠液中消化3h后溶解度为58.4%;相较于CaCO
实施例2
本实施例中花生肽钙螯合物的制备方法包括以下步骤:
1、将50g花生蛋白粉溶于1000mL蒸馏水后得到质量浓度为5%的花生蛋白粉溶液,调节溶液的pH为7.0后加入碱性蛋白酶0.83g,于45℃水浴恒温振荡器中酶解2h,反应结束后100℃沸水浴灭酶10min。
2、将上述酶解液的pH调整为6.5,然后加入0.83g木瓜蛋白酶,于65℃恒温振荡器中酶解4h,反应结束后100℃沸水浴灭酶10min,8000r/min下离心15min后取上清液。
3、将上清液经过真空浓缩,保持酶解液中底物浓度为3%(m/v)、盐酸浓度为0.4mol/L,于75℃恒温水浴中脱酰胺处理2h,反应结束后放置室温,4000r/min下离心10min取上清液得到脱酰胺酶解液。
4、将上述脱酰胺酶解液pH调至3.0,按照料液比0.15:1加入大孔吸附树脂AB-8,调整温度至30℃进行静态吸附6h,将富集处理后的多肽溶液过滤,收集滤液。
5、将上述滤液pH调节至4.0后按照肽钙质量比2:1加入无水氯化钙,迅速搅拌使其溶解,用保鲜膜封口后置于40℃水浴振荡器中反应40min。
6、反应结束后经过真空浓缩去除鳌合体系中三分之二的水分,在去除水分后的鳌合体系中加入5倍体积的无水乙醇,静置3h。
7、将静置后的鳌合体系进行离心,收集沉淀,用无水乙醇洗涤至上清液加入钙指示剂不变色,40℃烘干后即可获得花生肽钙螯合物。
根据实施例1中的方法制备模拟胃液和模拟小肠液。结果如图11-13所示,花生肽钙螯合物的钙结合能力为138.77mg/g,粒径为638nm,电势为-19.2mV;如图14、15所示,花生肽钙螯合物在模拟胃液中消化3.5h后释放率为62.2%;在模拟小肠液中消化3h后溶解度为59.4%;相较于CaCO
实施例3
本实施例中花生肽钙螯合物的制备方法包括以下步骤:
1、将50g花生蛋白粉溶于1000mL蒸馏水后得到质量浓度为5%的花生蛋白粉溶液,调节溶液的pH为8.0后加入碱性蛋白酶1.25g,于50℃水浴恒温振荡器中酶解3h,反应结束后100℃沸水浴灭酶10min。
2、将上述酶解液的pH调整为6.0,然后加入1.25gProteAXH肽酶,于45℃恒温振荡器中酶解2h,反应结束后100℃沸水浴灭酶10min,8000r/min下离心15min后取上清液。
3、将上清液经过真空浓缩,保持酶解液中底物浓度为3%(m/v)、盐酸浓度为0.4mol/L,于90℃恒温水浴中脱酰胺处理5h,反应结束后放置室温,4000r/min下离心10min取上清液得到脱酰胺酶解液。
4、将上述脱酰胺酶解液pH调至2.0,按照料液比0.2:1加入大孔吸附树脂DM301,调整温度至30℃进行静态吸附12h,将富集处理后的多肽溶液过滤,收集滤液。
5、将上述滤液pH调节至8.0后按照肽钙质量比2:1加入无水氯化钙,迅速搅拌使其溶解,用保鲜膜封口后置于50℃水浴振荡器中反应80min。
6、反应结束后经过真空浓缩去除鳌合体系中三分之二的水分,在去除水分后的鳌合体系中加入5倍体积的无水乙醇,静置3h。
7、将静置后的鳌合体系进行离心,收集沉淀,用无水乙醇洗涤至上清液加入钙指示剂不变色,40℃烘干后即可获得花生肽钙螯合物。
根据实施例1中的方法制备模拟胃液和模拟小肠液。结果如图11-13所示,花生肽钙螯合物的钙结合能力为164.34mg/g,粒径为612nm,电势为-16.5mV;如图14、15所示,花生肽钙螯合物在模拟胃液中消化3.5h后释放率为63.4%;在模拟小肠液中消化3h后溶解度为58.3%;相较于CaCO
实施例4
本实施例中花生肽钙螯合物的制备方法包括以下步骤:
1、将50g花生蛋白粉溶于1000mL蒸馏水后得到质量浓度为5%的花生蛋白粉溶液,调节溶液的pH为9.0后加入碱性蛋白酶1.67g,于55℃水浴恒温振荡器中酶解4h,反应结束后100℃沸水浴灭酶10min。
2、将上述酶解液的pH调整为6.0,然后加入1.67g外切蛋白酶,于45℃恒温振荡器中酶解3h,反应结束后100℃沸水浴灭酶10min,8000r/min下离心15min后取上清液。
3、将上清液经过真空浓缩,保持酶解液中底物浓度为3%(m/v)、盐酸浓度为0.8mol/L,于85℃恒温水浴中脱酰胺处理4h,反应结束后放置室温,4000r/min下离心10min取上清液得到脱酰胺酶解液。
4、将上述脱酰胺酶解液pH调至4.0,按照料液比0.25:1加入大孔吸附树脂XAD-2,调整温度至40℃进行静态吸附12h,将富集处理后的多肽溶液过滤,收集滤液。
5、将上述滤液pH调节至6.0后按照肽钙质量比4:1加入无水氯化钙,迅速搅拌使其溶解,用保鲜膜封口后置于60℃水浴振荡器中反应80min。
6、反应结束后经过真空浓缩去除鳌合体系中三分之二的水分,在去除水分后的鳌合体系中加入5倍体积的无水乙醇,静置3h。
7、将静置后的鳌合体系进行离心,收集沉淀,用无水乙醇洗涤至上清液加入钙指示剂不变色,40℃烘干后即可获得花生肽钙螯合物。
根据实施例1中的方法制备模拟胃液和模拟小肠液。结果如图11-13所示,花生肽钙螯合物的钙结合能力为149.57mg/g,粒径为534nm,电势为-20.3mV;如图14、15所示,花生肽钙螯合物在模拟胃液中消化3.5h后释放率为60.2%;在模拟小肠液中消化3h后溶解度为59%;相较于CaCO
实施例5
本实施例中花生肽钙螯合物的制备方法包括以下步骤:
1、将50g花生蛋白粉溶于1000mL蒸馏水后得到质量浓度为5%的花生蛋白粉溶液,调节溶液的pH为10.0后加入碱性蛋白酶2.9g,于55℃水浴恒温振荡器中酶解3h,反应结束后100℃沸水浴灭酶10min。
2、将上述酶解液的pH调整为7.0,然后加入2.9g ProteAXH肽酶,于50℃恒温振荡器中酶解4h,反应结束后100℃沸水浴灭酶10min,8000r/min下离心15min后取上清液。
3、将上清液经过真空浓缩,保持酶解液中底物浓度为3%(m/v)、盐酸浓度为1.0mol/L,于90℃恒温水浴中脱酰胺处理5h,反应结束后放置室温,4000r/min下离心10min取上清液得到脱酰胺酶解液。
4、将上述脱酰胺酶解液pH调至1.0,按照料液比0.3:1加入大孔吸附树脂ADS-7,调整温度至40℃进行静态吸附15h,将富集处理后的多肽溶液过滤,收集滤液。
5、将上述滤液pH调节至7.0后按照肽钙质量比5:1加入无水氯化钙,迅速搅拌使其溶解,用保鲜膜封口后置于70℃水浴振荡器中反应100min。
6、反应结束后经过真空浓缩去除鳌合体系中三分之二的水分,在去除水分后的鳌合体系中加入10倍体积的无水乙醇,静置3h。
7、将静置后的鳌合体系进行离心,收集沉淀,用无水乙醇洗涤至上清液加入钙指示剂不变色,40℃烘干后即可获得花生肽钙螯合物。
根据实施例1中的方法制备模拟胃液和模拟小肠液。结果如图11-13所示,花生肽钙螯合物的钙结合能力为154.00mg/g,粒径为556nm,电势为-18.7mV;如图14、15所示,花生肽钙螯合物在模拟胃液中消化3.5h后释放率为63.4%;在模拟小肠液中消化3h后溶解度为58%;相较于CaCO
实施例6
本实施例中花生肽钙螯合物的制备方法包括以下步骤:
1、将50g花生蛋白粉溶于1000mL蒸馏水后得到质量浓度为5%的花生蛋白粉溶液,调节溶液的pH为8.0后加入碱性蛋白酶0.42g,于50℃水浴恒温振荡器中酶解2h,反应结束后100℃沸水浴灭酶10min。
2、将上述酶解液的pH调整为7.0,然后加入0.42g复合蛋白酶,于50℃恒温振荡器中酶解4h,反应结束后100℃沸水浴灭酶10min,8000r/min下离心15min后取上清液。
3、将上清液经过真空浓缩,保持酶解液中底物浓度为3%(m/v)、盐酸浓度为0.4mol/L,于95℃恒温水浴中脱酰胺处理4h,反应结束后放置室温,4000r/min下离心10min取上清液得到脱酰胺酶解液。
4、将上述脱酰胺酶解液pH调至8.0,按照料液比0.3:1加入离子树脂IRA900C1,调整温度至50℃进行静态吸附18h,将富集处理后的多肽溶液过滤,收集滤液。
5、将上述滤液pH调节至8.0后按照肽钙质量比3:1加入无水氯化钙,迅速搅拌使其溶解,用保鲜膜封口后置于50℃水浴振荡器中反应120min。
6、反应结束后经过真空浓缩去除鳌合体系中三分之二的水分,在去除水分后的鳌合体系中加入5倍体积的无水乙醇,静置3h。
7、将静置后的鳌合体系进行离心,收集沉淀,用无水乙醇洗涤至上清液加入钙指示剂不变色,40℃烘干后即可获得花生肽钙螯合物。
根据实施例1中的方法制备模拟胃液和模拟小肠液。结果如图11-13所示,花生肽钙螯合物的钙结合能力为146.34mg/g,粒径为519nm,电势为-21.8mV;如图14、15所示,花生肽钙螯合物在模拟胃液中消化3.5h后释放率为61.2%;在模拟小肠液中消化3h后溶解度为54%;相较于CaCO
以上实施例仅用以说明本发明的技术方案,而非对其进行限制;尽管参照前述实施例对本发明进行了详细的说明,对于本领域的普通技术人员来说,依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或替换,并不使相应技术方案的本质脱离本发明所要求保护的技术方案的精神和范围。
- 一种钙螯合肽及其制备方法和应用
- 一种具有抗氧化活性的裂壶藻肽螯合钙的制备方法
- 一种花生肽-钙、锌螯合物的制备方法
- 一种花生肽-钙螯合物的制备方法
