乳酸球菌的增殖促进剂
文献发布时间:2024-04-18 19:58:26
关联申请的参照
本申请享有在先的日本申请日本特愿2021-75882(申请日:2021年4月28日)和日本特愿2021-101500(申请日:2021年6月18日)的优先权的权益,其全部公开内容通过引用而成为本说明书的一部分。
技术领域
本发明涉及乳酸球菌的增殖促进剂。本发明另外涉及乳酸球菌用培养基和乳酸球菌的培养方法、以及乳酸球菌的增殖促进方法。
背景技术
乳酸球菌的培养中,通常使用LB培养基、MRS培养基等。但是,根据培养基的种类,有时无法充分得到乳酸球菌的增殖。作为以往的高效培养乳酸球菌的方法,已知专利文献1、专利文献2。
现有技术文献
专利文献
专利文献1:日本特开2020-137456号公报
专利文献2:日本特开2020-22393号公报
发明内容
本发明的目的在于,提供乳酸球菌的新的增殖促进剂。另外,本发明的目的在于提供新的乳酸球菌用培养基和乳酸球菌的新的培养方法、以及乳酸球菌的新的增殖促进方法。
本发明人发现,在乳酸球菌的培养中,通过使培养基中含有二羧酸或其盐,可促进乳酸球菌的增殖。本发明基于该见解。
根据本发明,提供以下的发明。
[1]一种乳酸球菌的增殖促进剂,其含有二羧酸和/或其盐作为有效成分。
[2]根据上述[1]所述的增殖促进剂,其中,二羧酸为碳原子数4~6的脂肪族二羧酸。
[3]根据上述[1]或[2]所述的增殖促进剂,其中,二羧酸和/或其盐为选自由苹果酸、α-酮戊二酸和它们的盐组成的组中的1种或2种以上。
[4]根据上述[1]~[3]中任一项所述的增殖促进剂,其中,乳酸球菌为乳球菌属细菌。
[5]根据上述[1]~[4]中任一项所述的增殖促进剂,其中,乳酸球菌为乳酸乳球菌乳酸亚种JCM5805。
[6]根据上述[1]~[5]中任一项所述的增殖促进剂,其中,在培养基中以0.01~8质量%的浓度使用二羧酸和/或其盐。
[7]根据上述[1]~[6]中任一项所述的增殖促进剂,其添加于实质上不含畜肉提取物的培养基中。
[8]一种乳酸球菌用培养基,其含有二羧酸和/或其盐。
[9]根据上述[8]所述的培养基,其以0.01~8质量%的浓度含有二羧酸和/或其盐。
[10]根据上述[8]或[9]所述的培养基,其实质上不含畜肉提取物。
[11]一种乳酸球菌的培养方法,其包括用上述[8]~[10]中任一项所述的培养基培养乳酸球菌的工序。
[12]一种乳酸球菌的增殖促进方法,其包括向乳酸球菌的培养基中添加二羧酸和/或其盐的工序。
[13]二羧酸和/或其盐作为乳酸球菌的增殖促进剂的应用。
根据本发明,通过使培养基含有二羧酸或其盐、并培养乳酸球菌,可以促进乳酸球菌的增殖,因此在能够简便且高效地培养乳酸球菌方面是有利的。另外,根据本发明,即使在不含畜肉提取物的培养基中,通过使其含有二羧酸或其盐,也能够促进乳酸球菌的增殖,在这方面也是有利的。
附图说明
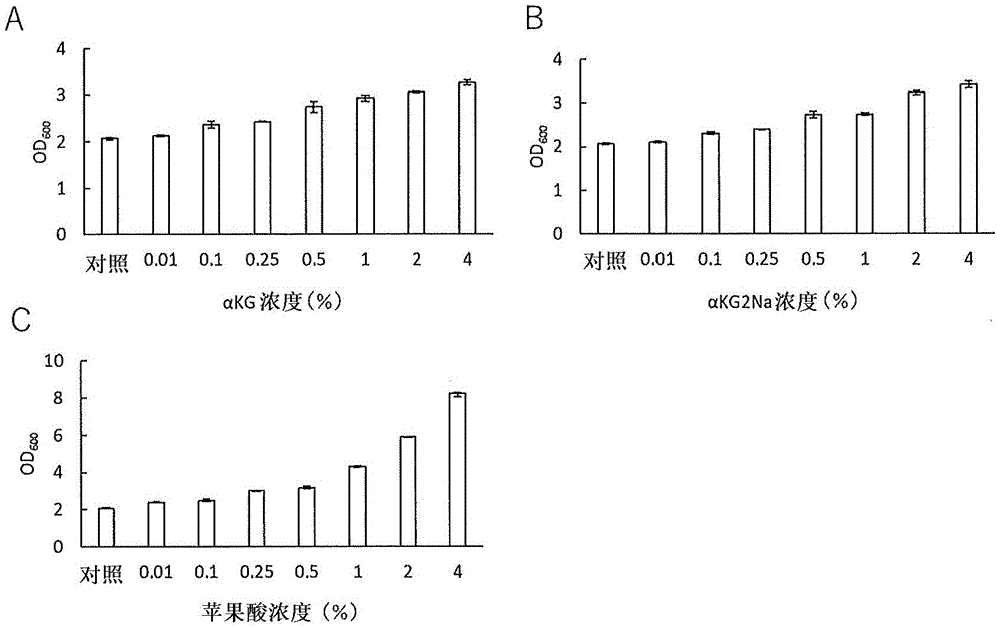
图1示出在厌氧培养条件下向MRS培养基中添加α-酮戊二酸或其盐或者苹果酸时的各浓度下的乳酸乳球菌乳酸亚种的菌量(图1A:α-酮戊二酸(αKG)、图1B:α-酮戊二酸二钠盐(αKG2Na)、图1C:苹果酸)。对照示出不添加二羧酸的情况。
图2示出在需氧培养条件下向MRS培养基中添加α-酮戊二酸或苹果酸时的各浓度下的乳酸乳球菌乳酸亚种的菌量(图2A:α-酮戊二酸(αKG)、图2B:苹果酸)。对照表示不添加二羧酸的情况。
图3示出在厌氧培养条件下向GM17培养基中添加α-酮戊二酸(αKG)或苹果酸时的各浓度下的乳酸球菌的菌量。对照表示不添加二羧酸的情况。
图4示出在需氧培养条件下向GM17培养基中添加α-酮戊二酸或苹果酸时的各浓度下的乳酸乳球菌乳酸亚种的菌量(图4A:α-酮戊二酸(αKG)、图4B:苹果酸)。对照表示不添加二羧酸的情况。
图5示出在厌氧培养条件下向MRS培养基中添加α-酮戊二酸(αKG)时的各浓度下的各种乳酸球菌的菌量。对照表示不添加二羧酸的情况。
图6示出在厌氧培养条件下向MRS培养基中添加α-酮戊二酸(αKG)时的各浓度下的乳杆菌属的乳酸杆菌的菌量。对照表示不添加二羧酸的情况。
图7示出在厌氧培养条件下向MRS培养基中添加柠檬酸时的各浓度下的乳酸乳球菌乳酸亚种的菌量。对照示出不添加柠檬酸的情况。
图8示出在厌氧培养条件下向MRS培养基中添加α-酮戊二酸(αKG)或苹果酸时的各浓度下的片球菌属的乳酸球菌的菌量。对照表示不添加二羧酸的情况。
图9示出在厌氧培养条件下向不含畜肉提取物的MRS培养基中添加α-酮戊二酸(αKG)时的各浓度下的各种乳酸球菌的菌量。对照表示不添加二羧酸的情况。
图10示出在厌氧培养条件下在不含畜肉提取物的培养基(无畜肉提取物)和含有畜肉提取物的培养基(有畜肉提取物)中的各种乳酸球菌的菌量。
具体实施方式
本发明的增殖促进剂可以用于乳酸球菌的培养。成为增殖促进对象的乳酸球菌没有特别限定,可列举例如乳球菌(Lactococcus)属、明串珠菌(Leuconostoc)属、片球菌(Pediococcus)属、链球菌(Streptococcus)属等的乳酸球菌。
作为乳球菌属的乳酸球菌,可列举例如:乳酸乳球菌(
作为乳球菌属细菌的具体例,可列举例如乳酸乳球菌乳酸亚种JCM5805、乳酸乳球菌乳酸亚种NBRC12007、乳酸乳球菌乳酸亚种NRIC1150、乳酸乳球菌乳酸亚种JCM20101、乳酸乳球菌乳酸亚种JCM7638、乳酸乳球菌乳酸亚种ATCC11454、格氏乳球菌NBRC100934、乳酸乳球菌乳脂亚种JCM16167、乳酸乳球菌乳脂亚种NBRC100676、乳酸乳球菌叶蝉亚种JCM1180和乳酸乳球菌叶蝉亚种JCM11040等,优选为乳酸乳球菌乳酸亚种JCM5805。
作为明串珠菌属细菌,可列举例如乳酸明串珠菌等。作为明串珠菌属细菌的具体例,可列举例如乳酸明串珠菌NBRC12455等。
作为片球菌属细菌,可列举例如乳酸片球菌(
作为链球菌属细菌,可列举例如嗜热链球菌等。
上述乳酸球菌株中,JCM菌株可以从理化学研究所生物资源中心微生物材料开发室(茨城县筑波市高野台3丁目1番地之1)获得,NBRC菌株可以从独立行政法人制品评价技术基础机构生物遗传资源部门(千叶县木更津市上总镰足2丁目5番8号)获得,NRIC菌株可以从东京农业大学菌株保存室(东京都世田谷区樱丘1丁目1番1号)获得,ATCC菌株可以从美国典型培养物保藏中心(American type culture collection,美国)获得。
乳酸乳球菌乳酸亚种JCM5805菌株如上所述可以从理化学研究所生物资源中心微生物材料开发室获得,本发明中可以使用保存在理化学研究所生物资源中心微生物材料开发室以外的保存机构的JCM5805菌株的相同菌株。具体而言,JCM5805菌株的相同菌株可以从独立行政法人制品评价技术基础机构生物遗传资源部门(千叶县木更津市上总镰足2丁目5番8号)、东京农业大学菌株保存室(东京都世田谷区樱丘1丁目1番1号)和美国典型培养物保藏中心(American type culture collection,美国)等获得。
作为本发明的增殖促进剂的有效成分的二羧酸只要是在其结构中具有2个羧基的化合物,则没有特别限定,可以优选使用脂肪族二羧酸。构成脂肪族二羧酸的烃链优选为饱和烃链。脂肪族二羧酸可以在其烃链的碳原子上进一步具有氧代基(=O)和/或羟基(-OH)。本发明中,脂肪族二羧酸优选为碳原子数4~6个的脂肪族二羧酸、更优选为碳原子数4或5的脂肪族二羧酸。作为碳原子数4~6个的脂肪族二羧酸,可列举例如酮戊二酸(α-酮戊二酸(本说明书中有时称为“αKG”)、β-酮戊二酸(丙酮二羧酸))、苹果酸、己二酸、草酸、琥珀酸、马来酸、戊二酸等,优选为α-酮戊二酸和苹果酸中的任一者或两者。
本发明中,二羧酸可以为盐的形态,例如可列举金属盐、铵盐等。作为金属盐,可列举钠盐、钾盐等碱金属盐。作为铵盐,可列举铵、四甲基铵等盐。作为二羧酸的盐,可列举例如α-酮戊二酸钠盐、苹果酸钠盐等。需要说明的是,本发明的增殖促进剂可以以二羧酸及其盐中的任一者或两者作为有效成分。
二羧酸和/或其盐在培养基中的浓度(固体成分浓度)的下限值(以上或超过)可以设为0.01质量%、0.1质量%、0.25质量%、0.5质量%,其上限值(以下或低于)可以设为8质量%、4质量%、2质量%。这些下限值和上限值可以分别任意地组合。上述二羧酸和/或其盐在培养基中的浓度的范围例如可以设为0.01~8质量%、0.1~4质量%、0.25~4质量%、0.5~4质量%、0.5~3质量%、0.5~2质量%。本发明的增殖促进剂通过以达到上述那样的浓度范围的方式来设定二羧酸在培养基中的浓度并使用,从而可以促进乳酸球菌的增殖、高效地培养乳酸球菌。
本发明的增殖促进剂可以添加到培养乳酸球菌的培养基中而使用。本发明中可以使用的培养基只要是用于乳酸球菌的培养的培养基则没有特别限定,例如可列举MRS培养基(deMan,Rogosa,&Sharpe培养基)、M17培养基、LB培养基等。将本发明的增殖促进剂添加到培养基的时期可以为乳酸球菌的培养中,也可以在乳酸球菌的培养之前预先添加。本发明中可以使用的培养基中,可以含有畜肉提取物作为辅助营养成分等。作为畜肉提取物,可列举例如牛肉提取物、猪肉提取物、鸡肉提取物等。另一方面,从环境负荷、成本、食品安全性等观点出发,本发明中可以使用的培养基优选实质上不含畜肉提取物,更优选不含畜肉提取物。在此,“实质上不含”畜肉提取物例如可列举畜肉提取物的含量小于0.8质量%、小于0.5质量%、小于0.3质量%、小于0.1质量%、小于0.05质量%或小于0.01质量%的情况。在此,使用的畜肉提取物的性状可列举提取液、粉末、颗粒等。培养基中的畜肉提取物的含量通过将作为畜肉提取物的提取物纯度的固体成分质量除以培养基的质量再乘以100来计算。不含畜肉提取物的培养基可以通过在上述例示的培养基的原料中不使用畜肉提取物而适当地制备。本发明的增殖促进剂可以添加到不含畜肉提取物的培养基中而使用。
使用添加了本发明的增殖促进剂的培养基的乳酸球菌的培养条件没有特别限定,可以应用通常的乳酸球菌的培养条件。
乳酸球菌的培养期间可以设为20~48小时,从增殖期的观点出发,优选为20~30小时。
乳酸球菌的培养温度的下限值(以上或超过)可以设为20℃、25℃、28℃,其上限值(以下或低于)可以设为40℃、35℃、30℃。这些下限值和上限值可以分别任意地组合,培养温度的范围例如可以设为20~40℃、20~35℃、25~35℃、30~35℃,最优选设为约30℃。
乳酸球菌的培养可以为液体培养,也可以为固体培养。液体培养可以使用条件可控的发酵槽来进行,例如可列举搅拌培养、通气培养、振荡培养、静置培养等。培养可以为厌氧条件或需氧条件中的任一者。搅拌速度、通气量可根据微生物菌体的种类、培养条件适宜选择。
本发明中使用的培养基的pH只要不影响乳酸球菌的增殖即可,例如可以设为6.0~6.7的范围。培养基的pH可以适当调整,例如可以通过向培养基中添加氢氧化钠等碱、磷酸等酸来调整。
通过用添加了本发明的增殖促进剂的培养基来培养乳酸球菌,可得到乳酸球菌的培养物。所得到的乳酸球菌培养物可以直接、或在浓缩、稀释、干燥、分离、纯化等处理后配合于饮食品等。即,本发明的增殖促进剂可以在目的在于应用于饮食品的乳酸球菌的增殖促进中使用,从该观点出发,本发明中可以使用允许作为食品的二羧酸和/或其盐来作为有效成分。
根据本发明的另一方面,提供含有二羧酸和/或其盐的乳酸球菌用培养基。本发明的乳酸球菌用培养基可以按照与本发明的增殖促进剂有关的记载来实施。根据本发明的乳酸球菌用培养基,可促进乳酸球菌的增殖,因此在能够高效地培养乳酸球菌方面是有利的。
根据本发明的另一方面,另外提供乳酸球菌的培养方法,其包括用本发明的培养基培养乳酸球菌的工序。本发明的培养方法可以按照与本发明的增殖促进剂和本发明的培养基有关的记载来实施。
根据本发明的另一方面,进一步提供乳酸球菌的增殖促进方法,其包括向乳酸球菌的培养基中添加二羧酸和/或其盐的工序。本发明的增殖促进方法可以按照与本发明的增殖促进剂有关的记载来实施。
根据本发明的另一方面,提供二羧酸和/或其盐作为乳酸球菌的增殖促进剂的应用、用于乳酸球菌的增殖促进的应用、或在本发明的乳酸球菌的增殖促进方法中的应用。本发明的应用可以按照与本发明的增殖促进剂和方法有关的记载来实施。
实施例
基于以下的例子更具体地说明本发明,但是本发明不受这些例子限定。
例1:二羧酸对乳酸球菌的增殖促进效果的研究(1)
例1中研究了二羧酸对乳酸球菌的增殖促进效果。
(1)方法
a菌体
作为乳酸球菌,使用乳酸乳球菌乳酸亚种JCM5805菌株(
b培养方法
(i)厌氧培养
培养基使用MRS培养基(MRS BROTH,CODE:CM0359,Oxoid公司,组成示于表1,本说明书的例3~6中同样)。将作为二羧酸的α-酮戊二酸(富士胶片和光纯药公司)、α-酮戊二酸二钠(本说明书中有时称为“αKG2Na”)(富士胶片和光纯药公司)和苹果酸(东京化成工业公司)以图1所示的浓度(0.01~4.0质量%)分别添加于培养基,以与对照(不添加二羧酸的培养基)达到相同pH的方式添加氢氧化钠(pH6.2±0.2)。然后,在15ml锥形管(FALCON)中,以菌体的浓度相对于所制备的培养基10ml达到0.1%(v/v)的方式进行接种(播种),在培养箱(东京理化器械公司)中在30℃培养24小时(静置培养)。
[表1]
表1:MRS培养基的组成
(ii)需氧培养
培养基使用MRS培养基。将作为二羧酸的α-酮戊二酸、α-酮戊二酸二钠和苹果酸以图2所示的浓度(0.5~2.0质量%)分别添加于培养基,以与对照(不添加二羧酸的培养基)达到相同pH的方式添加氢氧化钠(pH6.2±0.2)。然后,以菌体的浓度相对于培养基10ml达到0.1%(v/v)的方式进行接种(播种),将接种后的培养基供于自动培养探索装置OT-201(东方科学仪器公司,本说明书中有时称为“生物绘图仪”),在30℃培养24小时(搅拌强度条件:中等(Medium))。
c菌数的测定
关于菌数的测定,通过使用吸光度计(Biochrom GeneQuant1300)测定培养基的OD600(浊度)来进行。
d统计分析
测定值以平均值±标准误差来表示。进行单因素方差分析后进行Tukey检验,相对于对照组p<0.05时,认为有显著性差异。
(2)结果
结果如图1和图2所示。厌氧培养中,相对于对照(不添加二羧酸的培养基),添加了αKG(图1A)和苹果酸(图1C)的培养基中,确认到浓度依赖性地显著促进乳酸球菌的增殖。另外,相对于对照(不添加二羧酸的培养基),添加了αKG2Na(图1B)的培养基中,在0.1~4质量%时确认到浓度依赖性地显著促进乳酸球菌的增殖,在0.01质量%时也有促进乳酸球菌的增殖的倾向。同样地,在需氧培养中,相对于对照(不添加二羧酸的培养基),添加了αKG(图2A)和苹果酸(图2B)的培养基中,也确认到浓度依赖性地显著促进乳酸球菌的增殖。同样地,在向不含畜肉提取物的培养基中添加二羧酸及其盐中的任一者时,也确认到促进乳酸球菌的增殖。
例2:二羧酸对乳酸球菌的增殖促进效果的研究(2)
例2中,使用与例1中使用的培养基不同的培养基研究了二羧酸对乳酸球菌的增殖促进效果。
(1)方法
a菌体
使用例1(1)a中记载的乳酸球菌。
b培养方法
(i)厌氧培养
培养基使用在M17培养基(Difco M17 Broth,BD公司,组成示于表2,本说明书中以下同样)中添加有20g/L的葡萄糖的培养基(本说明书中有时称为“GM17培养基”)。将作为二羧酸的α-酮戊二酸和苹果酸以图3所示的浓度(0.5~2质量%)分别添加于培养基,以与对照(不添加二羧酸的培养基)达到相同pH的方式添加氢氧化钠(pH6.5±0.2)。然后,在15ml锥形管(FALCON)中,以菌体的浓度相对于所制备的培养基10ml达到0.1%(v/v)的方式进行接种(播种),在培养箱(东京理化器械公司)中在30℃培养24小时(静置培养)。
[表2]
表2:M17培养基的组成
(ii)需氧培养
培养基使用GM17培养基。将作为二羧酸的α-酮戊二酸和苹果酸以图4所示的浓度(0.5~2质量%)分别添加于培养基,以与对照(不添加二羧酸的培养基)达到相同pH的方式添加氢氧化钠(pH6.5±0.2)。然后,以菌体的浓度相对于所制备的培养基10ml达到0.1%(v/v)的方式进行接种(播种),将接种后的培养基供于自动培养探索装置OT-201(东方科学仪器公司,本说明书中有时称为“生物绘图仪”),在30℃培养24小时(搅拌强度条件:中等)。
c菌数的测定
与例1(1)c的记载同样地进行。
d统计分析
与例1(1)d的记载同样地进行。
(2)结果
结果如图3和图4所示。厌氧培养中,相对于对照(不添加二羧酸的培养基),添加了αKG(图3A)和苹果酸(图3B)的培养基中,确认到显著促进乳酸球菌的增殖。同样地,在需氧培养中,相对于对照(不添加二羧酸的培养基),添加了αKG(图4A)和苹果酸(图4B)的培养基中,也确认到浓度依赖性地促进乳酸球菌的增殖。由例1和例2的结果确认,不论培养基的种类如何,通过二羧酸均可显著促进乳酸球菌的增殖。
例3:二羧酸对乳酸球菌的增殖促进效果的研究(3)
例3中研究了α-酮戊二酸对各种乳酸球菌的增殖促进效果。
(1)方法
a菌体
作为菌体,使用表1中记载的乳酸球菌。
[表3]
表3:乳酸球菌列表
b培养方法
将作为二羧酸的α-酮戊二酸以2.0质量%的浓度添加于培养基,除此以外与例1(1)b(i)的记载同样地进行(厌氧培养)。
c菌数的测定
与例1(1)c的记载同样地进行。
d统计分析
测定值用平均值±标准误差来表示。进行Student-t检验,相对于对照组p<0.05时,认为有显著性差异。
(2)结果
结果如图5所示。关于格氏乳球菌、乳酸乳球菌乳脂亚种、乳酸乳球菌叶蝉亚种、乳酸乳球菌乳酸亚种和乳酸明串珠菌的乳酸球菌,相对于对照(不添加二羧酸的培养基),不论菌株,均确认到二羧酸会显著促进增殖。
例4:二羧酸对乳酸杆菌的增殖促进效果的研究(4)
例4中研究了α-酮戊二酸对乳杆菌属的乳酸杆菌的增殖促进效果。
(1)方法
a菌体
作为菌体,使用表2中记载的乳杆菌属的乳酸杆菌。
[表4]
表4:乳酸杆菌列表
b培养方法
将作为二羧酸的α-酮戊二酸以图6所示的浓度(0.5~2质量%)分别添加于培养基,除此以外与例1(1)b(i)的记载同样地进行(厌氧培养)。
c菌数的测定
与例1(1)c的记载同样地进行。
d统计分析
与例1(1)d的记载同样地进行。
(2)结果
结果如图6所示。对于乳杆菌属的乳酸杆菌,相对于对照(不添加二羧酸的培养基),未确认到二羧酸所带来的增殖促进。
例5:三羧酸对乳酸球菌的增殖促进效果的研究
例5中研究了三羧酸对乳酸球菌的增殖促进效果。
(1)方法
a菌体
使用与例1(1)a中记载的乳酸球菌同样的乳酸球菌。
b培养方法
在培养基中,代替二羧酸而将作为三羧酸的柠檬酸(富士胶片和光纯药公司)以图7所示的浓度(0.25~1质量%)分别添加于培养基,除此以外与例1(1)b(i)的记载同样地进行(厌氧培养)。
c菌数的测定
与例1(1)c的记载同样地进行。
d统计分析
与例1(1)d的记载同样地进行。
(2)结果
结果如图7所示。对于乳酸球菌,相对于对照(未添加柠檬酸的培养基),虽然确认到柠檬酸显著促进增殖,但是增殖促进效果的程度是二羧酸更大。
例6:二羧酸对乳酸球菌的增殖促进效果的研究(4)
例6中研究了二羧酸对片球菌属的乳酸球菌的增殖促进效果。
(1)方法
a菌体
作为菌体,使用表5中记载的片球菌属的乳酸球菌。
[表5]
表5:乳酸球菌列表
b培养方法
将作为二羧酸的α-酮戊二酸(以图8A(0.1~4质量%)和图8C(1~4质量%)所示的浓度)和苹果酸(以图8B(0.1~2质量%)和图8D(1~2质量%)所示的浓度)分别添加于培养基,除此以外与例1(1)b(i)的记载同样地进行(厌氧培养)。
c菌数的测定
与例1(1)c的记载同样地进行。
d统计分析
与例1(1)d的记载同样地进行。
(2)结果
结果如图8所示。关于片球菌属的乳酸球菌,相对于对照(不添加二羧酸的培养基),在添加了αKG(图8A和C)和苹果酸(图8B和D)的培养基中,确认到浓度依赖性地显著促进增殖。
例7:二羧酸对乳酸球菌的增殖促进效果的研究(5)
例7中研究了在不含畜肉提取物的培养基中二羧酸对乳酸球菌的增殖促进效果。
(1)方法
a菌体
作为菌体,使用表6中记载的乳酸球菌。
[表6]
表6:剖,酸球菌列表
b培养方法
培养基使用按照表7所示的组成进行了调整的MRS培养基(添加磷酸而调节为pH6.2)。将作为二羧酸的α-酮戊二酸以2.0质量%的浓度添加于培养基,以与对照(不添加二羧酸的培养基)达到相同pH的方式添加氢氧化钠(pH6.2±0.2)。然后,
在15ml锥形管(FALCON)中,以菌体的浓度相对于所制备的培养基10ml达到0.1%(v/v)的方式进行接种(播种),在培养箱(东京理化器械公司)中在30℃培养24小时(静置培养)。
[表7]
表7:MRS培养基的组成(不含畜肉提取物)
c菌数的测定
与例1(1)c的记载同样地进行。
d统计分析
与例1(1)d的记载同样地进行。
(2)结果
结果如图9所示。在不含畜肉提取物的培养基中,通过添加二羧酸,使乳酸乳球菌乳酸亚种、格氏乳球菌、乳酸乳球菌乳脂亚种、乳酸乳球菌叶蝉亚种和乳酸明串珠菌的乳酸球菌相对于对照(不添加二羧酸的培养基)确认到显著促进增殖。
例8:培养基中的畜肉提取物对乳酸球菌的增殖带来的影响的研究
例8中研究了培养基中的畜肉提取物对乳酸球菌的增殖带来的影响。
(1)方法
a菌体
作为菌体,使用表8中记载的乳酸球菌。
[表8]
表8:乳酸球菌列表
b培养方法
不含畜肉提取物的培养基使用按照表7所示的组成进行了调整的MRS培养基(初始pH为7.0左右,因此添加磷酸而调节为pH6.2)。含有畜肉提取物的培养基使用按照表9所示的组成制备的MRS培养基(添加磷酸而调节为pH6.2)。然后,在15ml锥形管(FALCON)中,以菌体的浓度相对于所制备的培养基10ml达到0.1%(v/v)的方式进行接种(播种),在培养箱(东京理化器械公司)中在30℃培养24小时(静置培养)。
[表9]
表9:MRS培养基的组成(含有畜肉提取物)
c菌数的测定
与例1(1)c的记载同样地进行。
d统计分析
与例1(1)d的记载同样地进行。
(2)结果
结果如图10所示。使用仅有无畜肉提取物这一点不同的培养基研究对乳酸球菌的增殖带来的影响,结果确认到,对于乳酸球菌的增殖,相较于不含畜肉提取物的培养基,含有畜肉提取物的培养基显著更高。另外,根据例7和例8的结果,向不含畜肉提取物的培养基中添加了二羧酸的培养基相较于含有畜肉提取物的培养基(未添加二羧酸),OD
- 新型乳酸球菌噬菌体Lac-GAP-1及其用于抑制乳酸球菌增殖的用途
- 新型乳酸球菌噬菌体Lac‑GAP‑1及其用于抑制乳酸球菌增殖的用途
