用于体外血液处理的系统和方法
文献发布时间:2023-06-19 19:30:30
技术领域
在本文中,本公开涉及体外血液处理。更具体地,本公开涉及诸如血液透析的体外血液处理在治疗癌症中的使用,以及用于这种治疗的系统和用于控制并且显示在这种体外血液处理期间记录的数据(s-g历史数据)的用户界面。
背景技术
大多数的人癌细胞显示出将它们与正常细胞区分开的改变的能量代谢。正常细胞通过线粒体氧化磷酸化、氧化葡萄糖的好氧过程获取其大部分能量,首先通过糖酵解且随后通过三羧酸(TCA)循环产生三磷酸腺苷。相反地,该途径仅在癌细胞中是继发性的。这在1920年代由Warburg首次观察到。他注意到,在癌细胞已经通过糖酵解代谢葡萄糖后,从丙酮酸盐产生乳酸盐。在正常细胞中,这仅在厌氧条件下发生,但在癌细胞中,即使在存在大量氧气的情况下,也增加了这种替代途径。这种现象被称为“好氧糖酵解”或“Warburg效应”(Warburg等人,1927年,Gen Physiol 8:519-530)。通过随后的研究证实了癌细胞中存在特征性糖酵解表型,该研究还观察到在大多数癌细胞中涉及糖酵解的酶的过度表达。
以上代谢转化赋予癌细胞选择性生长优势,并且有助于抵抗缺氧和凋亡的能力。由于肿瘤细胞增殖的速率超过新的血管形成的速率,许多肿瘤在低氧环境中生长。癌细胞中存在各种代谢变化,并且最常见和最众所周知的是它们通过好氧糖酵解产生能量的习惯。而且,糖酵解的许多中间体(诸如例如,核糖、甘油和丝氨酸)也是在癌细胞生长和增殖期间必需的生物合成途径和合成代谢途径的中间体。此外,糖酵解从ADP产生ATP,这允许维持肿瘤中的细胞生长。然而,糖酵解比氧化磷酸化效率低得多,因此需要大量的葡萄糖来产生足够量的ATP。因此,该代谢途径需要大量的葡萄糖。许多癌细胞对葡萄糖作为其主要能量供应者成瘾。由于多种原因,如果他们的葡萄糖供应是由针对性的,则糖酵解肿瘤细胞变得脆弱。
此外,许多癌细胞也显示出对谷氨酰胺的成瘾。依赖谷氨酰胺的细胞表现出高速率的谷氨酰胺高摄取不仅是由于其在核苷酸和氨基酸生物合成中作为氮源的作用,而且是由于谷氨酰胺是癌症中的主要线粒体基质,并且是产生用于氧化还原控制和大分子合成的NADPH所需的。
在于癌症中,存在其他代谢改变,其在存活方面具有重要作用,并且重要地,许多癌症显示出令人惊讶的改变其代谢图的良好能力。这种抵御环境挑战(诸如当葡萄糖、谷氨酰胺或氧气变低时)的可塑性对于癌细胞的存活是重要的。
此外,许多癌细胞也显示出对谷氨酰胺的依赖。依赖谷氨酰胺的癌细胞表现的谷氨酰胺摄取的高速率不仅是由于其作为核苷酸和氨基酸生物合成的氮源的作用,而且是由于谷氨酰胺是许多癌症中的主要线粒体代谢基质,并且是产生用于氧化还原控制和大分子合成的NADPH所需的。
在癌症中,存在许多代谢改变,并且诸如谷氨酰胺的各种氨基酸在癌症代谢中具有重要作用,以控制氧化还原平衡并且产生用于持续增殖的结构单元,此外,当需要采取新的代谢限制时,许多癌症显示出利用那些替代途径来改变其代谢图的令人惊讶的良好能力。当诸如葡萄糖、谷氨酰胺或氧气的代谢能量资源变得稀缺时,这种品质(能力)是癌症及其抵御环境挑战的能力的重要特征。
因此,为了通过代谢方法有效地影响癌症,从多于一个方向影响其代谢系统是重要的。降低的葡萄糖能够由大多数癌细胞容易地处理,但是如果若干代谢可能性同时地受影响(如减少葡萄糖和谷氨酰胺),则这些变化的总和变得比各个部分更具破坏性。
除了作为许多癌症的全局能量来源的葡萄糖、酮和谷氨酰胺之外,丝氨酸和甘氨酸满足维持癌症中的细胞生长和增殖的重要的特定需要,例如,通过单碳代谢。除了大量能量需求之外,癌细胞还必须积累用于构建新细胞组分(包括核酸、蛋白质和脂质)的结构单元,以及用于维持其细胞氧化还原状态同样地重要的辅因子(Amelio等人:Trends.Biochem.Sci.(2014年),Vol.39(4):191-198)。
研究已经证明精氨酸是细胞生长是必需的,并且在快速生长状态下可能成为限制性的,并且如果从癌细胞中去除,则也影响存活(Albaugh等人,J.Surg.Oncol.(2017),Vol.115(3),273-280)。
鉴于以上,已经提出降低的血糖可以作为针对广泛的糖酵解依赖性肿瘤的策略。在低血糖条件下,脂肪,特别是酮体能够代替葡萄糖作为正常细胞的主要代谢燃料,然而,许多肿瘤在代谢脂质和酮体以获取能量所需的基因和酶方面存在异常。因此,能量从碳水化合物到酮的转换具体地指向糖酵解依赖性肿瘤细胞中的能量代谢(Seyfried等人,2010年,Nutrition and Metabolism,7:7)。
根据这种方法,例如,WO2011070527公开了一种治疗个体中增生性疾病(癌性或非癌性)的方法,其中,血液透析设备用于降低血糖浓度。
为了降低血糖而使用血液透析设备具有以下优点:可以降低血液中的葡萄糖浓度,从而与饮食葡萄糖剥夺相比以更受控且有效的方式降低。然而,WO2011070527中公开的方法和设备需要连接至血液进入流、血液返回流和透析液的血糖传感器和血谷氨酰胺传感器,这些传感器都连接至血液透析机器的中央控制单元。此外,WO2011070527的中央控制单元还连接至脑电图仪(EEG),以便向中央单元提供与自发电脑活动有关的信息,以启动葡萄糖和谷氨酰胺水平的升高。如此大量的传感器和仪器导致高水平的复杂性以及相关联的高成本。此外,接受这种治疗的患者必须在进行治疗前几天仅摄入限制葡萄糖的饮食。这对患者来说并不是无关紧要的负担。
一直需要改进的治疗癌症的方法。
发明内容
在本发明的第一方面,提供了一种用于治疗患有癌症的对象的体外血液处理系统(50),系统包括:
体外血液回路(52a、52b);
透析液流体回路(54a、54b);
所述体外血液回路(52a、52b)和透析液流体回路(54a、54b)由过滤单元(58)的膜(59)分开;
至少一个血液泵(60),用于控制通过血液回路(52a、52b)的血液的流动;
至少一个透析液流体泵(62、68),用于控制通过透析液流体回路(54a、54b)的透析液流体的流动;
可选地,一个或多个输注管线(66、80、81、82),每个输注管线被连接至体外血液回路(52a、52b)或适于直接地连接至待治疗的对象的血管系统,每个输注管线包括输注泵;
系统计算单元(64),所述系统计算单元可操作地连接至血液泵(60)和透析液流体泵(62、68),并且可选地,可操作地连接至一个或多个输注管线(66、80、81、82)的一个或多个输注泵,所述系统计算单元具有用户界面,所述用户界面包括输入装置和显示装置;其中
系统计算单元(64)适于接收(901)在0.1mM和0.5mM的范围内的谷氨酰胺的期望血液浓度值GLN
系统计算单元(64)适于接收(903)在2mM至4mM的范围内的葡萄糖的期望血液浓度值GLUCOSE
系统计算单元(64)适于接收(905)在1mM至15mM的范围内的诸如乙酰乙酸盐、β-羟基丁酸盐或药学上能接受的乙酰乙酸盐、β-羟基丁酸盐的衍生物、酯和盐的酮体的期望血液浓度值KETONE
系统计算单元(64)适于接收(902)浓度值GLN
系统计算单元(64)适于接收(904)浓度值GLUCOSE
可选地,系统计算单元(64)适于接收(907)浓度值KETONE
可选地,系统计算单元(64)适于通过一个或多个输注管线(66、80、81、82)中的一个输注管线接收(906)浓度值KETONE
系统计算单元(64)适于接收(911)来自被治疗的对象的血液中谷氨酰胺的实际浓度值GLN
系统计算单元(64)适于控制所述血液泵(60)和所述透析液流体泵(62、68),以此使得谷氨酰胺的实际血液浓度值GLN
并且,
如果系统(50)包括所述输注管线(66、80、81、82)中的一个或多个输注管线,并且在所述输注管线(66、80、81、82)中的一个输注管线适于将所述输注液体输注至体外血液管线(52b)中或将所述输注液体直接地输注至待治疗的对象的血管系统中的情况下,系统计算单元(64)适于控制所述输注管线的输注泵,以此使得实际血液浓度值KETONE
或者,
如果系统(50)不包括此类输注管线(66、80、81、82),则系统计算单元(64)适于将KETONE
在本公开中,术语“对象”涉及需要治疗的人或动物患者。
在优选实施例中,体外血液处理系统(50)包括所述输注管线(60、80、81、82)中的一个或多个输注管线,并且系统计算单元(64)适于通过所述一个或多个输注管线(66、80、81、82)中的一个输注管线接收(906)浓度值KETONE
系统计算单元(64)适于控制所述输注管线的输注泵,以此使得实际血液浓度值KETONE
在优选实施例中,系统计算单元(64)适于监测GLN
术语“药学上能接受的包含谷氨酰胺的化合物”涉及寡肽,通常是氨基酸残基中的至少一个氨基酸残疾是谷氨酰胺的二肽。此类二肽的典型示例是L-丙氨酰-L-谷氨酰胺和L-甘氨酰-L-谷氨酰胺。在液体组合物中通常使用包含谷氨酰胺的化合物代替谷氨酰胺,以便增强稳定性和溶解性。
术语“酮体”涉及可以由肝脏从脂肪酸产生的含有酮基的水溶性分子。通常,根据本发明的酮体是β-羟基丁酸盐或药学上能接受的β-羟基丁酸盐的衍生物,诸如其对映体(R)-β-羟基丁酸、(S)-β-羟基丁酸盐或对映体混合物、或其药学上能接受的盐、其药学上能接受的酯、以及乙酰乙酸盐。根据本发明,中链甘油三酯也被认为是酮体的衍生物。术语“中链甘油三酯”或“MCT油”是具有两个或三个脂肪酸的甘油三酯,具有6至12个碳原子的脂肪族尾部。这样的中链甘油三酯或MCT油可以在人体中转化成酮体。包含酮体或酮体衍生物的输注液的示例是
优选地,过滤膜具有小于60kDa的截留分子量(MWCO)
更优选地,过滤膜具有小于约50kDa或小于约40kDa(诸如小于30kDa、小于10kDa、小于5kDa或小于2kDa)的MWCO。
优选地,血液回路包括热管理系统,所述热管理系统用于在使用期间加热或冷却血液管线中的血液。
更优选地,热管理系统是可控制将血液回路中的血液的温度调节至在20℃至43℃之间的温度的。
优选地,系统(50)还包括一个或多个传感器(S、90、91、92、93),用于检测选自葡萄糖组、谷氨酰胺和酮体的分析物,传感器(S、90、91、92、93)优选地定位在透析液流体回路的流出物部分(54a)中,传感器与系统处理单元(64)通信并且提供指示血液中或优选地用过的透析液流体中的分析物的浓度的输出;其中,系统处理单元(64)被配置成从传感器(S、90、91、92、93)的输出中确定分析物的代表性血液浓度,从而监测GLN
在第二方面中,本发明提供了一种用于在根据第一方面的体外血液处理系统(50)中使用的治疗装置,装置包括过滤单元(58),所述过滤单元具有膜(59),所述膜(59)将集成的血液管线(52a、52b)和集成的透析液流体管线(54a、54b)分开,其中,血液管线(52a、52b)和/或透析液流体管线(54a、54b)包括传感器(S、90、91、92、93),所述传感器(S、90、91、92、93)用于监测GLN
如以下示出的,用于分析谷氨酰胺、葡萄糖和酮体的合适的传感器和测定是本领域已知的。
在第三方面中,本发明提供了一种使用系统(50)治疗患有癌症的对象的方法,所述方法包括:
体外血液回路(52a、52b);
透析液流体回路(54a、54b);
所述体外血液回路(52a、52b)和所述透析液流体回路(54a、54b)由过滤单元(58)的膜(59)分开;
至少一个血液泵(60),用于控制通过血液回路(52a、52b)的血液的流动;
至少一个透析液流体泵(62、68),用于控制通过透析液流体回路(54a、54b)的透析液流体的流动;
以及可选地,一个或多个输注管线(66、80、81、82),每个输注管线被连接至体外回路(52a、52b)或适于直接地连接至要治疗的对象的血管系统,每个输注管线包括输注泵;
其中,该方法包括:
接收(901)浓度值GLN
接收(903)浓度值GLUCOSE
接收(905)浓度值KETONE
接收(902)浓度值GLN
接收(904)浓度值GLUCOSE
可选地,系统计算单元,
可选地,接收(907)浓度值KETONE
可选地,通过所述一个或多个输注管线(66、80、81、82)中的一个输注管线接收(906)浓度值KETONE
接收(909)浓度值GLN
接收(910)浓度值GLUCOSE
接收(911)浓度值KETONE
控制所述血液泵(60)和所述至少一个透析液流体泵(62、68),使得谷氨酰胺的实际浓度值GLN
并且,
如果系统(50)包括所述输注管线(66、80、81、82)中的一个或多个输注管线,并且所述输注管线(66、80、81、82)中的一个输注管线将所述输注液体输注至体外血液管线(52b)中或将所述输注液体直接地输注至要治疗的对象的血管系统中,则控制所述输注,以此使得KETONE
或者,
如果系统(50)不输注包含酮体的任何输注液体,则在KETONE
优选地,所述系统(50)包括所述输注管线(66、80、81、82)中的一个或多个输注管线,并且方法还包括:
接收(906)浓度值KETONE
通过所述一个或多个输注管线(66、80、81、82)中的一个输注管线将所述输注液体输注至体外血液管线(52b)中或将所述输注液体直接地输注至待治疗的对象的血管系统中;并且
控制所述输注管线的输注泵,以此使得实际血液浓度值KETONE
优选地,癌症选自人结肠癌和胶质母细胞瘤,以及前列腺癌、乳腺癌和肝癌。
在第四方面中,本发明提供了一种适于控制用于治疗患有癌症的对象的体外血液处理系统(50)的系统计算单元(64);所述系统计算单元包括:
多个输出装置,所述多个输出装置适于可操作地连接至至少一个血液泵(60)、至少一个透析液流体泵(62、68)以及可选地一个或多个输注泵,用于控制一个或多个输注管线(66、80、81、82)中的每一个输注管线中的流动;
用户界面,所述用户界面包括输入装置和显示装置;以及
存储器装置和计算装置;
系统计算单元(64)适于接收(901)谷氨酰胺的期望血液浓度值GLN
系统计算单元(64)适于接收(903)葡萄糖的期望血液浓度值GLUCOSE
系统计算单元(64)适于接收(905)酮体的期望血液浓度值KETONE
系统计算单元(64)适于接收(902)谷氨酰胺的透析液浓度值GLN
系统计算单元(64)适于接收(904)葡萄糖的透析液浓度值GLUCOSE
可选地,系统计算单元(64)适于接收(907)浓度值KETONE
可选地,系统计算单元(64)适于接收(906)酮体的输注液体浓度值KETONE
系统计算单元(64)适于接收(909)谷氨酰胺的实际血液浓度值GLN
系统计算单元(64)适于接收(910)葡萄糖的实际血液浓度值GLUCOSE
系统计算单元(64)适于接收(911)从β-羟基丁酸盐和乙酰乙酸盐的组选择的酮体的实际血液浓度值KETONE
系统计算单元(64)适于控制所述血液泵(60)和所述透析液流体泵(62、68),以此使得谷氨酰胺的实际血液浓度值GLN
并且,
在输注泵可操作地连接至系统计算单元(64)的情况下,系统计算单元(64)适于控制所述输注泵,以此使得实际血液浓度值KETONE
并且,
在无输注泵可操作地连接至系统计算单元(64)的情况下,系统计算单元(64)适于将KETONE
在第五方面中,本发明提供了适于癌症的透析治疗的透析流体,包含诸如乙酰乙酸盐、β-羟基丁酸盐或药学上能接受的β-羟基丁酸盐的衍生物、酯和盐的酮体。
优选地,透析流体还包括a)谷氨酰胺或包含谷氨酰胺的化合物;以及b)葡萄糖。
优选地,
a)谷氨酰胺或包含谷氨酰胺的化合物的浓度的量值为0mM至0.5mM,优选地量值为0.05mM至0.3mM;
b)葡萄糖的浓度的量值为0mM至6mM,优选地量值为0.5mM至4mM;并且
c)酮体的浓度的量值为1mM至15mM,优选地量值为2mM至12mM。
本公开的以上发明内容不旨在描述其每个实施例或每个实施方案。通过结合附图参考以下详细的描述和权利要求,本公开的优点以及对本公开的更完整理解将变得显而易见和容易理解。
附图说明
图1是根据本发明的系统在使用时的示意图。
图2是包括可以采用本文中描述的用户界面和方法的输入装置和显示装置的示例性的体外血液处理系统的框图。
图3是可以包括如在本文中描述的图形用户界面的示例性的透析系统的立体图示。
图4是图2所示的示例性的透析系统的一部分的前视图。
图5是根据本发明的实施例的具有热管理的系统的一部分的示意图。
图6示出了研究1的结果的图表。
图7示出了研究2的结果的图表。
图8A、图8B和图8C示出了根据本发明的治疗目标。
图9是示出本发明的控制算法的流程图。
图10示出了A549细胞和RCC4细胞在如所示的培养基A至培养基C中的生长速率。
图11呈现了肺癌A549细胞、肾癌RCC4细胞和原发性RCC细胞在21%或5%氧气下的培养基A至培养基C中培养3天之后的量。星号表示通过Tukey多重比较测试由双路(2Way)ANOVA确定的显著不同的值。
图12示出了在添加8mM Acac、16mM BOHB或4mM Acac/8mM BOHB的组合的培养基A至培养基C中在常氧和缺氧下培养人胶质瘤细胞系A172的结果。4mM LiCl和8mM LiCl被用作Acac的对照。通过星号标记通过Sidak多重比较测试由单路(one-Way)ANOVA确定的显著不同的值。
图13示出了在添加8mM Acac、16mM BOHB或4mM Acac/8mM BOHB的组合的培养基A至培养基C中在常氧和缺氧下培养胶质瘤细胞系U118MG的结果。4mM和8mM LiCl被用作Acac的对照。通过星号标记通过Sidak多重比较测试由单路ANOVA确定的显著不同的值。
图14呈现了在添加8mM Acac、16mM BOHB或4mM Acac和8mM BOHB的组合的培养基B至培养基C中在常氧和缺氧下培养胶质瘤细胞系A172的结果。4mM和8mM LiCl分别地用作4mM Acac/8mM BOHB或8mM Acac的对照。通过星号标记通过Sidak多重比较测试由单路ANOVA确定的显著不同的值。
图15呈现了在添加8mM Acac、16mM BOHB或4mM Acac和8mM BOHB的组合的培养基B至培养基C中在常氧和缺氧下培养胶质瘤细胞系U118MG的结果。4mM和8mM LiCl分别地用作4mM Acac/8mM BOHB或8mM Acac的对照。通过星号标记通过Sidak多重比较测试由单路ANOVA确定的显著不同的值。
图16呈现了在添加8mM Acac、16mM BOHB或4mM Acac和8mM BOHB的组合的培养基B至培养基C中在常氧和缺氧下培养肾癌细胞系RCC4的结果。4mM和8mM LiCl分别地用作4mMAcac/8mM BOHB或8mM Acac的对照。通过星号标记通过Sidak多重比较测试由单路ANOVA确定的显著不同的值。
具体实施方式
将参考图1至图5描述选择、查看和过滤用于体外血液处理的历史数据的示例系统和方法。体外血液处理系统可以记录或存储一个或多个体外血液处理的一个或多个参数和/或事件,产生历史数据。在本文中描述的示例系统和方法提供图形用户界面,以显示这样的历史数据。通常,历史数据可以包括患者流体去除数据、流体数据、处理数据、抗凝数据、压力数据、事件数据、设定数据、患者数据、警报数据、系统电压和电流数据、系统计时数据、用户交互数据(例如,与用户界面的交互,诸如按钮按压和屏幕选择)等。在本发明中,数据可以包括患者的血流中某些物质的浓度,因为系统可以包括用于检测那些浓度的一个或多个传感器。检测的物质可以包括葡萄糖、谷氨酰胺和其他氨基酸(例如丝氨酸、甘氨酸和精氨酸)、酮和细胞因子。
患者流体去除数据可以包括总的患者流体去除数据、非计划患者流体去除数据、选择的限制数据(例如,针对在诸如1小时、3小时或24小时的选择的时间段上非计划患者流体增益/损失的选择的限制)等。流体数据可以包括预输注数据、透析液数据、后置换流体过滤后数据、过滤数据、流出物数据、过滤分数数据、预稀释数据、患者每千克比率数据、超滤率数据、血液流速%后超滤率数据等。处理数据可以包括处方流出物剂量数据、递送的流出物剂量数据、目标流出物剂量数据、处方超滤率(UFR)剂量数据、目标UFR剂量数据、递送的UFR剂量数据等。抗凝数据可以包括肝素数据、估计的患者柠檬酸负载数据、柠檬酸溶液数据、钙溶液数据、置换溶液数据、钙补偿数据、注射器体积递送数据、推注递送数据等。压力数据可以包括进入管线压力数据、返回管线压力数据、过滤压力数据、跨膜压(TMP)数据、过滤器上的压降(P DROP)数据(例如,过滤器的血液隔室中的压力状态)、自检验数据、压力报警数据、断连和闭塞限制数据、稳定压力数据等。事件数据可以包括系统配置数据、警报数据、设定数据、治疗设定数据、咨询数据、处方设定数据、系统设定数据、抗凝数据、压力数据、患者数据、机械数据、剂量数据等。
图1所描绘的示例体外血液处理系统10可以用于执行在本文中描述的示例方法和/或过程。在至少一个实施例中,系统10可以是或可以包括用于体外处理血液的机器。系统10可以例如替代地是或包括血液处理装置或血液成分制备装置或用于流体递送和/或收集的其他医疗设备。
如示出的,示例体外血液处理系统10包括计算装置12。计算装置12可以被配置成从输入装置20接收输入并且将输出发送至显示装置22。此外,计算装置12可以包括数据存储器14。数据存储器14可以允许访问处理程序或例程16以及一种或多种其他类型的数据18,可以利用该数据实现用于在执行体外血液处理、记录历史数据、过滤历史数据和显示历史数据中使用的示例方法和/或过程。例如,计算装置12可以被配置成记录或记载诸如流速和体积的数据,以允许用户使用输入装置20(例如,基于来自用户的输入)选择并且查看历史数据的各种集合,并且使用显示装置22显示用户选择的历史数据。
计算装置12可以可操作地耦合至输入装置20和显示装置22,以例如向输入装置20和显示装置22中的每一个传输数据和从输入装置20和显示装置22中的每一个传输数据。例如,计算装置12可以使用例如模拟电连接、数字电连接、无线连接、基于总线的连接等电耦合至输入装置20和显示装置22中的每一个。如在本文中进一步描述的,用户可以向输入装置20提供输入,以操纵或修改显示在显示装置22上的一个或多个图形描绘(例如,窗口、区、区域、按钮、图标等),以选择和/或显示历史数据。此外,各种设备和装置可以可操作地耦合至计算装置12,以在计算装置12内使用,以执行一个或多个体外程序/治疗以及在本文中描述的功能、方法、和/或逻辑。如示出的,系统10可以包括输入装置20和显示装置22。输入装置20可以包括能够向计算装置12提供输入以执行在本文中描述的功能、方法、和/或逻辑的任何装置。例如,输入装置20可以包括触摸屏(例如,电容式触摸屏、电阻式触摸屏、多点触摸的触摸屏等)、鼠标、键盘、轨迹球等。输入装置20可以允许用户选择并且过滤要在显示装置22上查看的各种历史数据(例如,显示描绘历史数据的图形用户界面)。
同样地,显示装置22可以包括能够向用户显示信息的任何设备(诸如图形用户界面等),以执行在本文中描述的功能、方法和/或逻辑。例如,显示装置22可以包括液晶显示器、有机发光二极管屏幕、触摸屏、阴极射线管显示器等。在至少一个实施例中,触摸屏设备可以放在显示屏上,允许用户触摸显示器上的图形按钮和图标以使特定动作能够发生。
如在本文中进一步描述的,显示装置22可以被配置成显示图形用户界面,该图形用户界面包括用于选择并且显示体外血液治疗的实时数据和/或历史数据的一个或多个区和/或区域。例如,由显示装置22显示的图形用户界面可以包括或显示二维图、绘制在二维图上的数据集、表示事件接近二维图的一个或多个图形元素或图标、时间间隔选择区、事件类型选择区域、事件列表区或视图、事件信息区域、历史数据区、事件显示区等。
用户可以使用每个图形、区、视图、按钮、图标、面板、区域、对话等来选择和查看显示装置22的图形用户界面上的历史数据。如在本文使用的,图形用户界面的“区”可以被定义为可以显示信息或可以执行功能的图形用户界面的一部分。区可以存在于其他区内,可以单独地或同时地显示等。例如,较小的区可以被定位在较大的区内,区可以并行地定位等。附加地,如在本文中使用的,图形用户界面的“区域”可以被定义为图形用户界面的一部分,其位于比其所在区域小的区域。
处理程序或例程16可以包括用于执行计算数学、矩阵数学、标准化算法、比较算法或实现在本文中描述的一个或多个示例方法和/或过程需要的任何其他处理的程序或例程。数据18可以包括例如历史数据、用户帐户、许可信息、治疗简档、位图、视频、校准数据、系统配置信息、解决方案数据、工程日志、事件和警报数据、系统压力、系统电压、系统电流、自检验序列数据、用户交互数据、处理状态数据、监视器使用数据、利用数据、软件可执行文件、患者信息、处理概要信息、处理运行时间数据、图形(例如,图形元素、图标、按钮、窗口、对话、下拉菜单、图形区域、图形区、3D图形等)、图形用户界面、来自根据在本文中的公开采用的一个或多个处理程序或例程的结果,或实现在本文中描述的一个和/或多个过程或方法可能必需的任何其他数据。
在一个或多个实施例中,可以使用在可编程计算机(诸如包括例如处理能力、数据存储器(例如,易失性或非易失性存储器和/或存储元件)、输入装置、和输出装置的计算机)上执行的一个或多个计算机程序来实现系统10。可以应用在本文中描述的程序代码和/或逻辑来输入数据,以执行在本文中描述的功能并且成期望的输出信息。输出信息可以作为输入应用于如在本文中描述的一个或多个其他装置和/或方法,或者将以已知方式应用。
可以使用任何可编程语言(例如,适于与计算机系统通信的高级程序的和/或面向对象的编程语言)来提供用于实施在本文中描述的方法和/或过程的程序。任何这样的程序可以例如被存储在可由在计算机系统(例如,包括处理设备)上运行的通用或专用程序读取的任何合适的装置(例如,存储介质)上,用于当读取合适的装置用于执行在本文中描述的过程时配置并且操作计算机系统。换言之,至少在一个实施例中,可以使用配置有计算机程序的计算机可读存储介质来实现系统10,其中,这样配置的存储介质使计算机以特定的且预定义的方式操作,以执行在本文中描述的功能。此外,在至少一个实施例中,系统10可以被描述为由在包括用于执行的代码的一个或多个非暂时性介质中编码的逻辑(例如,目标代码)实现,并且当由处理器执行时,可操作以执行诸如在本文中描述的方法、过程和/或功能的操作。
同样地,系统10可以被配置在远程站点(例如,应用服务器)处,该远程站点允许一个或多个用户经由远程计算机设备(例如,经由网络浏览器)访问,并且允许用户采用根据本公开的功能(例如,用户访问与一个或多个程序相关联的图形用户界面来处理数据)。
计算装置12可以是例如任何固定或移动计算机系统(例如,控制器、微控制器、个人计算机、小型计算机等)。计算装置12的确切配置不是限制性的,并且本质上可以使用能够提供合适的计算能力和控制能力(例如,图形处理、体外血液处理设备的控制等)的任何装置。
如在本文中描述的,数字文件可以是包含可以是可由在本文中描述的计算装置12读取和/或写的数字位(例如,以二进制、三进制等编码)的任何介质(例如,易失性或非易失性存储器、CD-ROM、穿孔卡、可记录磁带等)。
此外,如在本文中描述的,用户可读格式的文件可以是可呈现在可由用户读取和/或理解的任何介质(例如,纸张、显示器等)上的数据的任何表示(例如,ASCII文本、二进制数、十六进制数、十进制数、图形等)。
鉴于以上,将显而易见的是,如在根据本公开的一个或多个实施例中描述的功能可以以本领域技术人员将已知的任何方式实现。同样地,计算机语言、计算机系统或用于实现在本文中描述的过程的任何其他软件/硬件不应该对在本文中描述的系统、过程或程序(例如,由这样的系统、过程或程序提供的功能)的范围进行限制。
将认识到,图形用户界面可以与在本文中描述的实施例结合使用。用户界面可以提供允许对其的用户输入、输入的改变、文件的导入或导出的各种特征,或者通常可以适于与在本文中描述的过程一起使用的任何其他特征。例如,用户界面可以允许用户选择并且过滤要在显示设备上显示的各种历史数据。
在本公开中描述的包括归因于系统或各种组成部件的那些方法和/或逻辑的方法和/或逻辑可以至少部分地以硬件、软件、固件或其任何组合的形式来实现。例如,可以在一个或多个处理器(包括一个或多个微处理器、DSP、ASIC、FPGA或任何其它等效集成或离散逻辑电路,以及这样的部件或其它装置的组合)内实施技术的各种方面。术语“处理器”或“处理电路”通常可以单独地或与其他逻辑电路组合地指代前述逻辑电路中的任何逻辑电路,或任何其他等效电路。
可以在相同的装置内或在单独的装置内实施这样的硬件、软件和/或固件,以支持本公开中描述的各种操作和功能。另外,描述的部件中的任何部件可以一起或单独地实施为离散但可互操作的逻辑装置。描绘不同的特征(例如,使用框图等)旨在突出不同的功能方面,并且不一定暗示这样的特征必须由单独的硬件或软件部件来实现。相反,功能可以由单独的硬件或软件部件执行功能,或者集成在公共的或单独的硬件或软件部件内。当在软件中实施时,归于本公开中描述的系统、装置和方法的功能可以体现为计算机可读介质(诸如RAM、ROM、NVRAM、EEPROM、闪存、磁数据存储介质或光数据存储介质等)上的指令和/或逻辑。指令和/或逻辑可以由一个或多个处理器执行,以支持在本公开中描述的功能的一个或多个方面。
本文描述的用于选择和查看体外血液治疗中的历史数据的示例性系统和由此类示例性系统执行或使用的示例性方法通常可以称为透析系统。。如在本文中使用的一般术语透析包括血液透析、血液过滤和血液透析过滤。在透析中,通常将血液从身体中取出并且将血液暴露于处理装置,以从其中分离物质和/或向其添加物质,然后将血液返回身体。因此,在本文中参考图2至图4的示例体外血液处理系统描述了能够执行一般透析的体外血液处理系统。其他系统可以受益于在本文中描述的系统、方法和设备,并且本公开不限于任何特定的流体处理系统。
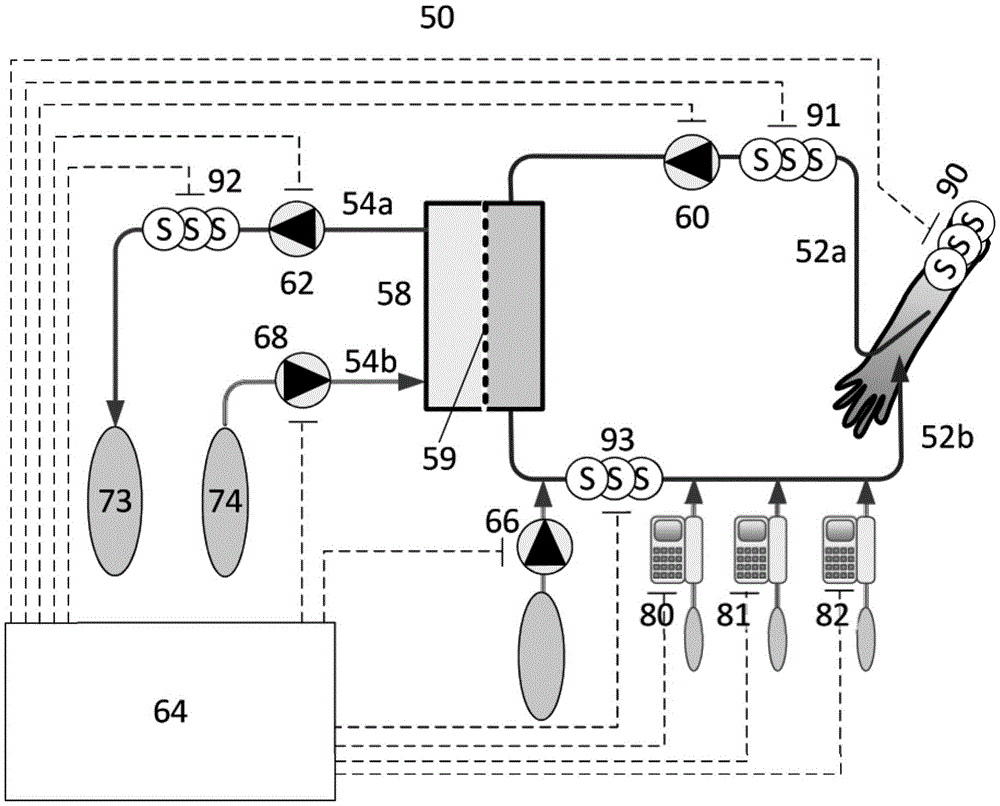
在图2的示意图中,示例体外血液处理系统50通常包括血液管路52,该血液管路包括动脉管线52a和静脉管线52b,该动脉管线和静脉管线可连接至患者的血管系统。该设备包括过滤单元58,该过滤单元具有由半透过滤膜59分开的主室(血液室)和次室(透析液室)。主室的入口被连接至抽血管线或动脉管线52a。同样地,主室的出口被连接至回血管线或静脉管线52b。
次室的入口被连接至新鲜透析液流体供应管线54b,该新鲜透析液流体供应管线又连接至用于提供新鲜透析溶液的源74。过滤单元58的次室的出口被连接至透析溶液或用过的透析液管线54a,该透析溶液或用过的透析液管线将用过的透析溶液输送至流出物连接器73。
在本发明中,过滤单元58包括膜59,该膜与常规血液透析过滤膜不同在于其被配置成从血液管路112中的血液去除相对小的化合物。膜被配置成具有50kDa或更小或甚至40kDa或更小(诸如30kDa或更小、10kDa或更小、5kDa或更小或2kDa或更小)的截留分子量(MWCO)。
血液通过血液管线52a、52b和过滤单元58的流动由定位在动脉管线52a中的血液泵60控制。同样地,新鲜透析液流体从源74通过过滤单元58至流出物收集器73的流动由供应管线54b中透析液流体泵68控制,而透析液流体管线54中的压力由用过的透析液管线54a中的泄压阀控制。替代地,代替泄压阀,第二泵62可以被包括在用过的透析液管线54a中。
还可以存在连接至血液管线52b的静脉部分的一个或多个输注管线66、80、81、82。在一些实施例中,这些输注管线中的一个或多个输注管线适合直接地连接至患者的血管系统(图中未示出)。一个或多个输注管线66、80、81、82中的每一个可以包含单独的泵。在一个实施例中,包含酮体或酮体衍生物的输注液体可以通过这样的输注管线输注。
系统计算单元64设置成与血液泵60、透析液流体泵68和一个或多个输注管线66、80、81、82的一个或多个泵以及泄压阀或附加透析液泵68连通,以便在使用中提供对那些装置的控制。在替代实施例中,系统计算单元64经由用于一个或多个输注管线66、80、81、82中的泵的图形用户界面向用户提供合适的设定数据。系统计算单元还与用于向系统处理单元64提供信息和指令的输入装置备通信。输入设备可以包括图形用户界面,诸如可以通过使用触摸屏布置来控制的图形用户界面。在一些实施例中,输入装置可以包括键盘。在一些实施例中,输入装置可以包括一个或多个传感器,用于检测患者的血液和/或用过的透析液中各种物质或状态的浓度。
例如,可以提供传感器,以检测对象的血液中氨基酸(诸如谷氨酰胺、丝氨酸、甘氨酸、精氨酸)、葡萄糖、酮和细胞因子中的一种或多种的浓度。特别地,这样的传感器应该适合检测对象的血液中谷氨酰胺、葡萄糖和酮体中的一种或多种的浓度。这种传感器S、91、93可以设置在血液管线52中,或者通过使用可以放置在患者的身体上其他地方的单独装置S、90来设置。传感器在它们被部署的程度上向系统处理单元64(直接地或经由附加输入装置)提供预期分析物的实际血液浓度的指示。可以在治疗期间周期性地或基本上连续地进行这种提供。
用于分析谷氨酰胺、葡萄糖和酮体的合适的传感器和测定在本领域中是已知的。例如,在US,A,4780191中公开了谷氨酰胺传感器。在US 9995750和US2016/168619中公开了谷氨酰胺测定的示例。在8532731B2、WO2016/178823、US5326697和US5618686中公开了用于确定酮体的浓度的传感器和测定的示例。在US2019/328288、US2018/128767和US 2011/105871中公开了用于葡萄糖的传感器和测定的示例。
而且,可以通过抽取并且单独分析(例如,实验室分析)患者的血液来测量患者的氨基酸(例如谷氨酰胺、丝氨酸、甘氨酸和精氨酸)以及葡萄糖、酮和细胞因子中的一种或多种的血液浓度(优选地,至少葡萄糖和谷氨酰胺的血液浓度)。尽管取决于分析的接近度和速度,可以在任何治疗期间部署设施,该方法在持久的治疗期间可能是特别相关的。
在另一实施例中,一个或多个传感器S、92可以可选地包括在流出物管线54b中。该传感器可以根据需要检测葡萄糖、氨基酸(诸如谷氨酰胺、丝氨酸、甘氨酸和精氨酸)、酮或细胞因子中的一种或多种的浓度。在流出物管线中测量的相关分析物的浓度可以用于确定患者的血液中相关分析物的代表性浓度,诸如以在欧洲专利EP2377563(其通过援引并入本文)中描述的方式。
当将身体中的细胞暴露于高于正常温度时,细胞内部发生变化。取决于治疗的区域的程度,治疗可以是局部的(仅肿瘤)、区域的(作为肢体)或全身热疗。非常高的温度可以导致癌细胞坏死/凋亡(热消融),但是高的温度也可以导致损伤或引起正常细胞的凋亡/坏死。因此,必须小心地控制热疗。
热疗是改善癌症治疗的一种有希望的方法,并且今天它需要特定设备,因此执行是麻烦的。许多关于热疗的治疗癌症的临床试验正在进行。如建议的额外实体回路非常适于在患者中引起低体温并且控制它。在处理体外血液含量的同时提高血液温度形成了良好的组合治疗,该良好的组合治疗能够通过改变的血液含量增强效果。
在返回的血液中300mL/min的血液流动和43度的温度的情况下,大约120瓦的效果被传递至患者,并且将容易地升高体温。在基本上不损伤血液的情况下血液温度可以在短时间升高至45℃。
可能需要冷却患者,以结束处理,但是也需要调节过于有效的处理。冷却将导致正常细胞和癌细胞的代谢速率的降低,但是随后也导致它们的氧气消耗降低。提及的变化将导致保护正常健康细胞,但是将导致癌细胞对例如常规癌症治疗的弱化,而且还导致癌症透析以及葡萄糖和谷氨酰胺和氧气的减少。冷却还可以导致给予患者的常规癌症治疗的较少的不良副作用,而且还经受癌症透析和常规癌症治疗的较积极的治疗。本附图未指示用于冷却或加热血液的任何装置,但是这种机构是本领域技术人员公知的,并且经常与一些类型的体外血液处理(诸如连续肾替代疗法(CRRT))结合使用。
图8A、图8B和图8C示出了本发明的治疗目标和原理。每个图公开了关于特定血液成分的浓度的正常条件的示例。图8A示出了患者在处理开始的时候通常具有0.20mM至0.8mM的范围内的谷氨酰胺的实际血液浓度GLN
在一个实施例中,谷氨酰胺的实际血液浓度GLN
图9公开了根据本发明的控制过程的算法900的示例的流程图。在开始处理之前,系统计算单元64适合接收关键化合物的处理目标浓度或期望血液浓度。通常,使用用户界面输入这些处理目标浓度。
因此,在步骤901中,系统计算单元64接收谷氨酰胺的期望血液浓度值GLN
在步骤903中,系统计算单元64接收葡萄糖的期望血液浓度值GLUCOSE
在步骤905中,系统计算单元64接收酮体的期望血液浓度值KETONE
在开始处理之前,系统计算单元64还适合接收用于以上关键组分在新鲜透析液液体中的浓度值。通常,还使用用户界面输入这些浓度值。
因此,在步骤902中,系统计算单元64接收新鲜透析液液体中谷氨酰胺的浓度值GLN
在步骤904中,系统计算单元64接收新鲜透析液液体中葡萄糖的浓度值GLUCOSE
在步骤907中,系统计算单元(64)适合接收浓度值KETONE
在步骤906中,系统计算单元64接收体外血液管线(52b)中待输注的或直接地输注至待治疗的对象/患者的血管系统中的输注液体中的酮体的浓度值KETONE
在开始处理之前,以及可选地在处理期间,系统计算单元64适于接收通过患者的血液确定的实际浓度值。这些浓度值可以在采集血液样品、接着在单独的分析单元中分析后获得。然后通过用户界面手动地输入浓度值。在一些实施例中,系统计算单元被连接至一个或多个这样的单独的分析单元,因此可以直接地从其接收数据。在一些实施例中,血液回路52a、52b和/或透析液回路54a、54b可以包括合适的传感器S、90、91、92、93,该合适的传感器被连接至接收数据的系统计算单元64。系统计算单元64通常基于最近接收的实际值GLN
因此,在步骤908中,系统计算单元64开始处理。
在步骤909中,系统计算单元64适于从患者接收谷氨酰胺的实际血液浓度值GLN
在步骤910中,系统计算单元64适于从患者接收葡萄糖的实际血液浓度值GLUCOSE
在步骤911中,系统计算单元64适于从患者接收酮体的实际血液浓度值KETONE
在步骤912中,系统计算单元64控制血液泵60和透析液液体泵62、68,以此使得GLN
在同时的步骤914中,系统计算单元64控制血液泵60和透析液液体泵62、68,以此使得GLUCOSE
在同时的步骤916中,系统计算单元64监测GLN
在同时的步骤918中,系统计算单元64监测GLUCOSE
在同时的步骤920中,系统计算单元64监测K
在一些实施例中,可以控制血液中其他物质的浓度。例如,已经发现从正常降低氨基酸(诸如丝氨酸、甘氨酸和精氨酸)的浓度是有益的。
在图3至图4的立体图和局部前视图中,可以实施如在本文中描述的治疗和图形用户界面的示例体外血液处理系统110,该示例体外血液处理系统通常包括具有第一管段114和第二管段116的血液管路112,该第一管段和第二管段分别地经由进入装置117和返回装置119连接至患者118的血管系统。如本领域技术人员将理解的,装置117和119可以是插管、导管或翼针等。管段114和116还被连接至过滤或处理单元120。在透析中,过滤单元120是透析器,其通常也称为过滤器。
还包括血液回路112的许多其他组件装置,诸如例如,压力传感器127、128、154、129。可以提供另外的传感器来监测葡萄糖和/或谷氨酰胺的浓度,酮(诸如羟基丁酸盐(BHB)、乙酰乙酸盐和丙酮)和/或细胞因子(诸如肿瘤坏死因子(TNF)(例如,TNF-α)、白介素(例如,IL-6))的浓度。然而,如以上标注,传感器可以被放置成与患者直接接触,而不是放置在血液回路112中。在它们存在的情况下,传感器通过无线连接或物理连接可操作地连接至计算装置12。
如图5中的示意形式所示,包括进血管线114和回血管线116的血液回路112还可以包括用于加热或冷却血液回路112内的血液的热管理系统500。热管理系统500可操作地连接至计算装置12、64。这样的热管理系统可以用于加热返回至患者的血液,诸如加热至约37℃。这样的系统还可以用于将返回的血液冷却低至20℃或将返回的血液温度提高至43℃,从而将患者加温至高达38℃至40℃的温度。而且,透析液回路还可以包括第二热管理系统501,以便确保血液在通过血液过滤器120之后已经达到了期望温度。
图3至图4中还示出了系统110的透析液流体侧或滤液侧,该系统的透析液流体侧或滤液侧通常包括具有第一透析液流体管段141和第二透析液流体管段142的透析液流体回路140。这些管段中的每一个管段在膜的与血液回路112的区段114、116相对侧上连接至过滤单元120。在这些图3至图4中,各自的流体泵144、146与这些管段141和142中的每一个管段可操作地相关联。
第一管段141还连接至透析液流体源(例如,流体袋149),该透析液流体源可以包括预混合在其中的电解质或其他处理化合物。第二管段142被连接至废物收集装置(例如,诸如袋153的废物容器)。压力传感器154也可以被设置在第二透析流体管段142中。
图3至图4示出了通常作为许多透析程序的基础模型的系统。可以添加(或删除)附加流体管线、回路和部件来增加处理选项。特别地,在本发明中,可以提供用于向患者供应(诸如通过添加到血液回路112)酮(例如,羟基丁酸盐(BOHB)、乙酰乙酸盐和/或丙酮)的附加管线。向患者供应酮是重要的,因为它降低了对于要处在进食引起的酮症的状态下的患者在开始处理之前的要求。在没有提供酮的单独供应的实施例中,流体源袋149还可以包括溶液中的一种或多种酮(诸如BOHB钠),用于通过膜扩散至血液回路中。
透析液流体源149、废物容器153和置换流体容器168中的一个或多个可以设置在与计算装置12可操作地通信的称(scale)400上。酮的任何附加源也可以设置在这样的称400上。这允许在使用中监测每个容器中的流体的质量,以提供使用的或收集的每种流体的量的准确记录。
此外,如图3至图4所示,系统110包括提供多种治疗选项的体外血液控制装置160,该体外血液控制装置可以经由控制屏/显示屏161(例如,设置在系统壳体193中的控制装置或控制器)来控制和/或监测。触摸屏控件可以并入本文和/或可以使用其他常规旋钮或按钮(未示出)(例如,可以经由如在本文中描述的触摸屏显示图形用户界面)。关于示例设备160的其他和较详细的信息可以在美国专利号5,679,245;美国专利号5,762,805;美国专利号5,776,345;和美国专利号5,910,252等中找到。
出于示例目的,将大致描述例如通过参考图3至图4描述的设备执行的一般透析处理程序。首先,血液通过例如血液泵124经由进入设备117从患者118除去,并且通过进入管线114流至过滤器120。过滤器120根据多个体外血液处理配置文件中选择的一个或多个体外血液处理配置文件(例如,通过控制设备160的屏幕界面161选择并且控制)来处理该血液。
处理配置文件还涉及减少患者的血液中的谷氨酰胺和葡萄糖。谷氨酰胺的浓度被降低至0.1mM至0.5mM的范围内的值,并且优选地降低至0.15mM至0.3mM的范围内的值。葡萄糖的血液浓度被降低至1mM至6mM的范围内的浓度,并且优选地在2mM至4mM的范围内。由于糖酵解和谷氨酰胺分解途径在许多癌细胞中增强,因此这种治疗对癌细胞比对身体中的健康细胞具有更显著且更不利的影响。虽然增强了糖酵解以满足癌细胞增加的能量需求,但是谷氨酰胺分解也许多癌细胞中增强了,并且能够提供生物合成前体,但也在保持活性氧物种(ROS)止血中起重要作用。通过增加癌细胞中的ROS产生来迫使癌细胞进入凋亡是放射疗法和化学疗法的重要目标。最后,谷氨酰胺可以在低水平葡萄糖期间起ATP源的作用。在一些实施方案中,治疗简档确保可以通过向血液管线提供合适的肠胃外营养组合物或作为直接进入患者的血管系统中的单独输注来满足患者的营养需求。在一些实施例中,在处理期间,酮体的血液浓度保持被保持在在1mM至15mM的范围内的值,并且优选地在2mM至12mM的范围内。虽然预期患者在暴露于这样的低血糖浓度时产生其自身的酮体(例如,来自摄入的或输注的脂质或体脂的储存),但是产生足够量的酮体的生物过程可能需要时间来开始。在本文中描述的治疗期间引入酮体确保了即使血谷氨酰胺和血糖浓度以异常高的速度降低的情况下,患者也及时地具有用于持续生命功能足够的能量源。
在某些处理(特别是保持高血酮浓度的那些治疗)中,向患者提供一种或多种药理学试剂的供应以帮助降低血糖浓度。这样降糖剂优选地包括双胍、α-葡糖苷酶抑制剂、SGLT2抑制剂和多巴胺激动剂。这样的试剂可以由系统通过包括在透析液流体源149、附加酮源(如果存在)中或作为要供应至血液回路112的附加输注或以其他方式供应至患者。
一示例双胍的是二甲双胍。示例α-葡糖苷酶抑制剂包括阿卡波糖或米格列醇。示例性SGLT2抑制剂包括坎格列净、达格列净和恩格列净。示例多巴胺激动剂包括溴隐亭。
在一些优选治疗中,可以向患者提供抗糖酵解剂,以进一步抑制肿瘤细胞中的糖酵解活度。这样的试剂可以由系统通过包括在透析液流体源149、附加酮源(如果存在)中或作为要供应至血液回路112的附加输注或以其他方式供应至患者。
在处理之后,系统通过返回管线116和返回设备119将加工过的或处理过的血液返回至患者118,该返回管线和返回装置被插入患者118的血管系统中或以其他方式连接至患者118的血管系统。
去往和来自患者118的血液流路形成血流回路112,该血液流路包括进入设备117、进入管线114、血液泵124、过滤器120以及回到患者的返回管线116和返回设备119。压力传感器可以用于感测系统110中的各种压力。例如,压力传感器127可以被连接在进入管线114中,并且允许监测进入管线114中的流体压力,并且第二压力传感器128可以被连接在第一血液泵124与进入过滤器120的血液入口之间的血液回路112中,并且可以用于检测和监测供应至过滤器120的入口的血液的压力。
系统110还可以包括在返回管线中的脱气室125,以提供像涡流一样操作以将空气推出血液的输送路径。可以将过滤后置换溶液添加至血液的顶部的脱气室中,以防止空气/血液接触面。脱气室监测管线191可以使用连接设备(诸如例如,返回压力端口129)将脱气室125连接至系统壳体193内的内部压力换能器。这使能返回压力监测能够实现,并且如果需要,是从脱气室除去空气能够实现。连接在血液回路112中的返回夹具131选择性地允许或终止血液流经血液回路112(例如,每当气泡检测器126在血液中检测到空气时,返回夹具131可以被激活)。
此外,泵162可以被连接至抗凝血剂容器164,以通过抗凝血剂管线165将抗凝血剂递送至管段114中的血液,并且泵166可以通过置换流体管线170从置换流体容器或袋168递送置换流体。次级流动回路140也在图3至图4中示出,因为它与过滤器120相互作用。次级流动回路140被连接至过滤器120的次室。从血液体外除去的物质通过次级流动回路140的出口管段142从过滤器120的次室除去,并且体外添加至血液的物质通过次级流动回路140的入口管段141移动至过滤器120中。
次级流动回路140通常包括诸如袋149的流体源、入口流体管线141、第三泵144、过滤器120的次室、废物流体管线142、压力传感器154、第四泵146和诸如容器153的废物收集装置。源流体袋149可以包含通常与血液等渗的无菌透析液流体,血液杂质将通过过滤单元120的半透膜扩散至该无菌透析液流体中。流体源袋还可以包括溶液中的一种或多种酮,用于通过膜扩散至血液回路中。
泵144被连接在入口流体管线141中,用于将透析液流体从透析液流体源149递送至过滤器120的入口中。提供废物收集容器153,以收集或容纳来自穿过过滤器120中的半透膜转移的血液的物质,和/或在使用的透析液流体已经经过过滤器120之后容纳使用的透析液流体。第四泵146被连接至废物收集管线142,用于使用过的透析液从过滤器120移动至废物收集容器153中。压力传感器154也可以位于废物收集管线142中,用于监测过滤器120的次室中的压力的目的。
在本文中描述的过滤单元120、流动管线以及初级流动回路112和次级流动回路140中的其他部件(除了例如泵和可能的几个其他物体之外)可以形成为一体的可置换的单元(例如,体外血液组)。该一体置换单元在本文中可以被称为“治疗装置”。这种治疗装置或一体可置换单元的示例在标题为“一体的血液处理流体模块”(Integrated BloodTreatment Fluid Module)的美国专利No.5,441,636中较详细地描述(也参见标题为“体外处理装置的保持设备”(Retention Device for Extracorporeal Treatment Apparatus)的美国专利No.5,679,245)。
取决于系统配置,在执行不同治疗中使用的治疗装置可以是可用的。如从图3至图4通常可以理解的,集成管道和过滤模块(由附图标记172标识)包括过滤器120和以上描述的可连接至设备160的所有管道和相关联的部件。例如,过滤器和管道可以被保持在塑料支撑构件174上,该塑料支撑构件又可连接至装置160(例如,可连接至装置160的系统壳体193)。治疗套件还可以包括监测葡萄糖和/或谷氨酰胺;酮(诸如羟基丁酸盐(BHB)、乙酰乙酸盐和丙酮)和/或细胞因子(诸如肿瘤坏死因子(TNF)(例如,TNF-α)、白介素(例如,IL-6))的浓度的传感器。这样的传感器可以被配置成监测血液回路中列出的组分的浓度,或者可以被配置成通过与患者的身体直接接触来监测列出的组分的浓度。
当处于连接至装置160的操作位置时,去往和来自过滤单元120的柔性流体引导管管线被保持在操作的泵连通的环路中,用于与泵124、144、146和166的蠕动泵构件操作接触,以使流体流经初级(血液)回路112和次级(透析液流体)回路140。模块172,包括过滤器120和所有管线以及相关联的流动部件在使用后可以是一次性的。
泵124、144、146和166的蠕动泵构件可以固定地设置在装置160上(不需要一次性管道环路部件),并且可以是可重复使用的。通常,电气、机械或机电部件也固定地设置在装置160中或装置160上(例如,可连接至设备160的系统壳体193)。这类部件的示例包括显示屏161(例如,触摸屏)、气泡检测器126、管线夹具131和用于联接至用于实施压力传感器127、128、129、154的压力传感器设备的连接设备等。还可以为任何需要或优选的传感器提供联接。
如上说明,进入设备117和返回设备119可以包括导管。在一些实施例中,导管可以包括闭塞导管,诸如气球闭塞导管。这种布置允许以图4所示的方式将进入设备117和返回设备119递送至肿瘤的部位(例如,经由股动脉或静脉进入)。这允许局部降低肿瘤周围的血糖浓度,从而提供将血糖和/或谷氨酰胺浓度降低至甚至更低水平的潜力。
参考示例1
在伴随耗尽选择的营养素的情况下,进行了不同的人癌细胞系细胞培养基中葡萄糖、谷氨酰胺和酮的敏感性的研究,与模拟通过癌症透析获得的条件。
对从肾细胞癌、结肠癌和胶质母细胞瘤确定的人癌细胞系的选择执行研究1。首先,在伴随限制葡萄糖和谷氨酰胺水平的情况下,研究在存在增加β-羟基丁酸酮的浓度的情况下生长对于细胞活力的影响。还测试了向细胞培养液添加柠檬酸盐。在这些条件下培养细胞3天,之后确定细胞活力。在第一个研究中,当谷氨酰胺从培养基中耗尽时,发现了对细胞活力的主要影响。
材料和方法
细胞培养条件
选择从人结肠癌(HCT15、NCI-H508和COLO205)、肾细胞癌(769-P、786-O和RCC4)和胶质母细胞瘤(LN-18、A-172和U-118MG)建立的细胞系用于分析。除了购自Sigma-Aldrich(Merck,德国)的RCC4和HCT15之外,所有的细胞系均获自美国模式培养物集存库(ATCC,LGC标准,UK)。此外,研究中包括从患者肾切除分离的原发性人肾细胞癌(RCC)细胞。遵循美国模式培养物集存库(ATCC)推荐的培养条件,即在添加1mM丙酮酸钠的DMEM培养基中生长细胞,该丙酮酸钠也被添加至RPMI-1640培养基,以保持条件较相似。
根据来自ATCC的推荐,在DMEM高葡萄糖培养基中培养769-P、RCC4、LN-18、A-172、U-118MG和原发性RCC细胞,而在RPMI-1640培养基中培养786-O HCT15、NCI-H508和COLO205在RPMI-1640培养基中培养。向二者添加1%青霉素-链霉素和10%小牛血清。根据标准程序扩增细胞并且冷冻等分样品。
根据“优化细胞接种密度以确保对数期生长的方案”,在96孔板中为每个细胞系确定最佳接种密度。该方案如下:
·制备单细胞悬浮液并且测量细胞计数/活力。
·在完全培养基中将细胞稀释至约160,000个细胞/ml。向96孔板的顶行添加200μL的细胞。将100μL的完全培养基等分至所有其它的孔中。在每个板上需要少量仅培养基的对照孔以充当空白。
·重复地,使用12孔通道移液器将细胞制备品1份沿板向下稀释成2份,即,向下一行中的100μL培养基天机100μL细胞。然后,向所有的孔添加50μL的完全培养基。盖上板。
·将该板在37℃、5%CO
·向板孔中加入50μL新鲜培养基,以实现200μL的最终体积,并且在37℃、5%CO
·使用CellTiter-Glo根据制造商的方案测定测量活力。
·将细胞数对发光强度的对数绘图,以找到实现对数生长的细胞浓度。
CellTiter-Glo发光细胞活力测定(Promega)用作活力的读数。
研究1
对于每个细胞系,在第0天将以上确定的最佳数量的细胞接种至96孔板中。下一天,在添加了表3以及文件“板概述”(plate overview)中概述的营养素的情况下,在PBS中清洗细胞,并且将培养基更换为不含葡萄糖或L-谷氨酰胺的DMEM(Fisher Scientific)或RPMI-1640培养基(Saveen Werner)。对于每个条件处理三个孔。在测试条件培养基中3d培养后,随着每天更换培养基,使用CellTiter-Glo活力测试确定细胞活力。对于每种细胞系重复实验三次。
表1.癌细胞系和培养基
表2.所选营养素的正常培养基含量
表3.测试条件研究1
矩阵示出研究1中使用的不同生长条件的组合。*葡萄糖的量被表示在为每个细胞系的标准培养基中存在的浓度的百分比。在指示的情况下,向培养基添加1mM柠檬酸盐。向不含葡萄糖或L-谷氨酰胺的DMEM(Fisher Scientific)或RPMI-1640培养基(SaveenWerner)添加指示的营养素。
表4产品订单信息
/>
研究1的结果在图6中所示的图表中呈现。在减少存在的谷氨酰胺和细胞培养基与减少细胞增殖之间显示了出明确的关联。
研究2
如以上说明,在研究1中,遵循ATCC推荐的培养条件。然而,丙酮酸盐是可能影响结果的潜在能量源。因此,在研究2中,在不添加丙酮酸钠的DMEM培养基中,在细胞系中的两个细胞系A172(胶质母细胞瘤)和RCC4(肾细胞癌)中测试与研究1中相同的培养条件。结果在图7中呈现。如在研究1中,在减少存在的谷氨酰胺和细胞培养基与减少细胞增殖之间显示了明确的关联。然而,在细胞培养基中不存在丙酮酸盐的情况下,结果要显著得多。而且似乎BOHB酮浓度的增加也抑制细胞的增殖。
在本文中引证的所有专利、专利文献和参考文献均以其整体并入,如同每一个单独地并入。已经参考说明性实施例提供了本公开,并且本公开不意味着以限制意义来解释。如之前描述的,本领域技术人员将认识到,其他各种说明性应用可以使用如在本文中描述的技术来利用在本文中描述的设备和方法的有益特性。在参考本说明书时,说明性实施例的各种修改以及本公开的附加实施例将是显而易见的。
示例2
研究设计
生长培养基
为了研究限制营养素的生酮环境对体外癌细胞生长的影响,配制了三个不同的细胞培养基。培养基A是常规地培养细胞系的完全RPMI1640培养基。培养基B用作在正常人血清中发现的条件的近似物。调节葡萄糖、谷氨酰胺、丝氨酸、甘氨酸和精氨酸的水平以匹配在人血清中发现的正常生理水平。基于其作为能量源的报道的用途和对癌细胞代谢状态的影响来选择这些营养素。培养基C用于仿真限制生酮营养素的癌症透析条件。这里,将选择的营养素的水平降低至培养基B中生理水平的一半,并且添加酮体BOHB。
以表5至表6中列出的材料和方法的方式来描述每个培养基的组合物。
氧气水平
人癌细胞系常规地确定并且以大气中氧气水平(21%O
酮
乙酰乙酸酮(acac)、BOHB和丙酮由肝在禁食或饥饿期间产生。BOHB是哺乳动物中的主要酮体,而acac构成约20%。研究酮对癌细胞的影响的大多数公开的体外研究主要集中在BOHB上,然而,有研究表明与BOHB相比,添加Acac具有不同的作用[Vallejo等人,JNeurooncol 2020年;147:317-326]。为了进一步模拟存在两种酮的体内生酮情况,并且为了研究BOHB和Acac可能的不同影响,研究中也包括Acac。
材料和方法
细胞系
除了来自Sigma-Aldrich(Merck)的RCC4之外,所有细胞系均购自ATCC(ATCC,LGC标准)。在患者知情同意并且区域伦理委员会许可后,从在瑞典哥德堡的萨尔格林斯卡大学医院进行的肾切除术中分离了原发性人肾细胞癌细胞。确定在标准细胞培养基中培养3天的96孔板中的每个细胞系的最佳接种密度。
培养条件和添加剂
以37℃和5%CO
培养基A、B和C制备如下。
培养基A:RPMI1640(31870-025,GIBCO),其添加1%PEST、200mM L-谷氨酰胺和10%透析血清。透析血清用于减少诸如氨基酸的小分子的量。
培养基B和C由无L-谷氨酰胺、葡萄糖和氨基酸的RPMI1640改良的培养基粉末(R9010-01,US Biological Life Sciences)制备。对于1L培养基,在不加热的情况下将7.4g粉末溶化在900mL无菌水中,并且添加2g碳酸氢钠。将表5中列出的氨基酸添加至与完全RPMI1640培养基中相同的浓度(表5)。在所有添加后,借助于通过0.22um膜过滤将培养基灭菌,并且分成两个瓶。
在培养基B中,为了模拟生理条件,基于来自梅奥诊所实验室(https://www.mayocliniclabs.com/test-catalog/clinical+and+interpretive/9265)的数据,将谷氨酰胺、丝氨酸、甘氨酸、精氨酸和葡萄糖的水平设定为人血清中测量的水平的中位数。
为了建模培养基C中的癌症透析条件,将这些营养素的水平降低至生理水平的50%。对于培养基A,将1%PEST和10%透析血清添加至培养基B和C。培养基A至C中选择的营养素的浓度总结在表6中。作为细胞培养基中的常见添加剂的丙酮酸钠,在任何使用的培养基中都不存在。
表5.RPMI1640中的氨基酸浓度
表6.培养基A、B和C的营养组成
氨基酸和其他添加剂购自Sigma Aldrich。
添加了所有的营养素之后,测量pH。pH值如下:具有10%未透析的FBS、1%PEST和200mM L-谷氨酰胺的完全RPMI1640,pH 7.78;培养基A,pH 7.56;培养基B,pH 7.62并且培养基C,pH 7.57。
在水中制备DL-β-羟基丁酸钠盐(H6501,SigmaAldrich)和乙酰乙酸锂(A8509,SigmaAldrich)的储备溶液,无菌过滤,等分并且储存在-20℃。氯化锂(L7026,SigmaAldrich)用作在Li-Acac中添加锂的对照。
活力测定
CellTiter-Glo发光细胞活力测定(Promega)根据制造商的说明用作细胞数的读数。在图12至图13所示的实验中,接种并且处理双板。一组板用于收集用于乳酸盐测量(参见以下)和CellTiterGlo测定的培养基。在实验结束,在-80℃下冷冻另一组板。冷冻的板旨在用于CyQuant细胞增殖测定(Thermo Fisher),该CyQuant细胞增殖测定测量每孔的DNA量。通过CellTiterGlo和CyQuant测定二者分析细胞量将确保培养条件对活力或生长速率的影响将不被每细胞的ATP水平的同时变化掩盖。
收集用于乳酸盐测量的培养基
在图12至图13所示的实验中,细胞培养基在第3天收集,转移至新的96孔板并且在-80℃下冷冻。该培养基可以用于分析分泌的乳酸盐的量作为代谢状态的量度。用于乳酸盐测量的若干试剂盒是可用的,例如,Lactate-Glo测定(J5021,Promega)被设计用于存在血清的测定。
结果
示例2被设计成回答以下问题:
-选择的癌细胞系的生长是否受常氧或缺氧下的培养基C中模拟的癌症透析条件的影响?
培养基A、B和C中的生长
作为第一步,如在材料和方法中的描述制备培养基A至培养基C,并且测试癌细胞系在这些培养基中生长的能力。确定选择的细胞系在每个培养基中随时间的生长曲线。在常氧(21%O
如图10所示,与培养基A相比,将选择的营养素降低至如培养基B中较生理水平显著地降低了A549肺癌细胞系和RCC4肾癌细胞系的生长速率。与培养基A相比,培养基C进一步降低了生长速率。
癌细胞在常氧和缺氧下的培养基A至培养基C中的生长
在图11中,显示了A549肺癌细胞系和RCC4肾癌细胞系以及原发性肾癌(RCC)细胞在常氧和缺氧下的培养基A至培养基C中培养3天后的细胞量。另外,与培养基A相比,降低了在培养基B和C中在常氧的生长速率。在5%O
对于A549,在培养基B与C之间发现了生长速率小但显著的降低,但是仅在常氧下。
本研究包括来自三个患者的原发性肾癌细胞。与已确定的细胞系类似,与培养基A相比,这些细胞在培养基B和C中显示了降低的生长速率。
总之,将氧气压力从21%O
接下来,决定在研究中还包括Acac,并且分析在培养基A至培养基C中BOHB和Acac单独或组合单独或组合存在下培养的细胞的活力。实验在21%O
作为手性分子,BOHB作为两种对映体D-BOHB和L-BOHB存在。D-BOHB通常在人类中产生和代谢。本研究中使用的BOHB盐含有D-BOHB和L-BOHB的50:50的混合物。为了确保高的活性D形式的存在,将添加的BOHB的总浓度增加至16mM,得到8mM D-BOHB的水平。为了保持活性酮的总浓度恒定,使用8mM Acac,并且对于两种酮的组合,将水平调节至4mM Acac和8mM BOHB(含有4mM D-BOHB)。
可用于体外使用的Acac是锂盐的形式。由于锂本身能够影响癌细胞的活力[Cohen-Harazi等人,Anticancer Res 2020年;40:3831-3837],因此8mM LiCl用作8mMAcac数据点的对照,并且4mM LiCl用作4mM Acac/8mM BOHB数据的对照。
在实验结束,收集并且冷冻来自每个孔的培养基,以使得稍后能够将乳酸盐水平确定为代谢状态的量度。此外,进行双重实验,其中,将一组板冷冻用于稍后使用CyQuant增殖测定来定量细胞数,并且通过CellTiterGlo活力测定来分析另一组中的细胞量。
单独或组合添加的BOHB和Acac的效果
如图12至图13所示,初始实验给出了关于营养物减少条件下高酮浓度对A172和U118MG胶质瘤细胞系的生长的影响的有希望的数据。
在培养基A中,在常氧和缺氧下,单独添加16mM BOHB对A172或U118MG细胞没有生长抑制作用,并且与8mM LiCl对照相比,8mM Acac没有进一步减少细胞数。
然而,与4mM LiCl对照相比,添加4mM Acac与8mM BOHB的组合显著地减少了在常氧的培养基A中A172细胞的数量。
来自培养基B的结果的解释受常氧对照样品中的技术误差的干扰。然而,在缺氧A172细胞中,BOHB将细胞数量显著地减少至无BOHB的培养基B中的量的约70%。在缺氧U118MG细胞中也观察到类似的减少。
而且,在培养基B中,在两种细胞系中,与8mM LiCl对照相比,8mM Acac显著地减少细胞数,但仅在21%O
在培养基C中,与8mM LiCl对照相比,单独添加8mM Acac没有显著地减少细胞量。然而,在两种细胞系中以及在21%O
此外,在两种细胞系中以及在两种氧气水平下,与4mM LiCl对照相比,BOHB和Acac的组合在培养基C中导致显著更少的细胞。
这些结果表明,单独天骄高水平的BOHB或Acac不能抑制胶质瘤细胞在营养丰富的环境(诸如培养基A)中的生长。此外,在具有更多生理营养水平的培养基B中,当添加酮时,仅观察到小的差异。在培养基C中发现了最大的影响,其中,在缺氧和常氧二者下,与它们各自的对照相比,单独的16mM BOHB以及8mM BOHB与4mM Acac的组合显著地减少了细胞数。当单独地添加8mM Acac时,为观察到这种情况。
然而,重复这些实验,重点关注在常氧条件下的培养基B和C,给出了不一致的结果。图14至图16示出了来自实验2至实验6的胶质瘤细胞系A172和U118MG以及肾癌细胞系RCC4组合的结果。当单独地加入BOHB或Acac时,在培养基C中观察到生长减少的趋势,特别是在A172细胞系中。
来自示例2的第一和第二部分的结果表明,癌细胞系在限制营养素的环境中生长较慢。测试的细胞系似乎在培养基B和C中是有活力的,尽管降低了增殖速率。在第3天对细胞的光学检查未显示任何漂浮的细胞,这可能是死亡细胞的迹象。
来自研究第三部分的数据显示胶质瘤细胞系对限制营养素的培养基C中高水平的BOHB或BOHB和ACAC的组合的敏感性增加。然而,对于肾癌细胞系RCC4没有发现这样的敏感性。
- 一种用于田间制炭尾气处理的可移动式系统及使用该系统处理制炭尾气的方法
- 一种应用于血液透析机的动力系统及其控制方法
- 用于控制运送血液的系统的设备,以及用于在体外血液处理设备的体外血液回路的血液线路中运送血液的方法
- 用于体外血液处理的系统、处理设备、套件和用于体外血液处理的系统的操作方法
